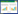服务
文章信息
- 王俊阳, 王为善, 赵华, 杨克迁
- Junyang Wang, Weishan Wang, Hua Zhao, Keqian Yang
- 细菌双杂交系统的改进
- The modified bacterial two-hybrid system
- 生物工程学报, 2016, 32(2): 231-240
- Chin J Biotech, 2016, 32(2): 231-240
- 10.13345/j.cjb.150150
-
文章历史
- Received: April 5, 2015
- Accepted: May 21, 2015
2. 中国科学院微生物研究所 微生物资源前期开发国家重点实验室,北京 100101
2. State Key Laboratory of Microbial Resource, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
基于腺苷酸环化酶的细菌双杂交系统利用了百日咳博代杆菌Bordetella pertussis中cya基因编码的钙调蛋白 (CaM) 依赖性腺苷酸环化酶激活区可以分成T18和T25两个相对独立的功能片段[1]的特点,当这两种片段在大肠杆菌BTH101 (cya-) 中作为两个独立的实体表达时,它们不能彼此识别与作用,因此不能互补大肠杆菌BTH101的cya-缺陷型性状,表现为β-半乳糖苷酶活性很低,生长在涂有X-gal的平板上的菌落呈白色。若这两个功能区分别与一对可相互作用的蛋白质融合表达,它们可形成有功能的腺苷酸环化酶,互补大肠杆菌BTH101的cya-缺陷型,使菌株的β-半乳糖苷酶活性上升,生长在涂有X-gal的平板上的菌落显蓝色[2, 3]。因此可以方便地应用该双杂交系统,通过蓝白斑筛选来高效地鉴定蛋白质间的相互作用[4, 5, 6, 7]。
与酵母双杂交系统[8]相比,细菌双杂交系统具有一些优点[3]:大肠杆菌比酵母菌生长繁殖快、转化效率高、遗传操作方便,可进行快速高通量的研究[2];适用范围广,可用于研究膜蛋白的相互作用[9]等,细菌双杂交系统被广泛应用于功能基因组学的研究[10]。但是,在使用过程中我们发现,细菌双杂交系统和酵母双杂交系统都具有检测灵敏度不高,从而导致假阳性和假阴性高发的缺陷。因此,提高细菌双杂交系统的检测灵敏度,有助于该方法更广泛地应用于研究细菌的蛋白质间的相互作用。
链霉菌能够产生丰富的次级代谢产物[11],目前临床上应用的抗生素约2/3由该属产生,因此链霉菌被称为药物合成的天然工厂[12]。对链霉菌的基础及应用研究目前已深入展开,相对于其他原核生物,链霉菌具有较大的基因组和较复杂的调控系统 (约8 M基因组,编码约8 000多个基因,以及多达12%的基因编码调控蛋白)[13, 14, 15, 16, 17, 18]。近期研究表明,调控蛋白之间的相互作用形成的异源二聚体在调控过程中发挥着重要作用[19]。因此,研究链霉菌体内相互作用的蛋白显得尤为重要。我们希望采用基于腺苷酸环化酶的细菌双杂交技术来筛选链霉菌已知靶蛋白的调控蛋白,但是在研究过程中发现此方法的检测灵敏度较低,假阳性高发。为了使细菌双杂交系统能够更精确地用于筛找相互作用的蛋白质,本文以探究该细菌双杂交系统灵敏度低的原因为切入点,进而根据具体原因采取相应策略,改进了此细菌双杂交系统的灵敏度,为研究链霉菌及其他细菌蛋白质之间的相互作用提供更好的方法支撑。
1 材料与方法 1.1 材料 1.1.1 菌种与质粒大肠杆菌Escherichia coli JM109,E. coli BTH101 (cya-)[3]菌株和质粒pIJ8660[20]为本实验室保存;质粒pKT25linker、pUT18Clinker、pT25-zip和pT18-zip由法国国家科学研究院Emmanuelle Bouveret惠赠[3];质粒pKT25-scbR、pTW1、pTW2、pTW1-1、pTW1-2、pTW1-3、pTW1-4、pTW1-5和pTW1-6为本实验室构建。
1.1.2 试剂和酶本研究所用Phusion DNA聚合酶,KOD plus DNA聚合酶,2×Taq mix和Taq DNA 连接酶均购自Biolink;dNTPs购自TaKaRa公司;高纯质粒小量快速提取试剂盒和胶回收试剂盒购自北京博迈德生物技术有限公司;引物在上海英骏生物技术有限公司合成。
1.1.3 主要仪器超低温冰箱 (DW-86L626),酶标仪 (Synergy H4 Hybrid Reader),台式离心机 (Sorvall legend RT+ centrifuge),PCR仪 (DNA Engine Peltier Thermo Cycler)。
1.1.4 引物本研究所用引物见表1。
| Primer name | Primer sequence (5ʹ-3ʹ) |
| pKT25-scbR-F | AGGGTCGACTCTAGAGGATCCCCGGGTACCTATGGCCAAGCAGGACCGGGCGATC |
| pKT25-scbR-R | ACGGCCAGTGAATTCTTACTTACTTAGGTACCCCTCAGTCCTTCCCGGTCGGTG |
| pKT-F | TCGCGGCCGAACTGGCACCGACCGGGAAGGACTGAGGGGTACCTAAGTAAGTAAG |
| pKT-R | TGCCGCGTGCGGATCGCCCGGTCCTGCTTGGCCATAGGTACCCGGGGATCCTCTAG |
| pTW1-18-F | AGGGTCGACTCTAGAGGATCCCCGGGTACCTTTTACACTTTATGCTTCCGGCTC |
| pTW2-18-R | ACGGCCAGTGAATTCTTACTTACTTAGGTACCCCCGGGGATCCTCTAGAGTCGAC |
| pTW1-F | ACGCCACTGCAGGTCGACTCTAGAGGATCCCCGGGGGTACCTAAGTAAGTAAG |
| pTW1-R | ACAACATACGAGCCGGAAGCATAAAGTGTAAAAGGTACCCGGGGATCCTCTAGAG |
| Gfp-F | AGCGGGTGTTGGCGGGTGTCGGGGCTGGCTTAACTATCATTTGTACAGTTCATCC |
| Gfp-R | TCGCTCACATTTAATGTTGATGAAAGCTGGCTATGATAATTCTAAGTAGCTGAC |
| pLac-F | TCCTCATCCTGTCTCTTGTCAGCTACTTAGAATTATCATAGCCAGCTTTCATCAAC |
| pLac-R | ACCGTATTACCGCCTTTGAGTGAGCTGATACCGCTCGCTCGGTAGTGGGATACGAC |
| pTW2-F | AGCTGTCTTCGGTATCGTCGTATCCCACTACCGAGCGAGCGGTATCAGCTCACTC |
| pTW2-R | TCACGCATGGTATGGATGAACTGTACAAATGATAGTTAAGCCAGCCCCGACAC |
| pTW1-1-18-F | AGTTGCGCGCCTGAAAAAACTGGTGGGTGAACGTTTTACACTTTATGCTTCCGGCTC |
| pTW1-1-18-R | ACGACGGCCAGTGAATTCTTACTTACTTAGGTACCCCGAATTCCCACGTTCACCCA |
| pTW1-1-F | TGAAAAAACTGGTGGGTGAACGTGGGAATTCGGGGTACCTAAGTAAGTAAG |
| pTW1-1-R | ACAACATACGAGCCGGAAGCATAAAGTGTAAAACGTTCACCCACCAGTTTTTTC |
| pTW1-2-18-F | AGTTGCGCGCCTGAAAAAACTGGTGGGTGAACGTTTTACACTTTATGCTTCCGGCTC |
| pTW1-2-18-R | ACGGCCAGTGAATTCTTACTTACTTAGGTACCCCCGGGGATCCTCTAGAGTCGAC |
| pTW1-2-F | TGGAACGCCACTGCAGGTCGACTCTAGAGGATCCCCGGGGGTACCTAAGTAAGTAAG |
| pTW1-2-R | ACAACATACGAGCCGGAAGCATAAAGTGTAAAACGTTCACCCACCAGTTTTTTC |
| pTW1-3ScbR-F | TGCAGGGTCGACTCTAGAGGATCCCCGGGTACCTATGGCCAAGCAGGACCG |
| pTW1-3ScbR-R | ACACAACATACGAGCCGGAAGCATAAAGTGTAAATCAGTCCTTCCCGGTCGGTG |
| pTW1-3-F | TCGCGGCCGAACTGGCACCGACCGGGAAGGACTGATTTACACTTTATGCTTCC |
| pTW1-3-R | TCTGCCGCGTGCGGATCGCCCGGTCCTGCTTGGCCATAGGTACCCGGGGATCCTCTAG |
| pTW1-5bldm-F | TGCAGGGTCGACTCTAGAGGATCCCCGGGTACCTGTGTCCGTTCTCCTCGAGCAG |
| pTW1-5bldm-R | ACGGCCAGTGAATTCTTACTTACTTAGGTACCCCTCAGTGGATGATGCCCGTG |
| pTW1-5-F | TCGCGGTGGCCCTGCGCACGGGCATCATCCACTGAGGGGTACCTAAGTAAGTAAG |
| pTW1-5-R | AGGCTTGCAGGCTGCTCGAGGAGAACGGACACAGGTACCCGGGGATCCTCTAG |
| pTW1-6whiI-F | CTGCAGGGTCGACTCTAGAGGATCCCCGGGTACCTGTGGCAGCACCGCAGAACTAC |
| pTW1-6whiI-R | ACGGCCAGTGAATTCTTACTTACTTAGGTACCCCTCACTTCAGGAAGTCCGGCAC |
| pTW1-6-F | AGGAACTGGACGTGCCGGACTTCCTGAAGTGAGGGGTACCTAAGTAAGTAAG |
| pTW1-6-R | TGATGACTGCGAGGTAGTTCTGCGGTGCTGCCACAGGTACCCGGGGATCCTCTAG |
| pTW1-4bldM-F | TGCAGGGTCGACTCTAGAGGATCCCCGGGTACCTGTGTCCGTTCTCCTCGAGCAG |
| pTW1-4bldM-R | AGTGAATTCTTACTTACTTAGGTACCCCTCAGTGGATGATGCCCGTGCGCAG |
| pTW1-4whiI-F | AACGCCACTGCAGGTCGACTCTAGAGGATCCCCGGTGGCAGCACCGCAGAACTAC |
| pTW1-4whiI-R | TGAGAGTGCACCATATTACTTAGTTATATCGATTCACTTCAGGAAGTCCGGCAC |
| pTW1-4-F | TCGCGGTGGCCCTGCGCACGGGCATCATCCACTGAGGGGTACCTAAGTAAGTAAG |
| pTW1-4-R | ACTGCGAGGTAGTTCTGCGGTGCTGCCACCGGGGATCCTCTAGAGTCGACCTG |
| pTW1-4-18-F | TCGCGGTGGCCCTGCGCACGGGCATCATCCACTGAGGGGTACCTAAGTAAGTAAG |
| pTW1-4-18-R | TGATGACTGCGAGGTAGTTCTGCGGTGCTGCCACCGGGGATCCTCTAGAGTCGAC |
构建质粒pKT25-scbR:以天蓝色链霉菌 Streptomyces coelicolor基因组为模板,用表1中的引物pKT25-scbR-F/R扩增基因scbR片段,以质粒pT25zip为模板,用表1中pKT-F/R引物扩增pKT25骨架片段,扩增出的基因片段经过琼脂糖凝胶电泳分析后,用胶回收试剂盒回收DNA片段,两个片段Gibson组装连接[21]。
构建质粒pTW1:分别以质粒pT25-zip和pT18-zip为模板,用表1中引物pTW1-18-F/R和pTW1-F/R扩增基因片段T18,以及pTW1-25骨架,两个片段Gibson组装连接[21]。
构建质粒pTW2:以pIJ8660为模板,用表1中引物pTW2-gfp-F/R扩增gfp片段,以E. coli BTH101为模板用表1中引物pLac-F/R扩增LacZ启动子序列,同时以pUT18Clinker为模板,用引物pTW2-F/R扩增pTW2骨架,3个扩增片段用Gibson法组装成质粒[21]。
构建质粒pTW1-1:用表1中引物pTW1-1-18-F/R和pTW1-1-F/R,分别以质粒pT18-zip和pT25-zip为模板进行PCR反应,将产物用Gibson体系组装[21]。
构建质粒pTW1-2:以pT18-zip为模板,pTW1-2-18-F/R为引物,PCR扩增出T18基因序列,以pT25-zip质粒为模板,用pTW1-2-F/R引物扩增pTW1-2质粒骨架,Gibson组装构建质粒[21]。
构建质粒pTW1-3:以质粒pKT25-scbR为模板,用表1中引物pTW1-3ScbR-F/R进行PCR扩增,得ScbR基因片段,以质粒pTW1-2为模板,用表1中pTW1-3-F/R引物进行PCR,得到pTW2-3骨架片段,Gibson连接两个片段[21]。
构建质粒pTW1-4;以天蓝色链霉菌基因组为模板,分别以表1中pTW1-4bldM-F/R和pTW1-4whiI-F/R为引物扩增DNA片段bldM和whiI,以pT18-zip质粒为模板,引物用表1中的pTW1-4-18-F/R,扩增T18片段;以质粒pTW1-1为模板,以表1中的pTW1-4-F/R为引物,扩增pTW1-4的线性DNA序列,将4个DNA片段Gibson组装[21],构建质粒。
构建质粒pTW1-5:以天蓝色链霉菌基因组为模板,以表1中pTW1-5bldm-F/R为引物扩增DNA片段bldM,以质粒pTW1-3为模板,用表1中引物pTW1-5-F/R,扩增pTW1-5线性片段,两片段Gibson组装构建环状质粒[21]。
构建质粒pTW1-6:以天蓝色链霉菌基因组为模板,以表1中pTW1-6whiI-F/R为引物扩增DNA片段whiI,以质粒pTW1-3为模板,用表1中引物pTW1-6-F/R,扩增pTW1-6线性片段,两片段Gibson组装构建环状质粒[21]。上述质粒的具体构建方法参考文献[22]。
1.2.2 细菌双杂交系统假阳性评价方法将天蓝色链霉菌中的重要调控蛋白ScbR的编码基因与细菌双杂交系统中的T25片段融合构建成质粒pKT25-ScbR,转化质粒pKT25-ScbR与质粒pUT18Clinker入BTH101菌中 (实验组同时作为阴性对照),并设置阳性对照 (质粒pT25-zip和pT18-zip同时转化入BTH101)、阴性对照1 (pKT25linker和pUT18Clinker质粒同时转化入BTH101) 和阴性对照2 (质粒pT25-zip和pUT18Clinker同时转化入BTH101),经过转化获得外源质粒的菌被涂布于含有合适抗生素的LB平板上 (含0.5 mmol/L IPTG和40 μg/mL X-gal),30 ℃培养48 h 后,观察LB-X-gal平板上菌落的显色反应。
1.2.3 细菌双杂交系统酶活检测方法β-半乳糖苷酶酶活测定方法参考Battesti等的方法[3]。
1.2.4 细菌双杂交系统的改进策略将构建的质粒pTW1-2和pWT2同时转入E. coli BTH101菌中,作为阴性对照1,阴性对照2为含有外源质粒pTW1-3和pWT2的E. coli BTH101菌,获得质粒pTW1-1和pTW2的E. coli BTH101菌作为阳性对照组,通过和假阳性评价方法中一样的操作步骤,观察各个LB-X-gal平板上菌落的显色情况,并分析β-半乳糖苷酶的活性,同时,从每个平板上挑取单菌落接入液体LB培养基中培养24 h,再从每种培养液中取出200 μL (共取4次) 置于96微孔板中,用酶标仪 (激发光为488 nm,发射光为529 nm) 检测蛋白GFP的荧光值[23]。
1.2.5 改进的细菌双杂交系统的验证方法用天蓝色链霉菌蛋白BldM或WhiI的编码基因分别与T18和T25融合构建质粒pTW1-5或pTW1-6,把基因bldM和whiI共同插入pTW1质粒与T25和T18融合构建pTW1-4质粒,然后将质粒pTW1、pTW1-4、pTW1-5、pTW1-6分别与质粒pTW2共同转化入E. coli BTH101 (其中共同转入质粒pTW2和pTW1-4的一组为阳性对照,其余组合为阴性对照),按照与上步方法一样的操作,观察LB-X-gal平板上菌落的显色情况,分析酶活,同时用酶标仪检测报告基因gfp的荧光值。
2 结果与分析 2.1 细菌双杂交系统的灵敏度分析在基于腺苷酸环化酶的细菌双杂交系统中,质粒pKT25linker和pUT18Clinker分别含有腺苷酸环化酶激活区的T25和T18两个相对独立的功能片段;质粒pT25-zip和pT18-zip含有能相互作用的zip基序 (Leucine zipper motif)[24],用于表达融合蛋白T25-zip和T18-zip。通过两个zip之间的互作,可以重建腺苷酸环化酶的活性[3]。为了筛找能与天蓝色链霉菌调控蛋白ScbR互作的调控蛋白,我们构建质粒pKT25-ScbR,希望通过该细菌双杂交技术筛选与其相互作用的蛋白。
首先对该细菌双杂交系统的灵敏性进行评鉴,结果表明,阳性对照E. coli BTH101 (pT25-zip+pT18-zip) 的菌落能够在X-gal平板上显蓝色 (图1A),阴性对照E. coli BTH101(pKT25linker+pUT18Clinker) 的菌落在X-gal平板上没有显蓝色 (图1B);然而随着培养时间的延长,阴性对照1的克隆也会逐渐显蓝色 (结果未展示)。而另外两组阴性对照E. coli BTH101 (pKT25-scbR+pUT18Clinker) 和E. coli BTH101 (pT25-zip+pUT18Clinker) 在X-gal平板上有部分克隆却显示为蓝色 (图1C和1D),这些结果表明该细菌双杂交系统的LacZ报告输出不灵敏,单纯的靠显色反应分辨阳性克隆存在一定的假阳性。
|
| 图1 蓝白斑评价细菌双杂交系统的灵敏性 Fig.1 The phenotype of different clones. (A) The phenotype of E. coli BTH101 (pT25-zip+pT18-zip). (B) The phenotype of E. coli BTH101 (pKT25linker+pUT18Clinker). (C) The phenotype of E. coli BTH101 (pKT25-scbR+ pUT18Clinker). (D) The phenotype of E. coli BTH101 (pT25-zip + pUT18Clinker). The transformants were spreaded on plates with 0.5 mmol/L IPTG and 40 μg/mL X-gal |
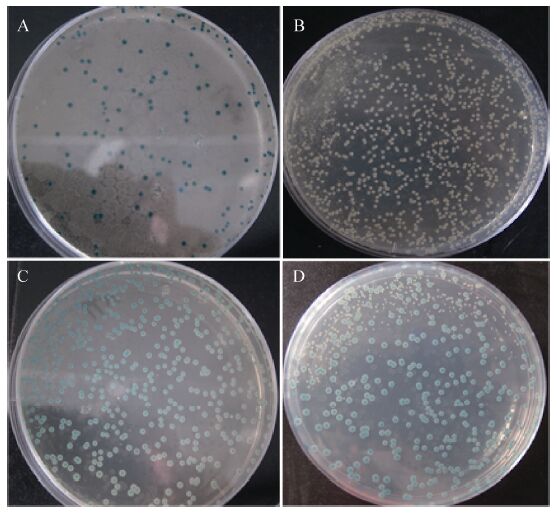
为了分析该细菌双杂交系统依靠蓝白斑显色反应鉴定阳性克隆不灵敏的原因,随机挑取以上克隆,进一步对LacZ活性进行定量分析,结果表明阴性对照E. coli BTH101 (pKT25-scbR+pUT18Clinker) 和阴性对照E. coli BTH101 (pT25-zip+pUT18Clinker) 不同的克隆之间有较大的酶活差异,而阳性对照E. coli BTH101 (pT25-zip+pT18-zip) 和阴性对照E. coli BTH101 (pKT25linker+pUT18Clinker) 的酶活相对比较稳定 (图2)。这表明该细菌双杂交系统灵敏度低的原因确实是由于不同克隆间LacZ酶活有较大差异造成的。阳性克隆中,lacZ基因的表达响应的是腺苷酸环化酶产生的cAMP信号,而在假阳性克隆中,由于存在非特异性相互作用,存在cAMP和除cAMP信号之外的其他生理因素对lacZ表达的影响,如在该系统中,除了cAMP和激活蛋白CAP结合后激活了lacZ基因的启动子[3],lacZ启动子还受到LacI等其他调控蛋白的直接或间接调控,所以不同克隆的生理状态也可能会影响lacZ的表达。
|
图2
细菌双杂交系统LacZ输出的灵敏性分析
Fig.2
The sensitivity of LacZ assay of bacterial two-hybrid system. The box-plot indicates the range of LacZ activities of random picked clones from selection plates. Box and Whisker plots provide a simple description of a distribution of values by depicting the 25 th and the 75 th percentile values as the bottom and top of a box,respectively. The median is depicted as a line across the box. The values are  ±s from three independent experiments. ±s from three independent experiments.
|
在该细菌双杂交系统中,蛋白质之间相互作用产生的cAMP信号为控制LacZ输出的主效信号,而其他的生理因素为非主效信号。因此为了提高该系统的灵敏度,应该降低本底cAMP信号 (非特异性相互作用产生cAMP信号) 和非主效的生理因素对该系统的影响。我们通过增加lacZ启动子的数量来缓冲本底cAMP信号和非主效的生理因素的影响,同时,为了提高双杂交系统的报告基因输出的灵敏性,降低假阳性发生的概率,采用了第二个报告基因gfp。改进后的双杂交系统,含有用lacZ启动子控制的gfp报告基因的低拷贝质粒pWT2 (图3A),因此该系统兼具蓝白斑高效筛选和GFP高效定量的双重优势。

|
图3
改进的细菌双杂交系统
Fig.3
The improved bacterial two-hybrid system. (A) The plasmids of the improved bacterial two-hybrid system. (B) The evaluation of the GFP output of the improved bacterial two-hybrid system. (C) The evaluation of the LacZ output the improved bacterial two-hybrid system. The values are 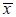 ±s from three independent experiments. ±s from three independent experiments.
|
实验结果表明,阴性对照E. coli BTH101 (pTW1-2+pWT2) 和E. coli BTH101 (pTW1-3+ pWT2) 的检测结果都明显低于阳性对照E. coli BTH101 (pTW1-1+pWT2) (图3B和3C)。同时,GFP作为报告输出的灵敏性明显好于LacZ。这可能是因为gfp在游离质粒上拥有多个拷贝,测得的GFP结果为多个lacZ启动子的综合效应,显著抵消了非特异信号和生理扰动;而lacZ只在基因组上存在一个拷贝,所以报告输出的结果的相对差异略大于GFP。总之,无论用LacZ活性分析还是GFP荧光强度分析,改进的细菌双杂交系统的灵敏性确实得到了明显的改善。
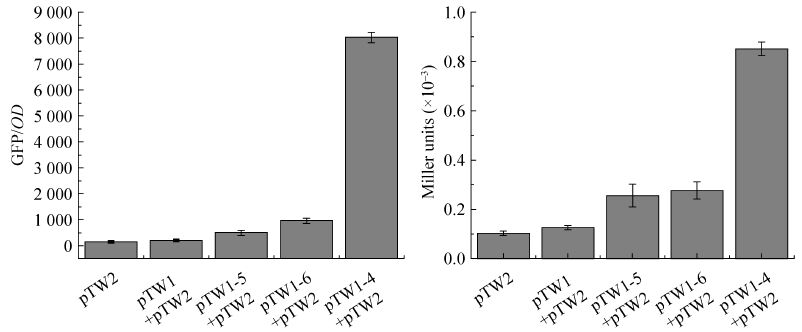
2.4 改进的细菌双杂交系统的验证Mark J. Buttner课题组最近报道天蓝色链霉菌的BldM和WhiI蛋白之间存在相互作用[19]。为了验证改进的双杂交系统的灵敏性,分别将BldM或WhiI与T25融合构建质粒pTW1-5或pT W1-6 (图3A),以及把BldM、WhiI分别插入pTW1质粒,与T25和T18融合构建pTW1-4质粒 (图3A)。然后测试双杂交系统对它们的响应,结果如图4所示,表明改进后的双杂交系统测试的BldM和WhiI相互作用的结果与结果3中Zip相互作用的结果相似:无论GFP还是LacZ输出的阳性结果都显著高于各个阴性对照。因此,改进后的细菌双杂交系统具有更灵敏的报告输出,能够明显降低假阳性的发生。
|
图4
改进的细菌双杂交系统的验证
Fig.4
The verification assays of the GFP and LacZ output of the improved bacterial two-hybrid system. Green fluorescence and LacZ activity of different strains was measured after incubation in LB medium for 24 h. The values are 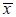 ±s from three independent experiments. ±s from three independent experiments.
|
蛋白质之间的相互作用具有重要的生物学意义,基于腺苷酸环化酶功能互补的细菌双杂交系统在鉴定原核生物蛋白之间相互作用中具有无可比拟的优势[25]。但是也存在灵敏度不高等问题[26]。本工作中,发现该系统灵敏度不高的原因是本底cAMP信号及其他内源调控系统对lacZ启动子的扰动造成的。针对这一发现,本工作创造性地采用了增加lacZ启动子的拷贝数来缓冲这些内源生理扰动的策略,并收到良好的效果;同时为了更精确地检测细菌双杂交系统的报告输出,本工作采用了gfp和lacZ双报告基因的策略,LacZ可以在平板上定性地高效筛选,GFP可以在液体培养中精确定量,同时检测两个不同的报告输出将大大降低假阳性的发生。
测试改进的细菌双杂交系统时发现,GFP输出相对于LacZ输出更为灵敏,这可能是由于gfp在质粒上,表现出多拷贝的累加效应,在一定程度上缓冲了本底cAMP信号和其他非主效生理因素的影响。另外,在利用改进的细菌双杂交系统时,首先初步用蓝白斑定性筛选,然后用GFP强度进行精确定量分析,将会收到更为理想的效果。总之,本研究改进的细菌双杂交系统的灵敏性得到了显著提高,有助于利用其更精确地研究原核生物蛋白质之间的相互作用。
| [1] | Munier H, Krin E, Gilles AM, et al. Structural and functional organization of the catalytic domain of a bacterial toxin: Bordetella pertussis adenylate cyclase//Papa S, Azzi A, Tager JM, Eds. Adenine Nucleotides in Cellular Energy Transfer and Signal Transduction: Molecular and Cell Biology Updates. Basel: Birkhäuser, 1992: 335-344. |
| [2] | Karimova G, Pidoux J, Ullmann A, et al. A bacterial two-hybrid system based on a reconstituted signal transduction pathway. Proc Natl Acad Sci USA, 1998, 95(10): 5752-5756. |
| [3] | Battesti A, Bouveret E. The bacterial two-hybrid system based on adenylate cyclase reconstitution in Escherichia coli. Methods, 2012, 58(4): 325-334. |
| [4] | Karimova G, Ullmann A, Ladant D.Bordetella pertussis adenylate cyclase toxin as a tool to analyze molecular interactions in a bacterial two-hybrid system. Int J Med Microbiol, 2000, 290(4/5): 441-445. |
| [5] | Karimova G, Ullmann A, Ladant D. A bacterial two-hybrid system that exploits a cAMP signaling cascade in Escherichia coli. Methods Enzymol, 2000, 328: 59-73. |
| [6] | Karimova G, Ladant D, Ullmann A. Two-hybrid systems and their usage in infection biology. Int J Med Microbiol, 2002, 292(1): 17-25. |
| [7] | Scheu PD, Witan J, Rauschmeier M, et al. CitA/CitB two-component system regulating citrate fermentation in Escherichia coli and its relation to the DcuS/DcuR system in vivo. J Bacteriol, 2012, 194(3): 636-645. |
| [8] |
Duan QD, Chen TQ. The principal and development of yeast two-hybrid. J Anim Sci Vet Med, 2009, 28(1): 56-58 (in Chinese). 段强德, 陈铁桥. 酵母双杂交体系的原理及研究进展. 畜牧兽医杂志, 2009, 28(1): 56-58. |
| [9] | Karimova G, Dautin N, Ladant D. Interaction network among Escherichia coli membrane proteins involved in cell division as revealed by bacterial two-hybrid analysis. J Bacteriol,2005, 187(7): 2233-2243. |
| [10] | Stynen B, Tournu H, Tavernier J, et al. Diversity in genetic in vivo methods for protein-protein interaction studies: from the yeast two-hybrid system to the mammalian split-luciferase system. Microbiol Mol Biol Rev, 2012, 76(2): 331-382. |
| [11] | Hopwood DA, Chater KF, Bibb MJ. Genetics of antibiotic production in Streptomyces coelicolor A3(2), a model streptomycete. Biotechnology, 1995, 28: 65-102. |
| [12] | Liu G, Chater KF, Chandra G, et al. Molecular regulation of antibiotic biosynthesis in Streptomyces. Microbiol Mol Biol Rev, 2013, 77(1): 112-143. |
| [13] | Bentley SD, Chater KF, Cerdeño-Tárraga AM, et al. Complete genome sequence of the model actinomycete Streptomyces coelicolor A3(2). Nature, 2002, 417(6885): 141-147. |
| [14] | Bibb MJ. Regulation of secondary metabolism in Streptomycetes. Curr Opin Microbiol, 2005, 8(2): 208-215. |
| [15] | van Wezel GP,McDowall KJ. The regulation of the secondary metabolism of Streptomyces: new links and experimental advances. Nat Prod Rep, 2011, 28(7): 1311-1333. |
| [16] | Takano E. γ-Butyrolactones: Streptomyces signalling molecules regulating antibiotic production and differentiation. Curr Opin Microbiol, 2006, 9(3): 287-294. |
| [17] | Kitani S, Miyamoto KT, Takamatsu S, et al. Avenolide, a Streptomyces hormone controlling antibiotic production in Streptomyces avermitilis. Proc Natl Acad Sci USA, 2011, 108(39): 16410-16415. |
| [18] | Choi SU, Lee CK, Hwang YI, et al. γ-butyrolactone autoregulators and receptor proteins in non-Streptomyces actinomycetes producing commercially important secondary metabolites. Arch Microbiol, 2003, 180(4): 303-307. |
| [19] | Al-Bassam MM, Bibb MJ, Bush MJ, et al. Response regulator heterodimer formation controls a key stage in Streptomyces development. PLoS Genet, 2014, 10(8): e1004554. |
| [20] | Sun J, Kelemen GH, Fernández-Abalos JM, et al. Green fluorescent protein as a reporter for spatial and temporal gene expression in Streptomyces coelicolor A3(2). Microbiology, 1999, 145(9): 2221-2227. |
| [21] | Gibson DG, Young L, Chuang RY, et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat Methods, 2009, 6(5): 343-345. |
| [22] | Sambrook J, Fritsh E, Maniatis T. Molecular Cloning: A Laboratory Manual. 3rd ed. New York: Cold Spring Harbor Laboratory Press, 2001: 1-66. |
| [23] | Pédelacq JD, Cabantous S, Tran T, et al. Engineering and characterization of a superfolder green fluorescent protein. Nat Biotechnol, 2006, 24(1): 79-88. |
| [24] | Karimova G, Ullmann A, Ladant D. Protein-protein interaction between Bacillus stearothermophilus tyrosyl-tRNA synthetase subdomains revealed by a bacterial two-hybrid system. J Mol Microbiol Biotechnol, 2001, 3(1): 73-82. |
| [25] | Brent R, Finley RL Jr. Understanding gene and allele function with two-hybrid methods. Annu Rev Genet, 1997, 31: 663-704. |
| [26] |
Liao GX, Yu GQ, zhu JB. Improvement of bacterial two hybrid system. Acta Biochim Et Biophys Sin, 2001, 33(3): 331-334 (in Chinese). 廖贡献, 俞冠翘, 朱家壁. 细菌双杂交系统的应用和改进. 生物化学与生物物理学报, 2001, 33(3): 331-334. |
 2016, Vol. 32
2016, Vol. 32