服务
文章信息
- 杨金龙, 程逸超, 朱圆圆, 朱均均, 陈婷婷, 徐勇, 勇强, 余世袁
- Jinlong Yang, Yichao Cheng, Yuanyuan Zhu, Junjun Zhu, Tingting Chen, Yong Xu, Qiang Yong, Shiyuan Yu
- 酚酮类对树干毕赤酵母乙醇发酵及脂肪酸组成的影响
- Effect of phenolic ketones on ethanol fermentation and cellular lipid composition of Pichia stipitis
- 生物工程学报, 2016, 32(2): 185-194
- Chin J Biotech, 2016, 32(2): 185-194
- 10.13345/j.cjb.150257
-
文章历史
- Received: June 3, 2015
- Accepted: August 17, 2015
2. 江苏省生物质绿色燃料与化学品重点实验室,江苏 南京 210037
2. Jiangsu Key Laboratory of Biomass-based Green Fuel and Chemicals, Nanjing 210037, Jiangsu, China
化石能源日益短缺,生物质能源是一种很有前景的替代能源[1]。在绿色经济中,燃料乙醇是一种发展较快并且很有前途的产业。在我国对国外石油依赖度很高、能源危机的今天,发展燃料乙醇更有着特殊的意义[2]。可再生植物资源主要是由纤维素、半纤维素和木质素3大部分组成。在一些农作物如玉米秸秆中,半纤维素 (尤其是木聚糖) 的含量与纤维素含量相当。植物纤维素原料中半纤维素的主要单糖是木糖,有效地利用木糖和其他半纤维素单糖是植物纤维素原料发酵生成乙醇的关键[3, 4],已知树干毕赤酵母是少数天然能够发酵木糖产生乙醇并且发酵效率较高的菌种之一[5]。木质纤维原料作为可再生植物资源制取燃料乙醇一般包括3大步骤:原料预处理、酶水解和乙醇发酵[6],然而木质纤维素在预处理过程中会产生一定量的副产物,其中包括弱酸、糠醛、酚类等[7],这些副产物具有一定的毒性,严重降低了发酵效率,甚至可以完全抑制发酵的进行[8, 9]。在木质纤维原料预处理和水解过程中,根据甲氧基化程度和官能团的不同,酚类可以分为酚醛、酚酮、酚酸等3类。Zhu等[10]研究了3种酚醛类 (香草醛、紫丁香醛、4-羟基苯甲醛) 和3种酚酸类(香草酸、紫丁香酸、4-羟基苯甲酸)对树干毕赤酵母乙醇发酵的影响,结果表明,酚醛类和酚酸类均有一定的抑制作用。Klinke等[11]在综述中总结了在稀酸预处理的水解液中发现了酚酮类物质。目前已知的酚酮类物质主要有4-羟基苯乙酮、4-羟基-3-甲氧基苯乙酮、4-羟基-3,5-二甲氧基苯乙酮[12]。然而酚酮类物质对树干毕赤酵母乙醇发酵的影响尚未见报道。此外,抑制物对微生物发酵的影响首先作用于微生物的细胞膜[13],细胞膜的流动性直接影响到物质的跨膜运输。而细胞膜脂肪酸是细胞总脂肪酸中含量最高、最为关键的一类,并且目前尚无统一的微生物细胞膜脂肪酸分析程序,因此,可以通过测定细胞总脂肪酸来间接反映细胞膜磷脂中脂肪酸的变化,从而推测抑制物对细胞膜的影响[14]。本文主要研究3种酚酮类物质对树干毕赤酵母乙醇发酵及其细胞脂肪酸组成的影响,这对于提高乙醇产率、降低植物纤维素原料生产燃料乙醇的成本具有十分重要的意义。
1 材料与方法 1.1 材料 1.1.1 菌种树干毕赤酵母Pichia stipitis NLP31,由南京林业大学生物化工研究所筛选并保藏,保存在4 ℃琼脂-糖斜面上。
1.1.2 培养基斜面培养基 (g/L):木糖20,蛋白胨5,酵母浸膏3,琼脂25,pH值5.5;活化及增殖培养基 (g/L):木糖30,蛋白胨5,酵母浸膏3,用蒸馏水配制;发酵培养基:木糖45 g/L,(NH4)2SO4 5 g/L,KH2PO4 3 g/L,MgSO4·7H2O 0.5 g/L,EDTA 30 mg/L,ZnSO4·7H2O 9 mg/L,MnCl2·2H2O 2 mg/L,CoCl2·6H2O 0.6 mg/L,CuSO4·5H2O 0.6 mg/L,Na2MoO4·H2O 0.8 mg/L,CaCl2·2H2O 9 mg/L,FeSO4·7H2O 6 mg/L,H3BO3 2 mg/L,KI 0.2 mg/L。用pH 6.0的柠檬酸缓冲液配制[15]。
1.2 方法 1.2.1 酵母培养方法活化及增殖培养条件:温度30 ℃,转速 170 r/min。当酵母增殖几轮,酵母OD600达到10以后,将离心后的酵母转入发酵培养基进行发酵,发酵条件为:温度30 ℃,转速150 r/min。
1.2.2 木糖发酵培养基中添加抑制物的发酵向木糖发酵培养基中分别添加不同浓度 (0.25、0.50、0.75、1.00、1.50 g/L) 的3种酚酮类抑制物 (4-羟基苯乙酮、4-羟基-3-甲氧基苯乙酮、4-羟基-3,5-二甲氧基苯乙酮),接入初始接种量OD600为10的树干毕赤酵母进行乙醇发酵。
1.2.3 总脂肪酸的提取脂肪酸的提取参考Bligh和Dyer脂肪酸提取步骤[16]。发酵结束后离心收集酵母 (3.0 g湿重),酵母泥用30 mL无菌水洗涤,4 000 r/min离心10 min,重复洗涤两次,将洗涤后的酵母泥悬浮在10 mL的10 %冷的三氯乙酸中。然后向三氯乙酸酵母悬浮液中加入20 mL蒸馏水、80 mL甲醇和40 mL氯仿,超声波下破碎细胞30 min。超声波结束后将该混合物再电磁搅拌90 min,电磁搅拌结束后加入40 mL氯仿和 40 mL蒸馏水于该悬浮液,分层后得到的氯仿层,用无水硫酸钠干燥后于旋转蒸发仪中蒸发去除有机溶剂,得到酵母总脂肪。
1.2.4 甲酯化制备在10 mL具塞玻璃管中,将10 mg左右的总脂肪溶解于9 mL新鲜配制的2%硫酸溶液 (用无水甲醇溶解),于70 ℃水浴中加热 2 h后,加入9 mL蒸馏水稀释,用正己烷萃取,将萃取后的正己烷混合,用蒸馏水洗涤正己烷,用无水硫酸钠干燥后进行GC/MS分析。
1.3 分析方法 1.3.1 木糖、乙醇和木糖醇浓度的测定木糖、乙醇和木糖醇等浓度定量分析在美国Agillent1260型高效液相色谱仪 (HPLC) 上进行。采用Bio-Rad HPX-87H柱 (7.8 mm× 300 mm),柱温55 ℃,流动相0.005 mol/L的硫酸,流速0.6 mL/min,上样量10 μL,示差折光检测器检测。外标法测定[15]。
1.3.2 酵母浊度的测定采用比浊法测定[10]。取0.5或1 mL发酵液于1.5 mL离心管中,10 000 r/min离心5 min后去除上清液,用生理盐水洗涤,重悬酵母,再重复操作一次后用蒸馏水稀释,在723N型分光光度计600 nm波长下用0.5 cm光径的比色皿测定吸光度,再乘以稀释倍数即为酵母的光密度 (OD) 值。
1.3.3 发酵参数的计算方法糖利用率表示消耗糖的浓度与发酵初始糖的浓度的百分比。乙醇得率是指实验中测定的乙醇浓度与发酵过程中所消耗的糖在理论上能够转化成乙醇浓度的百分比,理论上1 g葡萄糖得到0.51 g乙醇,而1 g木糖得到0.46 g乙醇[17]。
1.3.4 脂肪酸成分分析使用Trace GC/MS联用仪对甲酯化后的样品进行分析,色谱柱采用DB-5MS (30 m×0.25 mm ×0.25 μm),N2 作为柱中的载气,载气流速: 1.0 mL/min。质谱仪中离子化方式为EI,发射电流200 μA,电子能量为70 eV,气化室温度250 ℃。柱温采用程序升温:初温80 ℃,保持3 min;以8 ℃/min升到260 ℃,保持5 min。测定完后,经计算机化学工作站分析检索其中的脂肪酸组分,并经数据处理系统按峰面积归一化法计算各脂肪酸组分的相对百分含量。
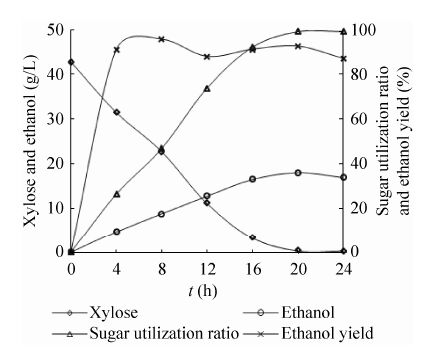
2 结果与讨论 2.1 未添加抑制物的木糖发酵培养基的乙醇发酵历程在研究酚酮类物质对树干毕赤酵母乙醇发酵影响之前,需要对树干毕赤酵母进行木糖乙醇发酵历程的研究。在250 mL的三角瓶中加入100 mL发酵培养基,以P. stipitis NLP31为发酵菌株,在初始接种量OD=10,150 r/min、30 ℃的摇床中发酵24 h,每隔4 h取样,HPLC分析发酵液成分,其木糖、乙醇、糖利用率和乙醇得率随时间的变化如图1所示。
从图1中可以看出,随着发酵时间的延长,木糖浓度直线下降,发酵20 h时,木糖浓度仅为0.39 g/L,乙醇浓度达到18.06 g/L,此时糖利用率、乙醇得率分别为99.08%和92.57%,说明树干毕赤酵母能够高效地利用木糖发酵产乙醇;发酵24 h时,糖的利用率为99.15%,乙醇得率下降为87.08%,乙醇浓度下降为17.00 g/L,这可能是由于酵母利用乙醇作为碳源来满足自身生存的需要。
|
| 图1 树干毕赤酵母木糖发酵过程中参数的变化 Fig.1 Changes in the parameters during the fermentation of xylose medium by P. stipitis NLP31. |
木质纤维原料预处理和水解过程中的抑制物对酵母发酵的影响已经有了广泛的研究,主要集中在碳水化合物降解产物 (甲酸、乙酸、乙酰丙酸、5-羟甲基糠醛和糠醛) 和木质素降解产物 (酚酸和酚醛),但很少有研究涉及到木质素降解产物中的酚酮类物质,尤其针对木糖乙醇发酵,本文探索了木质纤维原料预处理和水解过程中已发现的3种酚酮类物质 (4-羟基苯乙酮、4-羟基-3-甲氧基苯乙酮、4-羟基-3,5-二甲氧基苯乙酮) 对树干毕赤酵母木糖乙醇发酵的影响。在45 g/L木糖发酵培养基中,分别添加一定浓度 (0.25、0.50、0.75、1.00和1.50 g/L) 的3种酚酮类物质,在初始接种量OD=10,30 ℃、150 r/min的条件下发酵24、36 h,其发酵产物乙醇浓度、发酵副产物木糖醇浓度、糖利用率和乙醇得率随时间的变化如表1所示。
| Compound | Concentration (g/L) | Sugar utilization ratio (%) | Ethanol concentration (g/L) | Ethanol yield (%) | |||
| 24 h | 36 h | 24 h | 36 h | 24 h | 36 h | ||
| Control | / | 99.16 | 99.24 | 17.00 | 15.36 | 87.08 | 79.41 |
| 4-Hydroxyacetophenone | 0.25 | 98.78 | 98.78 | 17.59 | 16.60 | 92.32 | 87.12 |
| 0.50 | 87.85 | 98.69 | 15.42 | 17.93 | 90.89 | 94.08 | |
| 0.75 | 75.01 | 97.09 | 12.62 | 15.41 | 85.81 | 80.96 | |
| 1.00 | 70.44 | 89.89 | 12.05 | 13.06 | 89.10 | 75.67 | |
| 1.50 | 56.61 | 81.78 | 9.34 | 11.83 | 85.74 | 75.18 | |
| 4-Hydroxy-3-methoxy- acetophenone | 0.25 | 98.07 | 98.97 | 16.88 | 17.15 | 87.20 | 87.79 |
| 0.50 | 91.60 | 98.45 | 16.03 | 16.16 | 90.77 | 85.14 | |
| 0.75 | 89.09 | 98.42 | 14.63 | 15.54 | 80.80 | 77.70 | |
| 1.00 | 79.32 | 95.64 | 13.41 | 14.68 | 87.15 | 79.13 | |
| 1.50 | 65.58 | 73.05 | 11.03 | 11.43 | 85.09 | 79.16 | |
| 4-Hydroxy-3,5-dimethoxy- acetophenone | 0.25 | 98.08 | 99.07 | 18.50 | 18.05 | 88.37 | 85.36 |
| 0.50 | 92.84 | 98.23 | 16.87 | 16.97 | 92.10 | 87.57 | |
| 0.75 | 97.22 | 98.24 | 16.18 | 15.29 | 89.89 | 84.06 | |
| 1.00 | 94.64 | 98.96 | 15.70 | 15.84 | 89.51 | 86.37 | |
| 1.50 | 82.10 | 98.36 | 15.14 | 16.86 | 93.42 | 86.00 | |
从表1可以看出,当3种酚酮类的浓度为0.25 g/L、发酵24 h时,木糖的利用率分别为98.78%、98.07%和98.08%,乙醇得率分别为92.32%、87.20%和88.37%,相比于不添加酚酮类发酵木糖利用率有所下降,说明低浓度 (0.25 g/L) 的酚酮类已经对树干毕赤酵母发酵起到抑制作用,随着酚酮类物质浓度的增加,抑制作用也越发明显,木糖利用率逐渐下降,乙醇得率也随着下降,当3种酚酮类物质浓度达到1.50 g/L时,发酵24 h,糖利用率分别为56.61%、65.58%和82.10%,乙醇产量分别为9.34、11.03和 15.14 g/L,乙醇得率分别为85.74%、85.09%和93.42%,其中4-羟基苯乙酮对树干毕赤酵母发酵的抑制作用最为明显,木糖利用率降低42.47%,4-羟基-3,5-二甲氧基苯乙酮抑制作用最弱,木糖利用率降低17.05%,此现象说明低分子量的酚酮类对树干毕赤酵母发酵抑制更为明显,Palmqvist等[18]研究发现在木质纤维素降解产生的多种抑制物中,酚类化合物对发酵具有最强的抑制作用,并且低分子量酚类化合物毒性更强,且取代基的位置 (邻位、间位、对位) 也影响酚类的毒性。发酵36 h时,当3种酚酮类物质的浓度小于1.00 g/L时,木糖的利用率大于90%,随着浓度的增加,糖利用率逐渐降低;当3种酚酮类物质的浓度为1.50 g/L,此时的木糖利用率分别为81.78%、73.05%和98.36%,乙醇得率分别为75.18%、79.16%和86.00%。通过比较24、36 h的糖利用率、乙醇浓度和乙醇得率可以发现,随着发酵时间的延长,糖利用率和乙醇浓度在增加,但乙醇得率并没有相应的增加,这说明在抑制物存在的条件下,酵母利用木糖转化成产物乙醇的得率在降低,有部分木糖可能用于抵抗抑制物对酵母抑制作用的消耗。通过比较不难发现,3种酚酮类物质对树干毕赤酵母乙醇发酵的抑制作用的大小为:4-羟基苯乙酮>4-羟基-3-甲氧基苯乙酮>4-羟基-3,5-二甲氧基苯乙酮,低分子量的酚酮类物质抑制作用更大。当酚酮类物质的浓度小于1.00 g/L时,延长了发酵时间,对树干毕赤酵母木糖乙醇发酵性能影响较小;当酚酮类物质的浓度大于 1.00 g/L 时对树干毕赤酵母木糖乙醇发酵性能已起到明显的抑制作用。
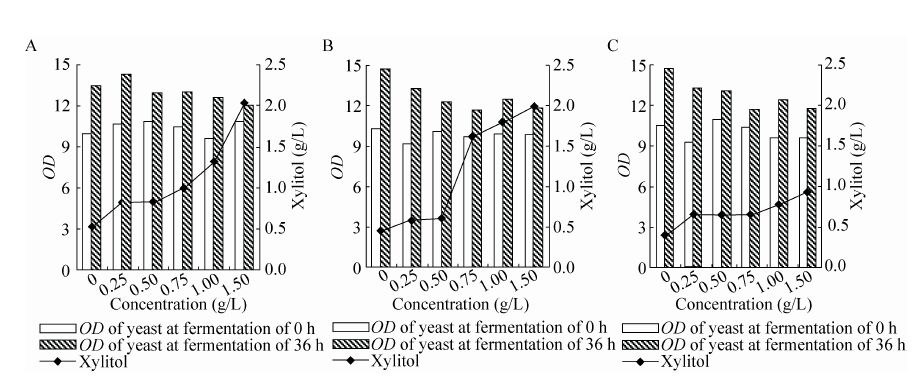
图2为发酵36 h时,酚酮类物质对树干毕赤酵母细胞OD值及发酵副产物木糖醇生成的影响。从图2可以看出,当不添加酚酮类物质时,酵母的生长繁殖速度较快,随着酚酮类物质浓度的增加,酵母生长繁殖的速度也减缓,然而酵母的生长速率仍然大于酵母的死亡速率,当酚酮类物质的浓度为1.50 g/L时,酵母的生长繁殖速度最慢,但酵母浓度高于发酵前的酵母浓度,说明酚酮类物质对酵母生长繁殖的抑制作用并不十分明显。
|
| 图2 添加酚酮类物质对树干毕赤酵母乙醇发酵过程中参数的变化 Fig.2 Changes in the parameters during the fermentation of phenolic ketones artificially added to the xylose medium by P. stipitis NLP31. (A) 4-hydroxyacetophenone. (B) 4-hydroxy-3-methoxy-acetophenone. (C) 4-hydroxy-3,5-dimethoxy-acetophenone. |
通过比较发酵副产物木糖醇,我们不难发现,随着酚酮类物质浓度的增加,木糖醇的产生也增加,同时,不同酚酮类物质对木糖醇的产量影响也有所不同。当不添加酚酮类物质时,发酵36 h,木糖醇的浓度小于0.5 g/L,随着酚酮类物质浓度的增加,木糖醇浓度也随之增加,当酚酮类物质的浓度为1.50 g/L时,添加4-羟基苯乙酮、4-羟基-3-甲氧基苯乙酮和4-羟基- 3,5-二甲氧基苯乙酮的木糖醇浓度分别为2.03、1.99和0.94 g/L,木糖醇的积累说明在含有抑制物的发酵培养基中,木糖代谢过程中的木糖醇脱氢酶的辅酶NADH积累,抑制了木糖醇脱氢酶的活力,使得木糖醇不能生成木酮糖,由此导致木糖醇的积累[12]。同时,不同分子量的酚酮类对生成树干毕赤酵母的发酵副产物的影响也不同,其中4-羟基苯乙酮影响最大,这也与4-羟基苯乙酮对树干毕赤酵母乙醇发酵抑制作用最强的情况相一致,说明4-羟基苯乙酮对树干毕赤酵母乙醇发酵代谢途径抑制作用最为明显。研究表明酚类物质和芳香族化合物抑制细胞的生长和代谢产物可能与具体的官能团有关[19],其中低分子量酚类化合物毒性更强[18],取代基的位置 (邻位、间位、对位) 对酚类毒性的强弱也有影响,根据这3种酚酮类物质对乙醇发酵的影响及其结构可以看出,随着甲氧基数目的增加,其抑制作用逐渐降低。但是并未阐明其毒性机制,一种可能的机制是酚类通过影响微生物的功能和蛋白质与脂质的比值干扰了细胞膜[20]。
2.3 酚酮类对树干毕赤酵母细胞脂肪酸组成的影响外界环境发生变化,微生物细胞膜首先受到冲击,因此可以推测,细胞对抑制物的反应可通过测定膜性质的变化而得知。磷脂是细胞膜的重要组成部分,磷脂中脂肪酸的变化会影响到膜的流动性。而目前对细胞膜脂肪酸的测定尚无统一方法,因此,可以通过测定细胞总脂肪酸来间接反映细胞膜磷脂中脂肪酸的变化,而细胞膜中脂肪酸组成的变化是细胞适应外部环境的内在调节机制作用[21]。细胞可以通过脂肪酸组成的变化来改变膜的一些特性以适应外界环境的变化,如不饱和脂肪酸和饱和脂肪酸的比例可以间接反映细胞膜的流动性。饱和脂肪酸紧密有序地排列,使细胞膜的流动性减小;不饱和脂肪酸由于不饱和键的存在,使分子键排列疏松而无序,从而会使膜的流动性增加。
实验以45 g/L木糖为发酵底物,在发酵培养基中分别添加1.50 g/L的4-羟基苯乙酮、4-羟基-3-甲氧基苯乙酮、4-羟基-3,5-二甲氧基苯乙酮,树干毕赤酵母发酵72 h时取样,收集酵母提取脂肪酸并甲酯化后采用GC/MS分别测定添加抑制物发酵前后树干毕赤酵母细胞脂肪酸的含量,总离子图经数据处理后按峰面积归一化法计算出各脂肪酸的相对百分含量,表2为树干毕赤酵母细胞脂肪酸的组成及相对含量。
| Fatty acid (Cn1: n2) | Retention time (min) | Relative content of fatty acid from P. stipitis NLP31 membrane lipid (%) | |||
| Control | 4-Hydroxyacetophenone | 4-Hydroxy-3-methoxy- acetophenone | 4-Hydroxy-3,5-dimethoxy- acetophenone | ||
| C8:0 | 20.78 | 1.51 | 1.92 | 5.01 | 0.48 |
| C14:0 | 17.20 | - | - | 0.28 | - |
| C16:0 | 19.85 | 23.72 | 18.95 | 16.55 | 18.48 |
| C16:1 | 19.59 | 10.18 | 7.52 | 12.68 | 15.38 |
| C18:0 | 22.25 | - | - | 2.08 | 1.36 |
| C18:1 | 22.00 | 55.00 | 55.74 | 51.66 | 48.85 |
| C18:2 | 21.91 | - | - | 8.85 | 9.09 |
| SFA | 25.23 | 20.87 | 23.92 | 20.32 | |
| UFA | 65.18 | 63.26 | 73.19 | 73.32 | |
| UFA/SFA | 2.58 | 3.03 | 3.06 | 3.61 | |
| Note: n1 shows the numbers of carbon atom,n2 shows the numbers of olefinic bond,SFA shows the saturated fatty acids,UFA shows the unsaturated fatty acids. | |||||
采用GC/MS对未添加酚酮类物质的对照组和分别添加4-羟基苯乙酮、4-羟基-3-甲氧基苯乙酮、4-羟基-3,5-二甲氧基苯乙酮的树干毕赤酵母的脂质成分分析。将得到的结果经计算机化学工作站分析检索其中的脂肪酸成分,得到树干毕赤酵母细胞脂肪酸主要含有辛酸 (C8:0)、肉豆蔻酸 (C14:0)、棕榈酸 (C16:0)、棕榈油酸(C16:1)、硬脂酸 (C18:0)、油酸 (C18:1) 和亚油酸 (C18:2)。其中饱和脂肪酸4种,单不饱和脂肪酸有2种,多不饱和脂肪酸有1种。不饱和脂肪酸主要有榈油酸 (16:1) 和油酸 (18:1),饱和脂肪酸主要为棕榈酸 (16:0) 以及少量的硬脂酸 (18:0)。由表2可以看出,发酵液中不添加酚酮类物质的树干毕赤酵母细胞中不饱和脂肪酸和饱和脂肪酸的比例为2.58,发酵液中添加酚酮类物质的树干毕赤酵母细胞中的不饱和脂肪酸和饱和脂肪酸的比例分别上升到3.03、3.06和3.61。影响细胞膜流动性的因素主要有脂肪酸碳链的长度及饱和程度、胆固醇含量、温度、酸碱度及离子强度等。添加酚酮类发酵后酵母细胞不饱和脂肪酸和饱和脂肪酸的比例从原来的2.58上升到3.61,树干毕赤酵母细胞膜的流动性随之上升,不稳定性提高。由于树干毕赤酵母细胞脂肪酸中不饱和脂肪酸的含量较高,使膜磷脂的不饱和度增加,很容易发生过氧化,从而影响酵母生长和乙醇发酵能力[12]。
3 结论植物纤维素原料生物炼制燃料乙醇的过程中,第一步原料预处理产生了一些对酵母乙醇发酵有抑制作用的物质,其中对弱酸类、糠醛类以及酚类中的酚醛和酚酸类的研究较多,而对酚酮类物质抑制树干毕赤酵母乙醇发酵的影响尚未见报道,同时辅以研究细胞脂肪酸含量的变化,进一步表征抑制物存在条件下对酵母乙醇发酵的影响。
通过研究3种酚酮类 (4-羟基苯乙酮、4-羟基-3-甲氧基苯乙酮、4-羟基-3,5-二甲氧基苯乙酮) 对树干毕赤酵母木糖发酵的影响结果表明,添加酚酮类物质延长了发酵时间,抑制了细胞的生长,增加了发酵副产物木糖醇的生成;随着酚酮类浓度的增加,抑制作用也逐渐增强,当酚酮类物质大于1.00 g/L时,抑制作用较为明显。通过比较添加浓度为1.50 g/L酚酮类物质对树干毕赤酵母细胞脂肪酸组成的影响,研究表明酚酮类物质提高了细胞中不饱和脂肪酸的比例,添加3种酚酮类物质后酵母细胞中不饱和脂肪酸和饱和脂肪酸的比例从原来的2.58分别上升到3.03、3.06和3.61,树干毕赤酵母细胞膜的流动性随之上升,不稳定性提高,从而影响酵母生长以及酵母乙醇发酵能力。
因此,通过本文的研究结果表明,酚酮类物质对乙醇发酵有一定的影响。可以通过以下途径来降低其抑制作用:1) 在原料预处理过程中,通过选择适当的预处理方法来减少抑制物的产生;2) 对已经产生的酚酮类物质如何通过适当的方法降低其抑制作用,如采用脱毒的方法降低其对微生物的抑制作用,或者通过菌株驯化和筛选、诱变等方法提高微生物对抑制物的耐受能力。此外通过本文的研究,可以为进一步研究抑制物对乙醇发酵的影响机理、提高微生物乙醇发酵能力以及加快燃料乙醇工业化生产、降低生产成本具有十分重要的指导意义。
| [1] | Bilgili F, Ozturk I. Biomass energy and economic growth nexus in G7 countries: evidence from dynamic panel data. Renew Sust Energ Rev, 2015, 49: 132-138. |
| [2] | Chu QL, Li X, Ma B, et al. Bioethanol production: an integrated process of low substrate loading hydrolysis-high sugars liquid fermentation and solid state fermentation of enzymatic hydrolysis residue. Bioresour Technol, 2012, 123: 699-702. |
| [3] | Gírio FM, Fonseca C, Carvalheiro F, et al. Hemicelluloses for fuel ethanol: a review. Bioresour Technol, 2010, 101(13): 4775-4800. |
| [4] |
Yue GJ, Wu GQ, Lin X. Insights into engineering of cellulosic ethanol. Chin J Biotech, 2014, 30(6): 816-827 (in Chinese). 岳国君, 武国庆, 林鑫. 纤维素乙醇工程化探讨. 生物工程学报, 2014, 30(6): 816-827. |
| [5] | Zhu JJ, Yong Q, Xu Y, et al. Detoxification of corn stover prehydrolyzate by trialkylamine extraction to improve the ethanol production with Pichia stipitis CBS 5776. Bioresour Technol, 2011, 102(2): 1663-1668. |
| [6] | Chen WH, Pen BL, Yu CT, et al. Pretreatment efficiency and structural characterization of rice straw by an integrated process of dilute-acid and steam explosion for bioethanol production. Bioresour Technol, 2011, 102(3): 2916-2924. |
| [7] |
Chen HZ, Liu LY. Technology of steam explosion: principles and applications. Beijing: Chemical Industry Press, 2007 (in Chinese). 陈洪章, 刘丽英. 蒸汽爆碎技术原理及应用. 北京: 化学工业出版社, 2007. |
| [8] | Trinh LTP, Kundu C, Lee JW, et al. An integrated detoxification process with electrodialysis and adsorption from the hemicellulose hydrolysates of yellow poplars. Bioresour Technol, 2014, 161: 280-287. |
| [9] | Almeida JRM, Modig T, Petersson A, et al. Increased tolerance and conversion of inhibitors in lignocellulosic hydrolysates by Saccharomyces cerevisiae. J Chem Technol Biotechnol, 2007, 82(4): 340-349. |
| [10] | Zhu JJ, Yang JL, Zhu YY, et al. Cause analysis of the effects of acid-catalyzed steam-exploded corn stover prehydrolyzate on ethanol fermentation by Pichia stipitis CBS 5776. Bioprocess Biosyst Eng, 2014, 37(11): 2215-2222. |
| [11] | Klinke HB, Thomsen AB, Ahring BK. Inhibition of ethanol-producing yeast and bacteria by degradation products produced during pre-treatment of biomass. Appl Microbiol Biotechnol, 2004, 66(1): 10-26. |
| [12] | Liu ZL. Molecular mechanisms of yeast tolerance and in situ detoxification of lignocellulose hydrolysates. Appl Microbiol Biotechnol, 2011, 90(3): 809-825. |
| [13] | Jönsson LJ, Alriksson B, Nilvebrant NO. Bioconversion of lignocellulose: inhibitors and detoxification. Biotechnol Biofuels, 2013, 6: 16. |
| [14] |
Gu YJ, Yang RJ, Zhao W. Effect of pulsed electric fields on lipid composition and membrane fluidity of Saccharomyces cerevisiae[EB/OL]. [12]. Beijing: Sciencepaper Online. http://www.paper.edu.cn/releasepaper/content/201212-501 (in Chinese). 顾艳洁, 杨瑞金, 赵伟. 高压脉冲电场对酿酒酵母细胞膜流动性及脂肪酸组成的影响[EB/OL]. [12]. 北京: 中国科技论文在线.http://www.paper.edu.cn/releasepaper/content/201212-501. |
| [15] |
Zhu JJ, Chen SX, Yong Q, et al. Biorefinery of corn stover for fuel ethanol. Chem Ind Forest Prod, 2011, 31(6): 35-40 (in Chinese). 朱均均, 陈尚钘, 勇强, 等. 玉米秸秆生物炼制燃料乙醇的研究. 林产化学与工业, 2011, 31(6): 35-40. |
| [16] | Bligh EG, Dyer WJ. A rapid method of total lipid extraction and purification. Can J Biochem Physiol, 1959, 37(8): 911-917. |
| [17] | Zhu JJ, Rong YY, Yang JL, et al. Integrated production of xylonic acid and bioethanol from acid-catalyzed steam-exploded corn stover. Appl Biochem Biotechnol, 2015, 176(5): 1370-1381. |
| [18] | Palmqvist E, Hahn-Hägerdal B. Fermentation of lignocellulosic hydrolysates. II: inhibitors and mechanisms of inhibition. Bioresour Technol, 2000, 74(1): 25-33. |
| [19] | Larsson S, Quintana-Sáinz A, Reimann A, et al. Influence of lignocellulose-derived aromatic compounds on oxygen-limited growth and ethanolic fermentation by Saccharomyces cerevisiae//Twenty-First Symposium on Biotechnology for Fuels and Chemicals. US: Humana Press, 2000, 617-632. |
| [20] | Keweloh H, Weyrauch G, Rehm HJ. Phenol-induced membrane changes in free and immobilized Escherichia coli. Appl Microbiol Biotechnol, 1990, 33(1): 66-71. |
| [21] | Sinensky M. Homeoviscous adaptation-a homeostatic process that regulates the viscosity of membrane lipids in Escherichia coli. Proc Natl Acad Sci USA, 1974, 71(2): 522-525. |
 2016, Vol. 32
2016, Vol. 32