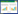服务
文章信息
- 高庆东, 祝旭龙, 向俊西, 吕毅, 李建辉
- Qingdong Gao, Xulong Zhu, Junxi Xiang, Yi Lü, Jianhui Li
- 基于组织工程研究的可降解支架材料选择策略
- Strategies to choose scaffold materials for tissue engineering
- 生物工程学报, 2016, 32(2): 172-184
- Chin J Biotech, 2016, 32(2): 172-184
- 10.13345/j.cjb.150230
-
文章历史
- Received:May 15, 2015
- Accepted: August 3, 2015
2. 延安大学医学院,陕西 延安 716000;
3. 西安交通大学第一附属医院 肝胆外科,陕西 西安 710061
2School of Medicine, Yan’an University, Yan’an 716000, Shaanxi, China;
3Department of Hepatobiliary Surgery, First Affiliated Hospital of Xi’an Jiao tong University, Xi’an 710061, Shaanxi, China
对于器官衰竭或特殊部位的组织损伤,器官或组织移植是唯一长期有效的治疗手段,然而供体器官来源有限,使得移植治疗不能广泛地开展[1]。组织工程的发展给这一医学难题带来了希望,美国科学基金会1987年提出“组织工程”的概念,1993年又有学者对其进行了系统地阐述:组织工程是应用生物学和工程学的原理技术,利用种子细胞和支架的复合,构建有活力的支架,对病损组织器官进行修复、重建,甚至永久替代,达到组织器官结构甚至功能上的理想修复,即构建了功能化的替代物[2]。目前组织工程技术已广泛应用于心脏瓣膜、气管、皮肤、软骨、骨、肌腱、血管、角膜、神经、肝脏和胰腺等各种器官组织的研究当中[3]。组织工程三大基本要素是种子细胞、支架材料及促进种子细胞定向分化的信号分子[4]。支架为细胞的粘附生长提供支撑和微环境,植入后与机体直接接触[5, 6],其重要性不言而喻。支架的高孔隙率及连通率有利于细胞在支架上的生长,提供良好的细胞营养环境[7]。而支架材料的选择决定了支架的基本性能,适合细胞生长的支架材料可以充当细胞外基质的角色,为种子细胞提供了粘附、生长以及分化的场所。随着材料科学日新月异的发展,各种适合细胞生长的材料层出不穷。虽然人体不同组织器官所需的支架性能不尽相同,但总的来说,理想的支架材料应具备:1) 良好的生物相容性,即对种子细胞及机体无毒,不会带来传染病、排斥反应等不良影响;2) 生物活性和可降解性,即携带有相应的信号分子、蛋白配体或受体,支架可降解,且降解速率与不同组织细胞再生的速度相匹配;3) 足够的机械强度和柔韧性;4) 适合的三维空间多孔结构,具有一定的孔隙率及良好的孔连通性,孔径大小适宜病损组织器官细胞生长,支架材料的界面良好,适宜细胞生长;5)批量生产性,保证材料来源充足、支架易加工成型、易消毒、可批量生产。
组织工程支架材料按其来源可分为天然及其改性修饰材料、人工合成与复合支架材料3种。涤纶、聚四氟乙烯以及各种合金等不可降解材料,虽然有力学性能良好、易于消毒等优点,但会不同程度地引起机体纤维增生反应,形成坚固的生物被膜,阻碍了细胞间营养物质的交换,不利于细胞生长。因此本文重点关注生物可降解材料,从材料学的角度列举了近年来适合细胞贴附生长的可降解支架,并简单介绍了制备工艺、预处理等影响其性能的因素,以期对组织工程支架材料的选取提供思路。
1 天然及其改性修饰的支架材料天然支架材料按其构成主要分为多糖类和蛋白质类两大类,包括胶原、明胶、纤维蛋白、纤维素、海藻酸盐、壳聚糖、胶原蛋白、透明质酸及其衍生物等。这类材料自身能够促进细胞的粘附、分化,利于细胞生长,且具有良好的生物相容性;缺点也很明显,如不能批量生产,力学性能不佳,降解速率不易控制,性能变化与结构变化不成比例,还有可能带来异种生物免疫相关的问题。
壳聚糖是甲壳素脱乙酰后的阳离子衍生物,而甲壳素大量存在于昆虫、甲壳纲动物的外壳及真菌的细胞壁中,是仅次于纤维素的第二大可再生资源。这类材料无毒、无免疫原性,加之来源充足、体内可降解以及具有良好的可塑性,已被开发成多种组织工程支架。将壳聚糖作为神经组织工程支架,与神经细胞体外共培养,结果显示神经细胞能够较好地在其表面生长[8]。对壳聚糖进行预处理后会获得更利于组织再生修复的一些性能。Liu等[9]将全氟磺酸涂层的壳聚糖支架植入大鼠皮下,组织学观察100 d后,周围仅有少数巨噬细胞浸润,而主要促进血管新生,证明涂层后支架的生物相容性得到进一步提高。
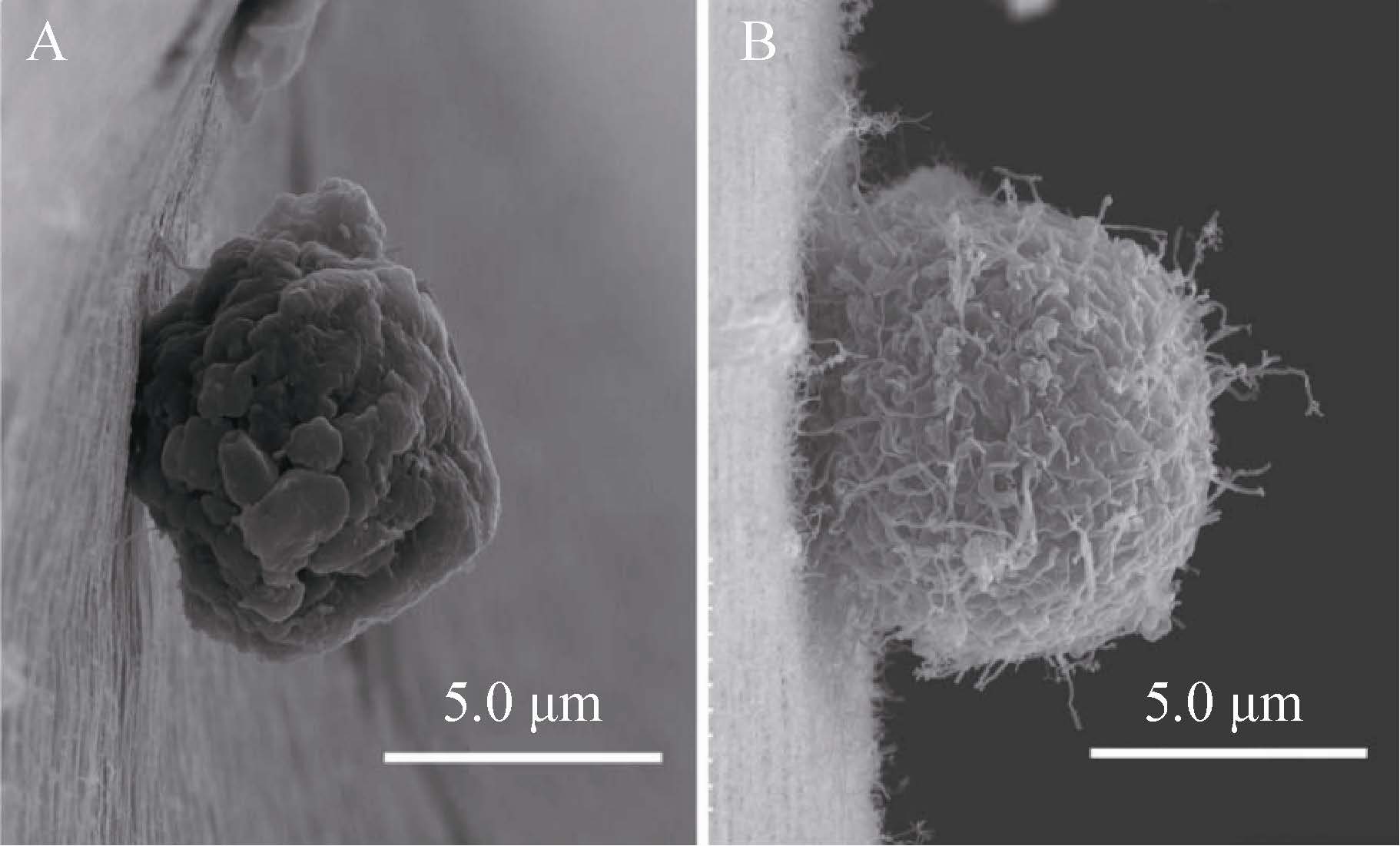
胶原蛋白广泛存在于细胞外基质和结缔组织中,是动物体内含量最丰富的蛋白质。胶原蛋白适合多种细胞贴附生长,能够促进细胞增殖和分化[10]。但其力学性能较差,须与其他材料复合来提高机械强度,如复合生物活性玻璃的胶原蛋白支架,不仅提高了支架的机械强度,而且利于羟基磷灰石生成,可以较好地应用于骨组织工程领域[11]。胆总管损伤时胆管上皮细胞再生速率约为1个月左右,Li等[12]把结合碱性成纤维细胞生长因子 (bFGF) 的胶原薄膜制备成胆管补片并植入猪的体内,观察4周时已有散在的胆管上皮细胞新生;12周时再生胆管已与自体组织很好地集成 (图1)。Li团队[13]制备的丝素蛋白/明胶复合支架作为肝脏组织工程支架,其仿生微血管网状结构满足了肝脏组织细胞的生长代谢,植入大鼠体内发现细胞在支架表面生长良好。Yin等[14]运用冷冻干燥技术制备丝素/明胶支架,初期实验测定了支架的孔隙率、结构稳定性等参数,指出丝素的加入增加了支架的结构稳定性,有望运用于牙周膜组织工程。
透明质酸是一种高分子多糖,是细胞外基质的主要成分,有营养细胞、促进细胞分化的生理作用。Tan等[15]制备了注射型透明质酸脂肪组织工程支架,支架与脂肪干细胞复合后植入动物体内,观察细胞的存活情况,发现细胞与支架表现出良好的交互作用。透明质酸还可以激活某些特异性受体,如CD44、ICAM-l,调节细胞粘附生长,但其结构疏松,力学性能不佳,且可加工性较差,很大程度上限制了它的使用。如对透明质酸进行改性修饰,或与其他材料复合,将是改善其材料力学性能的有效方法。
2 人工合成支架材料人工合成材料包括聚乳酸 (PLA)、聚羟基乙酸 (又名聚乙醇酸,PGA)、聚己内酯 (PCL) 以及它们相互之间的聚合物等。这类材料具有力学性能佳、可加工性好、降解速率可控、可批量生产、结构性能可修饰等优点[16],缺点是缺乏与种子细胞相互作用的信号转导蛋白及其受体或配体。
PLA、PGA及PLA/PGA共聚物 (PLGA) 等人工合成材料具有较好的生物相容性和可降解性。PLA无毒、生物相容性良好、强度高、易于加工,在体内3-6个月降解完全,被认为是最具前景的医用材料[17]。2001年有国外医生将PLA支架用于治疗临床恶性梗阻性黄疸患者,胆管维持通畅达9个月,但部分患者出现支架移位、支架表面细菌沉积堵塞等问题[18]。整形医师认为,接种脂肪干细胞的PGA支架能够聚积脂质,可用于脂肪移植等工作。Fu等[19]将脂肪干细胞来源的输尿管上皮细胞接种到PGA支架表面,细胞生长状况良好,并成功用于实验犬的输尿管修复。PLGA由PLA和PGA共聚得到,共聚物的降解速率取决于PLA和PGA的混合比例。PLA与PGA的比例为50∶50时PLGA降解速率最快,其余比例则PGA含量越高降解越快。PLGA是FDA批准了的一种人体植入性材料,其机械性能良好,加工过程易受控制,已经有可吸收缝线、生物骨水泥等多种制品应用于临床[20, 21]。
PCL是ε-己内酯单体开环聚合形成的产物,在人体中可自行降解,终产物为二氧化碳和水;且有无毒、理化性质稳定、生物相容性良好及较好的柔韧性等优点[22],但体内完全降解约需2-3年之久。左旋聚乳酸/PCL共聚物 (PLCL),平衡了材料的支撑性能和柔韧性,体内降解时间可缩短为6-12个月。Larranaga等[23]将PLCL支架复合生物活性玻璃,浸泡于代血浆溶液,28 d时观察到支架上的钙磷沉积多于对照组,指出它可能是较好的骨组织工程支架,但有待后续体内实验研究。Miyazawa团队致力于人工胆管的研究,利用PGA加强的PLA/PCL共聚物制成胆管补片或支架,修复猪的胆道缺损,并分别从血清学、影像学和组织学检验了修复效果。结果显示,实验猪的肝功能较术前无明显变化,胆道造影未见狭窄、堵塞,4-6个月出现新生胆管上皮细胞以及腺体样结构,6个月后支架完全降解。随后,他们又将猪的自体骨髓细胞接种于支架内表面,间置修复胆道,修复结果与未接种细胞的对照组无明显差异,可能是由于细胞接种于支架前未经过纯化、扩增,造血细胞占多数,间充质干细胞含量较少[24, 25, 26, 27, 28, 29]。
3 复合支架材料由于天然材料和人工合成材料各具特点,如果取长补短,组合成复合材料,则可能表现出优越的性能,兼备天然材料的亲细胞性与人工合成材料良好的力学性能。此类材料复合形式多样,可以将多种天然材料复合,也可以是多种人工合成材料复合,总的来说各具优点。日本研究者将PLA/PCL或聚丙烯/网状胶原用于制备可降解胆管假体,间置修复胆管缺损,实验动物经过6个月的观察,胆道通畅,无狭窄、胆漏,组织再生良好[30, 31]。Tian等[32]通过乳液静电纺丝技术制备PLCL/明胶复合支架,并添加血管生成因子,接种间充质干细胞体外培养20 d显示支架与细胞有良好的交互作用;利用其修复大鼠的室壁心肌组织,免疫染色结果提示复合支架较单纯PLCL支架表达更多的肌动蛋白和肌球蛋白表型。Fu等[33]对比了胶原/PLCL与明胶/PCL复合支架,MTT及扫描电镜结果显示人脐动脉平滑肌细胞在两种支架上均能良好地粘附生长,大鼠体内实验发现种子细胞在胶原/PLCL复合支架的存活情况优于明胶/PCL复合支架,推测可能是PCL降解过于缓慢导致残留物质影响了细胞的生长。Jin等[34]采用电纺工艺制备PLCL/胶原蛋白/透明质酸复合支架,并添加神经生长因子,大鼠实验显示其可以促进神经细胞感觉功能的恢复。Pan等[35]制备PLCL/明胶/右旋糖酐复合支架,支架内添加波洛沙姆微球,将脂肪干细胞接种于支架表面,体外培养14 d,细胞生长良好,存活数量与平面培养无统计学差异。
矿化胶原即胶原/羟基磷灰石复合材料,以胶原纤维蛋白分子为模板,调制钙磷盐沉积到有序排列的胶原纤维上。此类材料具有类似骨细胞外基质的分层结构,可降解、生物相容性好[36],广泛应用于骨组织工程;但是这种材料具有不可塑性,无法依据骨缺损形状进行充填重塑,亦即单纯矿化胶原材料无法制备出注射型支架。我国学者[37]早在2002年就制备出矿化胶原材料,并研究了其基本特性。两年后,Lian等[36]制备出矿化胶原/PLA复合支架,包含有重组人骨形成蛋白-2,并且接种了大鼠成骨细胞,用于修复实验兔前肢骨缺损。接种1周后细胞迁移、生长入支架内,12周时缺损被完整修复,部分支架被再生骨组织替代。Chen等[38]设计了注射型壳聚糖/矿化胶原复合材料,接种小鼠成骨细胞,用于修复不规则骨缺损。相比于单纯的壳聚糖组,虽然复合材料的细胞存活数目并无差异,但细胞的成骨基因表达水平较高,证明复合材料能够更好地促进成骨细胞分化、成熟及矿化。Li等[39]制备了不同组分比的矿化胶原支架,并与小鼠间充质干细胞体外共培养,发现胶原与羟基磷灰石的比例为80∶20或50∶50时细胞增殖能力最强。
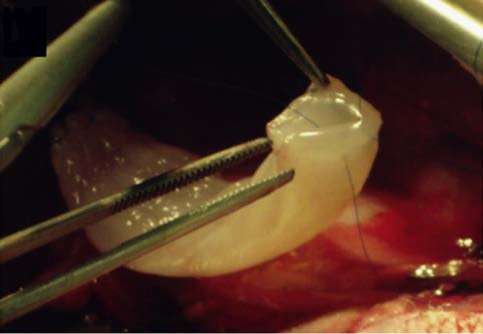
4 材料预处理和制备工艺对支架性能的影响 4.1 材料的预处理材料的预处理指材料植入人体前,为了进一步提高其性能预先所做的处理,包括涂层处理、表面修饰及包被细胞因子等。表面涂层是最常见的预处理方法,如用天然材料涂层处理PLGA支架能提高种子细胞在其表面的粘附生长能力。纳米级别的材料涂层由于其高比表面积更是有明显的促细胞粘附生长的作用,Hirata等[40]在胶原支架表面作碳纳米管涂层修饰,结果其表面细胞的粘附增殖能力明显优于无涂层的支架 (图2)。表面修饰又叫表面改性、表面生物功能化,目的是引入具有细胞识别功能的物质,提高支架的促细胞粘附生长作用,其方法包括化学改性法、等离子体法、自组装单分子层法、杂化改性法等。如引入胶原、壳聚糖、海藻酸盐等天然材料,可以提供其包含的细胞识别信号;引入氨基酸聚合物,其侧链的氨基酸序列可供细胞识别。Boccafoschi等[41]用多肽对左旋聚乳酸支架进行表面修饰,观察到其表面接种的大鼠室壁肌细胞C2C12生长良好,细胞能够较好表达收缩蛋白,表明心肌细胞保留了正常的收缩功能。利用氧等离子体进行表面修饰可以增加材料的亲水性,Andreas等[42]用氧等离子体处理电纺PCL支架,与小鼠成纤维细胞系NIH 3T3细胞共培养,观察了5 d,细胞数量平稳上升并保持了较好的活性。支架的预处理还包括将一些细胞因子如vEGF、HGF等,包被于可降解材料或制成微球,将微球与支架材料相混合,随着支架的降解,细胞因子被逐渐释放出来,可以促进工程组织或细胞的存活、成熟或分化。大脑局部缺血时,由于闭塞动脉无法营养其范围内的神经细胞,致使神经细胞功能受损难以恢复。Ju等[43]制备了一种复合人脐动脉上皮细胞和神经干细胞的透明质酸支架,支架内包含血管内皮生长因子和血管生成素-1两种缓释微球。将该支架植入脑缺血大鼠模型 (即大脑中动脉闭塞模型) 脑内缺血区域,与对照组 (支架不包含血管内皮生长因子和血管生成素-1两种缓释微球) 相比,组织学检查发现实验组支架周围有更多新生血管形成,且种子细胞在该支架上生长更旺盛、数量更多,间接达到了修复神经细胞功能的目的。本课题组将包含EGF、HGF的纳米缓释微球与PLCL复合制成胆道支架 (支架内表面涂有基质胶/胶原混合层,胶内加入bFGF、EGF,提供诱导因子的早期释放),随着支架的降解可以保证生长因子较长时间的贯续释放 (图3)。

|
| 图3 包埋生长因子纳米缓释微球的PLCL支架 Fig.3 PLCL scaffold that embeddinged growth factors sustained-release nano-microspheres. |
支架的制备工艺直接影响其形态结构、机械性能、孔隙率及孔隙贯通率,间接影响了种子细胞在支架上的粘附增殖[44]。支架制备技术目前呈现出较为多元化的局面,传统技术包含微球堆积法、溶液浇铸/粒子沥滤法、热致相分离法、静电纺丝法及快速成型法等;新兴的超临界技术包括超临界CO2发泡法、超临界CO2静电纺丝法、离子液体聚合物混合干燥法等。超临界流体性质介于液体和气体之间,通过改变流体温度和压力就可以控制支架的一些性能。
热致相分离技术能够制备出纳米级纤维模仿细胞外基质 (ECM) 的结构和功能 (ECM中胶原蛋白纤维直径为50-500 nm)[45],并且可以通过使用不同致孔剂如糖、无机盐、石蜡微球等形成适合细胞迁移生长及营养交换的多孔结构[46]。Wang等[47]通过热致相分离技术制备了左旋聚乳酸和PLCL不同质量比的小血管支架 (血管直径小于6 mm),接种猪的血管内皮细胞体外培养,细胞保持良好的黏附增殖能力,将其埋植入新西兰兔皮下,1月后组织切片未发现炎性细胞浸润,支架周围有新生血管形成。静电纺丝 (电纺) 技术能够简单且可控地将多种材料混合,制备的纳米级纤维支架具有极高的接触面积,能够极大地模拟细胞外环境,利于细胞-支架的交互作用[48, 49]。Zhao等[50]运用电纺技术制备了 (重组蛛丝蛋白/PCL/明胶)/(重组蛛丝蛋白/PCL/壳聚糖) 双层小血管支架,与大鼠骨髓间充质干细胞体外共培养,5 d后在显微镜下观察到细胞生长良好,形 态均匀。然而,一些研究者指出电纺技术制备的支架体积稳定性欠佳,可导致支架收缩变小,支架内部纤维排列错综复杂,孔径大小不一,制备出的支架之间的一致性较差[51, 52]。快速成型技术最早产生于1987年,使用计算机建模,通过逐层添加材料制备出多个层次,而后再粘结成型制备出支架。此技术包括3D打印法、三维生物描绘法及选择性激光烧结法等。由于其简便易行的操作,无需可能有毒的溶剂,精确控制纤维尺寸大小等优点引起人们的广泛关注[53]。Lee等[54]用快速成型技术制备了壳聚糖/PCL血管支架,体外实验证明拉伸强度达到了正常血管组织的要求。但是,这种技术设备要求高,且不易控制孔径和孔隙率。
此外,Antebi等[55]利用创新的仿生矿化技术制备矿化胶原支架,这种支架相比于传统方法制备的支架有着更好的支架-细胞交互界面和力学强度。将支架与人的骨髓间充质干细胞共培养,26 d时发现实验组细胞均匀广泛地生长,对照组细胞数量少,且仅生长于塌陷胶原外围。Wang等[56]应用微波辅助原位共沉淀技术制备矿化胶原支架,指出高浓度胶原和高降温速率会导致支架孔径减小、孔隙率降低,希望未来能够通过改进制备方法得到配比参数更精确的材料,以更好地适应各种骨缺损修复问题。
实际应用中通常是两种或者多种制备工艺结合,这样不同制备工艺之间可以相互补充,能制备出满足需要的组织工程支架。李好义等[57]将电纺技术和快速成型技术相结合,期望能够实时动态监测制备过程中支架的孔径、孔隙率及孔隙贯通情况,后续实验有待进行。相信随着将来制备工艺的成熟,组织工程支架的性状可以高度可控,并愈加接近临床需要。
5 展望生物工程与组织工程结合,或许能擦出耀眼火花。Maximilian等[58]运用细菌工程及特殊装置制备了醋酸杆菌纤维素血管支架 (图4),置换山羊的一侧颈动脉,达到了50%的远期通畅率。虽然结果远达不到治疗标准,但却是一种创新的思路,给组织工程材料领域带来一抹别样的色彩。
一些新型材料也展示出各自的独特性能。可降解聚丙烯延胡索酸酯支架力学性能优异,但是其具有生物惰性,有团队将弹性蛋白复合其中,制备了血管支架,实验结果显示其获得了良好的促细胞生长作用[59]。有研究者采用静电纺丝技术制备了可降解聚丙三醇-十二烷酸酯支架用于神经组织工程,这种支架材料特点是具有与神经组织相符的力学强度。将其体外复合大鼠胚胎干细胞诱导的神经细胞进行培养,组织学观察显示细胞在支架上生长良好[60]。
大多数生命过程发生于纳米尺度上或者介于纳米与微米尺度之间,细胞在纳米级纤维上的分化率明显高于微米级纤维。纳米无机刚性颗粒与可降解材料复合,能够增加大量的界面,使支架力学性能的刚性与韧性达到较完美的统一,其高比表面积和孔隙率,有利于细胞接种、迁移和增殖[61]。具有中空管状结构的超亲水性的二氧化钛纳米管已被用于药物载体、骨缺损的修复以及其他生物工程领域。Nuffer等[62]将纳米材料制备的支架与成骨细胞复合,与非纳米材料支架相比,纳米材料支架的高表面效应使蛋白更好的吸附,促进了细胞粘附增殖。然而有研究指出,用于医学领域的纳米材料作为种植体具有潜在不良反应,并提出“纳米毒理学”的概念,引起了较大的争议。有人反驳指出作为纳米材料的碳纳米管本身无细胞毒性,而是其纯度不足所致,因为体外实验证明细胞在碳纳米管上粘附、生长良好,接种神经细胞后还可以观察到神经树突的延伸[63]。
理想的组织工程支架材料应当模拟细胞生长的微环境,释放相应的生长因子,促进细胞粘附、增殖及分化,促进新生血管的形成,给再生细胞提供足够的营养。材料仿生化即模仿ECM的组分、结构以达到类似的功能,这有赖于对ECM结构、功能及机制的深入研究。未来支架材料的制备必须要参考材料科学、分子生物学、生命科学、工程学等多领域的知识,学科之间互相渗透、借鉴,取长补短,优化组合,使支架更接近机体自身组织的生物学特性。更加注重细胞与支架的复合,提高支架的生物相容性,使其更好地为细胞服务。通过联合种植多种细胞,建立细胞层次,依靠实质与间质细胞之间的相互作用,建立高度仿生化组织工程器官,最大限度贴近组织生理结构,贴近临床实际[64]。还要关注支架的生物安全性,如降解产物的毒性问题[65],支架置入的可操作性以及其应用的方便程度等问题。
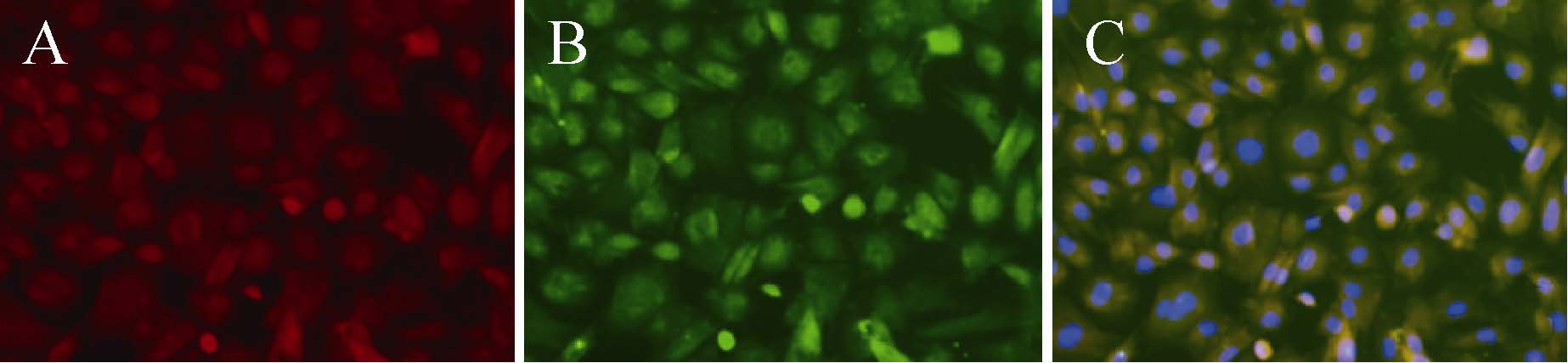
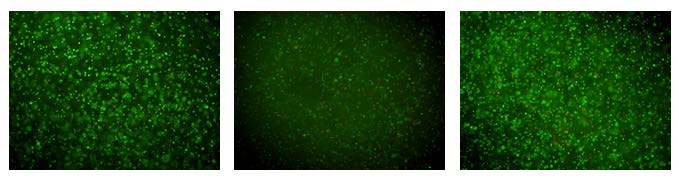
本课题组致力于组织工程胆管的研究[66],力求将PLCL与骨髓间充质干细胞相复合。另外,课题组在PLCL胆道支架内部混有包含生长因子的纳米缓释微球,支架内表面涂有基质胶/胶原混合层,胶内加入bFGF、EGF,提供诱导因子的早期释放。在前期工作中,我们已经将骨髓间充质干细胞体外诱导分化为胆管上皮样细胞[67] (图5)。将诱导细胞接种于胆管支架 内表面进行培养,于培养的1、3、7 d对细胞进行死活染色,活细胞平均比例分别为87.3%、87.6%、85.3% (图6、7),表明细胞在支架上生 长基本能够保持活性以及必要的营养交换。动态培养14 d,将材料进行冰冻切片,免疫荧光检测表明细胞阳性染色CK7、CK19,阴性染色ALB、AFP、CK18,表明细胞在三维培养过程中进一步成熟。Ki67染色发现,5.5%的细胞阳性染色,证明细胞仍保留了一定的增殖功能。
|
| 图6 将诱导细胞接种于支架内表面体外培养 Fig.6 Inoculated the induced cells to the scaffold internal surface and co-cultured in vitro. |
| [1] | Clark DC. Esophageal atresia and tracheoesophageal fistula. Am Fam Physician, 1999, 59(4): 910-916. |
| [2] | Langer R, Vacanti JP. Tissue engineering. Science, 1993, 260(5110): 920-926. |
| [3] | Wu L, Zhang H, Zhang J, et a1. Fabrication of three-dimensional porous scaffolds of complicated shape for tissue engineering. I. Compreession molding based on flexible-rigid combined mould. Tissue Eng, 2005, 11(7/8): 1105-1114. |
| [4] | Sundaram S, Niklason LE. Smooth muscle and other cell sources for human blood vessel engineering. Cell Tissues Organs, 2012, 195(1/2): 15-25. |
| [5] | Bhardwaj N, Kundu SC. Electrospinning: a fascinating fiber fabrication technique. Biotechnol Adv, 2010, 28(3): 325-347. |
| [6] | Bhardwaj N, Kundu SC. Chondrogenic differentiation of rat MSCs on porous scaffolds of silk fibroin/chitosan blends. Biomaterials, 2012, 33(10): 2843-2857. |
| [7] | Yan LP, Oliveira JM, Oliveira AL, et al. Macro/microporous silk fibroin scaffolds with potential for articular cartilage and meniscus tissue engineering applications. Acta Biomat, 2012, 8(1): 289-301. |
| [8] | Freier T, Montenegro R, Koh HS, et a1. Chitin-based tubes for tissue engineering in the nervous system. Biomaterials, 2005, 26(22): 4624-4632. |
| [9] | Liu BJ, Ma LN, Su J, et al. Biocompatibility assessment of porous chitosan-nafion and chitosan-PTFE composites in vivo. J Biomed Mater Res A, 2014, 102(6): 2055-2060. |
| [10] | Chomchalao P, Pongcharoen S, Sutheerawattananonda M, et al. Fibroin and fibroin blended three-dimensional scaffolds for rat chondrocyte culture. Biomed Eng on line, 2013, 12: 28. |
| [11] | Sarker B, Hum J, Nazhat SN, et al. Combining collagen and bioactive glasses for bone tissue engineering: a review. Adv Healthc Mater, 2015, 4(2): 176-194. |
| [12] | Li Q, Tao L, Chen B, et al. Extrahepatic bile duct regeneration in pigs using collagen scaffolds loaded with human collagen-binding bFGF. Biomaterials, 2012, 33(17): 4298-4308. |
| [13] | Li X, He JK, Liu YX, et al. Biomaterial scaffolds with biomimetic fluidic channels for hepatocyte culture. J Bionic Eng, 2013, 10(1): 57-64. |
| [14] |
Yin LH, Peng P, Mu X, et al. Preparation and characterization of three dimensional porous silk fibroin/gelatin composite scaffolds. J Funct Materials, 2013, 44(23): 3388-3391 (in Chinese). 殷丽华, 彭鹏, 牟星, 等. 丝素/明胶三维多孔支架的构建及其结构和性能表征. 功能材料, 2013, 23(44): 3388-3391. |
| [15] | Tan HP, Ramirez CM, Miljkovic N, et al. Thermosensitive injectable hyaluronic acid hydrogel for adipose tissue engineering. Biomaterials, 2009, 30(36): 6844-6853. |
| [16] | Li J, Stayshich RM, Meyer TY. Exploiting sequence to control the hydrolysis behavior of biodegradable PLGA copolymers. J Amer Chem Soc, 2011, 133(18): 6910-6913. |
| [17] | Löw K, Knobloch T, Wagner S, et al. Comparison of intracellular accumulation and cytotoxicity of free mTHPC and mTHPC-loaded PLGA nanoparticles in human colon carcinoma cells. Nanotechnology, 2011, 22(24): 245102-245114. |
| [18] | Haber GB, Freeman ML, Bedford R, et al. A prospective multi-center study of a bioabsorbable biliary wallstent (BAS) in 50 patients with malignant obstructive jaundice (MOJ). Gastrointest Endosc, 2001, 53(5): AB121. |
| [19] | Fu Q, Deng CL, Zhao RY, et al. The effect of mechanical extension stimulation combined with epithelial cell sorting on outcomes of implanted tissue-engineered muscular urethras. Biomaterials, 2014, 35(1): 105-112. |
| [20] | Meyer F, Wardale J, Best S, et al. Effects of lactic acid and glycolic acid on human osteoblasts: a way to understand PLGA involvement in PLGA/calcium phosphate composite failure. J Orthopaedic Res, 2012, 30(6): 864-871. |
| [21] | Gentile P, Chiono V, Carmagnola I, et al. An overview of poly(lactic-co-glycolic) acid (PLGA)-based biomaterials for bone tissue engineering. Int J Mol Sci, 2014, 15(3): 3640-3659. |
| [22] | Dash TK, Konkimalla VB. Poly-ε-caprolactone based formulations for drug delivery and tissue engineering: a review. J Control Release, 2012, 158(1): 15-33. |
| [23] | Larranaga A, Aldazabal P, Martin FJ, et al. Hydrolytic degradation and bioactivity of lactide and caprolactone based sponge-like scaffolds loaded with bioactive glass particles. Polym Degradat Stabil, 2014, 110: 121-128. |
| [24] | Miyazawa M, Torii T, Toshimitsu Y, et al. A tissue engineered artificial bile duct grown to resemble the native bile duct. Am J Transplant, 2005, 5(6): 1541-1547. |
| [25] | Aikawa M, Miyazawa M, Okada K, et al. Regeneration of extrahepatic bile duct possibility to clinical application by recognition of the regenerative process. J Smooth Muscle Res, 2007, 43(6): 211-218. |
| [26] | Aikawa M, Miyazawa M, Okada K, et al. Development of an artificial bile duct made of bioabsorbable polymer to be used for treatment of biliary stenosis. Gastroenterology, 2008, 134(4): A805. |
| [27] | Aikawa M, Miyazawa M, Okamoto K, et al. A novel treatment for bile duct injury with a tissue-engineered bioabsorbable polymer patch. Surgery, 2010, 147(4): 575-580. |
| [28] | Aikawa M, Miyazawa M, Okamoto K, et al. An extrahepatic bile duct grafting using a bioabsorbable polymer tube. J Gastrointest Surg, 2012, 16(3): 529-534. |
| [29] | Miyazawa M, Aikawa M, Okada K, et al. Regeneration of extrahepatic bile ducts of tissue engineering with a bioabsorbable polymer. J Artif Organs, 2012, 15(1): 26-31. |
| [30] | Nakashima S, Nakamura T, Miyagawa K, et al. Insitutissue engineering of the bile duct using polypropylene mesh-collagen tubes. Int J Artific Org, 2007, 30(1): 75-85. |
| [31] | Tashiro H, Ogawa T, Itamoto T, et al. Synthetic bioabsorbable stent material for duct-to-duct biliary reconstruction. J Surgical Res, 2009, 151(1): 85-88. |
| [32] | Tian LL, Prabhakaran MP, Ding X, et al. Emulsion electrospun nanofibers as substrates for cardiomyogenic differentiation of mesenchymal stem cells. J Mater Sci: Mater Med, 2013, 24(11): 2577-2587. |
| [33] | Fu W, Liu ZL, Feng B, et al. Electrospun gelatin/PCL and collagen/PLCL scaffolds for vascular tissue engineering. Int J Nanomed, 2014, 9(1): 2335-2344. |
| [34] | Jin J, Limburg S, Joshi SK, et al. Peripheral nerve repair in rats using composite hydrogel-filled aligned nanofiber conduits with incorporated nerve growth factor. Tissue Eng: Part A, 2013, 19(20): 2138-2164. |
| [35] | Pan JF, Liu NH, Sun H, et al. Preparation and characterization of electrospun PLCL/poloxamer nanofibers and dextran/gelatin hydrogels for skin tissue engineering. PLoS ONE, 2014, 9(11): e112885. |
| [36] | Liao SS, Cui FZ, Zhang W, et al. Hierarehieally biomimetic bone scaffold materials: nano-HA/collagen/PLA composite. J Biomed Mater Res Part B: APPl Biomater, 2004, 69(2): 158-165. |
| [37] |
Feng QL, Cui FZ, Zhang W. Nano-hydroxyapatite/ collagen composite for bone repair. Acta Acad Med Sin, 2002, 24(2): 124-128 (in Chinese). 冯庆玲, 崔福斋, 张伟. 纳米羚基磷灰石/胶原骨修复材料. 中国医学科学院学报, 2002, 24(2): 124-128. |
| [38] | Chen Y, Huang Z, Li XM, et al. In vitro biocompatibility and osteoblast differentiation of an injectable chitosan/nano-hydroxyapatite/collagen scaffold. J Nanomaterials, 2012, 2012: 40108. |
| [39] | Li N, Hans M, Ren YF. Porous collagen-hydroxyatite scaffolds with mesenchymal stem cells for bone regeneration. J Oral Implantol, 2015, 41(1): 45-49. |
| [40] | Hirata E, Uo M, Nodasaka Y, et al. 3D collagen scaffolds coated with multiwalled carbon nanotubes: initial cell attachment to internal surface. J Biomed Mater Res B: Appl Biomater, 2010, 93B(2): 544-550. |
| [41] | Boccafoschi F, Fusaro L, Botta M, et al. Arginine-glycine-glutamine and serine-isoleucine- lysine-valine-alanine-valine modified poly (L-lactide) films: bioactive molecules used for surface grafting to guide cellular contractile phenotype. Bionterphases, 2014, 9(2): 029002. |
| [42] | Haukas A. Electrospun polycaprolactone nanofiber scaffolds for tissue engineering [D]. Arkansas: University of Arkansas, 2012. |
| [43] | Ju RK, Wen YJ, Gou RB, et al. The experimental therapy on brain ischemia by improvement of local angiogenesis with tissue engineering in the mouse. Cell Transplantat, 2014, 23(S1): S83-S95. |
| [44] | Jeon H, Simon CG, Kim G. A mini-review: cell response to microscale, nanoscale, and hierarchical patterning of surface structure. J Biomed Materials Res Part B: Appl Biomater, 2014, 102(7): 1580-1594. |
| [45] | Xie CQ, Hu J, Ma HY, et al. Three-dimensional growth of iPS cell-derived smooth muscle cells on nanofibrous scaffolds. Biomaterials, 2011, 32(19): 4369-4375. |
| [46] | Holzwarth JM, Ma PX. 3D nanofibrous scaffolds for tissue engineering. J Mater Chem, 2011, 21(28): 10243-10251. |
| [47] | Wang WZ, Hu JW, He CL, et al. Heparinized PLLA/PLCL nanofibrous scaffold for potential engineering of small-diameter blood vessel: tunable elasticity and anticoagulation property. J Biomed Materials Res Part A, 2015, 103(5): 1784-1797. |
| [48] | Giusca CE, Perrozzi F, Melios C, et al. Electrostatic transparency of graphene oxide sheets. Carbon, 2015, 86(4): 188-196. |
| [49] | Shuakat MN, Lin T. Recent developments in electrospinning of nanofiber yarns. J Nanosci Nanotechnol, 2014, 14(2): 1389-1408. |
| [50] | Zhao L, Xu YL, He M, et al. Preparation of spider silk protein bilayer small-diameter vascular scaffold and its biocompatibility and mechanism research. Comp Interf, 2014, 21(9): 869-884. |
| [51] | Huang C, Geng XH, Ke QF, et al. Preparation of composite tubular grafts for vascular repair via electrospinning. Progr Nat Sci: Mater Int, 2012, 22(2): 108-114. |
| [52] | Ahmed M, Ghanbari H, Cousins BG, et al. Small caliber polyhedral oligomeric silsesquioxane nanocomposite cardiovascular grafts: influence of porosity on the structure, haemocompatibility and mechanical properties. Acta Biomater, 2011, 7(11): 3857-3867. |
| [53] | Tu TY, Wang Z, Bai J, et al. Rapid prototyping of concave microwells for the formation of 3D multicellular cancer aggregates for drug screening. Adv Healthc Mater, 2014, 3(4): 609-616. |
| [54] | Lee SJ, Heo DN, Park JS, et al. Characterization and preparation of bio-tubular scaffolds for fabricating artificial vascular grafts by combining electrospinning and a 3D printing system. Phys Chem Chem Phys, 2015, 17(5): 2996-2999. |
| [55] | Antebi B, Cheng XG, Harris JN, et al. Biomimetic collagen-hydroxyapatite composite fabricated via a novel perfusion-flow mineralization technique. Tissue Eng: Part C, 2013, 19(7): 487-496. |
| [56] | Wang JC, Liu CZ. Biomimetic collagen/hydroxyapatite composite scaffolds: fabrication and characterizations. J Bionic Eng, 2014, 11(4): 600-609. |
| [57] |
Li HY, Liu Y, He XT, et al. Electrospinning technology in tissue engineering scaffolds. Chin J Biotech, 2012, 28(1): 15-25 (in Chinese). 李好义, 刘勇, 何雪涛, 等. 应用于组织工程支架制备的电纺技术. 生物工程学报, 2012, 28(1): 15-25. |
| [58] | Scherner M, Reutter S, Klemm D, et al. In vivo application of tissue-engineered blood vessels of bacterial cellulose as small arterial substitutes: proof of concept? J Surg Res, 2014, 189(2): 340-347. |
| [59] | Barenghi R, Beke S, Romano I, et al. Elastin-coated biodegradable photopolymer scaffolds for tissue engineering applications. Biomed Res Int, 2014, 2014: 624645. |
| [60] | Dai XZ, Huang YC. Electrospun fibrous scaffolds of poly (glycerol-dodecanedioate) for engineering neural tissues from mouse embryonic stem cells. J Vis Exp, 2014, 18(88): e51587. |
| [61] | Park S, Im GI. Stem cell responses to nanotopography. J Biomed Mater Res Part A, 2015, 103(3): 1238-1245. |
| [62] | Nuffer JH, Siegel RW. Nanostructure-biomolecule interactions: implications for tissue regeneration and nanomedicine. Tissue Eng: Part A, 2010, 16(2): 423-430. |
| [63] | Galvan-Garcia P, Keefer EW, Yang F, et al. Robust cell migration and neuronal growth on pristine carbon nanotube sheets and yarns. J Biomater Sci Polym Ed, 2007, 18(10): 1245-1261. |
| [64] | Del Gaudio C, Baiguera S, Ajalloueian F, et al. Are synthetic scaffolds suitable for the development of clinical tissue-engineered tubular organs? J Biomed Mater Res Part A, 2014, 102(7): 2427-2447. |
| [65] | Yildirimer L, Seifalian AM. Three-dimensional biomaterial degradation-material choice, design and extrinsic factor considerations. Biotechnol Adv, 2014, 32(5): 984-999. |
| [66] |
Zhu XL, Yan T, Lü Y, et al. Repairing bile duct defects while preserving the sphincter of oddi. Chin J Hepat Surg, 2014, 20(1): 74-78 (in Chinese). 祝旭龙, 颜谭, 吕毅, 等. 保留Oddi括约肌的胆管修复策略. 中华肝胆外科杂志, 2014, 20(1): 74-78. |
| [67] |
Zhu XL, Yan T, Yao WJ, et al. Optimization of the method for isolating and culturing rat mesenchymal stem cells. J South Med Univ, 2014, 34(11): 1621-1626 (in Chinese). 祝旭龙, 颜谭, 姚维杰, 等. 大鼠骨髓间充质干细胞的分离与培养方法优化. 南方医科大学学报, 2014, 34(11): 1621-1626. |
 2016, Vol. 32
2016, Vol. 32