中国科学院微生物研究所、中国微生物学会主办
文章信息
- 韩笑奇, 白姝, 史清洪
- Han Xiaoqi, Bai Shu, Shi Qinghong
- 交联酶聚集体制备中钙离子的结构调控作用
- Structural regulation by calcium ion in preparing cross-linked enzyme aggregates
- 生物工程学报, 2016, 32(12): 1676-1684
- Chin J Biotech, 2016, 32(12): 1676-1684
- 10.13345/j.cjb.160155
-
文章历史
- Received: April 16, 2016
- Accepted: May 24, 2016
2 天津大学 系统生物工程教育部重点实验室,天津 300354
2 Key Laboratory of System Bioengineering of Ministry of Education, Tianjin University, Tianjin 300354, China
交联酶聚集体(Cross-linked enzyme aggregates,CLEAs)是本世纪初在交联酶晶体(Cross-linked enzyme crystals,CLECs)基础上发展起来的一种新型无载体固定化酶技术[1]。相较于CLEC中利用复杂的酶分子晶体制备固定化酶的方法[2],CLEA通过更加简便易行的物理沉淀方法使酶分子聚集,进而通过戊二醛等交联而成稳定的超分子结构。因其对酶纯度要求低、制备方法简单、聚集体稳定性高且易于回收和重复利用等诸多优点,单酶CLEA技术在生物催化和生物分离等领域展现良好的应用前景并得到了系统地研究[3-6]。López-Serrano等利用硫酸铵和十二烷基硫酸钠联合沉淀方法制备的交联脂肪酶聚集体具有高于天然脂肪酶1-2倍的催化活性[7]。此后,聚集体粒径和结构、聚集体稳定性等影响CLEA性能的参数和工艺条件也得到了系统地考察[8]。2014年,Torabizadeh等提出引入钠钙双离子聚集酶分子的阳离子辅助聚集策略。但结果显示,α-淀粉酶沉淀中钠钙双离子的存在改善了CLEA的稳定性并些许提高了淀粉底物的亲和性[9]。相比于单酶催化,生物体内更为普遍的代谢产物合成都是通过两个或多个酶的级联反应完成的[10-11]。Sheldon教授课题组于2003年提出了多酶CLEAs的“combi-CLEAs”概念[12],进而制备了级联催化(S)-扁桃酰胺合成的(S)-醇腈酶和腈水解酶双酶CLEA[13]。此后,该方法也被用于构建包括级联[14-15]和非级联反应[16]在内的多酶催化体系。相对于单酶CLEA,多酶CLEAs的复杂性不仅仅在于酶种类的增加,也带来了底物扩散和中间产物通道等诸多问题[17-19]。因此,CLEA合成的调控技术成为设计和优化酶催化体系的重要基础。
CLEA的制备通常包括沉淀和交联两个步骤[20-21],首先在无机盐、水溶性有机溶剂、聚合物乃至有机酸等作用下溶液中的酶析出形成聚集体[8],聚集体与戊二醛、葡聚糖等交联剂反应生成不溶性CLEAs。沉淀方法和交联剂对CLEAs中酶活性的影响虽已被广泛地观察,但少有涉及CLEAs尺寸和酶分子结构[20, 22]。CLEAs的尺寸乃至其中酶分子构象与生物催化体系中底物扩散、酶的生物活性和生物催化性能是密切相关的。
本研究以葡萄糖氧化酶(GOx)为研究对象,考察了钙离子对CLEAs尺寸的调控作用以及对酶分子结构、催化活性和CLEAs稳定性的影响,从而为优化葡萄糖氧化酶CLEA的合成提供指导。
1 材料与方法 1.1 材料GOx酶购于Sigma公司;无水乙醇、十二水合磷酸氢二钠(Na2HPO4∙12H2O)、二水合磷酸二氢钠(NaH2PO4∙2H2O)、氯化钙(CaCl2)和乙二胺四乙酸(EDTA)均为购于本地的分析纯试剂;50% (V/V)戊二醛和靛蓝胭脂红购于光复精细化工研究所。
1.2 方法 1.2.1 GOx酶CLEA的制备GOx酶CLEA的制备步骤如下:称取GOx酶4 mg置于1.5 mL离心管中,然后加入1 mL蒸馏水溶解,制得4 mg/mL的GOx酶溶液;称取27.75 mg氯化钙溶于1 mL蒸馏水中制得250 mmol/L的氯化钙浓缩液,浓缩液经蒸馏水依次稀释制得浓度为25、2.5和0.25 mmol/L的氯化钙工作液。然后,分别量取60 μL的GOx酶溶液置于5个1.5 mL离心管中后,再依次向GOx酶溶液中加入40 μL的蒸馏水和不同浓度的氯化钙工作液,各离心管中钙离子终浓度依次为100、10、1、0.1和0 mmol/L。上述溶液混合均匀后,加入900 μL无水乙醇并静置30 min沉淀GOx酶,沉淀后向离心管中加入50% (V/V)的戊二醛各42 μL,在2% (V/V)戊二醛终浓度下交联3 h。交联反应结束后,在3 000 r/min离心回收GOD酶CLEA并用蒸馏水反复置换除去残留戊二醛、乙醇和游离钙离子。制备的GOx酶CLEA经LABCONCO FreeZone冷冻干燥机冻干后称重,计算GOD酶CLEA的产率。使用前,将GOx酶CLEA溶解于600 μL的20 mmol/L磷酸盐缓冲液中(pH 7.0)。
1.2.2 GOx酶CLEA活性测定GOx酶CLEA的活性采用靛蓝胭脂红褪色法测定[23]。过氧化氢浓度的标准曲线绘制方法如下:向装有5 mL含1 mmol/L靛蓝胭脂红的20 mmol/L磷酸盐缓冲液(pH 7.0)的试管中分别加入0、0.5、1、1.5、2和2.5 mL的10 mg/L过氧化氢溶液并用蒸馏水稀释至15 mL配成过氧化氢浓度依次为0.0、0.5、1.0、1.5、2.0和2.5 mg/L的靛蓝胭脂红溶液。上述溶液在沸水中煮沸10 min后用自来水冷却至室温,在波长615 nm处测定其吸光度,绘制过氧化氢浓度与靛蓝胭脂红吸光度的标准曲线。
GOx酶CLEA活性测定方法如下:向装有1 mL含5 mmol/L葡萄糖的20 mmol/L磷酸盐缓冲液(pH 7.0)的试管中加入50 μL的GOx酶CLEA溶液;混合均匀并反应1 min后,加入5 mL含1 mmol/L靛蓝胭脂红的20 mmol/L磷酸盐缓冲液(pH 7.0)并加蒸馏水稀释至15 mL;上述溶液在沸水中煮沸10 min后用自来水冷却至室温,测定其在615 nm处吸光度。根据上述绘制的过氧化氢浓度与靛蓝胭脂红吸光度的标准曲线计算得到过氧化氢的产量。GOx酶CLEA活性(A)通过下式计算,

|
(1) |
向6只分别装有1 mL含5 mmol/L葡萄糖的20 mmol/L磷酸盐缓冲液(pH 7.0)的试管中加入50 μL的GOx酶CLEA溶液,混合均匀后在25 ℃下反应。反应过程中每间隔10 min取出一支试管,向其中加入5 mL含1 mmol/L靛蓝胭脂红的20 mmol/L磷酸盐缓冲液(pH 7.0)并加蒸馏水稀释至15 mL。上述溶液置于沸水中煮沸10 min后用自来水冷却至室温,测定其在615 nm处吸光度。根据过氧化氢浓度与靛蓝胭脂红吸光度标准曲线得到不同时刻过氧化氢产量,计算出相应的葡萄糖消耗量。GOx酶CLEA的底物转化速率由下式计算,

|
(2) |
GOx酶CLEA的最大反应速率(Vmax)和米氏常数(Km)采用Lineweaver-Burk双倒数作图法获得[24]。首先,向分别装有1 mL含5、10、15、20和25 mmol/L葡萄糖的20 mmol/L磷酸盐缓冲液(pH 7.0)的试管中加入50 μL的GOx酶CLEA溶液;然后,依据GOx酶CLEA活性测定方法测定不同底物浓度下的转化速率。最后,采用Lineweaver-Burk作图法求出GOx酶CLEA的Km值和Vmax值。
1.2.5 观测GOx酶CLEA粒径大小和形态结构GOx酶CLEA的粒径和形态分别采用光学显微镜和扫描电子显微镜(SEM)进行观测。步骤如下:20 μL的GOx酶CLEA溶液均匀滴至载玻片上后,置于倒置显微镜下观察本研究制备的GOx酶CLEA粒径大小。此外,20 μL的GOx酶CLEA溶液均匀滴至锡箔纸上后自然风干;风干样品喷金处理后在SEM下扫描CLEA的结构形态。
2 结果与分析 2.1 GOx酶CLEA的制备和性质不同钙离子浓度下制备GOx酶CLEA的收率如图 1所示。从中可以看出,GOx酶CLEA收率随着钙离子浓度的升高而降低;当GOx酶沉淀中钙离子浓度达到100 mmol/L时,GOx酶CLEA得率仅为40.2%。这一得率远低于没有钙离子条件下的GOx酶CLEA得率(对照CLEA,95.5%)。造成这一结果的原因可能在于如下两个方面:钙离子引入可能抑制了GOx酶分子间的聚集,促进更小粒径的GOx酶CLEA生成。最终结果是,离心和清洗条件下收集的GOx酶CLEA产品减少,损失增大。
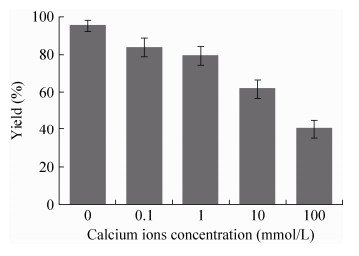
|
| 图 1 GOx酶CLEA收率随钙离子浓度的变化 Figure 1 Effect of calcium concentration on the CLEA yield of GOx enzyme. |
| |
不同钙离子浓度下制备的GOx酶CLEA形态如图 2所示。图 2 (A)为0.0 mmol/L钙离子浓度下GOx酶CLEA形态,其不仅具有较大的聚集体尺寸,而且呈现出一定的透光性。但随着沉淀过程中钙离子的引入GOx酶CLEA不仅透光性逐步丧失而且聚集体的表观尺寸(粒径)显著减小。通常,较小的CLEA粒径有利于底物的扩散,进而提高酶的催化效率。图 3中不同钙离子浓度下制备的CLEA粒子表面的扫描电镜(SEM)照片更清晰地显示出这种变化。从SEM结果可以看出,钙离子引起了GOx酶CLEA的纳米孔道结构发生了显著改变。图 3A显示,作为对照CLEA具有明显的纳米孔道结构。当钙离子浓度由0.0增至1.0 mmol/L后,CLEA不仅粒子尺寸降低(图 2C所示),CLEA粒子的纳米孔道结构也渐趋消失(图 3C所示)。这种变化与光镜下CLEA粒子透光性改变相一致。从上述显微镜结果可知,钙离子浓度为0.1 mmol/L时,GOx酶CLEA仍然具有明显的纳米孔道结构(图 3B所示),从而有利于底物和产物的扩散。同时,酶分子呈现较为紧密的结合,有利于维持酶的稳定性。此前,Wang等通过淀粉与木瓜蛋白酶的共沉淀获得了更大的微米级孔道结构以改善底物的传递[24]。随着钙离子浓度进一步增大,CLEA粒子内的纳米孔道结构渐趋消失(图 3C-E)。
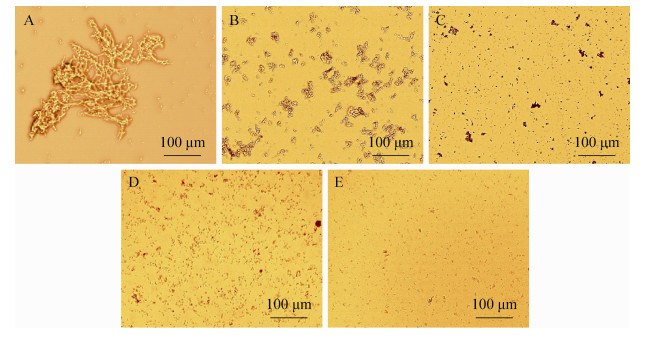
|
| 图 2 光学显微镜下GOx酶CLEAs形态照片 Figure 2 CLEA to pographies of GOx enzymes. The concentrations of calcium were (A) 0.0 mmol/L, (B) 0.1 mmol/L, (C) 1.0 mmol/L, (D) 10 mmol/L and (E) 100 mmol/L. |
| |
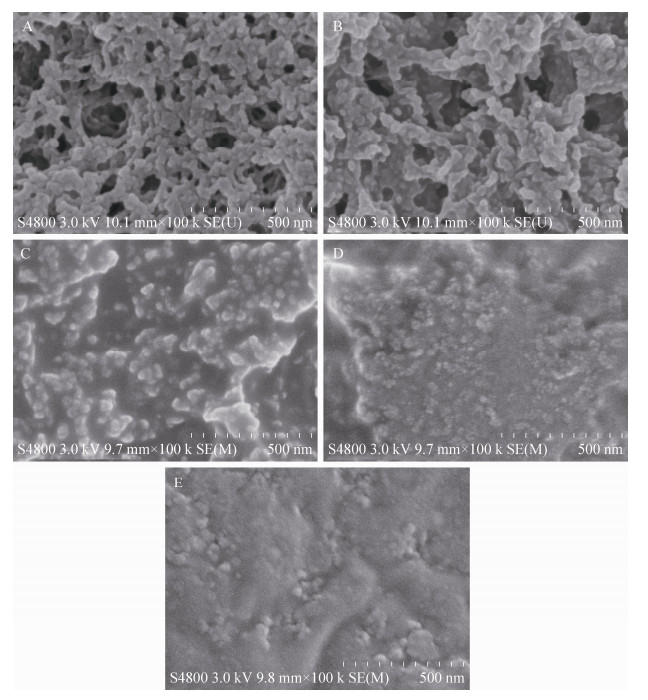
|
| 图 3 GOx酶CLEA的SEM Figure 3 SEM images of GOx enzymes CLEA. The concentrations of calcium were (A) 0.0 mmol/L, (B) 0.1 mmol/L, (C) 1.0 mmol/L, (D) 10 mmol/L and (E) 100 mmol/L. |
| |
在明确沉淀过程中钙离子的引入对GOx酶CLEA形态和孔道结构影响的基础上,进一步考察了这种变化对CLEA粒子GOx酶活性的影响。本文研究中定义对照CLEA粒子的GOx酶活性为100%。不同CLEA粒子中GOx酶的相对活性如图 4所示。CLEA酶活性分析中,反应液内无游离钙离子,因此GOx酶活性变化与CLEA粒子尺寸及纳米孔道结构的改变密切相关。从图 4中可以看出,低钙离子浓度下制备的CLEA粒子中GOx酶的活性显著提高。相较于对照CLEA,钙离子浓度为0.1 mmol/L条件下制备的CLEA粒子具有更高的GOx酶活性,其相对活性为对照CLEA的269% (图 4)。当钙离子浓度进一步提高至1.0 mmol/L时,制备的CLEA粒子中GOx酶活性仍比对照CLEA高42%。进一步研究显示,这种CLEA粒子中GOx酶活性的提高与钙离子的结合密切相关。0.1 mmol/L钙离子浓度下制备的CLEA粒子经10 mmol/LEDTA溶液处理除去结合钙离子后,CLEA粒子GOx酶活性降低了56%。这一结果表明,低浓度钙离子的引入不仅调控了CLEA粒子的尺寸和纳米孔道结构,也对酶的活性位点起到了保护作用。这种保护作用很有可能是通过稳定GOx酶构象等方式实现的。

|
| 图 4 不同GOx酶CLEA的相对活性变化 Figure 4 Relative activities of CLEAs of GOx enzymes. |
| |
在上述研究工作的基础上,进一步研究了0.1 mmol/L钙离子浓度下制备CLEA粒子的GOx酶底物转化率,结果如图 5所示。结果表明,制备的CLEA粒子获得了更高的GOx酶底物转化速率,转化速率达到0.28 mol/(g·h)。随着葡萄糖的消耗,底物浓度降低,底物转化速率逐步下降。而在相同条件下,对照CLEA粒子的底物转化速率仅为0.10 mol/(g·h),并随着催化反应时间而降低。
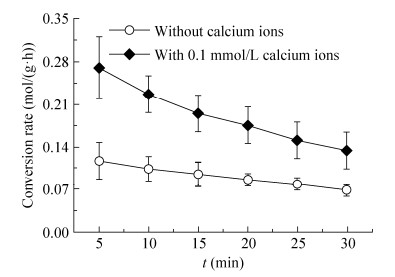
|
| 图 5 CLEA的GOx酶底物转化速率随时间变化情况 Figure 5 The relationship of turnover rate of CLEA of GOx enzyme and time. |
| |
GOx酶的CLEA粒子反应动力学的Lineweaver-Burk图见图 6。结果显示,CLEA粒子中GOx酶的Km值为51.06 mmol/L,仅略低于对照CLEA的Km值(64.83 mmol/L)。与此同时,0.1 mmol/L钙离子浓度下制备的CLEA粒子的GOx酶Vmax值达到81.30 mmol/(L∙min),其显著高于对照CLEA的34.48 mmol/(L∙min)。这一结果不同于钠钙双离子作用下以大分子淀粉为底物的α-淀粉酶的CLEA结果[9],表明钙离子存在下的CLEA制备方法对于促进小分子底物(如葡萄糖等)的反应更加有利。
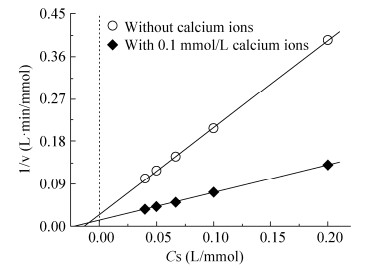
|
| 图 6 Ca2+对GOx酶CLEA反应动力学的影响 Figure 6 Effect of calcium ions on the CLEA kinetics of GOx enzyme. Cs is the concentration of the substrate. |
| |
CLEA粒子的稳定性测定通过CLEA粒子重复催化相同浓度葡萄糖溶液的方法进行测定,结果如图 7所示。从中可以看出,0.1 mmol/L钙离子浓度下制备的CLEA在重复使用过程中,酶的活性逐步降低,在重复使用8次后GOx酶活性损失了15%。相较于此,对照CLEA粒子在重复使用过程中酶活性的损失更为严重,重复使用8次后GOx酶活性降低了32%。这一结果显示,引入钙离子能够起到稳定GOx酶活性的作用。这也从另一侧面进一步验证了低浓度钙离子的引入对GOx酶活性位点和分子构象的保护作用。
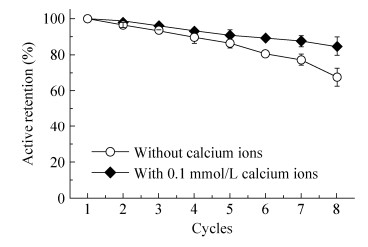
|
| 图 7 GOx酶CLEA活性随催化次数的变化 Figure 7 Relationship of relative activity of CLEA and operational cycles. |
| |
针对CLEA粒子尺寸和微观结构的调控,以GOx酶为研究对象,系统地考察了钙离子对CLEA粒子尺寸和微观结构以及酶催化性能和实用性的影响。研究结果表明,GOx酶沉淀过程中引入钙离子显著降低了CLEA粒子尺寸,同时CLEA粒子的纳米孔道结构也随之渐趋消失。0.1 mmol/L钙离子浓度下制备CLEA粒子仍保有清晰的、有利于底物和产物扩散的纳米孔道结构。以葡萄糖为底物的GOx酶催化结果显示,0.1 mmol/L钙离子浓度下制备的CLEA粒子GOx酶活性为对照CLEA的2.69倍;即便1.0 mmol/L钙离子浓度下制备的GOx酶CLEA活性仍高出对照CLEA 42%。此外,0.1 mmol/L钙离子浓度下制备的CLEA粒子不仅具有更高的GOx酶底物转化速率和很好的操作稳定性,而且CLEA中GOx酶的最大反应速率显著提高。研究结果显示,这归功于钙离子对GOx酶活性位点和酶分子构象的保护作用。本文的研究结果明确了钙离子对CLEA粒子尺寸和微观结构的调控作用,为制备具有高效生物催化活性的CLEA粒子奠定了基础。
| [1] | Cao LQ, van Rantwijk F, Sheldon RA. Cross-linked enzyme aggregates: a simple and effective method for the immobilization of penicillin acylase. Org Lett, 2000, 2 (10) : 1361–1364. DOI: 10.1021/ol005593x |
| [2] | Quiocho FA, Richards FM. Intermolecular cross linking of a protein in the crystalline state: carboxypeptidase-A. Proc Natl Acad Sci USA, 1964, 52 (3) : 833–839. DOI: 10.1073/pnas.52.3.833 |
| [3] | Sheldon RA. Characteristic features and biotechnological applications of cross-linked enzyme aggregates (CLEAs). Appl Microbiol Biotechnol, 2011, 92 (3) : 467–477. DOI: 10.1007/s00253-011-3554-2 |
| [4] | Brady D, Jordaan J. Advances in enzyme immobilisation. Biotechnol Lett, 2009, 31 (11) : 1639–1650. DOI: 10.1007/s10529-009-0076-4 |
| [5] | Sheldon RA. Engineering a more sustainable world through catalysis and green chemistry. J R Soc Interface, 2016, 13 (116) . DOI: 10.1098/rsif.2016.0087 |
| [6] | Gruškienė R, Kairys V, Matijošytė I. CLEA-based immobilization of methylotropic yeast alcohol oxidase: influence on storage stability and reaction efficiency. Org Process Res Dev, 2015, 19 (12) : 2025–2033. DOI: 10.1021/acs.oprd.5b00291 |
| [7] | López-Serrano P, Cao L, van Rantwijk F, et al. Cross-linked enzyme aggregates with enhanced activity: application to lipases. Biotechnol Lett, 2002, 24 (16) : 1379–1383. DOI: 10.1023/A:1019863314646 |
| [8] | Talekar S, Joshi A, Joshi G, et al. Parameters in preparation and characterization of cross linked enzyme aggregates (CLEAs). RSC Adv, 2013, 3 (31) : 12485–12511. DOI: 10.1039/c3ra40818c |
| [9] | Torabizadeh H, Tavakoli M, Safari M. Immobilization of thermostable α-amylase from Bacillus licheniformis by cross-linked enzyme aggregates method using calcium and sodium ions as additives. J Mol Catal B: Enzym, 2014, 108 : 13–20. DOI: 10.1016/j.molcatb.2014.06.005 |
| [10] | Sheldon RA. Fundamentals of green chemistry: efficiency in reaction design. Chem Soc Rev, 2012, 41 (4) : 1437–1451. DOI: 10.1039/C1CS15219J |
| [11] | Reetz MT. Biocatalysis in organic chemistryand biotechnology: past, present, and future. J Amer Chem Soc, 2013, 135 (34) : 12480–12496. DOI: 10.1021/ja405051f |
| [12] | Cao LQ, van Langen L, Sheldon RA. Immobilised enzymes: carrier-bound or carrier-free?. Curr Opin Biotechnol, 2003, 14 (4) : 387–394. DOI: 10.1016/S0958-1669(03)00096-X |
| [13] | Mateo C, Chmura A, Rustler S, et al. Synthesis of enantiomerically pure (S)-mandelic acid using an oxynitrilase-nitrilase bienzymatic cascade: a nitrilase surprisingly shows nitrile hydratase activity. Tetrahedron: Asymmetry, 2006, 17 (3) : 320–323. DOI: 10.1016/j.tetasy.2006.01.020 |
| [14] | van Rantwijk F, Stolz A. Enzymatic cascade synthesis of (S)-2-hydroxycarboxylic amides and acids: cascade reactions employing a hydroxynitrile lyase, nitrile-converting enzymes and an amidase. J Mol Catal B: Enzym, 2015, 114 : 25–30. DOI: 10.1016/j.molcatb.2014.08.012 |
| [15] | Chmura A, Rustler S, Paravidino M, et al. The combi-CLEA approach: enzymatic cascade synthesis of enantiomerically pure (S)-mandelic acid. Tetrahedron: Asymmetry, 2013, 24 (19) : 1225–1232. DOI: 10.1016/j.tetasy.2013.08.013 |
| [16] | Dalal S, Kapoor M, Gupta MN. Preparation and characterization of combi-CLEAs catalyzing multiple non-cascade reactions. J Mol Catal B: Enzym, 2007, 44 (3/4) : 128–132. |
| [17] | Zhang YHP. Substrate channeling and enzyme complexes for biotechnological applications. Biotechnol Adv, 2011, 29 (6) : 715–725. DOI: 10.1016/j.biotechadv.2011.05.020 |
| [18] | Fu JL, Liu MH, Liu Y, et al. Interenzyme substrate diffusion for an enzyme cascade organized on spatially addressable DNA nanostructures. J Amer Chem Soc, 2012, 134 (12) : 5516–5519. DOI: 10.1021/ja300897h |
| [19] | Sheldon RA, van Pelt S. Enzyme immobilisation in biocatalysis: why, what and how. Chem Soc Rev, 2013, 42 (15) : 6223–6235. DOI: 10.1039/C3CS60075K |
| [20] | Schoevaart R, Wolbers MW, Golubovic M, et al. Preparation, optimization, and structures of cross-linked enzyme aggregates (CLEAs). Biotechnol Bioeng, 2004, 87 (6) : 754–762. DOI: 10.1002/(ISSN)1097-0290 |
| [21] |
Wang MF, Qi W, Su RX, et al. Advances in cross-linked enzyme aggregates.
Prog Chem, 2010, 22 (1) : 173–178.
(in Chinese). 王梦凡, 齐崴, 苏荣欣, 等. 交联酶聚体技术研究进展. 化学进展, 2010 , 22 (1): 173-178. |
| [22] | Correia I, Aksu S, Ad o P, et al. Vanadate substituted phytase: immobilization, structural characterization and performance for sulfoxidations. J Inorg Biochem, 2008, 102 (2) : 318–329. DOI: 10.1016/j.jinorgbio.2007.09.005 |
| [23] |
Zhou JQ, Chen SH, Wang JW. A simple and convenient method to determine the activity of glucose oxidase.
Exp Technol Manage, 2008, 25 (12) : 58–60.
(in Chinese). 周建芹, 陈韶华, 王剑文. 测定葡萄糖氧化酶活力的一种简便方法. 实验技术与管理, 2008 , 25 (12): 58-60. |
| [24] |
Bu PP, Chen J, Du GC. Purification and characterization of a halophilic urethanase from Klebsiella pneumoniae.
Chin J Biotech, 2014, 30 (3) : 404–411.
(in Chinese). 卜攀攀, 陈坚, 堵国成. 耐盐氨基甲酸乙酯水解酶的分离纯化及酶学性质. 生物工程学报, 2014 , 30 (3): 404-411. |
| [25] | Wang MF, Jia CX, Qi W, et al. Porous-CLEAs of papain: application to enzymatic hydrolysis of macromolecules. Bioresour Technol, 2011, 102 (3) : 3541–3545. DOI: 10.1016/j.biortech.2010.08.120 |
 2016, Vol. 32
2016, Vol. 32




