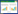服务
文章信息
- 房婷, 任军, 张金龙, 尹可欣, 杨秀旭, 于蕊, 张晓鹏, 于长明
- Ting Fang, Jun Ren, Jinlong Zhang, Kexin Yin, Xiuxu Yang, Rui Yu, Xiaopeng Zhang, Changming Yu
- 中试规模纯化重组鼠疫rF1-V 融合蛋白及其免疫原性分析
- Pilot-scale purification of rF1-V fusion protein of Yersinia pestis and characterization of its immunogenicity
- 生物工程学报, 2016, 32(1): 95-104
- Chin J Biotech, 2016, 32(1): 95-104
- 10.13345/j.cjb.150080
-
文章历史
- Received: February 9, 2015
- Accepted: April 27, 2015
鼠疫是由鼠疫耶尔森菌 (Yersinia pestis,以下简称鼠疫菌) 引起的自然疫源性烈性传染病。据记载,在人类历史上,世界范围内曾暴发过3次鼠疫大流行,并致使至少1.6亿人死亡[1]。人间鼠疫包括腺鼠疫、肺鼠疫、败血型鼠疫等类型,其中肺鼠疫通过气溶胶在人与人之间传播,在不能及时治疗的情况下病死率高达100%[2, 3]。美国疾病预防控制中心将鼠疫菌归类为易传染、高致死率、可引起公众恐慌社会动荡、需要进行特别公共卫生准备的A类微生物病原体[4]。同时鼠疫菌被作为传统的生物战剂之一,这种廉价且又容易操作的微生物成为国际恐怖分子制造生物恐怖的首选之一[5],因此研究鼠疫疫苗对于有效抵御平时、战时的鼠疫威胁均有重要意义。
尽管近期美国FDA (Food and drug administration) 已批准左氧氟沙星 (Levofloxacin) 用于应对各种形式的鼠疫 (http://www.fda.gov/ NewsEv-ents/Newsroom/PressAnnouncements/ucm302220.htm),预防性疫苗仍是减少鼠疫风险最有效的途径之一。人用鼠疫疫苗有全细胞灭活疫苗 (KWCV) 和鼠疫减毒活疫苗 (EV76株)[6, 7]。甲醛灭活的全菌苗 (KWCV) 曾在美国获得批准,通常在两个月内免疫3次,由于可能导致头疼、发热、淋巴结炎等副反应,副反应发生率为10%左右,该疫苗已于1999年停止生产。减毒活疫苗 (EV76株) 是一种色素沉着缺损性突变株的鼠疫菌,这种疫苗可以保护小鼠抵抗皮下或吸入途径攻击鼠疫菌。但人体接种后的副反应较大,如头痛、发热、无力等不适,另外有研究表明,小鼠和长尾猴免疫鼠疫减毒活疫苗后有导致死亡的情况[7, 8, 9]。因此对鼠疫减毒活疫苗的安全性存在一定的担忧。
近20年来,疫苗研究的重点转向以鼠疫菌荚膜蛋白F1 (Fraction 1 capsule,F1)、V毒力因子也称低钙反应V蛋白 (Low-calcium-response V,LcrV) 和鼠疫菌外膜蛋白 (Yersinia pestis outer membrane protein,Yops) 为架构的重组亚单位疫苗[3, 10]。其中由F1抗原和V抗原联合构成的鼠疫亚单位疫苗已成为国内外新型鼠疫疫苗研究的热点,不仅可以有效防护腺鼠疫,而且可以有效地阻止肺鼠疫的发生。由英国(PharmAthene UK Limited) 研发的rF1+rV疫苗[11, 12]已完成一期临床实验,美国 (DynPort vaccine company LLC,ACSC company) 研发的rF1-V融合蛋白疫苗[13, 14]已完成二期临床实验阶段,同时美国 (National institute of allergy and infectious diseases,NI AID) 研发的以鞭毛蛋白为佐剂的rF1-V融合蛋白疫苗[15]也已完成一期临床实验 (Clinical Trials govIdentifier: NCT00246467 NCT01122784 NCT01381744)。
1 材料与方法 1.1 材料工程菌株BL21 (DE3)/pET42a(+)-rF1-V由本实验室构建并保存。
层析柱和填料:离子交换填料:Source30 Q、疏水填料Phenyl Sepharose High Performance装于XK 26/20柱壳,凝胶过滤预装柱:HiLoad 26/60 Superdex 200 prep grade均购于GE Healthcare公司。Anti-mouse IgG-HRP (#2231)为Santa Cruze公司产品。酵母提取物、胰蛋白胨为OXIOD公司产品。细菌内毒素标准品购自厦门鲎试剂实验厂有限公司。卡那霉素 (Kanamycin,Kana)为华北制药公司产品。抗V和抗F1单克隆抗体购自Abcam公司。其余为国产或进口分析纯试剂。6-8周龄雌性BALB/c小鼠来自军事医学科学院实验动物中心。
B. Braun C30plus型生物反应器购自德国赛多利斯公司。高压均质机购自意大利Niro-soavi 公司。低温高速离心机购自Beckman Coulter公司。SDS-PAGE电泳仪为BIO-RAD公司产品。Image Quant LAS4000mini成像系统和纯化仪AKTA EXPLORER均为GE Healthcare公司产品。酶标仪Spectra Max Paradigm为Molecular Devices公司产品。
1.2 方法 1.2.1 发酵条件的优化和放大首先在5 L摇瓶 (装有1 L LB培养基) 的规模上对诱导OD值、诱导时间、诱导温度、IPTG浓度进行优化。然后将优化好的工艺条件放大至C30plus型生物反应器,该生物反应器总体积42 L,装载30 L培养基进行发酵。
1.2.2 中试发酵挑取工程菌BL21 (DE3)/pET42a(+)-rF1-V接种于5 mL含有30 μg/mL Kana的LB培养基中,37 ℃、220 r/min培养12 h。然后将其接入1 L含30 μg/mL Kana的LB培养基,37 ℃、220 r/min培养12 h。最后将其接入42 L生物反应器中 (装有30 L LB培养基),通过生物反应器反馈控制将温度调节为37 ℃,搅拌转速设定为200-400 r/min,溶氧通过通气量及搅拌转速控制为大于20%,pH通过发酵罐酸碱流加泵自动反馈流加1 mol/L NaOH或30%磷酸控制为7.0。整个发酵过程的发酵参数通过赛多利斯MFCS型发酵智能控制软件进行实时监控记录,根据优化条件控制发酵罐参数,放罐后离心收集菌体。
1.2.3 菌体破碎及硫酸铵分级沉淀发酵罐中诱导表达后,4 ℃、8 000×g离心10 min,收集菌体,称重。按菌体湿重 (g) 与缓冲液体积 (mL) 为1∶10重悬于缓冲液A (50 mmol/L Tris,2 mmol/L EDTA,5%甘油,pH 9.0)。高压匀浆 (工作压力为90 MPa) 后,4 ℃、12 000 r/min离心30 min收集上清。采用硫酸铵分级沉淀,终浓度为40%,冰浴搅拌30 min,4 ℃、10 000 r/min离心30 min,弃上清。沉淀用缓冲液A洗3遍后以2倍于上述体积重悬。
1.2.4 离子交换层析采用Source30Q装填于XK26/20层析柱内 (柱体积∶60 mL),先用1 mol/L NaOH,接触30 min以上去热原,缓冲液A线性流速为110 cm/h平衡5-10个柱体积→上样→缓冲液A再平衡5-10个柱体积→缓冲液B (50 mmol/L Tris,1 mol/L NaCl,pH 9.0) 梯度洗脱 30%B、10个柱体积,收集目的蛋白。
1.2.5 疏水相互作用层析采用Phenyl Sepharose High Performance 装填于XK26/20层析柱内 (柱体积∶60 mL),先用 1 mol/L NaOH,接触30 min以上去热原,缓冲液C (50 mmol/L Tris,2 mol/L NaCl,pH 9.0) 线性流速为110 cm/h平衡5-10个柱体积→样品用母液调节电导到2 mol/L NaCl离心后上样→缓冲液C再平衡5-10个柱体积→缓冲液D (50 mmol/L Tris,pH 9.0) 梯度洗脱 100% D、10个柱体积,收集目的蛋白。
采用无热原的凝胶过滤层析柱 (HiLoad 26/60 Superdex 200 prep grade,柱体积∶318 mL) 对样品进行精纯,缓冲液E为20 mmol/L PB,0.15 mol/L NaCl,pH 7.2,收集目的蛋白峰,用0.2 μm滤膜过滤分装后保存于-80 ℃待用。
1.2.7 纯化蛋白的鉴定将纯化好的蛋白分别进行蛋白浓度测定(Lowry法),方法见2010年版《中华人民共和国药典》 (三部)[16]附录VI B第二法;细菌内毒素检查采用凝胶限度试验,方法见 (2010年版《中华人民共和国药典》三部[16]附录XII E);纯度测定-采用还原型SDS-PAGE凝胶电泳法 (2010年版《中华人民共和国药典》 (三部)[16]附录IV C);鉴别试验采用免疫印迹法测定 (2010年版《中华人民共和国药典》 (三部)[16]附录VIII A)。N末端氨基酸序列测定和相对分离质量测定委托军事医学科学院仪器测试中心测定。
1.2.8 免疫动物将本室保存的rF1、rV和纯化好的rF1-V融合蛋白与氢氧化铝佐剂按比例混合,配制成抗原终浓度为0.2 mg/mL的疫苗。将雌性BALB/c (6-8周) 小鼠随机分为4组,每组10只,分别接种20 μg的rF1、rV、rF1-V,和各10 μg的 rF1+ rV。后腿进行肌肉注射0.1 mL/只,4周后用相同剂量进行加强免疫。首次免疫前、末次免疫后,采尾血,分离血清,用ELISA 法测定血清抗体。
96孔板每孔分别包被100 μL终浓度为 5 μg/mL的rF1、rV,免疫后血清作为一抗,以HRP标记的羊抗鼠-IgG为二抗,分别测定抗F1和V的抗体滴度,在450 nm测定吸光度,以630 nm为参比波长。阳性的判定标准为实验孔A值与阴性对照A值的比值大于或等于2.1。
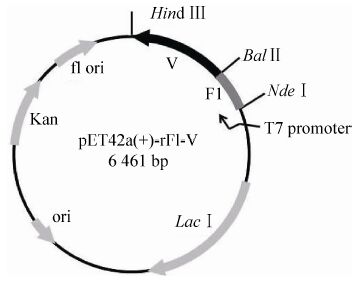
2 结果 2.1 发酵条件的优化和中试发酵情况构建的表达载体pET42a(+)-rF1-V见图1,首先在5 L摇瓶规模上对发酵的关键参数进行了优化,将收集的菌体按比例重悬,超声后采用SDS-PAGE分析上清和沉淀,最终确定小试的发酵条件为:诱导OD600值为0.6,诱导温度为25 ℃,IPTG浓度为50 μmol/L,诱导时间为5 h。在以上条件的基础上,进行了中试发酵的摸索,诱导OD值为1.2,其他条件不变。发酵实时监控曲线见图2,由图可见整个发酵过程条件稳定,各种参数无剧烈变化,有利于细菌生长。而且目的蛋白的表达量占20%以上,且绝大部分在上清中,实现了目的蛋白的高效可溶表达,有利于后连续工艺的开展。
|
| 图1 F1-V 表达载体示意图 Fig.1 Diagram of pET42a(+)-rF1-V expression plasmid. |
|
| 图2 rF1-V 发酵参数曲线 Fig.2 The fermentation parameters curve of rF1-V. |
经过逐级摸索和重复,最终将目的蛋白沉淀的饱和硫酸浓度定为40%,经过一步沉淀,可将目的蛋白进行有效富集并能起到一定的分离提纯的目的 (图3),目的蛋白纯度从20%提高到50%以上。
|
| 图3 rF1-V硫酸铵分级沉淀结果 Fig.3 SDS-PAGE analysis of rF1-V antigen obtained after ammonium sulfate precipitation. 1: marker; 2: the whole cell lysate; 3: the supernatant after homogenate and centrifuge; 4: the precipitation after homogenate and centrifuge; 5: the supernatant after the ammonium sulfate (AS) precipitation; 6: the precipitation after the AS precipitation. The position of rF1-V protein band was marked with an arrow. |
目的蛋白经过硫酸铵分级沉淀后,分别经过Source 30Q、Phenyl HP和Superdex 200三步层析柱纯化,目的蛋白纯度达到99%以上 (图4),回收率为24% (表1)。
|
| 图4 纯化洗脱图谱和SDS-PAGE 汇总图 Fig.4 Elution profile and SDS-PAEG analysis of every purification step. (A) Elution profile of Source30Q. (B) Elution profile of Phenyl Sepharose HP. (C) Elution profile of Superdex 200. (D) SDS-PAGE analysis of every step. 1: the whole cell lysate; 2: the supernatant after homogenate and centrifuge; 3: the precipitation after the AS precipitation; 4: the fraction collection of Source 30Q; 5: the fraction collection of Superdex 200; 6: the fraction collection of Phenyl HP; 7: marker. The position of rF1-V protein band was marked with an arrow. |
| Purification step | Total protein (mg) | Total volume (mL) | Purity (%) | Total protein of interest (mg) | Percentage yield (%) |
| Homogenate | 7 053.60 | 1 500.00 | 20.67 | 1 457.98 | 100.00 |
| The supernatant after the AS precipitation | 1 612.37 | 3 000 | 52.69 | 849.56 | 58.27 |
| Source 30Q | 1 135.20 | 190.00 | 56.10 | 636.85 | 43.68 |
| Phenyl HP | 418.07 | 58.90 | 90.50 | 378.35 | 25.95 |
| Superdex 200 | 259.34 | 288.06 | 99.02 | 355.75 | 24.40 |
将纯化所得蛋白进行了蛋白质浓度和细菌内毒素测定,均符合要求。Western blotting使用本实验室制备的rF1、rV抗原作阳性对照,一抗使用1∶10 000稀释的抗V和抗F1单抗,Western印迹表明,rF1-V抗原与抗V、F1抗体均有特异性结合。rF1-V的理论分子量为52 769 Da,这与检测结果一致。N端测序结果为ADLTA (图5),这与预测的蛋氨酸缺失的N端序列一致。原液分装后保存在-80 ℃。
|
| 图5 rF1-V的Western blotting、N端测序和MALDI-TOF-MS测定结果图 Fig.5 The results of Western blotting analysis,N terminal sequencing chromatograms using Edman degradation and MALDI-TOF-MS of rF1-V. (A) Western blotting analysis of rF1-V. 1,3: purified rF1-V; 2: rF1; 4: rV. (B) N terminal sequencing chromatograms of rF1-V,using Edman degradation. The first five cycles of rF1-V’s N-terminal sequencing is ADLTA. (C) MALDI-TOF-MS of rF1-V for whole protein mass was observed at m/z 52 764. dptu: N,N-diphenylthiourea. |
利用ELISA法分别检测各组小鼠抗F1和抗V的抗体滴度,滴度结果表示为终点滴度倒数的log10±s,组间抗体效价的比较采用GraphPad Prism 5.01软件的多重比较 (One-way ANOVA)。比较结果P﹤0.05,认为有统计学差异。图6A说明rF1-V融合蛋白诱导抗F1的抗体滴度明显高于 单一抗原rF1组和联合抗原免疫rF1+rV组 (P﹤0.001),而图6B则显示rF1-V融合蛋白诱导抗V的抗体滴度与其他两组对照组相比没有显著性差异。
|
| 图6 小鼠免疫后血清中抗F1和抗V的抗体滴度 Fig.6 The serum IgG titer of anti-F1 and anti-V after immunized. (A) The Logarithm of anti-F1 serum IgG titer of female BALB/c (6-8 weeks) mice which were immunized with 20 μg rF1,10 μg rF1+10 μg rV and 20 μg rF1-V twice (day 0 and day 28). (B) The Logarithm of anti-V serum IgG titer of female BALB/c (6-8 weeks) mice which were immunized with 20 μg rV,10 μg rF1+10 μg rV and 20 μg rF1-V twice (day 0 and day 28). |
外源蛋白重组表达系统可分为原核和真核表达系统。大肠杆菌表达体系是目前最成熟的原核表达系统,其生产周期短、成本低,但外源蛋白往往因为产物无法正确折叠以包涵体形式聚集[17]。利用基因工程生产外源蛋白,实现可溶性表达非常重要,可溶性表达不仅有利于下游的分离纯化,而且亦是衡量重组蛋白是否具有生物活性的重要标志之一。目前国外重组F1-V融合蛋白表达主要分为3种情况:一种是不带标签在大肠杆菌中以包涵体形式表达,后期纯化需要对其进行复性[18];一种是用植物细胞进行可溶性表达,但表达量非常低[19];还有一种是对F1和V进行基因改造,使其在大肠杆菌中以可溶形式表达,但带有His标签[20]。以上几种情况均不利于工艺的稳定、放大,也会给后期的产品质量控制带来一系列的问题。
前期工作已经构建了能高效表达rF1-V的工程菌,本研究对其可溶性表达条件进行了优化和放大,并实现了中试规模的高密度培养技术 (High cell density culture,HCDC)。在42 L反应器中,通过生物反应器反馈控制将温度调节为37 ℃/25 ℃,搅拌转速设定为 200-400 r/min,溶氧通过通气量及搅拌转速控制为大于20%,pH值通过发酵罐酸碱流加泵自动反馈流加1 mol/L NaOH或30%磷酸控制为7.0,最终菌体产量为143 g/批,蛋白表达量为20.67%,且绝大多数都在上清中,这为后续各项工作的开展打下了良好的基础。
在纯化工艺的开发中,充分利用目的蛋白的性质,最终将工艺确定为硫酸铵分级沉淀、阴离子交换层析、疏水相互作用层析和凝胶过滤层析的工艺流程。该流程各步骤之间衔接顺畅,无需换液、浓缩等中间步骤,在去除杂蛋白的同时也能有效去除内毒素和宿主DNA残留,目的蛋白纯度达到99%,且各项检定指标合格。同时,该工艺采用商品化的常规填料,生产周期较短,且便于线性放大,具有工业生产的潜力。
免疫原性结果显示,与对照rF1、rV以及rF1+V组比较,融合蛋白rF1-V诱导的抗体滴度更高或没有显著性差异,抗F1的抗体效价为1∶128 000、抗V的抗体效价为1∶640 000。通常来说,血清抗体的水平跟攻毒后小鼠的存活率密切相关。血清IgG效价越高,产生的保护性越好。一般来说,抗F1的抗体效价达到1∶1 000 000,抗V的抗体效价达到1∶2 000 000,即可以对600 MLD的攻毒产生80%以上的保护[21],预示该疫苗对鼠疫具有良好的保护效果。
rF1-V融合蛋白疫苗在啮齿类动物和豚鼠模型中产生了较高的抗体滴度[22, 23]和较好的保护性[13, 24]。文献显示rF1-V诱导的免疫主要以体液免疫为主,Dinc G等采用流式细胞术检测两次免疫rF1-V疫苗后的小鼠淋巴细胞,结果显示该疫苗无法显著增加表达IFN-γ、TNF-α的CD4+或CD8+ T细胞数量[25]。
我国现分为11种类型的鼠疫自然疫源地,分别分布于19个省市,其面积占国土整体的15%左右。2014年7月17日甘肃省玉门现鼠疫病例 1人死亡,经确诊为肺鼠疫 (http://www.qhcdc.- org.cn/Item/2175.aspx)。而肺鼠疫病程急、致死率高,肺鼠疫患者咳嗽产生的带菌飞沫可经呼吸道途径发生人-人传播,导致更加严重的人间鼠疫[2, 3],可见鼠疫的威胁从未远离。因此实现鼠疫疫苗的应急化规模生产,可以提高应对鼠疫无论是作为生物武器,还是突发传染性疾病的应急反应与有效处置能力,具有保障人民身体健康、维护社会稳定的重要意义。综上所述,本研究建立的中试规模高效纯化rF1-V融合蛋白的工艺为该疫苗的应急化规模制备提供一定的技术支撑。
| [1] | Achtman M, Morelli G, Zhu PX, et al.Microevolution and history of the plague bacillus, Yersinia pestis.Proc Natl Acad Sci USA, 2004, 101(51): 17837-17842. |
| [2] | Kool JL.Risk of person-to-person transmission of pneumonic Plague.Clin Infect Dis, 2005, 40(8): 1166-1172. |
| [3] | Rosenzweig JA, Jejelowo O, Sha J, et al.Progress on plague vaccine development.Appl Microbiol Biotechnol, 2011, 91(2): 265-286. |
| [4] | Ryman TK, Dietz V, Cairns KL.Too little but not too late: results of a literature review to improve routine immunization programs in developing countries.BMC Health Serv Res, 2008, 8: 134. |
| [5] | Christian MD.Biowarfare and bioterrorism.Crit Care Clin, 2013, 29(3): 717-756. |
| [6] | Ben Ouagrham-Gormley S.Growth of the anti-plague system during the soviet period.Crit Rev Microbiol, 2006, 32(1): 33-46. |
| [7] | Smiley ST.Current challenges in the development of vaccines for pneumonic plague.Expert Rev Vaccines, 2008, 7(2): 209-221. |
| [8] | Russell P, Eley SM, Hibbs SE, et al.A comparison of plague vaccine, Usp and Ev76 vaccine induced protection against Yersinia pestis in a murine model.Vaccine, 1995, 13(16): 1551-1556. |
| [9] | Welkos S, Pitt MLM, Martinez M, et al.Determination of the virulence of the pigmentation-deficient and pigmentation-/ plasminogen activator-deficient strains of Yersinia pestis in non-human primate and mouse models of pneumonic plague.Vaccine, 2002, 20(17/18): 2206-2214. |
| [10] | Feodorova VA, Corbel MJ.Prospects for new plague vaccines.Expert Rev Vaccines, 2009, 8(12): 1721-1738. |
| [11] | Williamson ED, Flick-Smith HC, Waters E, et al.Immunogenicity of the rF1+rV vaccine for plague with identification of potential immune correlates.Microb Pathog, 2007, 42(1): 11-21. |
| [12] | Williamson ED, Packer PJ, Waters EL, et al.Recombinant (F1+V) vaccine protects cynomolgus macaques against pneumonic plague.Vaccine, 2011, 29(29/30): 4771-4777. |
| [13] | Heath DG, Anderson Jr GW, Mauro JM, et al.Protection against experimental bubonic and pneumonic plague by a recombinant capsular F1-V antigen fusion protein vaccine.Vaccine, 1998, 16(11/12): 1131-1137. |
| [14] | Goodin JL, Nellis DF, Powell BS, et al.Purification and protective efficacy of monomeric and modified Yersinia pestis capsular F1-V antigen fusion proteins for vaccination against plague.Protein Expr Purif, 2007, 53(1): 63-79. |
| [15] | Mizel SB, Graff AH, Sriranganathan N, et al.Flagellin-F1-V fusion protein is an effective plague vaccine in mice and two species of nonhuman primates.Clin Vaccine Immunol, 2009, 16(1): 21-28. |
| [16] |
National Pharmacopoeia Committee.Pharmacopoeia of People’s Republic of China.Part 3.Beijing: China Medical Science Press, 2010 (in Chinese). 国家药典委员会.中华人民共和国药典.三部.北京: 中国医药科技出版社, 2010. |
| [17] | Berlec A, Strukelj B.Current state and recent advances in biopharmaceutical production in Escherichia coli, yeasts and mammalian cells.J Ind Microbiol Biotechnol, 2013, 40(3/4): 257-274. |
| [18] | Powell BS, Andrews GP, Enama JT, et al.Design and testing for a nontagged F1-V fusion protein as vaccine antigen against bubonic and pneumonic plague.Biotechnol Prog, 2005, 21(5): 1490-1510. |
| [19] | Rosales-Mendoza S, Soria-Guerra RE, Moreno-Fierros L, et al.Transgenic carrot tap roots expressing an immunogenic F1-V fusion protein from Yersinia pestis are immunogenic in mice.J Plant Physiol, 2011, 168(2): 174-180. |
| [20] | Tao P, Mahalingam M, Kirtley ML, et al.Mutated and bacteriophage T4 nanoparticle arrayed F1-V Immunogens from Yersinia pestis as next generation plague vaccines.PLoS Pathog, 2013, 9(7): e1003495. |
| [21] | Ren J, Dong DY, Zhang JL, et al.Protection against anthrax and plague by a combined vaccine in mice and rabbits.Vaccine, 2009, 27(52): 7436-7441. |
| [22] | Petrovsky N, Aguilar JC.Vaccine adjuvants: current state and future trends.Immunol Cell Biol, 2004, 82(5): 488-496. |
| [23] | Fellows P, Adamovicz J, Hartings J, et al.Protection in mice passively immunized with serum from cynomolgus macaques and humans vaccinated with recombinant plague vaccine (rF1V).Vaccine, 2010, 28(49): 7748-7756. |
| [24] | Jones SM, Griffin KF, Hodgson I, et al.Protective efficacy of a fully recombinant plague vaccine in the guinea pig.Vaccine, 2003, 21(25/26): 3912-3918. |
| [25] | Dinc G, Pennington JM, Yolcu ES, et al.Improving the Th1 cellular efficacy of the lead Yersinia pestis rF1-V subunit vaccine using Sa-4-1BBL as a novel adjuvant.Vaccine, 2014, 32(39): 5035-5040. |
 2016, Vol. 32
2016, Vol. 32