服务
文章信息
- 刘云涛, 苏艳, 张宝江, 苏玲玲, 姜慧娇
- Liu Yuntao, Su Yan, Zhang Baojiang, Su Lingling, Jiang Huijiao
- 牛源金黄色葡萄球菌粘附因子Efb 与ClfA 的免疫生物学特性比较
- Immunological comparison of Efb and ClfA of Staphylococcus aureus isolated from bovine
- 生物工程学报, 2015, 31(9): 1335-1343
- Chin J Biotech, 2015, 31(9): 1335-1343
- 10.13345/j.cjb.140582
-
文章历史
- Received: November 25, 2014
- Accepted: January 21, 2015
2. 新疆畜牧科学院饲料研究所,新疆 乌鲁木齐 830000
2. Feed Research Institute, Xinjiang Academy of Animal Science, Urumqi 830000, Xinjiang, China
金黄色葡萄球菌 Staphylococcus aureus作为一种重要的致病菌,广泛存在于自然界,也是引起奶牛乳腺炎的主要病原菌之一 [1]。粘附素是金黄色葡萄球菌表达的一类特异性蛋白,能够识别机体的细胞外基质并与之发生特异性结合,介导金黄色葡萄球菌粘附于宿主细胞表面,促进细菌对宿主组织的入侵,尤其是在该菌感染的早期,粘附被认为是细菌感染的重要一步,是构成细菌感染的先决条件[2]。粘附素分子中聚集因子ClfA被认为是在金黄色葡萄球菌表面最主要的粘附因子之一[3, 4]。ClfA能介导病原菌与细胞表面的Fg的结合,ClfA的抗原决定表位位于配基结 合的A区[5]。与ClfA分布于细胞表面不同,Efb是一种分泌至细胞外的Fg结合蛋白,目前Efb被认为是在金黄色葡萄球菌感染过程中的一个关键致病因子[6]。Efb蛋白为一种双功能蛋白,既能够通过与Fg结合抑制血小板的凝集,同时又能够抑制补体的激活[7, 8, 9],因此Efb还是一个参与该菌免疫逃避的重要分子,研究其免疫对于防治其引起的感染具有重要意义。
ClfA和Efb这两种粘附素均能够与Fg结合,且ClfA被认为在免疫原性及免疫保护特性方面具有非常明显的优势。为深入认识Efb分子在免疫原性及免疫保护特性方面的特点,本研究将ClfA和Efb分别进行表达和免疫,通过对Efb免疫后抗血清对菌体的识别能力、抗粘附能力、抗体效价以及免疫保护效果与ClfA进行对比,分析这两种粘附素分子在抗原性、抗粘附特性以及免疫原保护特性方面的差异,进而评估Efb作为免疫候选抗原的价值,为筛选和构建金黄色葡萄球菌的亚单位疫苗奠定基础。
1 材料与方法 1.1 质粒及菌株牛乳源金黄色葡萄球菌新疆分离株由新疆农业大学动物医学学院微生物实验室分离、鉴定并保存;原核表达载体pET-28a(+)、大肠杆菌DH5α、大肠杆菌BL21 (DE3) 均由新疆农业大学动物医学学院微生物实验室保存;家兔抗金黄色葡萄球菌血清由新疆农业大学动物医学学院微生物实验室制备并保存。
1.2 主要试剂DL2000 DNA marker、DL5000 DNA marker、限制性内切酶EcoRⅠ、XhoⅠ,La-Taq DNA聚合酶,T4 DNA连接酶购自TaKaRa公司;质粒提取试剂盒、胶回收试剂盒购自Omega公司;纤维蛋白原 (F8630, 65%−85%)、纤连蛋白 (F1141,1 mg/mL)、弗氏完全佐剂、弗氏不完全佐剂购自Sigma公司;Blue Plus II Protein marker、Ni-NTA Resin购自北京全式金生物技术公司;山羊抗鼠HRP-IgG、山羊抗兔HRP-IgG购自北京中杉金桥生物技术有限公司;TMB显色液、DAB显色液、考马斯亮蓝R-250购自北京索莱宝科技有限公司。
1.3 实验动物6−10月龄雌性健康新西兰大白兔2.5 kg,5−7周龄雌性清洁级C57BL/6小鼠 (18−20 g),购自新疆医科大学实验动物中心。
1.4 Efb 与ClfA重组质粒的构建根据GenBank公布的金黄色葡萄球菌Efb和ClfA基因序列,应用Primer 5.0软件设计上下游引物,在上游引物中加入EcoRⅠ酶切位点,下游引物中加入XhoⅠ酶切位点,引物序列见表1,引物由生工生物工程 (上海) 股份有限公司合成。以金黄色葡萄球菌分离株基因组为模板,PCR扩增获得目的基因Efb和ClfA,经EcoRⅠ/XhoⅠ酶切后的目的片段,连接到同样经EcoRⅠ/XhoⅠ酶切的pET-28a(+) 载体中,连接产物转化至大肠杆菌DH5α感受态细胞,酶切鉴定挑取阳性克隆,由生工生物工程 (上海)股份有限公司测序。
| Genes | Primer names | Primer sequences (5'-3') |
| Efb | F1 | GCGGAATTCAGCGAAGGATACGGTCCAAG |
| R1 | TATTCTCGAGTAGTTCTCACTAATCC | |
| ClfA | F2 | GCGGAATTCGCAAGTGAAAATAGTGTTACGC |
| R2 | TATTCTCGAGTAATTTCACCAGGCTCATCAG |
将测序正确重组质粒pET-28a-Efb与pET-28a-ClfA转化至大肠杆菌BL21(DE3) 感受态细胞中,将阳性BL21(DE3) 菌种接种于LB培养基 (含50 μg/mL Kan),并以pET-28a 作阴性对照,37 ℃、200 r/min 振荡培养至OD600值为0.6,加入 IPTG至终浓度1 mmol/L,30 ℃诱导培养5 h,分别取诱导表达前后菌液进行SDS-PAGE分析,并对表达的重组蛋白进行亲和层析纯化。
将重组蛋白经SDS-PAGE后,电转移到硝酸纤维素膜上。依次加入家兔抗金黄色葡萄球菌血清,HRP标记山羊抗兔IgG,在DAB显色液中显色,洗涤,观察结果。
1.6 重组蛋白对Fg和Fn的结合活性测定将重组蛋白以20 μg/孔分别与包被有Fg (200 ng/孔) 和Fn(50 ng/孔) 的酶标板相互作用,37 ℃作用1 h,PBS洗涤3次,洗涤后以兔抗金黄色葡萄球菌血清为一抗 (稀释度1∶100),HRP标记的山羊抗兔IgG为二抗 (稀释度1∶6 000),以TMB显色,测定OD450值。
1.7 家兔免疫试验将9只雌性成年健康新西兰大白兔随机分为3组,每组3只,分别为Efb免疫组、ClfA免疫组和PBS对照组。首次免疫时抗原与弗氏完全佐剂等体积混合,第二次免疫和加强免疫抗原与弗氏不完全佐剂等体积混合。采用背部皮下多点注射方式,单次免疫剂量为200 μg/只,时间间隔均为21 d。初次免疫后14 d、35 d、42 d采血,分离血清-20 ℃保存。
1.8 Efb 和ClfA兔抗血清抑制金黄色葡萄球菌粘附Fg、Fn能力的检测分别以5 μg/mL Fg 100 μL 和6.25 μg/mL Fn 100 μL 4 ℃过夜包被酶标板[10, 11, 12],5%脱脂奶粉37 ℃封闭1 h,同时将对数生长期的金黄色葡萄球菌 (OD600=1.0) 与制备的免疫血清 (稀释度1∶25、1∶100) 各100 μL 37 ℃孵育1 h,将孵育后的金黄色葡萄球菌加入到封闭后的酶标板中,以对照组血清孵育的金黄色葡萄球菌作对照。37 ℃作用2 h,PBST洗涤3次,25%甲醛固定30 min,洗涤同上,结晶紫染色15 min,洗涤同上,最后用95%乙醇脱色5 min,测定OD405值。
1.9 小鼠免疫试验将18只雌性C57BL/6小鼠随机分为3组,每组6只,分别为Efb免疫组、ClfA免疫组和PBS对照组,按50 μg/只皮下注射免疫,免疫程序同新西兰大白兔免疫程序,进行2次免疫。初次免疫后14 d、35 d、49 d、63 d采血,分析血清-20 ℃保存备用。
1.10 小鼠免疫后血清抗体的检测用间接ELISA检测免疫后的血清效价,选择免疫后小鼠血清进行抗体水平监测。分别用 2 μg/mL的Efb和ClfA蛋白包被酶标板,以待检血清为一抗,1∶6 000稀释的HRP标记山羊抗鼠IgG为二抗,TMB为显色液,测定OD450值。
1.11 Efb 和ClfA小鼠抗血清对金黄色葡萄球菌结合能力的检测用5%戊二醛预处理酶标板,加入灭活金黄色葡萄球菌200 μL/孔 (OD600=0.4),37 ℃孵育16 h,加入不同稀释度的待检血清,37 ℃孵育 2 h,PBS洗涤3次,除去未结合的抗体,加入HRP标记山羊抗兔IgG,37 ℃作用45 min,洗涤后以TMB显色。
1.12 小鼠攻毒试验首次免疫后76 d,取金黄色葡萄球菌接种于BHI培养基,37 ℃培养,每只小鼠攻毒量为2×109 CFU (1MLD),分别对Efb免疫组、ClfA免疫组和PBS对照组各小鼠进行攻毒,攻毒后1周连续观察并记录小鼠死亡情况。
2 结果与分析 2.1 重组质粒的鉴定重组表达质粒经PCR鉴定,分别得到大小约为400 bp和1 600 bp的片段,经测序鉴定后序列正确。表明成功构建了原核表达质粒pET-28a-Efb与pET-28a-ClfA。
2.2 重组蛋白的SDS-PAGE和Western blotting分析对重组蛋白的SDS-PAGE结果显示,与诱导前相比,IPTG诱导的表达产物分别在23 kDa (图1A) 与90 kDa (图1B) 处有明显的蛋白条带,说明Efb和ClfA融合蛋白表达成功。Western blotting 分析结果表明,所表达的重组蛋白能够与兔抗金黄色葡萄球菌血清发生特异性反应 (图2),说明表达产物有良好的免疫原性。
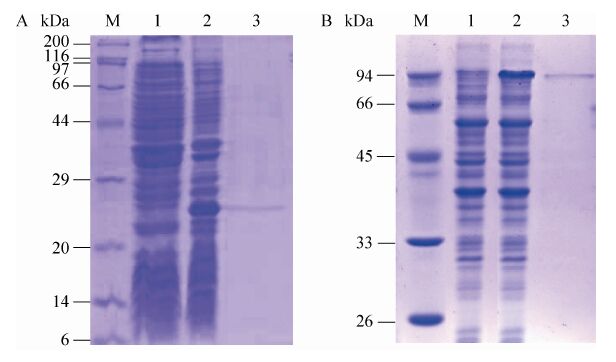
|
| 图1 Efb蛋白 (A) 和ClfA蛋白 (B) 的SDS-PAGE电泳 Fig.1 SDS-PAGE analysis of expressed Efb protein (A) and ClfA protein (B). (A) M: protein marker; 1: pET-28a-Efb/BL21 before induced; 2: pET-28a-Efb/BL21 induced by IPTG; 3: purified Efb protein. (B) M: protein marker; 1: pET-28a-ClfA/BL21 before induced; 2: pET-28a-ClfA/BL21 induced by IPTG; 3: purified ClfA protein. |

|
| 图2 重组蛋白Efb (A) 和ClfA (B) 的Western blotting分析 Fig.2 Western blotting analysis of expressed Efb protein (A) and ClfA protein (B). (A) M: protein marker; 1: Efb protein; 2: pET-28a induced. (B) M: protein marker; 1: pET-28a induced; 2: ClfA protein. |
分别用Fg (5 μg/mL) 和Fn (6.25 μg/mL) 包被酶标板后检测重组蛋白对二者的结合能力。检测结果表明:与PBS对照组相比,重组蛋白Efb和ClfA均对Fg表现出明显的结合能力 (P<0.01)。重组蛋白Efb对Fn的结合能力明显高于ClfA (P<0.01),该结果表明Efb在对Fn具有更强的结合优势 (图3)。

|
| 图3 重组蛋白与Fg (A) 和Fn (B) 结合能力检测 Fig.3 Binding activity of the recombinant proteins to Fg (A) and Fn (B). **P<0.01,***P<0.001,and ns means no significance,compared with mice immunized with PBS. |
在重组蛋白抗血清抑制金黄色葡萄球菌粘附Fg和Fn试验中发现,与对照组相比Efb和ClfA免疫组抗血清均可抑制金黄色葡萄球菌对Fg和Fn的结合 (P<0.01),ClfA抗血清在抑制金黄色葡萄球菌对Fg的粘附方面优于Efb (P<0.01) (图4A),Efb抗血清在抑制金黄色葡萄球菌对Fn的粘附方面优于ClfA (图4B)。

|
| 图4 重组蛋白抗血清抑制金黄色葡萄球菌粘附Fg (A) 和Fn (B) 能力检测 Fig.4 Fg (A) and Fn (B) adhesion inhibition assay of sera from rabbits immunized with Efb or ClfA protein. *P<0.05,***P<0.001,and ns means no significance,compared with mice immunized with PBS. |
采用间接ELISA法检测小鼠血清抗重组蛋白Efb和ClfA的特异性IgG水平 (图5)。检测结果表明第二次免疫14 d后,Efb蛋白免疫组与ClfA蛋白免疫组血清效价可达1∶40 500 (图6),二者均具有良好的抗体诱导能力。

|
| 图5 Efb与ClfA免疫小鼠抗体的变化 Fig.5 Serum antibody changes in mice immunized with Efb or ClfA protein. *P<0.05,**P<0.01,and ns means no significance,compared with mice immunized with PBS. |

|
| 图6 ELISA 测定Efb与ClfA鼠抗血清效价 Fig.6 Serum antibody titers of mice immunized with Efb or ClfA protein detected by ELISA. |
将1∶1 500、1∶4 500、1∶13 500稀释的重组蛋白抗血清与包被的金黄色葡萄球菌作用2 h后,ELISA法检测抗体对菌体的识别结合能力。结果显示,ClfA蛋白免疫组抗血清对全细菌的结合能力优于Efb (P<0.05) (图7)。

|
| 图7 重组蛋白抗血清结合金黄色葡萄球菌能力的ELISA检测 Fig.7 Binding to S. aureus by the sera from rabbits immunized with Efb or ClfA by ELISA. *P<0.05,***P<0.001,and ns means no significance,compared with mice immunized with PBS. |
免疫后76 d,选取牛源金黄色葡萄球菌菌株攻毒,攻毒后观察小鼠死亡情况。结果显示,攻毒后72 h,对照组全部死亡,Efb免疫组的存活率为83.3%,ClfA免疫组的存活率为100%。试验结果显示,Efb与ClfA对金黄色葡萄球菌的攻击均具有保护作用,ClfA的保护效力强于Efb。
3 讨论在金黄色葡萄球菌感染的早期,粘附到上皮细胞和细胞外基质的能力决定金黄色葡萄球菌的定居和繁殖,促进细菌对宿主组织的入侵[2]。金黄色葡萄球菌在感染过程中可表达多种粘附素分子,这些粘附素分子可通过不同的机制与途径和细菌表面结合,影响宿主对该菌的免疫识别,从而对感染的结果产生重要影响。
研究发现,金黄色葡萄球菌的持续感染与其能够产生多种与宿主的免疫系统相互作用的免疫调节分子有关[13]。补体系统是天然免疫的核心组分之一,尤其是C3组分可在补体激活中及在天然免疫与获得性免疫的转换中发挥重要作用[14]。Efb蛋白能够与补体中的C3b组分结合而抑制补体的激活,进而影响补体介导的调理和吞噬作用[6]。研究已证实Efb蛋白为一种双功能蛋白,其既能够通过与Fg结合,又能够抑制补体的激活[7, 8, 9],因此Efb不仅是金黄色葡萄球菌感染过程中的一个关键致病因子,还是参与该菌免疫逃避的重要分子。
以往对Efb的研究多集中于其免疫后的抗体对补体的抑制功能,对其免疫后抗体的粘附抑制和免疫保护特性进行的研究较少。此外在金黄色葡萄球菌众多粘附素分子中,ClfA被认为是金黄色葡萄球菌粘附于宿主细胞最主要的粘附因子之一[15],ClfA的抗体可部分阻断产生相应粘附素的金黄色葡萄球菌对细胞的粘附[16]。Eric等研制的针对金黄色葡萄球菌ClfA的DNA疫苗,免疫小鼠可产生高效价的抗体,却不能在腹腔攻毒时提供保护[17]。这 提示我们对多种粘附因子的抗原性、抗粘附特性及免疫保护特性进行比较研究的必要性。
为深入认识 Efb蛋白的免疫生物学特性及免疫保护效果,本研究分别表达了分离自牛乳腺炎的金黄色葡萄球菌的粘附素Efb和ClfA,比较二者的粘附特性并将Efb免疫后抗体的粘附抑制和免疫保护力与ClfA进行对比,从而评估Efb在免疫方面的潜力和价值。
本研究以重组蛋白Efb与ClfA分别免疫小鼠,血清抗体检测结果表明Efb与ClfA在免疫小鼠后均可诱导小鼠产生高效价的抗体。对重组蛋白Efb和ClfA与Fg和Fn的结合活性比较研究结果显示,两种重组蛋白均可结合Fg,重组蛋白Efb对Fn的结合活性大于蛋白ClfA (P<0.01)。两种蛋白对比后结果表明,Efb具有较强的Fn结合活性,明显优于ClfA对Fn的 结合。
在前期对Efb与ClfA研究的基础上[18, 19],本研究进一步将Efb蛋白免疫后抗血清的抗粘附能力和免疫保护力与ClfA蛋白免疫组进行比较与分析,重组蛋白Efb与ClfA抗血清均可显著抑制金黄色葡萄球菌对Fg和Fn的粘附 (P<0.01)。Efb抗血清在抑制细菌对Fn的粘附方面优于ClfA,而ClfA抗血清在抑制细菌对Fg的粘附方面优于Efb。
本研究结果还发现ClfA蛋白免疫小鼠血清抗体对细菌的亲和力高于Efb蛋白免疫组,这与Melania 等的研究结果一致[20]。本研究免疫保护试验显示ClfA在免疫保护方面优于Efb,因此推测Efb免疫后的抗体对菌体识别能力低于ClfA免疫组,可能导致了Efb免疫组攻毒后出现比ClfA免疫组保护率低。
本研究的对比结果表明Efb分子与ClfA一样,也具有良好的免疫原性和较强的免疫保护力,因此本研究结果提示Efb具有很好的潜力作为金黄色葡萄球菌疫苗的候选分子。
| [1] | DeGraves FJ, Fetrow J. Economics of mastitis and mastitis control. Vet Clin N Am-Food A, 1993, 9(3): 421-434. |
| [2] | Patti JM, Allen BL, McGavin MJ, et al. MSCRAMM-mediated adherence of microorganisms to host tissues. Annu Rev Microbiol, 1994, 48(1): 585-617. |
| [3] | Dickinson RB, Nagel JA, McDevitt D, et al. Quantitative comparison of clumping factor- and coagulase-mediated Staphylococcus aureus adhesion to surface-bound fibrinogen under flow. Infect Immun, 1995, 63(8): 3143-3150. |
| [4] | Francois P, Vaudaux P, Lew PD. Role of plasma and extracellular matrix proteins in the physiopathology of foreign body infections. Ann Vasc Surg, 1998, 12(1): 34-40. |
| [5] | Noureldin ANM, Shkreta L, Talbot BG, et al. DNA immunization of dairy cows with the clumping factor A of Staphylococcus aureus. Vaccine, 2006, 24(12): 1997-2006. |
| [6] |
Zhang X, Gao YP, Dong J, et al. Expression, purification of Staphylococcus aureus Efb protein and preparation of its functional antibody. Bull Acad Mil Med Sci, 2009, 33(6): 531-534 (in Chinese). 张鑫, 高亚萍, 董洁, 等. 金黄色葡萄球菌Efb蛋白的表达、纯化及功能抗体的制备. 军事医学科学院院刊, 2009, 33(6): 531-534. |
| [7] | Lee LY, Liang X, Hook M, et al. Identification and characterization of the C3 binding domain of the Staphylococcus aureus extracellular fibrinogen-binding protein (Efb). J Biol Chem, 2004, 279(49): 50710-50716. |
| [8] | Hammel M, Sfyroera G, Ricklin D, et al. A structural basis for complement inhibition by Staphylococcus aureus. Nat Immunol, 2007, 8(4): 430-437. |
| [9] | Palma M. Multiple Binding sites in the interaction between an extracellular fibrinogen-binding protein from Staphylococcus aureus and fibrinogen. J Biol Chem, 1998, 273(21): 13177-13181. |
| [10] | Mongodin E, Bajolet O, Cutrona J, et al. Fibronectin-binding proteins of Staphylococcus aureus are involved in adherence to human airway epithelium. Infect Immun, 2002, 70(2): 620-630. |
| [11] | Massey RC, Dissanayeke SR, Cameron B, et al. Functional blocking of Staphylococcus aureus adhesins following growth in ex vivo media. Infect Immun, 2002, 70(10): 5339-5345. |
| [12] | Piroth L, Que YA, Widmer E, et al. The fibrinogen-and fibronectin-binding domains of Staphylococcus aureus fibronectin-binding protein A synergistically promote endothelial invasion and experimental endocarditis. Infect Immun, 2008, 76(8): 3824-3831. |
| [13] | Lowy MD. Staphylococcus aureus infections. N Engl J Med, 1998, 9(12): 520-532. |
| [14] | Lambris JD. The mutifunctional role of C3, the third component of complement. Trends Immunol, 1988(12): 387-393. |
| [15] | Brouillette E. DNA immunization against the clumping factor A (ClfA) of Staphylococcus aureus. Vaccine, 2002, 20(17): 2348-2357. |
| [16] |
Jiang XJ, Hao YQ, Zhang AR, et al. Cloning and expression of the region A of clumping factor A gene of Staphylococcus aureus and its immunological characteristics. Chin Vet Sci, 2009, 39(7): 626-631 (in Chinese). 姜晓娟, 郝永清, 张爱荣, 等. 金黄色葡萄球菌凝聚因子A区基因的克隆表达及表达产物免疫特性的研究. 中国兽医科学, 2009, 39(7): 626-631. |
| [17] | Eric B, Pierre L, Lulzim S, et al. DNA immunization against the clumping factor A (ClfA) of Staphylococcus aureus. Vaccine, 2002, 20(17): 2348-2357. |
| [18] |
Wei HN, Wang SM, Shao JG, et al. Cloning and sequence analysis of Efb gene of Staphylococcus aureus isolated from bovine milk. J Xinjiang Agric Univ, 2012, 35(6): 469-473 (in Chinese). 韦海娜, 王世民, 邵俊高, 等. 牛乳源金黄色葡萄球菌Efb基因的克隆与序列分析. 新疆农业大学学报, 2012, 35(6): 469-473. |
| [19] |
Shao JG, Su Y. Clone and sequence analysis of ClfA Gene of Staphylococcus aureus isolated from bovine milk in Xinjiang area. J Xinjiang Agric Univ, 2013, 36(2):103-107 (in Chinese). 邵俊高, 苏艳. 新疆地区牛乳源金黄色葡萄球菌粘附因子ClfA基因的克隆与序列分析. 新疆农业大学学报, 2013, 36(2): 103-107. |
| [20] | Scarpa M, Piccinini R, Brun P, et al. Relationship between virulence factor genes in bovine Staphylococcus aureus subclinical mastitis isolates and binding to anti-adhesin antibodies. J Dairy Res, 2010, 77(2): 159-167. |
 2015, Vol. 31
2015, Vol. 31