服务
文章信息
- 满朝来, 穆卫涛, 赵冬雪, 常杨
- Man Chaolai, Mu Weitao, Zhao Dongxue, Chang Yang
- 主要禽源病毒相关microRNA的研究进展
- Progress in microRNAs associated with major avian viruses
- 生物工程学报, 2015, 31(9): 1289-1300
- Chin J Biotech, 2015, 31(9): 1289-1300
- 10.13345/j.cjb.140538
-
文章历史
- Received: November 11, 2014
- Accepted: February 10, 2015
禽业生产是当今世界主要的肉蛋供应来源之一,但近年来禽类疾病呈现出多发趋势,其中病毒性疾病是导致禽类病死的最主要原因之一,给养禽业带来巨大的经济损失。随着研究的深入,人们发现microRNA (miRNA) 在动物机体免疫反应和抗病毒过程中发挥关键调控作用,有趣的是有些病毒不但可以编码miRNA,而且还可以调控宿主细胞miRNA的表达活性,这些差异表达miRNA对于病毒的感染、潜伏、复制和致病性起着关键的调控作用。目前,禽类病毒 (如鸡马立克氏病毒等疱疹病毒) 已经成为研究病毒与miRNA相互调控与作用机制的重要模型,本文简要总结近年来主要禽源病毒与miRNA相互作用的研究进展,以期为后续深入研究提供参考。
1 MicroRNAMicroRNA (miRNA) 是一类长约22 nt,被植物和动物广泛表达,用于基因转录后调控的一类小RNA分子,miRNA在许多生理和病理过程 (如发育、造血、抗逆和疾病等) 中呈现差异表达,发挥关键调控作用[1]。由于病毒完全依赖宿主细胞,许多病毒已经进化出了调控宿主细胞环境的能力。例如,禽类疱疹病毒在感染和复制过程中能够表达自身的miRNA,并参与病毒的感染、潜伏和复制等过程[2]。而有些病毒 (如禽白血病病毒[3, 4, 5]) 在感染过程中也能够诱导宿主细胞miRNA的表达改变,进而为病毒的复制和增殖创造条件。总之,人们越来越意识到miRNA是宿主-病毒间相互作用复杂网络调控中的一个重要效应因子。
2 禽类疱疹病毒与 miRNA禽类病毒中的疱疹病毒家族成员是迄今研究发现编码miRNA最多的一类病毒。常见的禽类疱疹病毒包括致瘤性马立克氏病病毒 (Oncogenic Marek's disease virus,MDV1)、非致瘤性马立克氏病病毒 (Non-oncogenic Marek's disease virus,MDV2)、火鸡疱疹病毒 (Herpesvirus of turkeys,HVT)、传染性喉气管炎病毒 (Infectious laryngotracheitis virus,ILTV)和鸭肠炎病毒 (Duck enteritis virus,DEV) 等。利用新一代测序技术 (如454和Illumina等) 分析鸡疱疹病毒MDV1、MDV2、HVT、ILTV和DEV等,发现每种疱疹病毒成员都能编码多种miRNA。根据miRBase数据库 (Http://www. mirbase.org/) 公布的最新数据表明,常见的禽类疱疹病毒编码miRNA的数量分别为:MDV1 (编码14种pre-miRNA和26种miRNA成熟体)、MDV2 (编码18种pre-miRNA和36种miRNA成熟体)、HVT (编码17种pre-miRNA和28种miRNA成熟体)、ILTV (编码7种pre-miRNA和10种miRNA成熟体) 和DEV (编码24种pre-miRNA和33种miRNA成熟体)[2]。
虽然每种禽类疱疹病毒编码的miRNA都具有唯一序列,而且没有明显的系统进化关系存在于禽类疱疹病毒各miRNA之间,但是禽类疱疹病毒编码miRNA的基因组定位却具有保守性和相似性,即miRNA常定位于病毒基因组的重复序列区域[2, 6]。另外,同一种属病毒的不同毒株miRNA序列常具有高度保守性,例如,MDV1不同毒力的分离株通常具有高度保守的miRNA,而碱基变异主要发生在假定启动子区域[7]。有趣的是,一些病毒编码的miRNA表现出与宿主细胞miRNA序列相似性的特征,例如,mdv1-miR-M4与gga-miR-155,mdv2-miR-M21 与gga-miR-29b,以及hvt-miR-H14与gga-miR-221等都具有共同的种子序列,表明这些病毒来源的miRNA可能具有细胞内源相应miRNA的功能[7]。
2.1 马立克氏病病毒 (MDV)MDV是鸡的一种嗜淋巴细胞疱疹病毒,引起的疾病以CD4+T细胞淋巴瘤形成、免疫抑制和神经障碍等症状为主要特征。通过鉴定MDV编码miRNA的基因组区域,人们发现两簇miRNA转录区分别位于该病毒meq原癌基因的侧翼,另一簇miRNA位于基因组的潜在相关转录本 (Latency associated transcript,LAT) 区域 内[8, 9]。虽然MDV-1和MDV-2编码的miRNA序列之间缺乏序列同源性,但是不同来源MDV编码miRNA的基因组区域却具有高度保守 性[10]。值得一提的是,定位于MDV1基因组meq基因上游的这一簇miRNA通常在高致病力病毒株比低致病力病毒株诱导的肿瘤组织中高表达。例如,来自于强毒株 (615K,也称T. King) meq簇的miRNA在诱导的淋巴瘤中比弱毒株 (RB1B) 高表达。其中,具有gga-miR-155相同种子序列的mdv1-miR-M4在强毒株中的表达能力是弱毒株的3倍,而且mdv1-miR-M4占MDV1所有miRNA表达水平的72%;另mdv1-miR-M2*/3p的表达水平也是弱毒株的6倍,所以来源于meq簇的miRNA在MDV致病过程中可能发挥着重要作用。对比而言,来自LAT簇的miRNA在强弱毒株中表达水平是相当的[11]。
2.1.1 MDV 致瘤性与 miRNA人类15%的肿瘤是由病毒导致的,但病毒诱导肿瘤的分子机制仍是复杂和需要深入研究的领域[12]。虽然人们已经确定MDV能够编码miRNA并参与病毒的潜伏和致瘤,但是关于MDV诱导淋巴瘤中病毒-宿主间的相互作用机制仍不十分清楚,例如,病毒的潜伏感染如何与肿瘤阶段界定?潜伏感染是否为肿瘤阶段的必要条件等问题仍需要回答,所以研究miRNA对MDV的致瘤作用对于防治病毒性肿瘤疾病具有重要的科学价值。目前,越来越多的证据表明病毒感染过程中差异表达的miRNA与病毒感染、复制和肿瘤形成有关。鸡马立克氏病淋巴瘤作为优秀的天然肿瘤模型为检测病毒利用miRNA在致瘤方面的功能和机制提供方便。
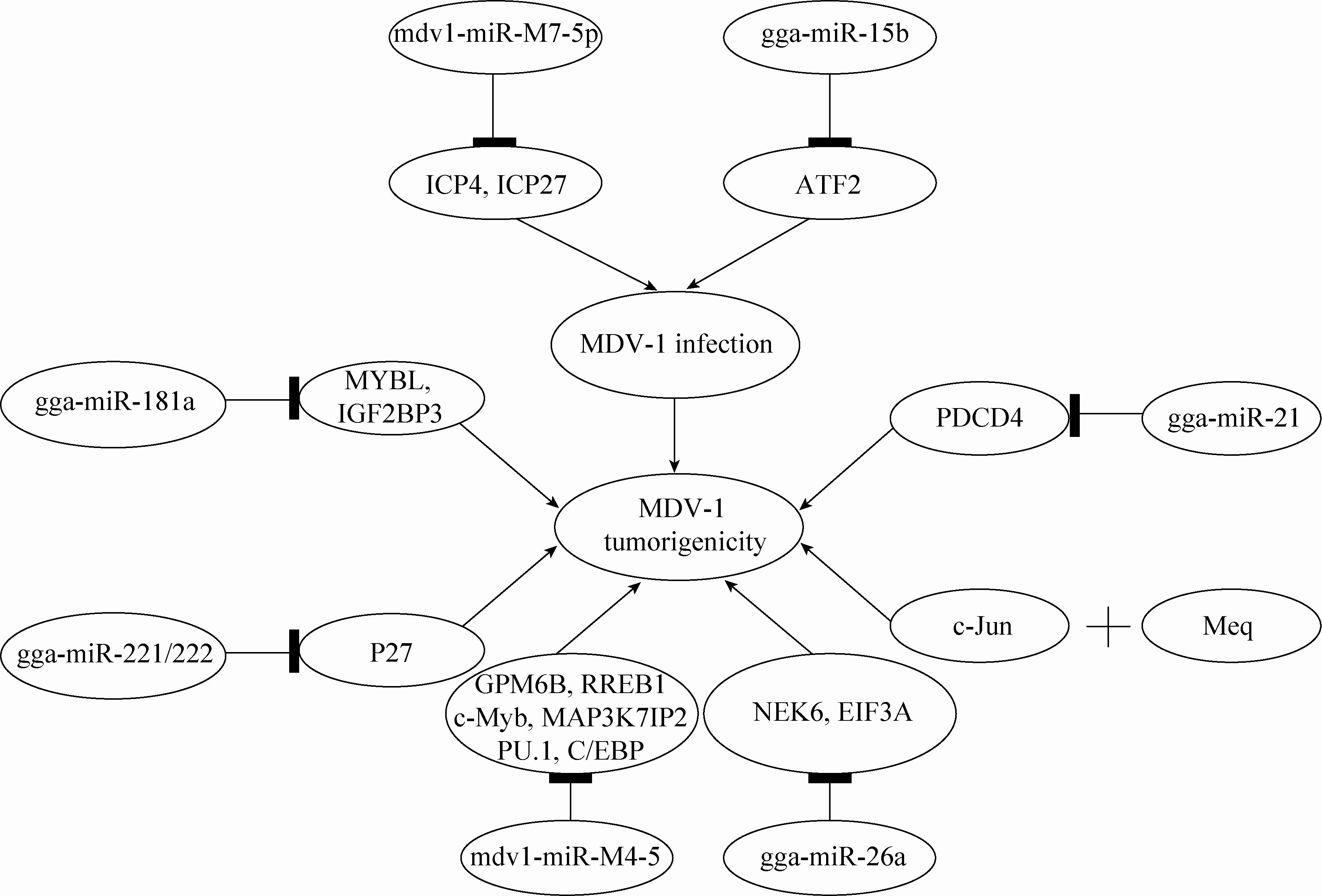
首先,在MDV1感染方面,越来越多的证据表明:差异表达的miRNA与病毒感染和复制有关 (表1和图1)。例如,Strassheim等[9]利用MDV感染淋巴细胞系MSB-1研究发现,在MDV病毒活化过程中ICP27蛋白 (ICP27被认为在病毒的激活过程中起重要作用) 水平与mdv1-miR-M7-5p呈负相关,说明这些来自LAT转录而来的miRNA可能促进了病毒的建立或维持潜伏。Tian等[13]研究发现靶向调控ATF2基因 (Activating transcription factor 2为转录激活子,参与调控多种基因的转录,并影响抗凋亡、细胞生长和DNA损伤反应等过程) 的gga-miR-15b在MDV易感鸡脾脏肿瘤中表达下调,进而导致ATF2显著上调,这可能与鸡对MDV是否具有抗性和易感性有关。总之,MDV1通过自身编码miRNA或影响细胞内源miRNA,直接或间接地改变宿主细胞环境,为病毒的感染、潜伏和复制等过程创造条件。
| Source of miRNA | miRNA | Target gene | Biological effects |
| MDV-1 | mdv1-miR-M7-5p | ICP4,ICP27 | Mdv1-miR-M7-5p may contribute to establish and/or maintain latency of MDV-1[9] |
| Spleen | gga-miR-15b | ATF2 | Gga-miR-15b might be related to Marek's disease resistance/susceptibility[13] |
| MSB-1 cell | gga-miR-21 | PDCD4 | Gga-miR-21 promotes tumor cell growth and apoptosis escape[14] |
| MDV-1 | mdv1-miR-M4-5p mdv1-miR-M2-3p | GPM6B, RREB1, c-Myb, MAP3K7IP2, PU.1, C/EBP | MiRNAs regulate several cellular processes, including cell proliferation and the adaptive immune response[17, 26] |
| Lymphomas | gga-miRNA-26a | NEK6 | Gga-miR-26a regulates MSB-1 cell proliferation and MDV infection[21] |
| Lymphomas | gga-miR-181a | MYBL1 | Gga-miR-181a contributes to MDV-induced lymphomagenesis[22] |
| Lymphomas | gga-miR-26a | EIF3A | Gga-miR-26a contributes to MDV-induced lymphomagenesis[22] |
| MSB-1 cell | gga-miR-221 gga-miR-222 | p27(Kip1) | MiRNAs can regulate cell cycle in the induction and progression of T-cell lymphomas[23] |
| MDV-1 | mdv1-miR-M2-3p, mdv1-miR-M9-5p | IL-18 | MiRNAs manipulate the host cell immune response[24] |
| MDV-1 | mdv1-miR-M4-5P | GPM6B, RREB1, c-Myb, MAP3K7IP2, PU.1, C/EBP | Mdv1-miR-M4-5p plays a crucial role in several physiological and pathological processes in lymphocyte biology[26] |
| MDV-1 | mdv1-miR-M4 | UL28, UL32 | Mdv1-miR-M4 can regulate cleavage/packaging of MDV-1 DNA[26] |
|
图1
miRNA与基因在MDV1感染与致瘤中作用机制示意图
Fig.1
Schematic diagram of mechanism of miRNAs and genes participating in MDV-1 infection and tumorigenicity.  : suppress;→: promote. : suppress;→: promote.
|
其次,在MDV1致瘤方面,一方面病毒编码基因能够影响病毒的致瘤性 (图1和表1)。例如,MDV1编码的Meq为AP-1家族的一种碱性亮氨酸拉链 (bZIP) 蛋白,Meq通过与c-Jun形成同源或异源二聚体可以诱导病毒和细胞基因的表达并参与肿瘤形成[14]。
另一方面,MDV1编码的miRNA也能显著影响MDV1的致瘤性[15]。例如,Li等[16]利用微阵列来筛选对MDV感染敏感的鸡脾脏细胞和病毒编码miRNA,结果表明有79种miRNA表达存在显著差异,这些miRNA可能在MDV感染和肿瘤形成的信号分子领域发挥功能。Goher等[17]利用miRNA深度测序技术对MDV毒株 (MD5) 和疫苗株 (Herpesvirus of turkeys,HVT) 混合感染和单独感染的病毒编码miRNA分别进行分析,研究发现mdv1-miR-M4-5p和mdv1- miR-M2-3p在感染过程中表现为最高表达,但在感染的不同时期 (感染后7 d和42 d) 的脾脏中,两种病毒编码的miRNA呈现出表达活性差异和相互干扰的现象,进一步分析发现这些差异表达的miRNA可能在调控多种细胞过程,如细胞增生和天然免疫反应中发挥作用。Luo等[18]利用MDV-GX0101毒株感染鸡后检测已知的病毒编码miRNA,结果发现miRNA在疾病发展的不同阶段呈现差异表达,说明这些miRNA在疾病发展过程中可能执行着不同的调控作用。
另外,MDV1编码的mdv1-miR-M4-5p具有与gga-miR-155相同的种子序列,并在MDV1诱导的肿瘤中高表达,而gga-miR-155却低表达,这种MDV1编码的miRNA表达上调,并伴有gga-miR-155特异性下调,是MD肿瘤细胞所特异的[6, 19]。Yu等[20]研究发现MDV1强毒株 (GX0101) 在致瘤过程中,mdv1-miR-M4是一个重要的调控子,参与了MDV的肿瘤形成过程,但不是致瘤必需的,而且Meq-簇编码的其他miRNA可能在MDV强毒株的致瘤过程中也起了关键作用。
总之,miRNA在MDV致瘤过程中的作用已经被人们发现,病毒编码的miRNA对病毒的免疫逃避、抗凋亡和增殖可能都具有重要作用,相信随着研究的深入,miRNA的致瘤机制将被逐渐揭开。
最后,MDV1利用宿主细胞编码的miRNA或宿主基因为致瘤创造条件 (图1和表1)。在体内研究方面,Li等[21]通过分析MDV诱导的淋巴瘤miRNA表达谱发现,gga-miRNA-26a在被感染鸡脾脏的溶细胞感染、潜伏和肿瘤转化等阶段中均表达下调,进一步研究发现gga-miR-26a能够靶向调控NEK6基因 (Never in mitosis gene A (NIMA)-related kinase 6,NEK6与细胞周期调节有关) 的表达,而NEK6在MDV感染组织 (如脾脏肿瘤和肝脏淋巴瘤) 中呈现高表达,表明gga-miR-26a和NEK6在MDV感染和致瘤过程中可能发挥重要作用。Lian等[22]利用深度测序技术分析MDV感染的样品 (脾脏肿瘤和肝脏淋巴瘤),共发现187种已知的鸡miRNA和16种MDV的miRNA,他们利用qPCR对其中17种新发现的miRNA进行了定量验证。结果发现gga-miR-181a、gga-miR-26a、gga-miR-221、gga-miR-222、gga-miR-199*和gga-miR-140*表达下调,而gga-miR-146c上调,荧光素酶检测分析表明gga-miR-181a与MYBL1 (V-myb avian myeloblastosis viral oncogene homolog-like 1) 和IGF2BP3 (Insulin-like growth factor 2 mRNA-binding protein 3),gga-miR-26a与EIF3A (EIF3A在细胞转录和翻译过程中起重要的调控作用) 之间分别存在靶向调控作用,并可能参与促进了MDV诱导淋巴瘤的形成。
在体外细胞水平研究方面,Lambeth等[23]通过分析MDV转化淋巴细胞MSB-1的miRNA表达谱,发现gga-miR-221和gga-miR-222显著上调,并能够靶向鸡p27 (Kip1)(细胞周期依赖激酶抑制子Cyclin-dependent kinase (cdk) inhibitor p27 (Kip1))的3'-UTR,因为在多种肿瘤中miR-221和miR-222表达上调能够影响细胞周期调控蛋白p27 (Kip1)的表达,进而参与肿瘤形成,所以在T-细胞淋巴瘤的诱导和发展中,MDV可利用细胞miRNA机制来调控宿主细胞周期。Stik等[14]利用MDV1强毒株 (RB-1B) 和疫苗株 (CVI988) 感染MSB-1细胞来研究细胞miRNA的表达谱,结果发现gga-miR-21只在RB-1B感染组过表达,而在CVI988感染组不表达。gga-miR-21基因的启动子位于TMEM49基因的第10个内含子中,由AP-1和Ets元件驱动,病毒致瘤蛋白Meq能够结合到这一启动子上,并转录激活gga-miR-21的表达,gga-miR-21能够靶向鸡的PDCD4基因 (Programmed death cell 4,PDCD4为细胞凋亡相关基因),进而促进肿瘤细胞生长和凋亡逃避。
在病毒影响宿主基因方面,Parnas等[24]分别利用致瘤病毒MDV-1和非致瘤病毒MDV-2感染MSB1细胞来分析病毒编码miRNA的靶标mRNA,结果发现MDV-1编码基因RLORF8能够被4个MDV-1编码的miRNA (mdv1-miR- M2、mdv1-miR-M3、mdv1-miR-M4和mdv1-miR- M12) 所靶向,而且细胞内源基因IL-18也能够被MDV-1和MDV-2编码的miRNA (mdv1- miR-M2-3p、mdv1-miR-M9-5p、mdv2-miR-M18- 5p、mdv2-miR-M18-5p-1、mdv2-miR-M26-5p、mdv2-miR-M28-5p和mdv2-miR-M30-3p) 共同靶向。Mdv1-miR-M4是细胞miR-155的功能类似物[7],而miR-155在多种生理和病理过程中起关键调控作用[25]。Muylkens等[26]利用荧光素酶报告基因检测系统研究发现,mdv1-miR-M4-5P和miR-155均能高效靶向6个细胞内源基因 (GPM6B、RREB1、c-Myb、MAP3K7IP2、PU.1和C/EBP) 的3′-非翻译区 (3′-UTR) 的相同序列区域,而且mdv1-miR-M4也能特异性地抑制MDV-1编码的2种参与病毒DNA解离或包装功能蛋白 (UL28和UL32) 的翻译。
综上所述,MDV不但可以通过影响宿主细胞miRNA的表达来调控细胞功能蛋白基因的表达活性,而且也可以通过自身编码的miRNA来直接或间接影响宿主细胞功能基因的活性,从而间接地为MDV的复制与致瘤创造有利的细胞环境。
2.1.2 MDV 的防治既然MDV的感染和致瘤性与miRNA密切相关,那么通过影响或调控相关miRNA的表达活性可能实现对MDV的防治。例如,Zhao等[27]利用反向遗传技术,从MDV1基因组中删除6个miRNA簇序列,这导致MDV1丧失了致瘤性,进一步研究发现MDV1致瘤性的丧失是由于mdv1-miR-M4的缺失导致的,所以可以利用缺失miRNA编码序列的修饰后病毒作为弱毒疫苗用于预防马立克氏病。此外,Chen等[28]发现利用逆转录病毒载体表达miRNA来靶向MDV的功能基因,也能够显著抑制病毒复制,而且如果利用逆转录病毒载体来表达多个miRNA,这些miRNA可同时靶向目的基因的多个靶点,不但能够放大抗病毒效应,并且也能够有效避免病毒进化突变而造成的逃避。此外,研究抗肿瘤药物与miRNA的关系,也可能为病毒性肿瘤疾病的防治提供指导方向。Xu等[12]利用抗肿瘤药物诱导细胞凋亡来鉴定MDV-1编码的靶向miRNA,结果表明在化疗药物Cisplatin作用下mdv1-miR-M3通过直接靶向下调Smad2蛋白的表达进而抑制细胞凋亡,并且能够显著促进细胞存活,所以开发和利用病毒miRNA的抗凋亡能力可能为改善化疗效果,特别是为病毒性肿瘤的化疗提供有力的方向性理论指导。
2.2 其他禽类疱疹病毒与 miRNA鸡传染性喉气管炎 (Infectious laryngotracheitis,ILT) 是由ILTV引起的上呼吸道疾病。2009年,Rachamadugu 等[29]利用454 FLX基因组测序方法研究发现在鸡胚肾细胞中ILTV可编码7种miRNA,分别是iltv-miR-I1-5p、iltv-miR-I1-3p、iltv-miR-I2-5p、iltv-miR-I3-3p、iltv-miR-I4-5p、iltv-miR-I5-5p、iltv-miR-I5-3p、iltv-miR-I6-5p、iltv-miR-I6-3p和iltv-miR-I7-3p,至今ILTV编码的miRNA共发现7种pre-miRNA和10种成熟的miRNA。
DEV是一种能够引起水禽急性致死性疾病的疱疹病毒。Yao等[30]利用深度测序技术分析DEV感染的鸡胚胎成纤维细胞的RNA,结果发现几种DEV编码新miRNA,而且DEV编码miRNA主要来源于基因组的唯一长区 (Unique long region),并发现DEV-miR-D18和DEV-miR-D19的前体序列互相重叠,表现出与moRNA (miRNA-offset RNA)的相似性。这些miRNA的发现不但丰富了疱疹病毒家族成员编码miRNA的列表,而且对于深入理解miRNA在病理生理中的作用具有积极的意义。
3 传染性法氏囊病毒与 miRNA传染性法氏囊病毒 (Infectious bursal disease virus,IBDV) 是引起雏鸡的一种重要疾病。虽然目前研究尚未发现IBDV编码的miRNA,但是人们已经利用miRNA原理和基因重组技术在对抗IBDV复制领域进行有意义的探索。例如,鸡热休克蛋白90 (Chicken heat-shockprotein 90,cHsp90) 是IBDV感染细胞受体的一个功能型组分[31]。Yuan等[32]构建抗-cHsp90α的miRNA重组表达载体,并且发现抗-cHsp90α的人工miRNA具有抑制IBDV感染能力,这是利用miRNA靶向宿主细胞内源蛋白基因进而抑制病毒感染的有效例证。
此外,人们利用重组载体表达miRNA来靶向病毒功能基因,也取得了良好的抗病毒效果。例如,Wang等[33]利用重组腺相关病毒 (Avian adeno-associated virus,rAAAV) 载体来构建 抗-VP1和抗-VP2基因的重组miRNA表达载体用于研究抗IBDV的复制能力,结果表明,rAAAV是一种禽类细胞miRNA传递的有效载体,并且发现VP1基因更适合作为RNAi靶标用于干扰IBDV的复制。随后,Wang 等[34]利用构建抗-VP2的miRNA重组表达载体转染鸡成纤维细胞(DF-1),再利用IBDV感染细胞,结果发现miRNA重组载体的对VP2基因表达抑制率达到76%-82%,并显著降低病毒感染滴度,表明靶向病毒VP2基因的miRNA重组载体也能够有效抑制IBDV的复制。
值得一提的是,人们也发现了细胞内源miRNA的抗IBDV复制能力。Wang等[35]将鸡pri-gga-miRNA-21构建到慢病毒载体中,利用重组慢病毒来感染鸡DF-1细胞并结合IBDV感染,结果发现,gga-miR-21能够靶向和下调IBDV的VP1基因,显著降低IBDV的复制能力,这表明宿主细胞内源的gga-miR-21能够通过下调IBDV的VP1基因进而抑制IBDV的复制。
总之,利用miRNA原理和基因重组技术,通过调控宿主细胞或IBDV相关基因的表达活性,可以实现对IBDV感染或复制的有效抑制,这为IBDV的防治提供有价值的策略与方向。
4 禽白血病病毒与 miRNAJ亚群禽白血病病毒 (Avian leucosis virus-J subgroup,ALV-J) 能够引起感染鸡的多组织肿瘤发生,已经成为我国禽业生产中流行和爆发的常见疫病之一,目前仍无有效的疫苗防治,给养鸡业带来严重经济损失。在ALV-J致瘤机制探索方面,人们从ALV-J感染诱导宿主细胞内源miRNA表达变化方面进行了有意义的探索。例如,Wang等[3]利用miRNA芯片平台来检测ALV-J感染鸡诱导的肝脏肿瘤细胞中miRNA的表达变化,结果发现有4个miRNA发生显著的表达改变,生物信息学分析表明这些差异表达miRNA可能参与了肿瘤形成的信号通路,如MAPK和Wnt信号通路。Li 等[4]利用ALV-J感染10周龄鸡并检测肝脏miRNA的表达,结果表明,有12种miRNA存在差异表达 (P<0.01),其中感染组7种miRNA (gga-mir-221、gga-mir-222、gga-mir-1456、gga-mir-1704、gga-mir-1777、ga-mir-1790和gga-mir-2127) 表达上调并可能参与致瘤作用,而下调的miRNA可能在肿瘤抑制中起重要作用。Xu等[5]利用3种不同的禽类病毒MDV、ALV和网状内皮增生症病毒 (Reticuloendotheliosis virus,REV) 制备鸡的转化淋巴细胞,发现gga-miR-26a表达水平都一致下调,并且miR-26a的下调与其肿瘤抑制作用相一致,进一步研究发现miR-26a能够直接靶向IL-2,miR-26a下调能够降低对IL-2表达的抑制效应,而鸡IL-2可以促进T-细胞增生和细胞毒性,进而促进转化淋巴细胞的增生,这些miRNA的发现为进一步研究ALV-J感染的致瘤作用奠定基础。
有趣的是,ALV-J虽然具有与MDV1相似的致瘤能力,那么ALV-J是否也能够编码miRNA用于病毒的感染和致病过程呢?2006年,Chesters等[36]研究发现ALV-J的HPRS-103毒株3'-UTR存在一个E元件 (也称XSR元件) 的茎环结构,进一步研究发现E元件不是病毒致瘤性完全必需的,但该E元件确实可以促进一定遗传品系鸡的肿瘤发生。为确认E元件是否可以编码有功能的miRNA,Yao等[37]利用深度测序技术分析了ALV-J转化细胞系IAH30,结果发现RNA聚合酶II转录的E元件 (具有发夹结构的148个核苷酸非编码RNA) 确实可以编码一种新的小RNA,并将其称为E (XSR) miRNA,而且该miRNA在IAH30细胞系中高表达,暗示其在ALV-J的致病性和肿瘤性转化中可能具有重要作用;在另一方面,E (XSR) miRNA的发现对于解释不同遗传品系鸡对ALV-J致瘤的差异敏感性也具有重要的理论 价值。
截至目前,人们已经确认ALV-J不但可以调控宿主细胞内源miRNA表达活性改变[3, 4, 5],而且ALV-J也可以表达自身的miRNA[37],这些功能miRNA发现对于深入理解ALV的致病机制和禽白血病的防治必然发挥核心作用。当然,人们也尝试利用miRNA原理和重组技术进行抗ALV-J研究,并取得较好的抗病毒效果。例如,Wang 等[38]设计并构建了靶向env基因保守序列的miRNA重组真核表达载体,将该重组质粒转染DF-1细胞,再利用ALV-J感染细胞,结果表明靶向env基因的miRNA能够有效抑制ALV-J的复制,这对预防ALV感染可能是一个潜在的有用工具。
5 禽流感病毒与 miRNA高致病性禽流感 (Highly pathogenic Avian influenza,HPAI) 是由正粘病毒科A型禽流感病毒 (Avian influenza virus,AIV) 导致一类重要的病毒性禽类疾病,不但给养禽业带来巨大经济损失,而且也给人类健康也带来重大威胁。A型流感病毒基因组包含8段负链RNA,其中RNA片段2编码3种蛋白:PB1、PB1-F2和N40[39]。由于这几种蛋白对于病毒的复制和致病性是关键的,所以靶向它们的表达可能成为控制和抗HPAI的方法。Kumar等[40]选取300个在鸡肺中表达的miRNA用于筛选靶向H5N1病毒株片段2的miRNA,结果表明gga-miR-133c、gga-miR-1710和gga-miR-146c*被预测能够靶向这3种蛋白 (PB1、PB1-F2和N40) 基因,这些miRNA的发现使其在禽流感疾病的防治中可能具有一定的参考应用价值,同时也暗示了鸡可能具有遗传潜能来抵抗或忍受H5N1感染。
此外,人们对AIV感染诱导宿主细胞miRNA表达变化也进行了有意义的尝试。例如,Wang等[41]通过深度测序分析低致病性禽流感病毒株 (H5N3) 感染后蛋鸡的肺和气管组织表达的miRNA,结果发现肺组织有73种、气管组织有36种miRNA分别在感染组与SPF对照组之间存在差异表达,而且对照组具有更多的miRNA高表达,其中包括免疫相关的miRNA,如miR-146。为进一步验证遗传背景是否对鸡AIV感染后的miRNA调控中起基本作用,肉鸡和蛋鸡AIV感染后的差异表达miRNA是否具有相同的调控模式,该课题组[42]利用相同的平台技术对肉鸡的AIV感染进行了检测。结果发现肉鸡具有更多的miRNA (108种miRNA) 在感染组的肺中高表达 (其中gga-miR-34a、gga-miR-122-1、gga-miR-122-2、gga-miR-146a、gga-miR-155、gga-miR-206、gga-miR-1719、gga-miR-1594、gga-miR-1599和gga-miR-451等可能在AIV感染的宿主反应中发挥主要的调控作用),而对照组仅为13个miRNA,这一结果与蛋鸡的相反,所以,该研究表明肉鸡中可能存在对AIV感染反应不同于蛋鸡的miRNA调控机制。
通过研究AIV感染与miRNA间的调控关系,人们不仅发现鸡体内存在对AIV具有抗性的miRNA[40],也发现了肉鸡和蛋鸡间对AIV感染的miRNA反应差异[41, 42],这些研究不仅暗示AIV感染不同品系鸡致病机制的复杂性,同时也为深入理解宿主细胞miRNA与AIV感染之间的调控关系奠定基础,这对于开发新策略用于防治AIV具有重要的理论和实践意义。
6 新城疫病毒与 miRNA新城疫病毒 (Newcastle disease virus,NDV) 属于副黏病毒科副黏病毒属的一种病毒。该病毒主要危害鸡、珠鸡和火鸡,在被侵袭的鸡群中迅速传播,强毒株可使鸡全群毁灭。本课题组利用NDV LaSota弱毒株疫苗免疫7日龄海兰褐雏鸡,分别在免疫后7 d和14 d回收免疫组和对照组雏鸡的主要免疫组织器官 (如法氏囊、胸腺和肝脏等),分析免疫相关pri-miR-181b1的表达活性变化,结果发现在免疫后14 d的免疫组雏鸡法氏囊组织中pri-miR-181b1表达活性上调,而其他免疫组织未发现转录活性改变,而miR- 181b具有促进NK细胞 (Natural killer cell) 的发育和功能活性的能力[43, 44, 45]。本研究表明新城疫弱毒株疫苗免疫后可能会诱导免疫相关miRNA的表达活性改变,进而参与免疫应答,后续研究仍有待于深入开展。
7 展望目前,研究多发现于禽类疱疹病毒感染宿主细胞引起细胞内源miRNA、病毒编码miRNA或编码基因的表达活性改变,其他科属病毒编码miRNA和诱导宿主细胞miRNA表达活性改变的特性还知之甚少,而且具体的miRNA表达改变机制和原因仍需要深入研究。鸡作为现代分子生物学研究的重要模式动物之一,具有基因背景简单、便于操作、研究结果对禽类疾病防治和基础医学研究参考价值大等诸多优势,相信随着研究的深入,禽类病毒疾病模型将为揭开“病毒-miRNA-细胞”这一博弈领域的机制面纱发挥更大的作用。
| [1] | Zhang B, Wang Q, Pan X. MicroRNAs and their regulatory roles in animals and plants. J Cell Physiol, 2007, 210(2): 279-289. |
| [2] | Yao Y, Nair V. Role of virus-encoded microRNAs in avian viral diseases. Viruses, 2014, 6(3): 1379-1394. |
| [3] | Wang Q, Gao Y, Ji X, et al. Differential expression of microRNAs in avian leukosis virus subgroup J-induced tumors. Vet Microbiol, 2013, 162(1): 232-238. |
| [4] | Li H, Ji J, Xie Q, et al. Aberrant expression of liver microRNA in chickens infected with subgroup J avian leukosis virus. Virus Res, 2012, 169(1): 268-271. |
| [5] | Xu H, Yao Y, Smith LP, et al. MicroRNA-26a-mediated regulation of interleukin-2 expression in transformed avian lymphocyte lines. Cancer Cell Int, 2010, 10: 15-21. |
| [6] | Burnside J, Morgan R. Emerging roles of chicken and viral microRNAs in avian disease. BMC Proc, 2011, 5(Suppl 4): S2. |
| [7] | Morgan RW, Burnside J. Roles of avian herpesvirus microRNAs in infection, latency, and oncogenesis. Biochim Biophys Acta, 2011, 1809 (11/12): 654-659. |
| [8] | Burnside J, Morgan RW. Genomics and Marek's disease virus. Cytogenet Genome Res, 2007, 117(1/4): 376-387. |
| [9] | Strassheim S, Stik G, Rasschaert D, et al. mdv1-miR-M7-5p, located in the newly identified first intron of the latency-associated transcript of Marek's disease virus, targets the immediate-early genes ICP4 and ICP27. J Gen Virol, 2012, 93(Pt 8): 1731-1742. |
| [10] | Yao Y, Zhao Y, Xu H, et al. Marek's disease virus type 2 (MDV-2)-encoded microRNAs show no sequence conservation with those encoded by MDV-1. J Virol, 2007, 81(13): 7164-7170. |
| [11] | Morgan R, Anderson A, Bernberg E, et al. Sequence conservation and differential expression of Marek's disease virus microRNAs. J Virol, 2008, 82(24): 12213-12220. |
| [12] | Xu S, Xue C, Li J, et al. Marek's disease virus type 1 microRNA miR-M3 suppresses cisplatin-induced apoptosis by targeting Smad2 of the transforming growth factor beta signal pathway. J Virol, 2011, 85(1): 276-285. |
| [13] | Tian F, Luo J, Zhang H, et al. MiRNA expression signatures induced by Marek's disease virus infection in chickens. Genomics, 2012, 99(3): 152-159. |
| [14] | Stik G, Dambrine G, Pfeffer S, et al. The oncogenic microRNA OncomiR-21 overexpressed during Marek's disease lymphomagenesis is transactivated by the viral oncoprotein Meq. J Virol, 2013, 87(1): 80-93. |
| [15] | Nair V. Latency and tumorigenesis in Marek's disease. Avian Dis, 2013, 57(Suppl 2): 360-365. |
| [16] | Li ZJ, Zhang YP, Li Y, et al. Distinct expression pattern of miRNAs in Marek's disease virus infected-chicken splenic tumors and non-tumorous spleen tissues. Res Vet Sci, 2014, 97(1): 156-161. |
| [17] | Goher M, Hicks JA, Liu HC. The interplay between MDV and HVT affects viral miRNA expression. Avian Dis, 2013, 57(Suppl 2): 372-379. |
| [18] | Luo J, Sun AJ, Teng M, et al. Expression profiles of microRNAs encoded by the oncogenic Marek's disease virus reveal two distinct expression patterns in vivo during different phases of disease. J Gen Virol, 2011, 92(Pt3): 608-620. |
| [19] | Yao Y, Zhao Y, Smith LP, et al. Differential expression of microRNAs in Marek's disease virus-transformed T-lymphoma cell lines. J Gen Virol, 2009, 90(Pt7): 1551-1559. |
| [20] | Yu ZH, Teng M, Sun AJ, et al. Virus-encoded miR-155 ortholog is an important potential regulator but not essential for the development of lymphomas induced by very virulent Marek's disease virus. Virology, 2014, 448: 55-64. |
| [21] | Li X, Lian L, Zhang D, et al. gga-miR-26a targets NEK6 and suppresses Marek's disease lymphoma cell proliferation. Poult Sci, 2014, 93(5): 1097-1105. |
| [22] | Lian L, Qu L, Chen Y, et al. A systematic analysis of miRNA transcriptome in Marek's disease virus-induced lymphoma reveals novel and differentially expressed miRNAs. PLoS ONE, 2012, 7(11): e51003. |
| [23] | Lambeth LS, Yao Y, Smith LP, et al. MicroRNAs 221 and 222 target p27Kip1 in Marek's disease virus-transformed tumour cell line MSB-1. J Gen Virol, 2009, 90(Pt5): 1164-1171. |
| [24] | Parnas O, Corcoran DL, Cullen BR. Analysis of the mRNA targetome of microRNAs expressed by Marek's disease virus. Mbio, 2014, 5(1): e01060-13. |
| [25] | Faraoni I, Antonetti FR, Cardone J, et al. miR-155 gene: a typical multifunctional microRNA. Biochim Biophys Acta, 2009, 1792(6): 497-505. |
| [26] | Muylkens B, Coupeau D, Dambrine G, et al. Marek's disease virus microRNA designated Mdv1-pre-miR-M4 targets both cellular and viral genes. Arch Virol, 2010, 155(11): 1823-1837. |
| [27] | Zhao Y, Xu H, Yao Y, et al. Critical role of the virus-encoded microRNA-155 ortholog in the induction of Marek's disease lymphomas. PLoS Pathog, 2011, 7(2): e1001305. |
| [28] | Chen M, Payne WS, Hunt H, et al. Inhibition of Marek's disease virus replication by retroviral vector-based RNA interference. Virology, 2008, 377(2): 265-272. |
| [29] | Rachamadugu R, Lee JY, Wooming A, et al. Identification and expression analysis of infectious laryngotracheitis virus encoding microRNAs. Virus Genes, 2009, 39(3): 301-308. |
| [30] | Yao Y, Smith LP, Petherbridge L, et al. Novel microRNAs encoded by duck enteritis virus. J Gen Virol, 2012, 93(Pt7): 1530-1536. |
| [31] | Lin TW, Lo CW, Lai SY, et al. Chicken heat shock protein 90 is a component of the putative cellular receptor complex of infectious bursal disease virus. J Virol, 2007, 81(16): 8730-8741. |
| [32] | Yuan W, Zhang X, Xia X, et al. Inhibition of infectious bursal disease virus infection by artificial microRNAs targeting chicken heat-shock protein 90. J Gen Virol, 2012, 93(Pt4): 876-879. |
| [33] | Wang Y, Sun H, Shen P, et al. Effective inhibition of infectious bursal disease virus replication by recombinant avian adeno-associated virus-delivered microRNAs. J Gen Virol, 2009, 90(Pt6): 1417-1422. |
| [34] | Wang Y, Sun H, Shen P, et al. Effective inhibition of replication of infectious bursal disease virus by miRNAs delivered by vectors and targeting the VP2 gene. J Virol Methods, 2010, 165(2): 127-132. |
| [35] | Wang YS, Ouyang W, Pan QX, et al. Overexpression of microRNA gga-miR-21 in chicken fibroblasts suppresses replication of infectious bursal disease virus through inhibiting VP1 translation. Antiviral Res, 2013, 100(1): 196-201. |
| [36] | Chesters PM1, Smith LP, Nair V. E (XSR) element contributes to the oncogenicity of Avian leukosis virus (subgroup J). J Gen Virol, 2006, 87(Pt9): 2685-2692. |
| [37] | Yao Y, Smith LP, Nair V, et al. An avian retrovirus uses canonical expression and processing mechanisms to generate viral microRNA. J Virol, 2014, 88(1): 2-9. |
| [38] | Wang W, Zhang ZP, Tian J, et al. Inhibition of avian leukosis virus subgroup J replication by miRNA targeted against env. Virus Genes, 2013, 47(1): 34-41. |
| [39] | Tauber S, Ligertwood Y, Quigg-Nicol M, et al. Behaviour of influenza A viruses differentially expressing segment 2 gene products in vitro and in vivo. J Gen Virol, 2012, 93(Pt4): 840-849. |
| [40] | Kumar A, Vn MA, Raut AA, et al. Identification of chicken pulmonary miRNAs targeting PB1, PB1-F2, and N40 genes of highly pathogenic avian influenza virus H5N1 in silico. Bioinform Biol Insights, 2014, 8: 135-145. |
| [41] | Wang Y, Brahmakshatriya V, Zhu H, et al. Identification of differentially expressed miRNAs in chicken lung and trachea with avian influenza virus infection by a deep sequencing approach. BMC Genomics, 2009, 10: 512. |
| [42] | Wang Y, Brahmakshatriya V, Lupiani B, et al. Integrated analysis of microRNA expression and mRNA transcriptome in lungs of avian influenza virus infected broilers. BMC Genomics, 2012, 13: 278. |
| [43] | Frank C, Martin F, Valarie M, et al. Cutting edge: microRNA-181 promotes human NK cell development by regulating Notch signaling. J Immunol, 2011, 187(12): 6171-6175. |
| [44] | Ziętara N, Łyszkiewicz M, Witzlau K, et al. Critical role for miR-181a/b-1 in agonist selection of invariant natural killer T cells. Proc Natl Acad Sci USA, 2013, 110(18): 7407-7412. |
| [45] | Henao-Mejia J, Williams A, Goff LA, et al. The microRNA miR-181 is a critical cellular metabolic rheostat essential for NKT cell ontogenesis and lymphocyte development and homeostasis. Immunity, 2013, 38(5): 984-997. |
 2015, Vol. 31
2015, Vol. 31