服务
文章信息
- 孟闪闪, 蔡文萍, 马纪
- Meng Shanshan, Cai Wenping, Ma Ji
- 荒漠甲虫小胸鳖甲抗冻蛋白的酵母表达及应用
- Yeast expression and application of an antifreeze protein from the desert beetle Microdera punctipennis
- 生物工程学报, 2015, 31(8): 1255-1265
- Chin J Biotech, 2015, 31(8): 1255-1265
- 10.13345/j.cjb.140491
-
文章历史
- Received: October 20, 2014
- Accepted: December 10, 2014
抗冻蛋白 (Antifreeze protein,AFP) 是一类广泛存在于鱼类、植物、真菌、昆虫等变温生物中的蛋白质[1, 2],具有来源、类型、结构和活性的多样性[3]。抗冻蛋白的主要功能是热滞效应 (Thermal hysteresis activity,THA),即降低溶液的冰点,但不改变其熔点,从而产生冰点与熔点之间的温度差值。这种热滞值越大,抗冻蛋白的活性就越高[4],因而AFP亦称为热滞蛋白 (Thermal hysteresis protein,THP)。抗冻蛋白可以抑制冰晶生长,并改变冰晶形态;植物和鱼类抗冻蛋白还具有重结晶抑制效应 (Recrystallization inhibition,RI)[5]。昆虫抗冻蛋白具有十分独特的b-螺旋结构,由数目不等的保守基序TCTxSxxCxxAx (X代表任意氨基酸) 组成,分子内部可形成众多二硫键[6]。在所有抗冻蛋白中,昆虫抗冻蛋白具有很高的热滞活性,黄粉虫抗冻蛋白浓度为1 mg/mL时的热滞活性可达5.5 ℃,为鱼类抗冻蛋白热滞活性的10−100倍[7, 8]。因此昆虫抗冻蛋白可能具有更高的应用价值。
抗冻蛋白可用于细胞、组织和器官的超低温保存[9, 10],使冷藏和冷冻食品保持质地柔软,减少滴液以防止营养成分的损失[11, 12, 13]。鱼类AFP添加于冰淇淋和牛奶中,可消除冰渣,改善质量和口味[14]。目前,昆虫抗冻蛋白已在原核生物中成功表达,赵干等[15]克隆并利用大肠杆菌表达了小胸鳖甲 Microdera punctipennis 融合抗冻蛋白,该蛋白对细菌具有显著的抗冻保护作用。大肠杆菌表达系统具有时间短、成本相对较低的优势,但由于目的蛋白常以包涵体形式表达,影响产物的活性[16]。Leinala等[17]在大肠杆菌中表达了云杉卷叶蛾抗冻蛋白,但都是无活性的包涵体,需经变性复性处理,得到部分有活性的蛋白。L oewen等[18]用酵母菌表达美绒杜父鱼Hemitripterus americanus II型AFP,经过对发酵条件的优化,可使l0 L发酵罐的产量达30 mg/L。Li等[19]用分泌载体pGAP ZaA在巴斯德毕赤酵母的蛋白水解酶缺陷型SMDl168H体内表达大西洋鲱鱼Clupea haren gus的Ⅱ型AFP,该蛋白具有抗冻功能,酵母细胞在低温下的存活率得以提高。赵干等[20]利用pGAPZαA真核表达载体在SMD1168中表达了有活性的小胸鳖甲抗冻蛋白。由于SMD1168为蛋白酶缺失型菌株,生长缓慢,导致外源蛋白的产量不高[21]。另外,pGAPZαA表达载体以Zeocin为选择性标记,而Zeocin是一种强诱变剂,可能导致转化子发生突变。从应用的角度考虑,需要建立一个更为可行的表达系统。
本研究选用pPIC9K作为酵母整合载体,该载体在多克隆位点前含有信号肽编码序列,使表达的蛋白分泌到胞外,而酵母自身分泌的蛋白很少[22, 23],便于目的蛋白的纯化与浓缩。pPIC9K含组氨酸脱氧酶基因 (HIS4),在转化菌株中作为筛选标志,含有抗G418 (Kanamycin) 的基因,可通过提高G418的浓度,简便快速地筛选高拷贝的转化子。本研究所采用的抗冻蛋白MpAFP698源自新疆荒漠昆虫小胸鳖甲[15],通过原核表达质粒pGEX-4T-1-Mpafp698,获取目的基因Mpafp698,构建真核表达载体pPIC9K-Mpafp698,电转化毕赤酵母,并将Mpafp698导入酵母GS115基因组中,筛选高拷贝转化子,以期提高抗冻蛋白的表达量,为昆虫抗冻蛋白的应用奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌种、质粒及实验动物大肠杆菌Escherichia coli菌株,pGEX-4T-1- Mpafp698质粒,pPIC9K质粒,宿主菌Pichia pastoris GS115均为本实验室保存。昆明白小鼠购自新疆医科大学动物中心。
1.1.2 工具酶及其他试剂超纯水,氨卞青霉素 (Amp)、G418抗生素,限制性内切酶、Taq DNA聚合酶、T4 DNA连接酶和pMD18-T载体均购自大连TaKaRa公司;DNA相对分子质量标准物、蛋白质相对分子质量标准物和DNA片段回收试剂盒购自北京天根生物工程公司;YPD固体培养基、YPD液体培养基、BM GY培养基、BMMY培养基及其他试剂均为国产分析纯。
1.2 方法 1.2.1 酵母表达载体的构建与鉴定利用本实验室构建的原核表达质粒pGEX-4T-1-Mpafp698,获取小胸鳖甲的抗冻蛋白基因Mpafp698 (GenBank Accession No. AY821792)。用限制性内切酶NotⅠ和EcoRⅠ双酶切pGEX-4T-1-Mpafp698,经0.7%琼脂糖凝胶电泳,切胶回收Mpafp 698基因片段;将质粒pPIC9K同样用NotⅠ和EcoRⅠ双酶切,回收pPIC9K载体片段,用T4 DNA连接酶在16 ℃过夜连接pPIC9K载体与Mpafp698基因片段,获得重组质粒pPIC9K-Mpafp698 (图1)。连接产物转化E. coli TOP10感受态细胞,涂布于LB平板上 (含1‰氨苄青霉素),筛选重组子。碱裂解法小量提取重组质粒pPIC9K-Mpafp698,并用限制性内切酶EcoRⅠ和NotⅠ进行酶切鉴定。鉴定正确的重组质粒用限制性内切酶SacⅠ线性化,用电转仪 (2.0 kV,5−10 ms) 转化毕赤酵母GS115感受态细胞,并涂布于G418抗性选择YPD平板上,30 ℃培养2−4 d后,挑取抗G418的阳性克隆,提取酵母基因组DNA。载体上携带有醇氧化酶基因(AOX1),用3′AOX1引物和5′AOX1引物 (表1) 进行PCR扩增,鉴定转化菌。以空载体pPIC9K同样转化酵母菌,作为对照。
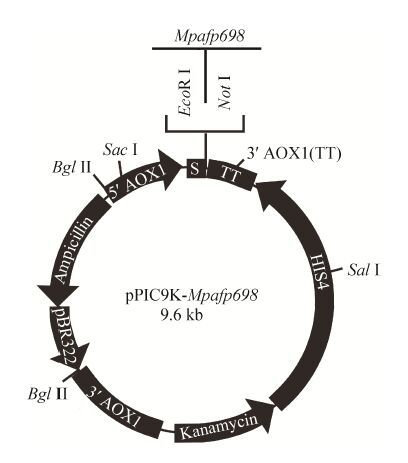
|
| 图1 pPIC9K-Mpafp698重组质粒示意图 Fig.1 Schematic diagram of pPIC9K-Mpafp698 recombinant plasmid |
| Primer name | Primer sequence (5′-3′) | Size (bp) |
| 3′AOX1 | GCAAATGGCATTCTGACATCC | 21 |
| 5′AOX1 | GACTGGTTCCAATTGACAAGC | 21 |
在无菌条件下将重组转化的酵母菌单克隆接种到25 mL BMGY培养基中,30 ℃摇床振荡培养 (250 r/min) 至OD600达到4.0−6.0 (大约16−18 h)。室温条件下4 500 r/min离心5 min后收获菌体,用BMMY培养基稀释菌体至OD600=1.0。在1 L的三角瓶中培养,在30 ℃恒温摇床振荡培养菌液 (250 r/min) 。每隔24 h补加100%甲醇至终浓度0.5%,培养至96 h时终止诱导。三氯乙酸 (TCA) 法浓缩纯化酵母表达的MpAFP698。对空载体pPIC9K转化菌也进行同样的诱导表达。
1.2.3 MpAFP698的Tricine SDS-PAGE和Western blotting分析取发酵上清浓缩液加入6×SDS上样缓冲液煮沸5 min,12 000 r/min离心2 min,取上清进行Tricine SDS-PAGE检测,以等量空载体转化菌的诱导后上清液做相同处理作为对照组。电泳分离后,电转移至硝酸纤维素膜上。用1%脱脂奶粉封闭2 h,依次滴加一抗稀释液 (室温反应2 h、PBS洗涤3次) 及羊抗兔IgG:HRP (室温反应1 h、PBS洗涤3次),最后加底物DAB显色并拍照。一抗为小胸鳖甲抗冻蛋白的特异性兔抗血清,由本实验室制备。
1.2.4 MpAFP698抗冻蛋白热滞活性的测定使用渗透压仪 (Automatic Osmometer,Model 5004,北京迪索公司) 测量溶液的渗透浓度,单位为毫渗 (mOsm)。1 mOsm相当于 1 mmol/L溶质溶于1 kg水中,而1 Osm/kg的溶质会使溶液的冰点下降1.858 ℃。所以,将渗透浓度乘以-1.858可估算样品的冰点值。因此,热滞活性 (THA) 的近似计算方法为:-1.858× (对照溶液的渗透浓度−抗冻蛋白溶液的渗透浓度) mOsm/1 000。选取不同浓度的抗冻蛋白,每组设3个重复。
1.2.5 MpAFP698对SF9细胞低温保存的影响选取昆虫卵巢细胞SF9为实验材料。收集对数生长期的细胞,在培养液中分别加入:BSA (阴性对照)、10%DMSO、MpAFP,另设一组只有培养液的空白对照。细胞的最终密度为5×106/mL-1×107/mL,将细胞分装入冻存管中,放入−20 ℃冰箱2 h,然后放入−70 ℃冰箱过夜,之后移入液氮容器内。细胞在37 ℃温水中复苏后,加入含10%小牛血清培养液重悬细胞,用尼康光学显微镜 (Nikon,Japan) 观察细胞形态 (10×20倍),用细胞计数板计数。同时,使用电导仪 (雷磁,DDS-307A,上海) 测定细胞电导率,单位以微西门子每米 (mS/m) 表示,通过电导率来判断细胞完整性以及冷冻保藏剂对细胞的保护效果。
1.2.6 MpAFP698对小鼠血细胞低温保存的影响为了检验抗冻蛋白在血细胞保存方面的效果,采用后眼眶采血法采集昆明白小鼠血液,经2 000 r/min离心10 min弃上清。用10 mmol/L PBS (pH 7.4) 洗涤红细胞3−4 次,PBS重悬细胞,并将红细胞稀释为10%浓度。将75 µL 10%红细胞悬液与不同体积的MpAFP698和BSA混合至终体积为150 µL,使抗冻蛋白终浓度为0.05 mg/mL,BSA终浓度为0.05 mg/mL。加入同体积PBS的细胞悬液作为阴性对照。每个样品设3个重复。分别置于4 ℃、室温 (20 ℃)、−20 ℃处理,观察溶血情况并拍照。
1.2.7 MpAFP698对小鼠器官冷冻保存的影响使用颈椎脱臼法处死昆明白小鼠,分别取出心、肝、脾、肾和股骨肌,用生理盐水洗净。实验组使用抗冻蛋白溶液浸泡器官,对照组以生理盐水浸泡器官,分别将实验组和对照组置于4 ℃和−20 ℃处理后,制作小鼠组织器官的石蜡切片,用尼康光学显微镜观察石蜡切片 (10×20倍)。
2 结果与分析 2.1 pPIC9K-Mpafp698转化酵母菌的筛选对整合了pPIC9K-Mpafp698外源基因的酵母菌提取基因组DNA,以3′AOX1和5′AOX1分别为上下游引物,进行PCR扩增 (图2)。空白酵母由于自身带有野生型AOX1基因,可扩增出一条2 200 bp的条带。线性化的pPIC9K空载整合到酵母基因组后,PCR扩增会出现一条 2 200 bp的条带和一条来源于GS115/pPIC9K的AOX1基因,大小为492 bp (图2,泳道1、2)。若宿主菌的基因组中整合了线性化的pPIC9K-Mpafp698,则PCR会扩增出一条 2 200 bp的条带和一条与AOX1 (GS115/pPIC9K) 相融合、带有目的基因的798 bp的条带 (492 bp+ 306 bp) (图2,泳道3−9)。

|
| 图2 pPIC9K-Mpafp698整合的重组酵母的PCR 鉴定 Fig.2 Identification of the recombinant yeast containing pPIC9K-Mpafp698 by PCR. M: DNA marker DL15000+2000; 1−2: GS115-pPIC9K; 3−9: GS115-pPIC9K-Mpafp698; 10: pPIC9K; 11: negative control with no template |
选取抗高浓度G418 (4.0 mg/mL) 的酵母菌株 (含pPIC9K-Mpafp698) 和空载体转化菌 (含pPIC9K) 进行甲醇诱导表达,上清液经TCA沉淀纯化,制备成电泳样品后,进行Tricine SDS-PAGE分析 (图3)。泳道1−4是不同的重组转化菌株,泳道5是空载体pPIC9K转化菌。结果显示,与空载体转化菌相比,在15 kDa和30 kDa附近重组菌均有诱导表达蛋白的条带出现,其中30 kDa条带大于理论值,可能是二聚体。
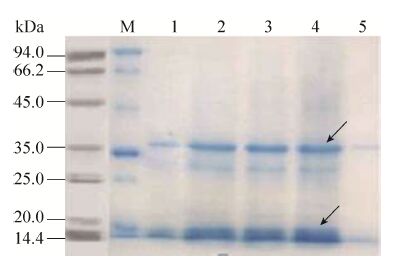
|
| 图3 发酵上清液的SDS-PAGE检测 Fig.3 SDS-PAGE analysis of the fermentation supernatants. M: protein molecular weight standard; 1−4: fermentation supernatant of GS115-pPIC9K-Mpafp698 recombinant yeast; 5: fermentation supernatant of GS115-pPIC9K recombinant yeast. The arrows indicate the bands of the target protein |
将Tricine SDS-PAGE后的凝胶转印到硝酸纤维素膜进行Western blotting 分析,结果显示,pPIC9K-Mpafp698整合菌在15 kDa和30 kDa附近分别出现特异性条带,而空载体转化菌未出现任何条带 (图4),证明重组菌表达的蛋白能被抗冻蛋白MpAFP698的特异性抗血清所识别,发生抗原抗体特异性免疫反应,表明MpAFP698获得表达。其中30 kDa附近的条带呈扩散状,可能与存在不同程度的糖基化修饰或形成聚合体有关。每升发酵液中抗冻蛋白的表达量可达0.85 g,热滞活性为1.55 ℃。
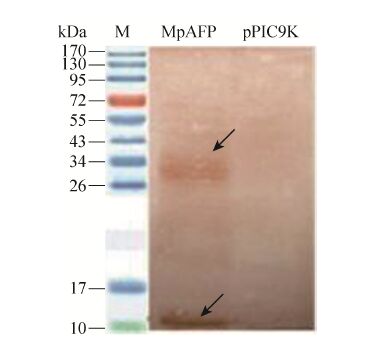
|
| 图4 发酵上清液的Western blotting检测 Fig.4 Western blotting analysis of the fermentation supernatant. M: prestained protein molecular weight standard; MpAFP: GS115-pPIC9K-Mpafp698 fermentation supernatant; pPIC9K: GS115-pPIC9K fermentation supernatant. The arrows indicate the bands of the expressed protein |
将对照组和分别添加了DMSO、BSA和MpAFP的不同处理组的细胞冰冻复苏后,进行细胞计数。结果表明,添加抗冻蛋白组的细胞数显著多于其他各组 (图5),说明抗冻蛋白可以有效地保护细胞。设置BSA无关蛋白组可以排除添加的蛋白本身对细胞存活的影响。

|
| 图5 不同处理组SF9细胞冰冻复苏后的计数结果 Fig.5 Numbers of SF9 cells after freeze-thaw with addition of different agents. CK: cell culture only; BSA: with addition of BSA; DMSO: with addition of DMSO; AFP with addition of MpAFP |
在上述细胞计数的同时,观察细胞形态。可以看到,在冰冻复苏后,添加MpAFP的SF9细胞形态饱满,活细胞数高于对照组和添加DMSO保护剂的细胞 (图6),说明抗冻蛋白对细胞具有良好的抗冻保护作用。

|
| 图6 不同处理组SF9细胞冰冻复苏后的显微形态观察(10×20倍) Fig.6 Microscopic morphology (10×20 times) of SF9 cells after freeze-thaw with addition of different agents. CK: cell culture only; BSA: with addition of BSA; DMSO: with addition of DMSO; AFP with addition of MpAFP |
通过检测冰冻复苏后细胞的电导率,可以判断细胞完整性。结果表明,添加抗冻蛋白组的电导率和添加DMSO组的电导率均低于CK对照组 (图7),抗冻蛋白组极显著地低于CK对照组 (F2,6=25.10,F0.01 (2,6) =10.92,P<0.01),且显著低于DMSO组 (F2,6=8.815,F0.05 (2,6) =5.143,P<0.05),说明AFP组的细胞完整性较好。
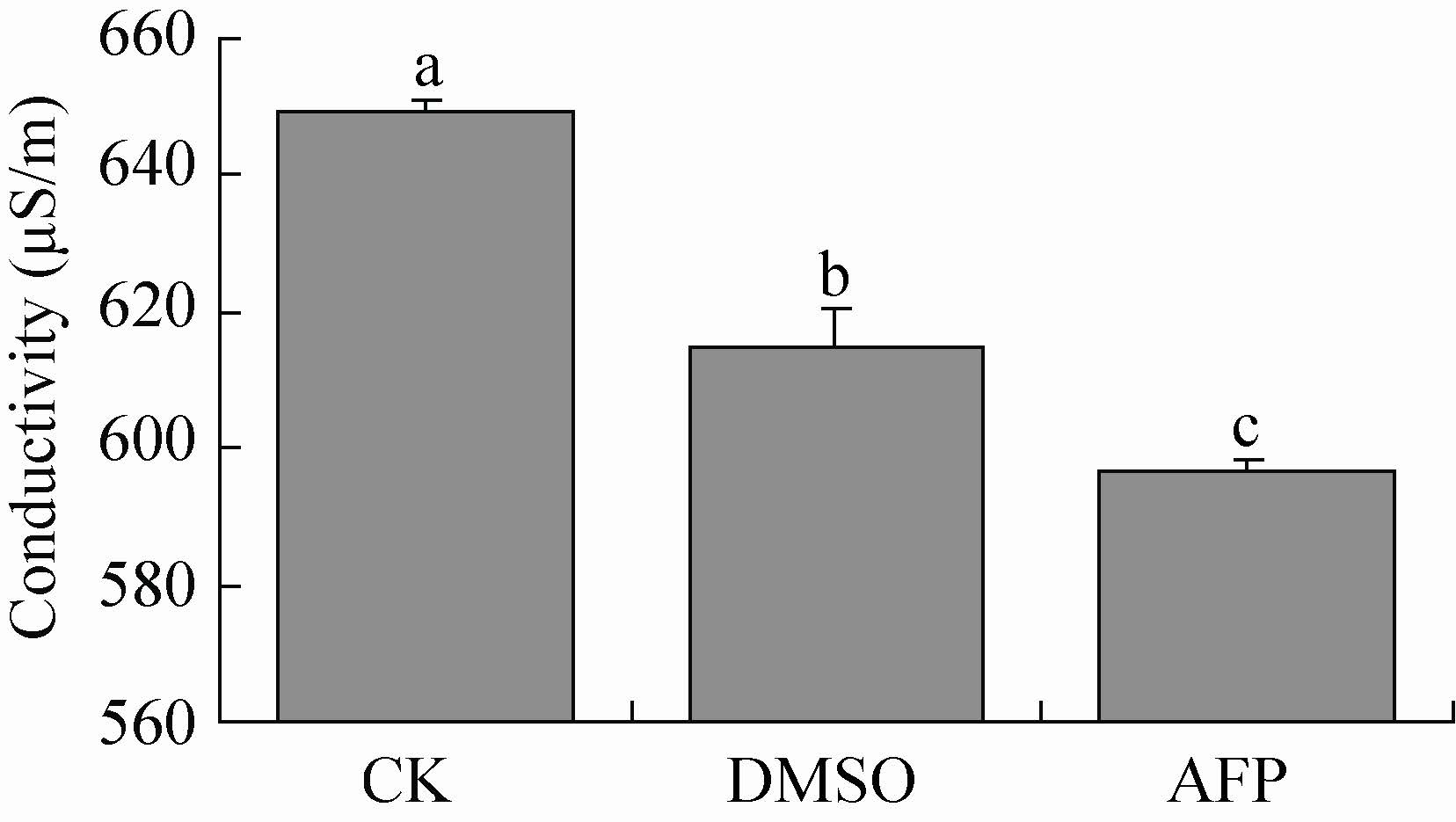
|
| 图7 不同处理组SF9细胞冰冻复苏后的电导率 Fig.7 Conductivity of SF9 cells after freeze-thaw with addition of different agents. CK: cell culture only; BSA: with addition of BSA; DMSO: with addition of DMSO; AFP with addition of MpAFP. Different letters show statistical significance |
对红细胞的保护实验结果显示,在室温 (20 ℃) 放置2 d时,PBS空白对照组和BSA对照组都出现了浑浊,表明有溶血现象,而抗冻蛋白组的上清液仍保持清澈,溶血现象不明显;在室温放置4 d时3组均出现了浑浊,表明发生了溶血现象(图8A)。在4 ℃放置2 d时,PBS组、BSA组和MpAFP处理组的血液上清液都很清澈,红细胞溶血现象均不明显;而在4℃放置4 d时,PBS组和BSA组都出现了严重的溶血现象,相比之下,添加抗冻蛋白组的上清液较为清澈,溶血现象较轻 (图8B),说明在4 ℃低温条件下抗冻蛋白对红细胞起到明显的保护 效果。

|
| 图8 不同温度下MpAFP对红细胞的保护效果 Fig.8 Protective effect of MpAFP698 on red blood cells at different temperatures. Red blood cells were added with PBS,BSA and AFP respectively at 20 °C (A) and 4 °C (B) for 2−4 days |
检测MpAFP698对低温处理的小鼠肌肉、心、肝、肾的保护作用,石蜡切片在光学显微镜下 (10x20倍) 观察显示,与对照组相比,AFP组的肌肉 (图9)、肾脏 (图10)、肝脏 (图12) 在4 ℃和−20 ℃处理后,细胞间隙较小,保护效果显著。其中,抗冻蛋白对肝脏的保护效果在4 ℃最为显著,而对心脏 (图11) 的保护效果在两种温度下都不明显。

|
| 图9 MpAFP对肌肉保护的石蜡切片观察(10× 20倍) Fig.9 Paraffin sections (10×20) of mouse muscle protected with MpAFP |

|
| 图10 MpAFP对肾脏保护的石蜡切片观察(10× 20倍) Fig.10 Paraffin sections (10×20) of mouse kidney protected with MpAFP |

|
| 图11 MpAFP对心脏保护的石蜡切片观察(10× 20倍) Fig.11 Paraffin sections (10×20) of mouse heart protected with MpAFP |

|
| 图12 MpAFP对肝脏保护的石蜡切片观察(10×20倍) Fig.12 Paraffin sections (10×20) of mouse liver protected with MpAFP |
利用抗冻蛋白进行生物材料的低温保存,具有无毒无害、环保友好的优势。本研究通过构建荒漠昆虫抗冻蛋白基因的酵母表达载体pPIC9K-Mpafp698,并将其整合到酵母基因组中,获得了可分泌表达昆虫抗冻蛋白的重组酵母菌GS115-pPIC9K-Mpafp698。经甲醇诱导表达,可获得目的蛋白MpAFP698的分泌表达。以空载体转化菌为对照,对发酵上清液进行Tricine SDS-PAGE检测,结果显示,分泌表达的绝大多数蛋白都是抗冻蛋白,表明该系统用于抗冻蛋白表达具有杂蛋白少、纯化方便的优势,这与酵母pPIC9K表达载体分泌表达外源蛋白而自身蛋白很少分泌表达是一致的[22, 23]。在15 kDa和30 kDa附近都出现了诱导表达的蛋白条带,经免疫印迹分析,两个条带都能与目的蛋白MpAFP698产生特异性的抗原抗体反应,所以可以确定二者都是目的条带。出现较大条带的原因可能是糖基化、脂质化等修饰作用[24]。还可能存在多聚体现象,甲虫抗冻蛋白的显著特征是以不同数目的12-氨基酸重复序列组成的大量长短不一的蛋白质大家族,富含半胱氨酸[6],有可能在分子间形成二硫键而聚合,导致蛋白多聚体的出现,30 kDa条带有可能是二聚体。该蛋白的相关理化性质值得深入研究。我们所表达抗冻蛋白浓度为12.85 μmol/L (0.85 g/L),热滞活性为1.55 ℃,活性远高于鱼类抗冻蛋白,如美洲拟鲽 Pleuronectes americanusⅠ型AFPs在浓度达400 μmol/L时,仅能使冰点降低0.27 ℃[25],但这一活性低于黄粉虫幼虫天然抗冻蛋白的5.5 ℃[7],可能是由于抗冻蛋白特殊的β-螺旋结构折叠不完全所致[26]。
荒漠甲虫小胸鳖甲抗冻蛋白在冰冻条件下能够有效保护SF9细胞,细胞复苏后的活细胞数和生长状态都比BSA对照组要好,电导率低于对照组,表明细胞膜的完整性较好。Tomczak等研究认为,抗冻蛋白具有稳定膜结构的功 能[27]。Prathalingam等发现鱼类Ⅰ型抗冻蛋白可以显著提高精子细胞的渗透调节能力[28]。在室温和低温下的一定时间内,MpAFP都能有效保护红细胞,与其能够稳定细胞膜结构的推测是一致的。这是首次报道抗冻蛋白在室温条件下仍能发挥保护作用。除了对单细胞具有保护作用外[29],本研究还发现,小胸鳖甲抗冻蛋白对组织器官在低温下也有显著的保护作用,尤其是对肝脏的低温保护效果十分显著 ,鱼类抗冻糖蛋白对小鼠肝脏也有很好的低温保护效 果[30]。比较抗冻蛋白对不同器官的低温保护效果,发现MpAFP对心脏的保护效果不显著,抗冻蛋白这种低温保护效果的组织差异性的原因还有待深入研究。
本研究通过酵母表达系统获得荒漠甲虫抗冻蛋白MpAFP698,该蛋白可显著改善冷冻小鼠肝脏等的细胞形态,提高SF9细胞的存活率,降低血细胞的溶血率,为今后利用基因工程手段降低生产成本、生产高活性的抗冻蛋白奠定了基础,抗冻蛋白在医学、农业、食品等领域将具有广阔的应用前景。
| [1] |
Jing XH, Hao SG, Kang L. Cold adaptation in insects: progress in antifreeze protein research. Acta Entomol Sin, 2002, 45(5): 679-683 (in Chinese). 景晓红, 郝树广, 康乐. 昆虫对低温的适应——抗冻蛋白研究进展. 昆虫学报, 2002, 45(5): 679-683. |
| [2] |
Zhong QW, Fan TJ. Advances in fish antifreeze protein research. Acta Biochim Biophys Sin, 2002, 34(2): 124-130 (in Chinese). 钟其旺, 樊廷俊. 鱼类抗冻蛋白的研究进展. 生物化学与生物物理学报, 2002, 34(2): 124-130. |
| [3] | Yeh Y, Feeney RE. Antifreeze proteins: structures and mechanisms of function. Chem Rev, 1996, 96(2): 601-618. |
| [4] | Clark MS, Worland MR. How insects survive the cold: molecular mechanisms-a review. J Comp Physiol B, 2008, 178(8): 917-933. |
| [5] | Meyer K, Keil M, Naldrett MJ. A leucine-rich repeat protein of carrot that exhibits antifreeze activity. FEBS Lett, 1999, 447(2): 171-178. |
| [6] | Graether SP, Kuiper MJ, Gagné SM, et al. β-Helix structure and ice-binding properties of a hyperactive antifreeze protein from an insect. Nature, 2000, 406(6793): 325-328. |
| [7] | Graham LA, Liou YC, Walker VK, et al. Hyperactive antifreeze protein from beetles. Nature, 1997, 388(6644): 727-728. |
| [8] | Tyshenko MG, Doucet D, Davies PL, et al. The antifreeze potential of the spruce budworm thermal hysteresis protein. Nat Biotechnol, 1997, 15(9): 887-890. |
| [9] | Matsumura K, Hyon SH. Polyampholytes as low toxic efficient cryoprotective agents with antifreeze protein properties. Biomaterials, 2009, 30(27): 4842-4849. |
| [10] | Rubinsky L, Raichman N, Lavee J, et al. Antifreeze protein suppresses spontaneous neural activity and protects neurons from hypothermia re-warming injury. Neurosci Res, 2010, 67(3): 256-259. |
| [11] | Pham L, Dahiya R, Rubinsky B. An in vivo study of antifreeze protein adjuvant cryosurgery. Cryobiology, 1999, 38(2): 169-175. |
| [12] |
Han YB, Liu GL. Antifreeze protein and their potential application in fruits and vegetables fresh keeping. Nat Prod Res Dev, 2003, 15(4): 373-378 (in Chinese). 韩永斌, 刘桂玲. 抗冻蛋白及其在果蔬保鲜中的应用前景. 天然产物研究与开发, 2003, 15(4): 373-378. |
| [13] |
Wang SY, Zhao J, Wu JH. et al. Research progress in antifreeze proteins and application in food industry. J Beijing Technol Bus Univ: Nat Sci Ed, 2011, 29(4): 50-57 (in Chinese). 汪少芸, 赵珺, 吴金鸿, 等. 抗冻蛋白的研究进展及其在食品工业中的应用. 北京工商大学学报: 自然科学版, 2011, 29(4): 50-57. |
| [14] |
Feng CJ, Lu JF, Lv WJ. et al. Advance in antifreeze proteins research. Jiangsu J Agr Sci, 2007, 23(5): 481-486 (in Chinese). 冯从经, 陆剑锋, 吕文静, 等. 抗冻蛋白研究进展. 江苏农业学报, 2007, 23(5): 481-486. |
| [15] |
Zhao G, Ma J, Xue N. et al. Cloning of a cDNA encoding antifreeze protein in Microdera punctipenis dzunarica (Coleoptera: Tenebrionidae) and its activity assay. Acta Entomol Sin, 2005, 48(5): 667-673 (in Chinese). 赵干, 马纪, 薛娜, 等. 新疆准噶尔小胸鳖甲抗冻蛋白基因的克隆和抗冻活性分析. 昆虫学报, 2005, 48(5): 667-673. |
| [16] | Daly R, Hearn MTW. Expression of heterologous proteins in Pichia pastoris: a useful experimental tool in protein engineering and production. J Mol Recognit, 2005, 18(2): 119-138. |
| [17] | Leinala EK, Davies PL, Doucet D, et al. A β-helical antifreeze protein isoform with increased activity structural and functional insights. J Biol Chem, 2002, 277(36): 33349-33352. |
| [18] | Loewen MC, Liu X, Davies PL, et al. Biosynthetic production of type II fish antifreeze protein: fermentation by Pichia pastoris. Appl Microbiol Biot, 1997, 48(4): 480-486. |
| [19] | Li Z, Xiong F, Lin Q, et al. Low-temperature increases the yield of biologically active herring antifreeze protein in Pichia pastoris. Protein Expres Purif, 2001, 21(3): 438-445. |
| [20] |
Zhao G, Ma J, Yang CG. et al. The secreted expression of desert insect (Microdera punctipenis dzunarica) antifreeze protein in Pichia pastoris. Biotechnology, 2005, 15(2): 25-27 (in Chinese). 赵干, 马纪, 杨长庚, 等. 新疆准噶尔小胸鳖甲抗冻蛋白在毕赤酵母中的分泌表达. 生物技术, 2005, 15(2): 25-27. |
| [21] | Scorer CA, Clare JJ, McCombie WR, et al. Rapid selection using G418 of high copy number transformants of Pichia pastoris for high-level foreign gene expression. Nat Biotechnol, 1994, 12(2): 181-184. |
| [22] | Tschopp JF, Sverlow G, Kosson R, et al. High-level secretion of glycosylated invertase in the methylotrophic yeast, Pichia pastoris. Nat Biotechnol, 1987, 5(12): 1305-1308. |
| [23] | Barr KA, Hopkins SA, Sreekrishna K. Protocol for efficient secretion of HSA developed from Pichia pastoris. Pharm Eng, 1992, 12: 48-51. |
| [24] | Montesino R, Garcia R, Quintero O, et al. Variation in N-linked oligosaccharide structures on heterologous proteins secreted by the methylotrophic yeast Pichia pastoris. Protein Expres Purif, 1998, 14(2): 197-207. |
| [25] | Graether SP, Kuiper MJ, Gagné SM, et al. β-Helix structure and ice-binding properties of a hyperactive antifreeze protein from an insect. Nature, 2000, 406(6793): 325-328. |
| [26] | Parody-Morreale A, Murphy KP, Di Cera E, et al. Inhibition of bacterial ice nucleators by fish antifreeze glycoproteins. Nature, 1988, 333(6175): 782-783. |
| [27] | Tomczak MM, Hincha DK, Estrada SD, et al. A mechanism for stabilization of membranes at low temperatures by an antifreeze protein. Biophys J, 2002, 82(2): 874-881. |
| [28] | Prathalingam NS, Holt WV, Revell SG, et al. Impact of antifreeze proteins and antifreeze glycoproteins on bovine sperm during freeze-thaw. Theriogenology, 2006, 66(8): 1894-1900. |
| [29] | Chao H, Davies PL, Carpenter JF. Effects of antifreeze proteins on red blood cell survival during cryopreservation. J Exp Biol, 1996, 199(9): 2071-2076. |
| [30] | Lee CY, Rubinsky B, Fletcher GL. Hypothermic preservation of whole mammalian organs with antifreeze proteins. Cryo-Lett, 1992, 13(1): 59-66. |
 2015, Vol. 31
2015, Vol. 31




