服务
文章信息
- 罗启慧, 唐秀莹, 陈正礼, 汪开毓, 王承东, 李德生, 李才武
- Luo Qihui, Tang Xiuying, Zhengli Chen Chen Zhengli Chen, Wang Kaiyu, Wang Chengdong, Li Desheng, Caiwu Li
- 大熊猫胃肠道神经肽Y 和长型瘦素受体的表达
- xpression of neuropeptide Y and long leptin receptor in gastrointestinal tract of giant panda
- 生物工程学报, 2015, 31(8): 1175-1183
- Chin J Biotech, 2015, 31(8): 1175-1183
- 10.13345/j.cjb.140559
-
文章历史
- Received:November 18, 2014;
- Accepted: January 4, 2015
2. 中国保护大熊猫研究中心 濒危动物遗传与育种四川省重点实验室,四川 雅安 625014
2. Key Laboratory for Reproduction and Conservation Genetics of Endangered Wildlife of Sichuan Province,China Conservation and Research Center for the Giant Panda,Ya’an 625014,Sichuan,China
瘦素 (Leptin) 是由脂肪组织分泌的含167个氨基酸残基的肽类,通过与其受体结合而发挥生理调控功能。根据胞内片段氨基酸长度及序列组成的差异,瘦素受体可分为长型受体和短型受体。OB-Rb是唯一的长型受体并被认为是激活信号传递通路的主要功能性受体[1]。神经肽Y (Neuropeptide Y,NPY) 由36个氨基酸组成,从分子结构看,哺乳类的序列大体一致。Leptin和NPY因参与调节能量代谢、神经内分泌和免疫反应等功能而受到关注,且Leptin具有介导NPY功能的作用[2, 3]。Leptin与其受体OB-Rb结合通过激活JAK/STAT、MAPK等信号通路调节下游因子 (包括NPY,POMC等) 的分泌与释放[4, 5]。资料显示哺乳类[6, 7]、两栖类[8]、鱼类[9, 10]等的胃肠道上都有OB-Rb和NPY表达,但分布不同。NPY和OB-Rb在胃肠道的表达分布与胃肠道的消化吸收等功能密切相关[11, 12, 13]。有关大熊猫胃肠道NPY和OB-Rb的分布和形态特点未见报道。大熊猫因食性特殊,其胃肠道结构理应发生适应性进化,为探讨大熊猫胃肠道NPY和OB -Rb表达分布情况,本实验运用HE、免疫组织化学方法对NPY和OB-Rb在大熊猫胃肠道各段进行研究,为大熊猫胃肠道内分泌研究提供形态学依据。
1 材料与方法 1.1 实验动物大熊猫胃肠道组织由中国保护大熊猫研究中心濒危动物繁殖与保护遗传四川省重点实验室提供,共3例。
1.2 HE 染色和免疫组化检测 1.2.1 样品处理与切片胃肠各段用 4%多聚甲醛磷酸缓冲液 (pH 7.4) 进行固定。石蜡切片,片厚6 μm,切片3组:苏木精-伊红 (Hematoxylin-eosin,HE) 染色观察组织学形态;免疫组化染色;免疫组化阴性对照。
1.2.2 NPY和OB-Rb免疫组化检测切片37 ℃烤片过夜,常规脱蜡至水,入3% H2O2中15 min 以除去内源性过氧化物酶活性,蒸馏水洗5 min,重复3次。将切片浸入pH 9.0的Tris/EDTA中,煮沸修复15 min,自然冷却至室温。Tris-HCL缓冲盐溶液 (TBS) 洗5 min,重复2次。5%封闭液,37 ℃,30 min。倾去多余液体不洗,分别滴加TBS稀释后的一抗NPY (1∶800) (兔抗鼠NPY多克隆抗体,英国Abcam公司) 和OB-Rb (1∶200) (兔抗鼠OB-Rb多克隆抗体,北京博奥森公司),4 ℃,孵育10 h,TBS洗5 min,重复3次。配制二抗 (1∶1 000) (山羊抗兔IgG H&L (HRP),英国Abcam公司),37 ℃,孵育1 h,TBS洗5 min,重复4次。配制SABC (1∶100),37 ℃,孵育20 min,0.02% Tween 20 TBS洗 5 min,重复4次,TBS洗5 min,重复3次。新鲜配制3,3-二氨基联苯胺 (Diaminobezibin,DAB) 显色5−10 min,镜下观察显色情况,脱水、透明、封片。
阴性对照实验用TBS代替一抗,其余步骤相同。
1.3 显微拍照及图像分析
将制得的切片在Nikon50i-BF荧光生物数码显微镜下拍照观察记录,用江苏捷达801形态分析软件对阳性细胞进行分析,每只动物每个部位随机选取5张切片,测量阳性细胞的表达总面积、平均光密度值及灰度值。平均光密度表示在视野内所有阳性产物的平均反应强度;平均灰度值为阳性产物的染色强度,染色越深,其灰度值越小。数值用均数±标准差 ( ±s) 表示,直接存于计算机,用Duncan多重比较的方法进行统计分析,P<0.05为差异显著。
±s) 表示,直接存于计算机,用Duncan多重比较的方法进行统计分析,P<0.05为差异显著。
本实验HE染色观察到大熊猫胃肠道组织学无病理性变化。胃肠道黏膜肌层和肌层均较厚,质地致密,且胃肠各段的内环肌层都厚于外纵层。整个胃肠道表现为单细胞和多细胞黏液腺非常丰富。小肠绒毛较长,绒毛上杯状细胞相当丰富,过渡到结肠段绒毛消失,但杯状细胞更加发达。
2.2 OB-Rb在胃肠道中的表达结果 2.2.1 OB-Rb 在胃肠道中分布及形态特征对大熊猫胃肠道OB-Rb进行观察,阳性物质多表达于胞质中,也有胞膜着色的细胞,视切面不同而异,核呈阴性。阴性对照实验,仅见背景染色,未见阳性物质。阳性细胞呈现为黄褐色,有卵圆形、多边形等。胃肠道均有OB-Rb的表达,胃腺上有大量阳性细胞,胃底腺的阳性胞质呈深浅不一的棕黄色,阳性细胞胞核呈椭圆形、多边形、不规则形 (图1A和图1B)。从细胞形态和大小判断,推测为壁细胞和主细胞。肠道外膜、部分黏膜下和肌间神经丛上均有阳性表达 (图1C),且肠黏膜神经丛上也有OB-Rb的表达。肠道从外至内的各层组织中以黏膜层中的固有层表达最为丰富 (图1D−F),在肠腺周围环绕着较多阳性细胞 (图1D),从其形态结构和分布疑似淋巴细胞样阳性细胞。

|
| 图1 大熊猫胃肠道OB-Rb的表达(SABC) Fig.1 OB-Rb immunoreactivity in the gastrointestinal (SABC). (A,B) Stomach. (C) Duodenum. (D) Jejunum. (E) Ileum. (F) Colon. Arrow shown positive position. The icon marked A−B for 50 μm; C−F for 100 μm. |
对大熊猫胃肠道5个部位OB-Rb阳性细胞表达总面积、平均光密度及平均灰度测量所得的数据用Duncan多重比较的方法进行了统计分析,实验结果详见表1。可见胃肠各段OB-Rb阳性产物分布不同,呈现一定的规律:其中阳性表达总面积以胃、结肠较大,空肠表达量最低;结肠的平均光密度值高;平均灰度值则呈现相反的趋势。
| Stomach | Duodenum | Jejunum | Ileum | Colon | |
| Positive cell areas (μm2) | 1 215.26±149.68b | 849.53±29.55c | 555.29±41.30d | 955.05±24.46c | 1 620.78±131.49a |
| The mean of light density | 0.24±0.01b | 0.22±0.01c | 0.25±0.01b | 0.23±0.01c | 0.26±0.01a |
| The mean of gray density | 148.47±1.37b | 152.58±2.68a | 144.82±2.97b | 151.65±2.04a | 139.58±1.09c |
| The difference between mean with different small letters within a row is significant (P<0.05). | |||||
在整个胃肠道中,NPY阳性反应的神经纤维和神经元细胞体呈棕褐色或棕黄色。阴性对照切片染色结果为未见阳性产物 (图2A)。NPY神经纤维遍布胃肠壁各层且分布不均。呈串珠状或点状排列,黏膜下神经丛和肌间神经丛内均有分布,其中以前者分布居多 (图2B)。在胃肠消化管的浆膜至黏膜下层,胃和十二直肠区域有粗大的NPY阳性神经纤维,到肠道的回肠区NPY阳性神经纤维开始变少。NPY阳性神经纤维分布密度与神经丛的分布可能直接相关,有小血管的地方几乎都有NPY阳性神经纤维的伴行 (图2C)。
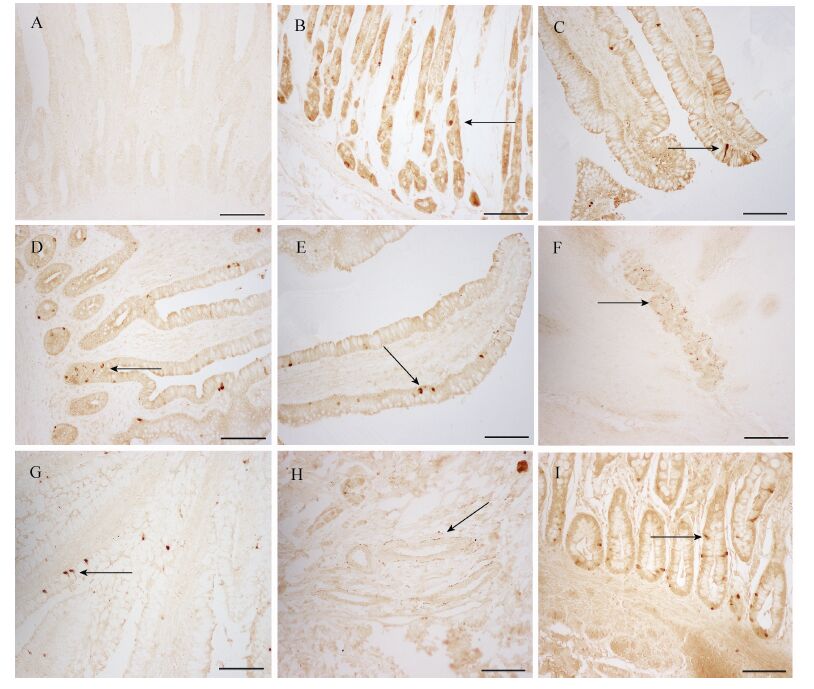
|
| 图2 大熊猫胃肠道NPY的表达(SABC) Fig.2 NPY immunoreactivity in gastrointestinal (SABC). (A) Jejunum (Negative). (B) Stomach. (C) Duodenum. (D,E) Jejunum. (F) Jejunum nerve plexus. (G) Ileum. (H) Ileal blood vessels. (I) Colon. Arrow shown positive position. The icon marked for 100 μm. |
胃肠的NPY阳性神经元胞体大小不等,形状不一,呈卵圆形,不规则形或扁平形,胞质呈棕褐色。在胃有腺部、回肠、结肠、直肠的黏膜层上分布有很多阳性NPY细胞体,尤以结肠区分布较多 (图2D−F)。但胃、十二指肠和空肠分布神经元胞体较少,阳性显色也较浅。NPY阳性细胞体散在地分布在胃肠腺中,有的穿插于肠黏膜上皮细胞和杯状细胞之间。细胞形态多样,多数具有胞质突起,似开放型细胞。细胞呈长梭形、柱形、锥形等,细胞胞质突起的形态也是多样,有的阳性细胞具有细长的胞突伸向肠腔 (图2G−H)。也有卵圆形或椭圆形的NPY阳性细胞,没有胞质突起,似封闭型细胞 (图2I)。
2.3.2 NPY在胃肠道中分布比较NPY阳性神经纤维及细胞的分布密度在大鼠胃肠道各部位显示不均匀的分布 (表2),分别对表达总面积、平均光密度值及平均灰度值进行统计学分析,发现胃与各肠段差异明显 (P<0.05),而各肠段之间差异并不明显。
| Stomach | Duodenum | Jejunum | Ileum | Colon | |
| Positive cell areas (μm2) | 253.70±58.18a | 237.01±68.24b | 207.65±16.62c | 219.51±50.10b | 224.60±19.07b |
| The mean of light density | 0.36±0.02a | 0.28±0.02b | 0.26±0.01b | 0.26±0.02b | 0.28±0.02b |
| The mean of gray density | 113.66±6.71b | 132.61±5.61a | 136.82±6.32a | 140.21±7.92a | 134.55±7.94a |
| The difference between mean with different small letters within a row is significant (P<0.05). | |||||
大熊猫实为肉食动物,有尖锐发达的犬齿、较短的肠道和肉食动物的消化生理特点。但由于生存环境变化,食性和习性的改变,机体渐渐适应了低营养、低消化率的竹类。对大熊猫消化系统及味觉基因的分析结果显示,大熊猫本身没有能够消化竹子纤维的基因,消化竹纤维主要靠胃肠道细菌群;另外,大熊猫废弃肉类食物主要原因为Umami受体基因T1R1的失活,无法感知肉的鲜味[14, 15]。基于外部环境和大熊猫本身的进化,大熊猫胃肠道的大体和显微形态结构发生了深刻的适应性变化。本实验显示大熊猫胃肠道组织学结构正常,与王平等[16, 17]的研究结果大致相同,主要表现在小肠绒毛较长,肠道黏膜肌层与肌肉层较厚,单细胞和多细胞黏液腺丰富。这与大熊猫胃肠道的黏液丰富以及大熊猫特有的排黏现象相适应。另一方面也有助于大熊猫粪便的排出,支持大熊猫依靠快吃快拉来维持新陈代谢的平衡现象。
自OB-Rb和NPY被成功克隆以来,有关OB-Rb和NPY在各类动物中枢和外周的分布研究国内外已有较多报道,OB-Rb和NPY在中枢系统的共表达也有相关研究。研究发现,OB-Rb和NPY在不同种属的表达部位和表达量并不一致。在对哺乳类和禽类的相关报道中,OB-Rb的分布研究较多的是在下丘脑,胃肠道组织中也有报道。如Jin等[18]用RT-PCR、原位杂交法和免疫组化法发现OB-Rb在大鼠垂体前叶、脉络丛、大脑、下丘脑和脑膜等部位表达,且发现OB-Rb mRNA在微血管表达量较低,但在大脑的表达量是下丘脑的5倍。 Mix等[19]研究发现,在人的胃黏膜有瘦素受体的表达,并推测瘦素通过旁分泌或自分泌作用于胃上皮细胞。Sobhani等[13]通过免疫组化、RT-PCR和Western blotting分析发现瘦素的阳性细胞位于胃底腺下半部分,瘦素受体存在于胃体和胃窦细胞基底外侧膜,认为胃黏膜上皮细胞是瘦素的靶细胞。本实验在对大熊猫胃肠道OB-Rb 表达研究中发现,在胃组织中OB-Rb主要表达于胃腺及其周围间质组织,主要位于胃底腺的中下部,与上述研究结果基本一致。笔者分析认为瘦素受体长型阳性细胞主要位于胃底腺的主细胞和壁细胞,且多数为壁细胞,并且OB-Rb在胃中表达量较高,认为OB-Rb与大熊猫胃的消化吸收功能密切相关。有研究表明大鼠、小鼠小肠瘦素受体长型表达于细胞质中,见于绒毛、肠腺和肠基底膜[20]。现有研究显示在大鼠、小鼠和人体小肠的吸收细胞存在瘦素受体长型,认为瘦素具有调节营养物质吸收的生理作用。在对小鼠结肠炎模型上瘦素受体的表达研究中还发现瘦素受体的表达与T淋巴细胞调节炎症有关[21]。另外B淋巴细胞作为体液免疫应答过程中的主要效应细胞,其表面存在OB-Rb,作为T淋巴细胞两大亚群的CD4+和CD8+ T淋巴细胞表面也具有OB-Rb[22]。同时,NK细胞也能调节OB-Rb的表达[23]。本实验结果发现OB-Rb表达于肠上皮细胞、肠腺细胞及部分淋巴细胞,再次为OB-Rb在肠道的表达提供了依据。同时发现OB-Rb在结肠的表达总面积和平均光密度比其他部位高,平均灰度值达到最低。分析认为这与大熊猫特殊的食性和肠道结构有关。大熊猫从食肉慢慢进化为以食竹为主,其肠道主要以纤维素消化为主。加上大熊猫没有盲肠,结肠部位不仅起着消化重吸收的作用,同时承担着肠道免疫中最核心的部分。结合以往他人的研究与我们在研究中发现OB-Rb可高表达于淋巴细胞,推测OB-Rb在结肠中起到了较强的 免疫调控作用。
已发现NPY存在于大鼠、豚鼠、猪的胃肠道中,并称NPY有控制非脉管平滑肌张力的作用[6]。神经肽Y在人体的胃肠道的免疫反应性的分布、定量及起源也有阐述[24]。已有研究称神经肽Y在肠道是一种节后交感神经元分泌的神经递质,且神经肽Y可影响水的吸收和离子转运[25]。NPY对胃肠道的机械消化和化学消化均有影响,NPY调节胃肠道的功能源于它在胃肠道的表达分布。在对大熊猫胃肠道NPY表达研究发现,NPY神经纤维遍布胃肠壁各层且分布不均,呈串珠状或点状排列,黏膜下神经丛和肌间神经丛内均有分布,我们研究结果与人和大鼠空肠的NPY神经纤维分布研究结果相似[26]。NPY阳性细胞体散在地分布于胃肠腺中,有的穿插于肠黏膜上皮细胞和杯状细胞之间。细胞形态多样,多数具有胞质突起,分为开放型和封闭型细胞,与鱼类肠道NPY阳性细胞形态报道基本一致[9, 27, 28]。NPY在胃中表达量较肠道各段高,推测虽然NPY在胃肠各段消化功能均有调节作用,但对胃来说具有更强的调控能力,可能因为大熊猫吃进的竹类食物在胃内并没有充分的消化,那么就需要更强大的收缩力使胃内容物排到口径更小的肠道中去的缘故。
综上,本研究丰富了大熊猫胃肠道的形态学资料,同时发现OB-Rb和NPY在大熊猫胃肠道中有表达,首次对它们在大熊猫胃肠道的分布位置及相对表达量作了分析。研究显示大熊猫胃肠道OB-Rb和NPY分布类似于大多数哺乳动物,但也有差异。OB-Rb分布广泛,不仅表达于吸收细胞,且在各类免疫相关细胞也有丰富表达。关于NPY阳性物质除了表达在神经纤维外,在黏膜层发现大量阳性NPY细胞,并呈现多种形态。另发现大熊猫肠道NPY神经纤维较少,推测这与大熊猫和其他动物体内神经丛分布情况不同及大熊猫独特的肠道结构有关。OB-Rb和NPY在大熊猫胃肠道的丰富表达,提示OB-Rb和NPY参与大熊猫的生长发育、消化吸收、免疫等多种功能,为大熊猫的内分泌的形态学研究提供了依据,但具体机制还有待进一步研究。
| [1] | Heshka JT, Jones PJH. A role for dietary fat in leptin receptor, OB-Rb, function. Life Sci, 2001, 69(9): 987-1003. |
| [2] | Czaja K, Lakomy M, Kaleczyc J, et al. Leptin receptors, NPY, and tyrosine hydroxylase in autonomic neurons supplying fat depots in a pig. Biochem Biophys Res Commun, 2002, 293(3): 1138-1144. |
| [3] | Horvath TL, Diano S, van den Pol AN. Synaptic interaction between hypocretin (orexin) and neuropeptide Y cells in the rodent and primate hypothalamus: a novel circuit implicated in metabolic and endocrine regulations. J Neurosci, 1999, 19(3): 1072-1087. |
| [4] | Meister B. Control of food intake via leptin receptors in the hypothalamus. Vitam Horm, 2000, 59: 265-304. |
| [5] | Udagawa J, Hatta T, Otani H. Expression of the long form of leptin receptor (Ob-Rb) mRNA in the brain of mouse embryos and newborn mice. Brain Res, 2000, 868(2): 251-258. |
| [6] | Allen JM, Hughes J, Bloom SR. Presence, distribution, and pharmacological effects of neuropeptide Y in mammalian gastrointestinal tract. Digest Dis Sci, 1987, 32(5): 506-512. |
| [7] | Aparicio T, Kermorgant S, Darmoul D, et al. Leptin and Ob-Rb receptor isoform in the human digestive tract during fetal development. J Clin Endocr Metab, 2005, 90(11): 6177-6184. |
| [8] | Buono S, Putti R. Leptin, leptin receptors and ACTH immunoreactivities are present in the gastrointestinal tract and the neural tube of tadpoles of the new Triturus. J Mol Histol, 2004, 35(2): 103-109. |
| [9] | Jensen J, Conlon JM. Characterization of peptides related to neuropeptide tyrosine and peptide tyrosine-tyrosine from the brain and gastrointestinal tract of teleost fish. Eur J Biochem, 2005, 210(2): 405-410. |
| [10] | Liu Q, Chen Y, Copeland D, et al. Expression of leptin receptor gene in developing and adult zebrafish. Gen Comp Endocr, 2010, 166(2): 346-355. |
| [11] | Heredia MP, Delgado C, Pereira L, et al. Neuropeptide Y rapidly enhances [Ca2+] transients and Ca2+ sparks in adult rat ventricular myocytes through Y1 receptor and PLC activation. J Mol Cell Cardiol, 2005, 38(1): 205-212. |
| [12] | Nilsson T, Edvinsson L. Neuropeptide Y stimulates DNA synthesis in human vascular smooth muscle cells through neuropeptide YY1 receptors. Can J Physiol Pharm, 2000, 78(3): 256-259. |
| [13] | Sobhani I, Bado A, Vissuzaine C, et al. Leptin secretion and leptin receptor in the human stomach. Gut, 2000, 47(2): 178-183. |
| [14] | Jin K, Xue C, Wu X, et al. Why Does the Giant Panda Eat Bamboo? A comparative analysis of appetite-reward-related genes among mammals. PLoS ONE, 2011, 6(7): e22602. |
| [15] | Li R, Fan W, Tian G, et al. The sequence and de novo assembly of the giant panda genome. Nature, 2009, 463(7279): 311-317. |
| [16] |
Wang P, Cao Z, Chen MS, et al. Histological study of giant panda, Ailuropoda melanoleucaⅠ, the microstructure of digestive tract. Acta Sci Nat Univ Pekinensis, 1983(5): 67-78 (in Chinese). 王平, 曹焯, 陈茂生, 等. 大熊猫 (Ailuropoda melanoleuca) 的组织学研究-Ⅰ消化道的显微结构. 北京大学学报: 自然科学版, 1983(5): 67-78. |
| [17] |
Wang P, Chen MS. Histological study of giant panda (Ailuropoda melanoleuca) Ⅲ, the digestive tract of different age groups. Acta Zool Sin, 1989, 35(1): 33-40 (in Chinese). 王平, 陈茂生. 大熊猫的组织学研究 Ⅲ. 消化道显微结构的年龄变化. 动物学报, 1989, 35(1): 33-40. |
| [18] | Jin L, Zhang S, Burguera BG, et al. Leptin and leptin receptor expression in rat and mouse pituitary cells. Endocr, 2000, 141(1): 333-339. |
| [19] | Mix H, Widjaja A, Jandl O, et al. Expression of leptin and leptin receptor isoforms in the human stomach. Gut, 2000, 47(4): 481-486. |
| [20] | Barrenetxe J, Villaro AC, Guembe L, et al. Distribution of the long leptin receptor isoform in brush border, basolateral membrane, and cytoplasm of enterocytes. Gut, 2002, 50(6): 797-802. |
| [21] | Siegmund B, Sennello JA, Jones-Carson J, et al. Leptin receptor expression on T lymphocytes modulates chronic intestinal inflammation in mice. Gut, 2004, 53(7): 965-972. |
| [22] | Papathanassoglou E, El-Haschimi K, Li XC, et al. Leptin receptor expression and signaling in lymphocytes: kinetics during lymphocyte activation, role in lymphocyte survival, and response to high fat diet in mice. J Immunol, 2006, 76(12): 7745-7752. |
| [23] | Wrann CD, Ehmer U, Lautenbach A, et al. Obesity and NK cells affect the expression of the long form of the leptin receptor Ob-Rb in liver of F344 rats. Exp Toxicol Pathol, 2010, 62(1): 1-8. |
| [24] | Koch TR, Roddy DR, Carney JA, et al. Distribution, quantitation, and origin of immunoreactive neuropeptide Y in the human gastrointestinal tract. Regul Peptides, 1988, 21(3): 309-319. |
| [25] | Holzer-Petsche U, Petritsch W, Hinterleitner T, et al. Effect of neuropeptide Y on jejunal water and ion transport in humans. Gastroenterology, 1991, 101(2): 325-330. |
| [26] |
Jia YS, Pan CH, Wu RW, et al. Distribution of NPY immunoreact ive nerves in the jejunum of rat. Acta Univ Medi Anhui, 1997, 32(1): 1-3 (in Chinese). 贾友苏, 潘朝宠, 吴瑞炜, 等. 大鼠空肠神经肽 Y 免疫反应性神经的分布. 安徽医科大学学报, 1997, 32(1): 1-3. |
| [27] |
Weng YZ, Fang YQ. Distribution and morphology of neuropeptide Y and β-endorphin endocrine cells in the gut of grey mulet, Mugil cephalus L. Acta Hydrobiol Sin, 2003, 27(6): 619-624 (in Chinese). 翁幼竹, 方永强. 神经肽Y和β-内啡肽内分泌细胞在鲻鱼肠道中的分布和形态. 水生生物学报, 2003, 27(6 ): 619-624. |
| [28] |
Liu ZG, Weng YZ, Song HX, et al. Location of 5 types of gastrointestinal hormone endocrine cells in digestive tract of juvenile Epinephelus coioides. J Fish Sci Chin, 2009, 16(2): 199-205 (in Chinese). 刘志刚, 翁幼竹, 宋海霞, 等. 5种胃肠激素样内分泌细胞在斜带石斑鱼稚鱼期消化道中的定位. 中国水产科学, 2009, 16(2): 199-205. |
 2015, Vol. 31
2015, Vol. 31




