服务
文章信息
- 冯凡, 许杨, 陶勇, 刘伟丰, 林白雪
- Feng Fan, Xu Yang, Tao Yong, Liu Weifeng, Lin Baixue
- 提高大肠杆菌通过MVA途径合成异戊二烯
- Improving isoprene production by engineered heterologous mevalonate pathway in Escherichia coli
- 生物工程学报, 2015, 31(7): 1073-1081
- Chin J Biotech, 2015, 31(7): 1073-1081
- 10.13345/j.cjb.150007
-
文章历史
- Received: January 7, 2015
- Accepted: March 3, 2015
2. 南昌大学中德联合研究院,江西 南昌 330047;
3. 中国科学院微生物研究所,北京 100101
2. Jiangxi-OAI Joint Research Institute, Nanchang University, Nanchang 330047, Jiangxi, China;
3. Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
异戊二烯 (2-甲基-l,3-丁二烯) 是合成橡胶的重要前体物质[1, 2, 3],每年异戊二烯产量的95%被用于合成橡胶。此外,异戊二烯还是萜类化合物的结构骨架[4, 5, 6, 7]。目前,异戊二烯主要是通过高温裂解石油气、化学合成和异戊烯脱氢法等化工手段获得,这样的生产方式能耗高、污染大、工艺复杂且生产效率低,而且随着石油等不可再生资源的枯竭,传统的异戊二烯生产方式将逐渐被淘汰。随着生物技术的不断发展,以工程菌为对象,解决能源问题的可行性越来越大[8, 9, 10]。
自然界中,某些植物可以合成并释放异戊二烯,而异戊二烯的合成前体物质异戊烯焦磷酸 (IPP) 和二甲基烯丙基焦磷酸酯 (DMAPP) 已知的合成途径有甲羟戊酸途径 (Mevalonate pathway,MVA pathway) 和2-C-甲基-D-赤藓糖醇-4-磷酸途径 (MEP pathway) 。随着合成生物学技术的不断发展,目前已有研究者在大肠杆菌及酵母底盘中成功合成了多种萜类化合物或前体[11, 12, 13, 14]。Keasling等[11, 12, 13]在大肠及酵母背景中通过代谢元件模块化构建及合成路径的调控进行青蒿二烯合成的研究已经成为萜类生产研究的典范。
本实验室将MVA途径分成3个代谢元件模块 (图1),然后将其构建到大肠杆菌中,使大肠杆菌生成异戊二烯,但细菌自身对于外源的MVA途径缺乏调控能力。陶勇等提出了蛋白质预算理论 (Protein budget)[15],认为单个细胞在特定生理条件下能表达的蛋白质总量是相对恒定的,细胞内不同蛋白质之间的表达存在一定的比例。为了提高异戊二烯的产量,本研究基于合成生物学“元件-模块-系统”的理念[15],通过调控元件的表达能力来提高模块的功能,进而使整个系统达到最优状态。已有研究表明,在合成生物学中通过强启动子、采用高拷贝复制起始位点质粒作为载体往往不能使各模块的功能达到最优状态[9, 16]。在整个系统里往往一个蛋白质的过表达会破坏细胞内蛋白质间的相互平衡[17, 18],为了使我们搭建的系统能良好地运作,在本研究中我们通过在上游元件内增加稀有密码子和基因拷贝数、改变下游元件拷贝数来改变单个元件的表达能力,从而使整个模块的功能得到优化,最终使整套系统的异戊二烯产量得到提高。
|
| 图1 MVA 途径模块示意图 Fig.1 Mevalonate pathway functional modules. |
克隆宿主菌Escherichia coli DH5α和表达宿主菌E. coli BW25113 为本实验室保存;带有MVA途径酶编码基因的质粒 (表1)。前期的工作已经构建好了一株3质粒体系的菌株,在E. coli BW25113宿主菌中含有pYESs、pSPMIc、pBAD-S 3个质粒,成功地将外源MVA代谢途径引入到大肠杆菌中并实现了表达。pYESs质粒含有乙酰辅酶A酰基转移酶/HMG-CoA合成酶 (MvaE)、甲羟戊酸合酶 (Mvas) 两个酶的编码基因;pSPMIc质粒含有甲羟戊酸激酶 (MVK)、磷酸甲羟戊酸激酶 (PMK)、二磷酸甲羟戊酸脱羧酶(MVD)、异戊烯焦磷酸异构酶 (Idi) 4个酶的编码基因;pBAD-S质粒含有异戊二烯合成酶 (Isps)。
| Description | Reference | |
| Strains | ||
| E. coli BW25113 | ∆(araD-araB)567∆lacZ4787(::rrnB-3), lambda-, rph-1, ∆(rhaD-rhaB)568, hsdR514 | This lab |
| E. coli DH5α | F-, φ80dlacZ△M15 | This lab |
| Plasmids | ||
| pBAD-S | pBR32, Carbr, ParaBAD, Isps | This lab |
| pYBIS-GFP | p15A, Strpr, ParaBAD, GFP | This lab |
| pSBIC-GFP | pSC101, CMr, ParaBAD, GFP | This lab |
| pABIA-GFP | colA, Carbr, ParaBAD, GFP | This lab |
| pUBIA-GFP | colE1, Carbr, ParaBAD, GFP | This lab |
| pDBIA-GFP | cloDF13, Carbr, ParaBAD, GFP | This lab |
| pRBIA-GFP | RSF1020, Carbr, ParaBAD, GFP | This lab |
| pYESs | p15A, Strpr, ParaBAD, MvaE-Mvas | This lab |
| pYE1Ss | p15A, Strpr, ParaBAD, *MvaE-Mvas | This study |
| pYESKs | p15A, Strpr, ParaBAD, MvaE-Mvas-MVK | This study |
| pSKPMIc | pSC101, CMr, ParaBAD, MVK-PMK-MVD-Idi | This lab |
| pASa | colA, Carbr, ParaBAD, Isps | This study |
| pUSa | colE1, Carbr, ParaBAD, Isps | This study |
| pDSa | cloDF13, Carbr, ParaBAD, Isps | This study |
| pRSa | RSF1020, Carbr, ParaBAD, Isps | This study |
| Replicon | Copy number |
| pBR32 | 15-20 |
| pSC101 | ~5 |
| colE1 | 15−20 |
| cloDF13 | 10−90 |
| colA | 20−40 |
| p15A | 18−22 |
| RSF1020 | 10−60 |
GC 气相色谱分析仪 (Agilent公司);凝胶成像系统 (美国BIO-RAD公司);Mulotifuge X1R 高速冷冻离心机 (美国Thermo公司);SDS-PAGE 电泳仪 (美国BIO-RAD公司);Taq DNA聚合酶、限制性内切酶(NcoⅠ、XhoⅠ等) 购自NEB公司;质粒提取试剂盒、普通 PCR 产物回收试剂盒、胶回收试剂盒购自Omega公司;其他试剂为国产分析纯。
1.1.3 培养基与溶液LB液体培养基:1%蛋白胨,0.5%酵母提取物,1% NaCl。
固体培养基为上述成分再加入1.5%的琼脂粉。
ZY培养基:1%蛋白胨,0.5%酵母提取物。
M9培养基 (g/L):Na2HPO46,KH2P04 3,NH4Cl l,NaCl 0.5,MgSO4 0.12。
1 000×微量元素:50 mmol/L FeCl3,20 mmol/L CaCl2,10 mmol/L MnCl2,10 mmol/L ZnSO4,CoCl2、NiCl2、Na2MO4、Na2SeO3、H3BO3 各 2 mmol/L。
50×5052: 25%甘油,2.5%葡萄糖,10%阿拉伯糖。
50×M溶液:1.25 mol/L Na2HPO4,1.25 mol/L KH2PO4,2.5 mol/L NH4Cl,0.25 mol/L Na2SO4。
1 mol/L MgSO4:称取24.6 g MgSO4•7H2O加ddH2O溶解,定容至100 mL,高压灭菌。
自诱导培养基[19]ZYM-5052:在100 mL ZY 培养基中加入 2 mL 50×M溶液,2 mL 50× 5052,1 mL 1 mol/L MgSO4,100 μL 1 000×微量元素。
1.2 方法 1.2.1 PCR获得目的基因片段以质粒pBAD-S为模板,Is-F和Is-R为引物;pYESs为模板E1-F和Ms-R为引物;pSKPMIc为模板,MK-F和MK-R为引物 (表3)。PCR条件:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃ 5 min。加入DpnⅠ酶消化模板,消化后产物回收。
| Primer name | Primers sequence (5'−3') | Restriction enzyme cutting site |
| Is-F | CGCCTCGAGTTTCTACCGAGAACGTGAGC | XhoⅠ |
| Is-R | ACCGAGCTCTCAACGCTCGAATGGCAGGA | SacⅠ |
| E1-F | CGCCTCGAGATGAGGAGGAAAACCGTTGT | XhoⅠ |
| Ms-R | ACCGAGCTCTTAGTTGCGGTAAGAGCGAA | SacⅠ |
| MK-F | ACCGAGCTCTCATCACAGCAGCGGCCTGA | SacⅠ |
| M K-R | AGTCCATGGTAAATTCGTGTTTCCTGGCA | NcoⅠ | The bold sequences are the rare codons. Restriction sites are underlined. |
PCR得到的产物和载体,用相应的限制性内切酶处理,按表1中描述,将相应基因连接到不同拷贝数的载体 (表2) 再转化到E. coli DH5α感受态细胞中,在对应的抗性平板上挑取阳性克隆鉴定,并送上海生工生物工程技术服务有限公司测序。
1.2.3 不同重组菌的构建按表4描述,将各部分表达载体转化到 E. coli BW25113宿主菌中,在Carbr、CMr、Strpr三抗平板上挑取阳性克隆。
| Strain | Plasmids | Reference |
| BW-01 | pYESs, pSKPMIc, pBAD-S | This lab |
| BW-02 | pYE1Ss, pSKPMIc, pBAD-S | This study |
| BW-03 | pYESKs, pSKPMIc, pBAD-S | This study |
| BW-04 | pYESKs, pSKPMIc, pASa | This study |
| BW-05 | pYESKs, pSKPMIc, pUSa | This study |
| BW-06 | pYESKs, pSKPMIc, pDSa | This study |
| BW-07 | pYESKs, pSKPMIc, pRSa | This study |
从新鲜的平板 (Carbr、CMr、Strpr三抗) 挑取单克隆,接种于5 mL含有对应抗性的LB液体培养基中,37 ℃、250 r/min 振荡培养12 h。然后按1%接种量转接到50 mL自诱导培养基 (含Carbr、CMr、Strpr三抗),37 ℃、250 r/min 诱导16 h,然后进行SDS-PAGE分析。
1.2.5 重组菌的生物转化及产物测定经过诱导的菌液4 ℃、4 000 r/min离心收集菌体。用M9培养基 (含4%葡萄糖) 重悬,使其OD600=60。取1 mL加入顶空瓶密封进行生物转化,然后行气相色谱检测,以异戊二烯标准品作为定量标准。系统采用Agilent Techbologies 7890A GC System型气相色谱仪,色谱柱为HP-55% phenyl methyl siloxan色谱柱(30 m× 320 μm×0.25 μm),检测器为火焰离子化检测器;气化室温度50 ℃,柱箱温度240 ℃,检测器温度280 ℃。
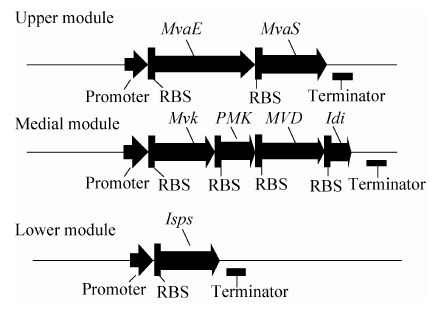
2 结果与分析 2.1 MVA 途径上游编码酶基因载体的优化实验室已经构建好BW-01产气菌株为了降低MvaE基因的表达量,使整个系统更平衡,根据文献报道的精氨酸密码子AGA/AGG会降低外源蛋白质的表达水平[20],设计了引物 (表3) PCR得到带有2个AGG稀有密码子的MvaE-Mvas基因片段 (约2 400 bp);MVK基因片段 (约1 100 bp),图2为PCR产物鉴定。测序结果也表明,片段的序列与实验室保存的序列一致。

|
| 图2 MvaE-Mvas、MVK、Isps 3 个基因片段PCR产物鉴定 Fig.2 PCR analysis of MvaE-Mvas,MVK and Isps gene fragments. M: GeneRuler 1 kb DNA ladder; 1: MvaE-Mvas gene PCR products; 2,3: Isps gene PCR products; 4,5: MVK gene PCR products. |
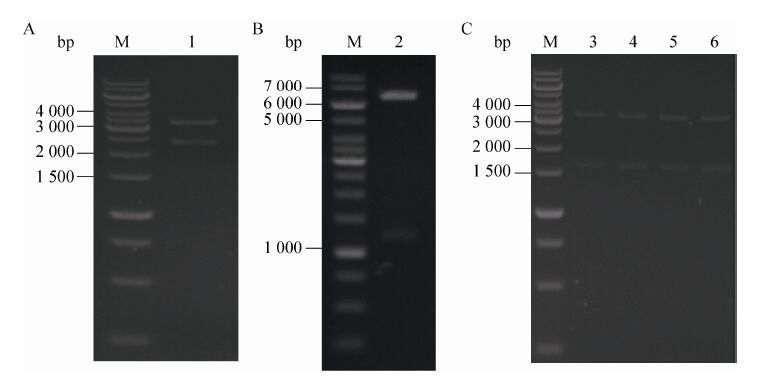
增加了稀有密码子的MvaE-Mvas片段用XhoⅠ和SacⅠ双酶切后分别连接到载体 pYBIS。如图3A所示,重组质粒再用XhoⅠ和SacⅠ双酶切后产生3 400 bp大小的载体和 2 400 bp的目的条带,表明表达载体构建成功,命名为pYE1Ss。将MVK基因片段和质粒pYESs用SacⅠ和NcoⅠ双酶切后连接。如图3B所示,重组质粒再用SacⅠ和NcoⅠ双酶切后,产生 6 500 bp大小的载体和约1 100 bp的目的条带,表明表达载体构建成功,命名为pYESKs。
|
| 图3 重组质粒pYE1Ss(A)、pYESKs(B)、pASa(C)、pUSa(C)、pDSa(C)、pRSa(C)的酶切验证 Fig.3 The enzymatic digestion of pYE1Ss(A),pYESKs(B),pASa(C),pUSa(C),pDSa(C) and pRSa(C). M: GeneRuler 1 kb DNA ladder; 1: pYE1Ss digested with XhoⅠand SacⅠ; 2: pYESKs digested with SacⅠand NcoⅠ; 3: pASa digested with XhoⅠand SacⅠ; 4: pUSa digested with XhoⅠand SacⅠ; 5: pDSa digested with XhoⅠand SacⅠ; 6: pRSa digested with XhoⅠand SacⅠ. |
用模板pBAD-S质粒和引物 (表3) PCR获得我们需要的Isps基因片段 (约1 700 bp,图2);将Isps基因片段用XhoⅠ和SacⅠ双酶切后,分别连接到不同复制起始位点的载体pABIA、 pUBIA、pDBIA、pRBIA。如图3C所示,重组质粒再用XhoⅠ和SacⅠ双酶切后,产生3 300 bp大小的载体和1 700 bp的目的条带,表明表达载体构建成功,分别命名为pASa、pUSa、pDSa、pRSa。
2.3 重组产气菌株的诱导表达将优化了上游表达载体的重组产气菌株诱导表达16 h,SDS-PAGE分析结果显示 (图4A),增加了稀有密码子后BW-02菌中MvaE (93.2 kDa) 的表达量明显比对照组的BW-01菌减少。在单个质粒pYESs上又增加关键限速酶编码基因MVK (48.6 kDa) 的BW-03菌株在蛋白表达上和对照组的BW-01菌无明显差异。

|
| 图4 不同上游载体 (A) 和不同下游载体菌 (B) 诱导表达的SDS-PAGE全菌图 Fig.4 SDS-PAGE analysis of cells of different upstream vectors (A) and different downstream vectors (B). M: PageRuler unstained protein ladder; 1,4: BW-01 total cell protein; 2: BW-02 total cell protein; 3: BW-03 total cell protein; 5: BW-04 total cell protein; 6: BW-05 total cell protein; 7: BW-06 total cell protein; 8: BW-07 total cell protein. |
将优化了Isps酶编码基因载体的重组产气菌株诱导表达16 h,SDS-PAGE分析结果显示 (图4B),改变Isps酶编码基因 (60 kDa) 载体的拷贝数,其蛋白表达未有明显差异,但从图上可以看到不同拷贝数的Isps载体,对MvaE (93.2 kDa) 的蛋白表达产生微弱的影响。
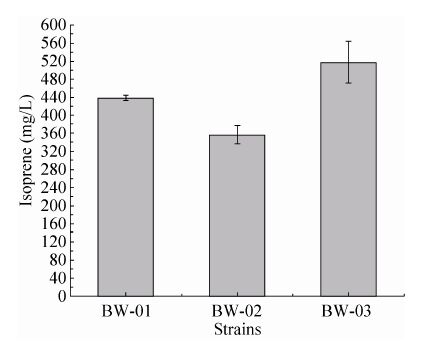
2.4 重组产气菌的生物转化及产物测定采用摇瓶实验,自诱导培养基诱导重组产气菌蛋白表达,16 h后收集菌体,用M9培养基 (含4%葡萄糖) 重悬,取1 mL加入顶空瓶密封进行生物转化,然后直接用气相测谱检测异戊二烯产量,以标准品异戊二烯为定量标准。优化上游基因载体 (图5),增加稀有密码子后,MvaE的表达量明显下降,同时也使异戊二烯产量下降;上游载体上增加了限速酶MVK基因,SDS-PAGE分析结果显示,MVK基因自身的表达量未有明显提高,但异戊二烯的产量提高,BW-03菌株的产量达到517.3 mg/L。
|
| 图5 转入不同上游表达载体后菌株的异戊二烯产量 Fig.5 The production of isoprene with recombinant bacteria harboring different upstream vectors. |
改变Isps酶编码基因载体 (图6),由于不同载体的复制起始位点不同,导致载体在菌体内的拷贝数有区别,诱导表达后,Isps酶的表达量未有明显差异,但对MvaE (93.2 kDa) 的蛋白表达产生微弱的影响。通过检测发现,pRBIA质粒作为Isps酶编码基因载体使异戊二烯产量明显高于其他载体菌株,BW-07菌株的产量达到761.1 mg/L。

|
| 图6 转入不同下游表达载体后菌株的异戊二烯产量 Fig.6 The production of isoprene with recombinant bacteria harboring different downstream vectors. |
本研究基于合成生物学的理念,采用合成生物学手段对原有的异戊二烯产气菌株进行改造,成功地提高了异戊二烯的产量,达到761.1 mg/L。
异戊二烯的生物合成其代谢途径和调控机制复杂,将外源MVA代谢途径的编码酶基因整个构建在大肠杆菌中并实现了异源表达,但由于所需的编码酶基因多,只有一个载体的表达系统很难将整个代谢通路完全构建成功,需要使用多个重组质粒搭建一套完整的代谢途径,这其中就涉及到多个表达模块在细胞内的调控。本实验开始构建的菌株BW-01诱导表达后Isps和MvaE基因编码的蛋白质都有明显的过表达,基于蛋白质预算理论认为在合成生物学的研究中,模块间不同的重组蛋白表达处于相对的平衡状态时,才能使模块的功能以及模块间或模块与宿主细胞间的适配性达到最佳状态。针对本研究中的问题,我们采用增加稀有密码子、改变载体拷贝数和增加关键限速酶编码基因在载体上的拷贝数的方式来影响目的蛋白在大肠杆菌中的表达量。实验结果显示,增加稀有密码子后MvaE基因表达量有明显下降,但伴随的是Isps基因编码蛋白质的更多表达,这样并没有使整个系统内蛋白质的表达处于相对平衡状态,异戊二烯的产量反而下降。增加了MVK基因在载体上的拷贝,由于共用一个启动子,且在翻译阅读顺序上靠后,因此在蛋白质表达上未见明显变化,但是异戊二烯的产量却有了提高,推测是由于这一个表达基因的增加从而使细胞内的蛋白质又进行了一次平衡,增加了整个系统的适配性。改变Isps基因载体的拷贝数,我们选取的都是中低拷贝的载体,其在细胞内的理论拷贝数存在差异但都较接近,结果显示拷贝数的改变不只对Isps基因编码蛋白质表达有一定的影响,也使MvaE 基因的蛋白质表达发生了改变,从而导致异戊二烯产量有了不同程度的提高。
蛋白质的表达受到多种因素的影响,要实现定量精确调控还很困难,本研究中我们针对整个系统中某一个蛋白质表达水平进行微调控,最后却改变了整个系统内不同蛋白质的相对表达量。针对外源引入的这套代谢途径在大肠杆菌中生产我们需要的目的产物,传统的蛋白质重组表达系统理念,单纯增加或减少某个蛋白的表达来达到提高产量的思路是不可行的,我们并非追求获得某个蛋白的高效表达,而是为了找到一个最优的组合,使产物积累量得到提升。
本研究在蛋白质预算理论的指导下,对实验室前期得到的工程菌做了优化,找到了一个较好的模块组合,使新得到的工程菌的异戊二烯产量较原有菌株提升了73%。这也印证了蛋白质预算理论的正确性,为今后进一步的研究提供了重要参考。
| [1] | Willot M, Christmann M. Total synthesis: towards artificial terpene cyclases. Nat Chem, 2010, 2(7): 519-520. |
| [2] | Kirby J, Keasling JD. Biosynthesis of plant isoprenoids: perspectives for microbial engineering. Annu Rev Plant Biol, 2009, 60: 335-355. |
| [3] | Kim SW, Keasling JD. Metabolic engineering of the nonmevalonate isopentenyl diphosphate synthesis pathway in Escherichia coli enhances lycopene production. Biotechnol Bioeng, 2001, 72(4): 408-415. |
| [4] | Bouvier F, Rahier A, Camara B. Biogenesis, molecular regulation and function of plant isoprenoids. Prog Lipid Res, 2005, 44(6): 357-429. |
| [5] | Ajikumar PK, Tyo K, Carlsen S, et al. Terpenoids: opportunities for biosynthesis of natural product drugs using engineered microorganisms. Mol Pharm, 2008, 5(2): 167-190. |
| [6] | Chang MC, Keasling JD. Production of isoprenoid pharmaceuticals by engineered microbes. Nat Chem Biol, 2006, 2(12): 674-681. |
| [7] | Liu D, Du J, Zhao GR, et al. Applications of synthetic biology in medicine and energy. CIESC J, 2011, 62(9): 2391-2397. |
| [8] | Rohmer M. The discovery of a mevalonate-independent pathway for isoprenoid biosynthesis in bacteria, algae, and higher plants. Nat Prod Rep, 1999, 16(5): 565-574. |
| [9] | Anthony JR, Anthony LC, Nowroozi F, et al. Optimization of the mevalonate-based isoprenoid biosynthetic pathway in Escherichia coli for production of the anti-malarial drug precursor amorpha-4,11-diene. Metab Eng, 2009, 11(1): 13-19. |
| [10] | Chen AR, Ruddock PL, Lamm AS, et al. Stemodane and stemarane diterpenoid hydroxylation by Mucor plumbeus and Whetzelinia sclerotiorum. Phytochemistry, 2005, 66(16): 1898-1902. |
| [11] | Ro DK, Paradise EM, Ouellet M, et al. Production of the antimalarial drug precursor artemisinie acid in engineered yeast. Nature, 2006, 440(7086): 940-943. |
| [12] | Huang Q, Roessner CA, Croteau R, et al. Engineering Escherichia coli for the synthesis of taxadiene, a key intermediate in the biosynthesis of taxol. Bioorg Med Chem, 2001, 9(9): 2237-2242. |
| [13] | Newman JD, Marshall J, Chang M, et al. High level production of amorpha-4,11-diene in a two-phase partitioning bioreactor of metabolically engineered Escherichia coli. Biotechnol Bioeng, 2006, 95(4): 684-691. |
| [14] | Dai ZB, Liu Y, Huang LQ, et al. Production of miltiradiene by metabolically engineered Saccharomyces cerevisiae. Biotechnol Bioeng, 2012, 109(11): 2845-2853. |
| [15] |
Liu WF, Tao Y. Protein budget: cost estimating criteria for synthetic biology. Chin J Biotech, 2013, 29(8): 1123-1132 (in Chinese). 刘伟丰, 陶勇. 蛋白质预算: 合成生物学的成本标尺. 生物工程学报, 2013, 29(8): 1123-1132. |
| [16] | Jones KL, Kim SW, Keasling JD. Low-copy plasmids can perform as well as or better than high-copy plasmids for metabolic engineering of bacteria. Metab Eng, 2000, 2(4): 328-338. |
| [17] | Malakar P, Venkatesh KV. Effect of substrate and IPTG concentrations on the burden to growth of Escherichia coli on glycerol due to the expression of Lac proteins. Appl Microbiol Biotechnol, 2012, 93(6): 2543-2549. |
| [18] | Glick BR. Metabolic load and heterologous gene expression. Biotechnol Adv, 1995, 13(2): 247-261. |
| [19] | Studier FW. Protein production by auto-induction in high-density shaking cultures. Protein Expr Purif, 2005, 41(1): 207-234. |
| [20] | Gurvich OL, Baranov PV, Gesteland RF, et al. Expression levels influence ribosomal frameshifting at the tandem rare arginine codons AGG_AGG and AGA_AGA in Escherichia coli. J Bacteriol, 2005, 187(12): 4023-4032. |
 2015, Vol. 31
2015, Vol. 31




