服务
文章信息
- 孙启星, 陈旭升, 任喜东, 郑根成, 毛忠贵
- Sun Qixing, Chen Xusheng, Ren Xidong, Zheng Gencheng, Mao Zhonggui
- 基于pH调节和有机氮源流加调控补料分批发酵过程提高ε-聚赖氨酸产量
- Enhanced ε-poly-L-lysine production through pH regulation and organic nitrogen addition in fed-batch fermentation
- 生物工程学报, 2015, 31(5): 752-756
- Chin J Biotech, 2015, 31(5): 752-756
- 10.13345/j.cjb.140453
-
文章历史
- Received: September 16, 2014
- Accepted: November 26, 2014
ε-聚赖氨酸 (ε-poly-L-lysine,ε-PL) 是由25-35个L-赖氨酸单体通过聚合酶催化α-COOH和ε-NH2缩合而成的一种同型氨基酸聚合物。ε-PL作为一种安全而高效的生物防腐剂被广泛应用于日本、韩国和欧美等国家和地区的食品工业[1, 2];我国也于2014年4月批准其作为食品防腐剂在淀粉制品、肉制品和果蔬制品等食品中的使用[3]。另外,它还可以用作生物可降解材料、乳化剂、高吸收性水凝胶、药物载体、抗癌增进剂和生物芯片外被等。因此,ε-PL有着广泛的应用前景和巨大市场价值[4]。
当前,补料分批发酵是生产ε-PL的主要方式。Kahar等利用Streptomyces albulus S410 (小白链霉菌S410) 借助pH控制和葡萄糖流加策略,实现192 h ε-PL发酵产量达到48.3 g/L,这是目前报道的最高发酵水平[5]。采用上述同样发酵控制策略,Shih和Shen利用S. albulus IFO 14147经过10 d连续发酵,ε-PL产量仅达到5.2 g/L[6];Jia等利用S. albulus TUST2经过120 h补料分批发酵,实现ε-PL产量达到20.2 g/L[7]。Liu等[8]在上述工艺控制基础上,借助原位分离与发酵耦合技术,利用Streptomyces sp. GIM8实现192 h ε-PL产量达到23.4 g/L。为了提高链霉菌生产ε-PL能力,本实验室前期建立了一种基于甘油作为碳源的新型两阶段pH控制工艺,实现173 h ε-PL产量达到30.11 g/L[9, 10]。然而,在实验过程中发现,当补料分批发酵进行到中后期,ε-PL产率会逐渐下降。为了进一步提高ε-PL产量,本文拟利用pH调节和流加有机氮源(酵母粉) 的方法来提高ε-PL产率,达到提高ε-PL产量的目的;并初步分析两种策略提高ε-PL产量的潜在原因。
1 材料与方法 1.1 菌株和培养基Streptomyces sp. M-Z18为本实验室从土壤中筛选,经多轮化学诱变筛选获得的一株ε-PL高产突变株。种子培养基和发酵培养基参照文献[10]。
1.2 培养方法种子培养方法参照文献[9]。
5 L发酵罐补料分批发酵:1) 典型ε-PL补料分批发酵过程参照文献[10]进行;2) 调节pH调控ε-PL补料分批发酵:在96 h将pH调至4.1维持21 h,然后使pH自然下降至发酵pH 3.8并维持至发酵结束,其他操作与典型ε-PL补料分批发酵保持一致;3) 流加酵母粉调控ε-PL补料分批发酵:从80 h开始以3.13 mL/h的速度流加酵母粉溶液 (150 g/L) 至发酵罐中,到144 h结束,其他操作与典型ε-PL补料分批发酵保持一致。
1.3 测定方法菌体干重 (DCW)、甘油和ε-PL含量测定均按文献[11]进行。
磷酸烯醇式丙酮酸羧化酶 (PEPC)、天冬氨酸激酶 (ASPK)、柠檬酸合成酶 (CS)、6-磷酸葡萄糖脱氢酶 (G6PDH) 酶活测定方法均按照文献[12]进行。
细胞活力测定使用Bacstain-CTC rapid staining kit,测定方法参照文献[13]进行。
2 结果与分析 2.1 不同策略调控ε-PL补料分批发酵过程参数分析 2.1.1 典型ε-PL补料分批发酵过程利用Streptomyces sp. M-Z18发酵生产ε-PL的典型补料分批发酵过程如图1A所示。从图中可以看出,菌体在20-110 h处于快速生长阶段,并伴随着ε-PL的快速积累;而当菌体生长进入平稳期 (110 h以后),ε-PL积累速率逐渐下降直至停止。图1D显示的是菌体在每24 h内积累ε-PL的产量,ε-PL产率在72-96 h达到最大7.05 g/(L·d);随后开始逐渐下降,到168-192 h ε-PL产率仅为1.52 g/(L·d),远低于ε-PL平均产率3.63 g/(L·d),最终ε-PL产量仅为29 g/L (图1A)。由此可以看出,ε-PL合成与菌体生长之间高度相关,这也验证了其他学者关于ε-PL合成和菌体生长相偶联的实验结论[14, 15]。图1A显示,在菌体生长进入平稳期以前约10 h,溶氧出现缓慢上升趋势并一直持续到发酵结束 (转速和通气量不变),这表明菌体利用发酵液中溶解氧的能力在缓慢下降,也说明菌体的活力在逐渐下降。那么,有何措施提高菌体活力,以保持菌体处于持续生长状态呢?

|
| 图1 不同调控策略补料分批发酵生产ε-PL的过程参数 Fig.1 ε-PL production in the fed-batch fermentation by Streptomyces sp. M-Z18 under different regulation strategies. (A) Typical ε-PL fed-batch fermentation process. (B) ε-PL fed-batch fermentation by pH shift. (C) ε-PL fed-batch fermentation by yeast extract addition. (D) ε-PL productivity in three fed-batch fermentations. DO: dissolved oxygen; DCW: dry cell weight. |
pH是调控ε-PL生产菌生长和ε-PL合成的关键因素:高pH (大于5.0) 有利于菌体生长,但ε-PL合成受到限制,甚至引起已积累的ε-PL分解;低pH (小于4.0) 有利于ε-PL的生物合成,但会限制菌体细胞的生长[5]。因此,当发酵过程中溶氧上升到一定程度 (30%),通过适当提高pH值 (pH 4.1) 并维持一段时间来促进菌体的继续生长;而当溶氧处于稳定下降趋势后,再将pH值下调至最佳发酵pH (pH 3.8) 以继续ε-PL的合成,实验结果如图1B所示。从图中可以看出,在发酵100 h将pH提高至4.1以后,溶氧不会立即停止上升趋势,这可能是因为菌体需要适应高pH环境的改变;直到110 h溶氧才开始稳定下降;在120 h时将pH自然下调至pH 3.8,此时溶氧继续快速下降并一直持续到150 h,这表明菌体恢复了之前的生长活力。从菌体生长也能看出,在将pH升高至4.1以及恢复3.8后菌体保持了较快的增长,一直持续到第2次溶氧上升。从ε-PL产量上来看,在溶氧上升之前 (85 h),ε-PL被快速积累;但当溶氧上升后,ε-PL产率明显下降。当pH升高至4.1以后,ε-PL合成停止;而当pH重新恢复3.8以后,ε-PL合成又伴随着菌体的快速生长而被加快。从图1D可以看出,发酵前96 h,ε-PL产率几乎和典型补料分批发酵过程保持一致。由于96-120 h进行了升高pH调控操作,ε-PL产率显著低于典型补料分批发酵方式。然而,从120 h以后,经pH调节的ε-PL产率远远高于典型补料分批发酵。最终,经过pH调控的补料分批发酵实现ε-PL产量达到36.95 g/L,较未调控发酵提高了27.4%。
2.1.3 流加酵母粉调控ε-PL补料分批发酵过程有机氮源是菌体生长的速效氮源,能显著促进菌体的生长[16]。因此,在发酵过程溶氧上升之前就开始流加酵母粉,以保持菌体的持续生长,实验结果如图1C所示。从图1C可以看出,80 h流加酵母粉之后,溶氧继续保持快速下降趋势,在120 h溶氧甚至维持在10%以下,在150 h之后才开始缓慢上升。菌体生长也在150 h之前保持着较快增长;与此同时,ε-PL产量在180 h之前均保持较快增加。由图1D可以看出,从96 h开始ε-PL产率明显高于典型补料分批发酵。最终,ε-PL产量达到41.32 g/L,平均产率达到5.16 g/(L·d),比典型补料分批发酵结果分别提高了42.48% 和42.15%。
2.2 不同策略调控ε-PL补料分批发酵过程的菌体活力变化借助CTC细胞活性染色方法,如图2A所示,发现典型补料分批发酵进行到120 h菌体的活性即明显下降,到144 h以后菌体细胞几乎完全丧失活性。然而,采用pH调控或流加酵母粉调控可以使得细胞活性延长到144 h (pH调控) 甚至168 h (流加酵母粉) 以后才开始下降。为了更具体地表征菌体细胞活力,将细胞荧光强度以灰度值 (Gray value) 来表示:灰度值越大,其荧光强度越强,表明细胞代谢活性越强;反之亦然。从图2B可以看出,典型补料分批发酵灰度值从72 h开始快速下降,说明随着发酵进行细胞活力在不断下降,并且在168 h灰度值降低到最低。pH调节和流加酵母粉策略使其灰度值在72 h到120 h之间稳定保持在较高水平,表明在此发酵期间细胞保持着较强的生理代谢活性;而从144 h开始,两种策略下菌体灰度值开始逐渐降低,但是灰度值仍远远高于典型补料分批发酵。值得注意的是,pH调节策略在96 h即实现细胞活力最大程度提升;而流加酵母粉策略在120 h才实现最高细胞活力恢复。由此可以看出,pH调节较有机氮源流加在恢复菌体活力方面响应更快。造成有机氮源流加响应慢的原因可能在于流加初期有机氮源中含有的关键生长因子浓度还未达到细胞需求量,只有累积到一定浓度才能使得细胞恢复快速代谢能力。然而,pH调节策略168 h时灰度值为40左右,流加有机氮源策略168 h时灰度值还维持在70以上。综上所述,pH调节策略能够快速恢复菌体活力,但维持细胞活力时间较流加有机氮源明显偏短。
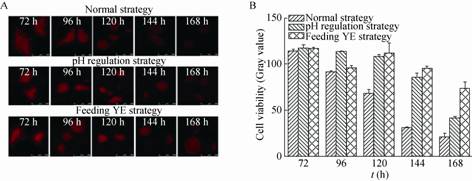
|
| 图2 不同策略调控ε-PL补料分批发酵过程细胞活力的变化 Fig.2 The change of cell viability of Streptomyces sp. M-Z18 in fed-batch fermentation under different regulation strategies. |
为进一步阐述pH调节和酵母粉流加对补料分批发酵过程ε-PL合成的影响,考察了3种条件下ε-PL合成初级代谢途径关键酶活性 (PEPC、CS、G6PDH和ASPK) 变化,实验结果如图3所示。典型补料分批发酵过程中4个关键酶活性均从72 h开始逐渐减小,说明细胞代谢活性和ε-PL产率降低并不是由于某个限制性酶引起的,而是由细胞整体活力降低导致。事实上,这一实验结果与图1D和图2的结论相一致,只不过关键酶活性比ε-PL产率和细胞染色活性提前下降了约24 h。在pH调节和流加酵母粉策略调控下,PEPC、CS和ASPK酶活都高于典型补料分批发酵,这样就为ε-PL的合成提供了大量的前体L-赖氨酸。同时,G6PDH酶活的增加会为细胞合成提供更多的碳骨架以用于细胞的生长。两种策略虽然都显著提高了关键酶活性,但作用机制可能不同。pH调节改变了菌体生长的低pH不利环境 (高pH有利于菌体生长);而流加酵母粉为细胞提供了关键生长因子,如维生素、氨基酸、核苷酸等,促进了细胞的二次生长。由于ε-PL合成与菌体生长之间高度相关,因此不管是调节pH还是流加酵母粉均显著促进了菌体的生长能力,进而提高了ε-PL产量。然而,流加酵母粉调控下的细胞中PEPC和CS酶活要高于pH调节策略,这样就使得柠檬酸循环的代谢流更大,能够为ε-PL合成提供更多的ATP和L-赖氨酸,最终流加酵母粉比pH调节使ε-PL产量提高11.8%。

|
| 图3 不同策略调控ε-PL补料分批发酵过程关键酶活性变化 Fig.3 The change of key enzymatic activity of Streptomyces sp. M-Z18 in fed-batch fermentation under different regulation strategies. |
针对补料分批发酵过程的中后期阶段ε-PL产率下降的问题,本研究提出了调节pH和流加酵母粉两种策略来改善细胞活性,以达到提高ε-PL产量的目的。利用上述两种策略分别实现ε-PL产量达到36.95 g/L和41.32 g/L,较未经调控补料分批发酵 (典型补料分批发酵) 分别提高了27.4%和42.5%。与此同时,利用CTC活细胞染色技术和关键酶活性监测方法发现:典型ε-PL补料分批发酵过程溶氧上升和ε-PL产率下降是由细胞自身活力和初级代谢途径关键酶活性下降引起的;两种调控方法是从提高菌体细胞活力和初级代谢途径关键酶活性角度达到促进ε-PL合成的效果。然而,是何原因引起细胞活力和关键酶活性下降仍需进一步研究。
| [1] | Shih IL, Shen MH, Van YT. Microbial synthesis of poly (ε-lysine) and its various applications. Bioresour Technol, 2006, 97(9): 1148-1159. |
| [2] | Yoshida T, Nagasawa T. ε-Poly-L-lysine: microbial production, biodegradation and application potential. Appl Microbiol Biotechnol, 2003, 62(1): 21-26. |
| [3] | 关于批准ε-聚赖氨酸等4种食品添加剂新品种等的公告[EB/OL]. [2014-09-10]. http://www.nhfpc.gov.cn/sps/s7890/201404/a93467d652c24a75a6de637abde31f30.shtml. |
| [4] | Yoshimitsu H, Kazuya Y. Amino-Acid Homopolymers Occurring in Nature. 3rd ed. New York: Springer-Verlag Berlin Heidelberg, 2010: 45-60. |
| [5] | Kahar P, Iwata T, Hiraki J, et al. Enhancement of ε-polylysine production by Streptomyces albulus strain 410 using pH control. J Biosci Bioeng, 2001, 91(2): 190-194. |
| [6] | Shih IL, Shen MH. Application of response surface methodology to optimize production of poly-ε-lysine by Streptomyces albulus IFO 14147. Enzyme Microb Technol, 2006, 39(1): 15-21. |
| [7] | Jia SR, Wang GL, Sun YF, et al. Improvement of ε-poly-L-lysine production by Streptomyces albulus TUST2 employing a feeding strategy//The 3rd International Conference on Bioinformatics and Biomedical Engineering., Beijing, China[C]. 2009: 1-4. doi: 10.1109/ICBBE.2009.5162940. |
| [8] | Liu SR, Wu Q, Zhang J, et al. Production of ε-poly-L-lysine by Streptomyces sp. using resin-based, in situ product removal. Biotechnol Lett, 2011, 33(8): 1581-1585. |
| [9] | Chen XS, Tang L, Mao ZG, et al. Optimization of medium for enhancement of ε-poly-L-lysine production by Streptomyces sp. M-Z18 with glycerol as carbon source. Bioresour Technol, 2011, 102(2): 1727-1732. |
| [10] | Chen XS, Li S, Liao LJ, et al. Production of ε-poly-L-lysine using a novel two-stage pH control strategy by Streptomyces sp. M-Z18 from glycerol. Bioprocess Biosyst Eng, 2011, 34(5): 561-567. |
| [11] | Chen XS, Ren XD, Dong N, et al. Culture medium containing glucose and glycerol as a mixed carbon source improves ε-poly-L-lysine production by Streptomyces sp. M-Z18. Bioprocess Biosyst Eng, 2012, 35(3): 469-475. |
| [12] | Li S, Chen XS, Dong C, et al. Combining genome shuffling and interspecific hybridization among Streptomyces improved ε-poly-L-lysine production. Appl Biochem Biotechnol, 2013, 169(1): 338-350. |
| [13] | Xu J, Chen YQ, Mao ZG, et al. Effect of acetic acid on citric acid fermentation in an integrated citric aicd-methane fermentation process. Appl Biochem Biotechnol, 2014, 174(1): 376-387. |
| [14] | Kahar P, Iwata T, Hiraki J, et al. Enhancement of ε-polylysine production by Streptomyces albulus strain 410 using pH control. J Biosci Bioeng, 2001, 91(2): 190-194. |
| [15] | Zhang Y, Feng X, Xu H, et al. ε-poly-L-lysine production by immobilized cells of Kitasatospora sp. MY 5-36 in repeated fed-batch cultures. Bioresour Technol, 2010, 101(14): 5523-5527. |
| [16] |
Li Y. Principles and Technology of Fermentation Engineering. Beijing: Higher Education Press, 2007: 50-53 (in Chinese). 李艳. 发酵工程原理与技术. 北京: 高等教育出版社, 2007: 50-53. |
 2015, Vol. 31
2015, Vol. 31




