服务
文章信息
- 陈伟, 朱荣, 葛春蕾, 陆源, 李利云, 李菲, 邬敏辰
- Chen Wei, Zhu Rong, Ge Chunlei, Lu Yuan, Li Liyun, Li Fei, Wu Minchen
- 人IL-29的定点突变及抗肿瘤活性初步分析
- Site-directed mutagenesis of human IL-29 and antineoplastic activity of the recombinant human IL-29 variant
- 生物工程学报, 2015, 31(5): 702-710
- Chin J Biotech, 2015, 31(5): 702-710
- 10.13345/j.cjb.140429
-
文章历史
- Received: August 29, 2014
- Accepted: November 15, 2014
2. 江南大学生物工程学院,江苏 无锡 214122;
3. 江南大学药学院,江苏 无锡 214122
2. School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China;
3. School of Pharmaceutical Science, Jiangnan University, Wuxi 214122, Jiangsu, China
人IL-29是2003年初发现的一种新的细胞因子[1, 2]。研究发现,IL-29和IL-28的靶细胞膜受体相同,是由IL-28R1和IL-10R2组成的异二聚体受体复合物,其中IL-28R1为结合亚基,对IL-29的细胞应答具有特异性,IL-10R2为辅助亚基,对IL-29的细胞应答无特异性[3]。而IL-29的胞内信号转导途径与Ⅰ型干扰素 (Interferon,IFN) 相同,通过激活Jak-STAT (Janus kinase-signal transducer of transcription) 信号通路而产生效应[4, 5, 6, 7],因此IL-29表现出与Ⅰ型IFN相似的生物学性质,如抗病毒、抗增殖、免疫调节、体内抗肿瘤等生物学活性[8, 9, 10, 11, 12]。由此,IL-29、IL-28A和IL-28B又被称为IFN-λ家族,它们分别称为IFN-λ1、IFN-λ2和IFN-λ3[13, 14]。
Gad等[3]研究发现,对IFN-λ3肽链中的 34 Arg、36 Lys和44 Leu等位点的氨基酸进行定点突变,可明显改变其抗病毒活性。本实验室郑海军等[15]应用生物信息学分析工具对人IL-29与IL-28B的三级结构进行分析比对,发现两者的受体结合区域的A、F螺旋中仅4个氨基酸残基不同,即IL-29/IL-28B肽链中的33 Lys/34 Arg、35 Arg/36 Lys、43 Lys/44 Leu和143 Ala/144 Pro,对这些氨基酸残基进行诱变可能影响IL-29与其受体结合的亲和力,进而改变IL-29的生物学活性。
基于上述研究发现和本实验室前期研究基础[16, 17],本文采用定点突变方法将IL-29成熟肽受体结合区域的33 Lys、35 Arg分别突变为33 Arg、35 Lys,从而改变其与受体结合的亲和力,以期获得抗肿瘤活性更高的IL-29变异体。
1 材料与方法 1.1 菌种、质粒和肿瘤细胞株大肠杆菌Escherichia coli JM109、毕赤酵母Pichia pastoris GS115由本实验室保存;质粒pUCm-T购自生工生物工程 (上海) 股份有限公司;质粒pPIC9KM购自Invitrogen公司;含hIL-29成熟肽基因的重组质粒pPIC9KM-hIL-29由本实验室构建[17];人肝癌细胞BEL7402、人结肠癌细胞HCT8及人胃癌细胞SGC7901由江南大学药学院金坚教授惠赠。
1.2 工具酶、培养基和生化试剂Taq plus DNA聚合酶、各种限制性内切酶、T4 DNA连接酶、DNA ladder marker、低分子量蛋白质marker、EZ-10柱式DNA回收试剂盒和硝酸纤维素膜 (NC膜) 均为BBI公司产品;胰蛋白胨、酵母提取物为英国OXOID公司产品;YPD、MD、BMGY、BMMY、DAB、SDS、G418和RPMI-1640培养基等均为生工生物工程 (上海) 股份有限公司产品,培养基的配制按Invitrogen公司操作手册;羊抗人IL-29多克隆抗体为美国R&D公司产品;HRP标记兔抗羊IgG为上海明睿公司产品;新生小牛血清为浙江天杭生物科技有限公司产品;胰酶细胞消化液、青霉素-链霉素溶液 (100×)、Cell Counting Kit-8试剂购自碧云天生物技术研究所;重组人干扰素α2b注射液为北京凯因科技股份有限公司产品;其余试剂均为国产分析纯。
1.3 定点突变根据NCBI公布的hIL-29的编码基因序列 (GenBank登录号:AY336716.1),结合生物信息学分析数据,设计1对PCR引物及1条突变引物,扩增产物为编码hIL-29成熟肽的cDNA,其碱基序列中第98位碱基T定点突变为C,第104位碱基C定点突变为T,引物序列见表1。
| Primer name | Primer sequence (5¢-3¢) |
| 5¢-Primer (hIL-29-F) | CTCGAGAAAAGAGGCCCTGTCCCCACTTCC |
| 3¢-Primer (hIL-29-R) | GCGGCCGCTCAGGTGGACTCAGGGTGG |
| Mutant primer (hIL-29-M) | TCCAATGCGTCCCTGGCCTTCTTGAAGCTCGCTA |
| The underlined sequences are the mutated sites. | |
hIL-29成熟肽基因的定点突变采用大引物PCR方法,以pPIC9KM-hIL-29质粒为模板、hIL-29-F和hIL-29-M为引物,进行第一轮PCR,反应条件:94 ℃预变性2 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃15 s,30个循环;最后72 ℃延伸10 min。再进行第二轮大引物PCR,以pPIC9KM-hIL-29质粒为模板、第一轮PCR产物和hIL-29-R为引物,反应条件:94 ℃ 2 min;94 ℃ 30 s,45 ℃ 30 s,72 ℃ 1 min,2个循环;94 ℃ 30 s,55 ℃ 30 s,72℃ 1 min,28个循环;最后72 ℃延伸10 min。PCR产物用EZ-10 Spin Column DNA Extraction Kit回收目的基因,按说明书操作。回收的目的基因与pUCm-T连接,转化JM109感受态细胞,经蓝白斑筛选阳性转化子,送上海生工生物工程技术服务有限公司测序鉴定。
1.4 重组毕赤酵母工程菌的构建与诱导表达pPIC9KM质粒和测序正确的重组质粒pUCm-T-hIL-29mut33,35同时用XhoⅠ和NotⅠ双酶切,回收酶切后的目的基因和pPIC9KM质粒,用T4 DNA连接酶于10 ℃连接过夜,连接产物转化JM109感受态细胞,提取质粒用PCR进行筛选,获得重组表达质粒pPIC9KM-hIL-29mut33,35,送上海生工生物工程技术服务有限公司测序鉴定。
经测序鉴定的pPIC9KM-hIL-29mut33,35用SalⅠ线性化,电转化毕赤酵母GS115,转化液涂布MD平板,挑选在MD平板上生长良好的菌落点种至含不同浓度G418的YPD平板,筛选出高拷贝整合的重组毕赤酵母,命名为hIL-29mut33,35/GS115,电转化及筛选按Invitrogen公司操作手册。提取工程菌株hIL-29mut33,35/GS115的基因组DNA,以通用引物5¢-AOX和3¢-AOX进行PCR,鉴定目的基因是否整合入GS115基因组内,重组工程菌的诱导表达按Invitrogen公司操作手册进行。
1.5 rhIL-29mut33,35的分离纯化及鉴定诱导表达的发酵液8 000 r/min离心10 min,收集上清液用超滤管 (截留相对分子量为10 kDa,Millipore公司) 超滤浓缩后,用柠檬酸-柠檬酸钠缓冲液 (10 mmol/L,pH 6.0) 透析,然后加至预先用上述缓冲液平衡的SP-Sepharose Fast Flow阳离子交换柱 (Φ 16 mm×200 mm),以同样缓冲液洗柱;以含NaCl的柠檬酸-柠檬酸钠缓冲液 (NaCl 浓度为0.2、0.4、0.6、0.8、1.0 mol/L,pH 6.0) 进行梯度洗脱,流速1.0 mL/min,收集各洗脱峰经SDS-PAGE分析,将含有rhIL-29mut33,35的洗脱液超滤浓缩后冷冻干燥。
rhIL-29mut33,35的活性用Western blotting鉴定,取少量纯化的重组蛋白冻干粉,以适量无菌超纯水溶解,经SDS-PAGE后将蛋白电转移至NC膜上,转移的NC膜用TBST缓冲液 (10 mmol/L Tris-HCl,15 mmol/L NaCl,0.05% 吐温-20,pH 7.2) 漂洗5次,用含10%健康兔血清的TBST缓冲液4 ℃封闭过夜,次日用TBST漂洗5次,加入羊抗人IL-29抗体 (1∶1 000) 37 ℃孵育2 h,TBST漂洗5次,加入HRP标记的兔抗羊IgG (1∶2 500) 37℃孵育1 h,TBST漂洗5次,用DAB试剂显色。
1.6 rhIL-29mut33,35的抗肿瘤活性分析将野生型rhIL-29、rhIL-29mut33,35、IFN-α2b (阳性对照) 分别设置50、500和1 000 ng/mL 3个剂量组,同时设置空白和阴性对照组 (肿瘤细胞自然生长组),每组设5个平行孔。
液氮冻存的BEL7402、HCT8和SGC7901细胞复苏后,用RPMI 1640完全培养液 (含10%小牛血清) 培养至对数生长期,经0.25%胰蛋白酶消化和RPMI 1640培养液洗涤后,用RPMI 1640完全培养液调整细胞浓度至1×108个/mL,接种96孔细胞培养板,100 μL/孔 (空白孔不接种),置37 ℃、5% CO2培养箱培养24 h后,吸去上清液;取上述样品用RPMI 1640完全培养液稀释,分别按剂量组每孔加入100 μL,空白和阴性对照组加入等体积的完全培养液,置37 ℃、5% CO2培养箱培养24 h后,每孔加入10 μL CCK-8试剂继续培养1 h,用酶标仪测定A450,计算各组样品对3株肿瘤细胞的增殖抑制率,结果用SPSS软件22.0进行单因素方差分析,检验水准α=0.05。
增值抑制率 (Inhibition ratio,IR)=(1-样品组A450值/阴性对照组A450值) ×100%。
2 结果与分析 2.1 hIL-29成熟肽基因的定点突变用大引物PCR方法对hIL-29基因进行定点突变,第一轮PCR产物经1%琼脂糖凝胶电泳分离,回收约130 bp的产物作为第二轮PCR的大引物,进行第二轮PCR,扩增产物经琼脂糖凝胶电泳结果显示,在约560 bp处有一条PCR产物条带 (图1,泳道1),其大小与预期相符。回收产物与pUCm-T连接的重组质粒pUCm-T-hIL-29mut33,35,经测序结果显示,基因大小为563 bp,编码181个氨基酸,将测定的hIL-29mut33,35序列与hIL-29的编码基因序列 (GenBank登录号:AY336716.1) 比对显示:第98位碱基T突变为C,三联体密码由CTT突变为CCT,编码产物由Lys突变为Arg;第104位碱基C突变为T,三联体密码由CCT突变为CTT,编码产物由Arg突变为Lys。将hIL-29mut33,35与pPIC9KM连接构建的重组表达质粒pPIC9KM-hIL-29mut33,35经测序鉴定,hIL-29mut33,35的序列与在pUCm-T-hIL-29mut33,35中的一致,且读码框完全正确。

|
| 图1 hIL-29mut33,35的PCR扩增 Fig.1 PCR amplification of hIL-29mut33,35.M: 250 bp DNA ladder marker; 1: product of second PCR amplified with primers hIL-29-R and the first PCR products; 2: empty. |
按1.4的方法,线性化的pPIC9KM- hIL-29mut33,35质粒电转化酵母GS115感受态细胞后,经G418筛选获得高拷贝的重组工程菌株hIL-29mut33,35/GS115。提取的工程菌株基因组DNA以通用引物5¢-AOX和3¢-AOX进行PCR鉴定的结果显示,PCR扩增产物为约2 200 bp和1 100 bp的DNA条带,约2 100 bp的产物为酵母GS115的AOX1基因,约1 100 bp的产物包括目的基因 (563 bp) 和pPIC9KM质粒上的5¢-AOX和3¢-AOX引物序列之间的片段 (500 bp),表明hIL-29mut33,35基因已成功整合入酵母GS115基因组中 (图2)。

|
| 图2 重组毕赤酵母hIL-29mut33,35/GS115的PCR鉴定 Fig.2 PCR detections of recombinant P. pastoris hIL-29mut33,35/GS115. M: 250 bp DNA ladder marker; 1: pPIC9KM/GS115; 2-3: hIL-29mut33,35/GS115. |
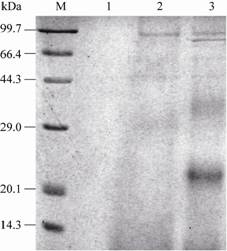
工程菌株hIL-29mut33,35/GS115用1.5%的甲醇诱导表达96 h的发酵上清液,经超滤和SP-Sepharose Fast Flow阳离子交换层析纯化的产物,经SDS-PAGE分析的图谱显示,在约23 kDa处有一明显目的蛋白条带 (图3,泳道3),而pPIC9KM/GS115的发酵液在该处无相同条带 (图3,泳道2)。经测定rhIL-29mut33,35的表观分子量高于理论计算的相对分子量 (约20 kDa),可能是rhIL-29mut33,35在酵母GS115表达过程中发生了糖基化修饰[18]所致。
|
| 图3 工程菌株hIL-29mut33,35/GS115发酵液的SDS-PAGE分析 Fig.3 SDS-PAGE analysis of expressed rhIL-29mut33,35. M: middle molecular weight protein marker; 1: empty; 2: pPIC9KM/GS115; 3: hIL-29mut33,35/GS115. |
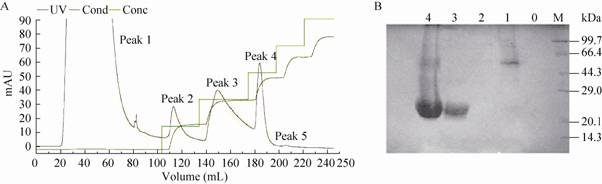
发酵上清的超滤浓缩液用SP-Sepharose Fast Flow层析纯化,收集的NaCl梯度洗脱液经SDS-PAGE分析显示,目的蛋白主要在0.4 mol/L和0.6 mol/L NaCl梯度被洗脱,而流穿峰和0.2 mol/L NaCl缓冲液洗脱的主要是色素和杂蛋白。从PAGE图谱分析,以0.4 mol/L NaCl缓冲液洗脱的目的蛋白纯度较高,而0.6 mol/L NaCl缓冲液的洗脱峰还含有少量杂蛋白 (图4)。如需获得纯度更高的目的蛋白,可将0.4 mol/L和0.6 mol/L NaCl的洗脱峰合并后,进一步用分子筛层析纯化。
|
| 图4 rhIL-29mut33,35的SP Sepharose Fast Flow层析纯化图谱与洗脱峰的SDS-PAGE分析 Fig.4 Chromatography patterns of the rhIL-29mut33,35 purified with SP Sepharose Fast Flow (A) and SDS-PAGE analysis of the eluted peats (B). (A) Peak 1: eluted with 0 mol/L NaCl buffer; Peak 2: eluted with 0.2 mol/L NaCl buffer; Peak 3: eluted with 0.4 mol/L NaCl buffer; Peak 4: eluted with 0.6 mol/L NaCl buffer; Peak 5: eluted with 0.8 mol/L NaCl buffer. B: SDS-PAGE analysis of the eluted peaks. (B) M: middle molecular weight protein marker; 0: empty; 1: eluted with 0 mol/L NaCl buffer; 2: eluted with 0.2 mol/L NaCl buffer; 3: eluted with 0.4 mol/L NaCl buffer; 4: eluted with 0.6 mol/L NaCl buffer. |
纯化的rhIL-29mut33,35经Western blotting分析结果显示,rhIL-29mut33,35与羊抗人IL-29抗体反应后,在NC膜上呈现特异性反应条带,其大小约为23 kDa (图5),与SDS-PAGE图谱的条带大小相同,但反应条带弥散,这可能是电泳转移过程中电极缓冲液温度升高和Western blotting的放大效应所致。

|
| 图5 rhIL-29mut33,35的Western blotting鉴定 Fig.5 Western blotting of the purified rhIL-29mut33,35. M: middle molecular weight protein marker; 0: empty; 1: the purified rhIL-29mut33,35. |
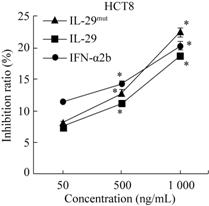
用CCK-8试剂检测rhIL-29mut33,35对肿瘤细胞BEL7402、HCT8和SGC7901的增殖抑制结果表明,各剂量组均显示增殖抑制效应,且细胞增殖抑制率随着rhIL-29mut33,35剂量的增加而增大,具有较明显的剂量-效应关系 (图6-8)。

|
| 图6 rhIL-29mut33,35对肝癌细胞BEL7402的增殖抑制效应 Fig.6 Anti-proliferative effect of rhIL-29mut33,35 on liver cancer cells BEL7402. *: P < 0.05,**: P < 0.01,compared with negative control. |
|
| 图7 rhIL-29mut33,35对结肠癌细胞HCT8的增殖抑制效应 Fig.7 Anti-proliferative effect of rhIL-29mut33,35 on colon cancer cells HCT8. *: P< 0.05,compared with negative control. |

|
| 图8 rhIL-29mut33,35对胃癌细胞SGC7901的增殖抑制效应 Fig.8 Anti-proliferative effect of rhIL-29mut33,35 on gastric cancer cells SGC7901. *: P < 0.05,**: P < 0.01,compared with negative control. |
单因素方差分析结果显示,rhIL-29mut33,35、野生型rhIL-29及商品化的IFN-α2b对3株肿瘤细胞的增殖均具有抑制效应,但对不同肿瘤细胞的增殖抑制率各有差异。rhIL-29mut33,35的低、中、高剂量组对肝癌细胞BEL7402增殖表现出明显的抑制作用 (图6),尤其高剂量组的抑制率达 (30.99±1.58)% (P<0.01)。对结肠癌细胞HCT8,仅高、中剂量组rhIL-29mut33,35的抑制作用比野生型rhIL-29的更强 (P < 0.05),低剂量组的抑制效应差异不大 (图7)。rhIL-29mut33,35的高剂量组对胃癌细胞SGC7901的抑制率达32.05 ± 2.02%,显著高于野生型rhIL-29的作用 (P < 0.01),提示变异体rhIL-29mut33,35可能对胃癌细胞SGC7901具有较好的增殖抑制效应 (图8)。
3 讨论自IL-29被发现以来,由于其具有与Ⅰ型干扰素相似的生物学活性而受到广泛的关注,国际上对IL-29的生物学功能与医药应用的相关研究日益深入。虽然IL-29与Ⅰ型IFN通过激活相同的 Jak-STAT信号通路而产生效应,但人体不同组织器官中IL-29受体 (IL-28R1) 的表达具有明显差异[19, 20]。本研究获得的变异体rhIL-29mut33,35对3株不同肿瘤细胞的增殖抑制效应不同,也可能与这些细胞表面IL-28R1的表达差异有关。IL-28R1在人体不同组织细胞表达的差异,使IL-29作用的靶细胞比Ⅰ型IFN的更局限。因此,IL-29作为潜在的新型干扰素类药物,其临床副作用可能比Ⅰ型IFN的更小[21]。
在抗病毒活性方面,国际上对IL-29的开发已进入临床应用研究,Ⅰ期临床试验发现,用聚乙二醇 (Polyethylene glycol,PEG) 对IL-29 (IFN-λ1) 进行修饰后,PEG-IFN-λ1的半衰期和稳定性均得到提高,同时最大限度地保留了IFN-λ1的生物学活性[22, 23]。目前,PEG-IFN-λ1已进入Ⅱ期临床试验,其临床适应症为丙型病毒性肝炎,给药剂量为80-240 μg,每周1次,以聚乙二醇化IFN-α2a (PEGASYS) 为对照。经4-12周临床应用显示PEG-IFN-λ1的疗效良好,与PEGASYS的效果基本相同,但不良反应更少,药物作用更温和,其他IFN常见的不良反应如肌痛、疲劳、恶心和头痛等的发生率有所下降[24, 25]。
本文采用定点突变方法对野生型hIL-29进行分子改造,获得的变异体rhIL-29mut33,35经初步分析,显示出较好的体外抗肿瘤细胞增殖活性,而且抗增殖作用要高于野生型rhIL-29的 (P<0.01),表明变异体rhIL-29mut33,35具有潜在的医药开发价值,为后续研制开发新的干扰素类抗肿瘤药物奠定了良好的基础。
| [1] | Sheppard P, Kindsvogel W, Xu W, et al. IL-28, IL-29 and their classⅡcytokine receptor IL-28R. Nature Immunol, 2003, 4(1): 63-68. |
| [2] | Kotenko SV, Gallagber G, Baurin W, et al. IFN-λs mediate antiviral protection through a distinct classⅡcytokine receptor complex. Nature Immunol, 2003, 4(1): 69-77. |
| [3] | Gad HH, Dellgren C, Hamming OJ, et al. Interferon-lambda is functionally an interferon but structurally related to the interleukin-10 family. J Biol Chem, 2009, 284(31): 20869-20875. |
| [4] | Onoguchi K, Yoneyama M, Takemura A, et al. Viral infections activate typesⅠand Ⅲ interferon genes through a common mechanism. J Biol Chem, 2007, 282(10): 7576-7581. |
| [5] | Zhou Z, Hamming OJ, Ank N, et al. Type Ⅲ interferon (IFN) induces a typeⅠIFN-like response in a restricted subset of cells through signaling pathways involving both the Jak-STAT pathway and the mitogen-activated protein kinases. J Virol, 2007, 81(14): 7749-7758. |
| [6] | Guenterberg KD, Grignol VP, Raig ET, et al. Interleukin-29 binds to melanoma cells inducing Jak-STAT signal transduction and apoptosis. Mol Cancer Ther, 2010, 9(2): 510-520. |
| [7] | Dumoutier L, Tounsi A, Michiels T, et al. Role of the interleukin (IL)-28 receptor tyrosine residues for antiviral and antiproliferative activity of IL-29/interferon-lambda 1: similarities with type I interferon signaling. J Biol Chem, 2004, 279(31): 32269-32274. |
| [8] | Witte K, Witte E, Sabat R, et al. IL-28A, IL-28B, and IL-29: promising cytokines with type I interferon-like properties. Cytokine Growth Factor Rev, 2010, 21(4): 237-251. |
| [9] | Doyle SE, Schreckhise H, Khuu-Duong K, et al. Interleukin-29 uses a typeⅠinterferon-like program to promote antiviral responses in human hepatocytes. Hepatology, 2006, 44(4): 896-906. |
| [10] | Dai J, Megjugorac NJ, Gallagher GE, et al. IFN-λ1 (IL-29) inhibits GATA3 expression and suppresses Th2 responses in human naive and memory T cells. Blood, 2009, 113(23): 5820–5838. |
| [11] | Mennechet FJ, Uze G. Interferon-lambda-treated dendritic cells specifically induce proliferation of FOXP3-expressing suppressor T cells. Blood, 2006, 107(11): 4417–4423. |
| [12] | Zitzmann K, Brand S, Baehs S, et al. Novel interferon-λs induce antiproliferative effects in neuroendocrine tumor cells. Biochem Biophys Res Commun, 2006, 344: 1334–1341. |
| [13] | Donnelly RP, Kotenko SV. Interferon-lambda: a new addition to an old family. J Interf Cytok Res, 2010, 30(8): 555-564. |
| [14] | Lopušná K, Režuchová I, Betakova T, et al. Interferons lambda, new cytokines with antiviral activity. Acta Virol, 2013, 57(2): 171-179. |
| [15] |
Zheng HJ, Zhu R, Ge CL, et al. Bioinformatics of human interleukin-29, Chin J Biologicals, 2013, 26(2): 209-212 (in Chinese). 郑海军, 朱荣, 葛春蕾, 等. 人白细胞介素-29的生物信息学分析. 中国生物制品学杂志, 2013, 26(2): 209-212. |
| [16] |
Chen W, Yu ML, Zheng HJ, et al. Cloning and eukaryotic expression of human interleukin-29 gene. Chin J Biologicals, 2012, 25(4): 446-448 (in Chinese). 陈伟, 于明磊, 郑海军, 等. 人白细胞介素-29 基因的克隆及真核表达. 中国生物制品学杂志, 2012, 25(4): 446-448. |
| [17] |
Zheng HJ, Lu Y, Chen W, et al. Optimization of condition for expression of native N-terminus of human interleukin-29 mature peptide in Pichia pastoris. Chin J Biologicals, 2013, 26(3): 402-405 (in Chinese). 郑海军, 陆源, 陈伟, 等. 天然N-末端人白细胞介素-29成熟肽在毕赤酵母中表达条件的优化. 中国生物制品学杂志, 2013, 26(3): 402-405. |
| [18] | Zachary JM, Eugenia M, Wei L, et al. Crystal structure of human inerferon-λ1 in complex with its high-affinity receptor interferon-λR1. Mol Bio, 2010, 404(4): 650-664. |
| [19] | Witte K, Gruetz G, Volk HD, et al. Despite IFN-lambda receptor expression, blood immune cells, but not keratinocytes or melanocytes, have an impaired response to type III interferons: implications for therapeutic applications of these cytokines. Genes Immun, 2009, 10(8): 702-714. |
| [20] | Li Q, Kawamura K, Ma G, et al. Interferon-lambda induces G1 phase arrest or apoptosis in oesophageal carcinoma cells and produces anti-tumour effects in combination with anti-cancer agents. Eur J Cancer, 2010, 46(1): 180-190. |
| [21] |
Zheng HJ, Chen W. Progress in research on human IL-29. Chin J Biologicals, 2012, 25(1): 118-122 (in Chinese). 郑海军, 陈伟. 人白细胞介素-29的研究进展. 中国生物制品学杂志, 2012, 25(1): 118-122. |
| [22] | Muir AJ, Shiffman ML, Zaman A, et al. Phase 1b study of pegylated interferon lambda 1 with or without ribavirin in patients with chronic genotype 1 hepatitis C virus infection. Hepatology, 2010, 52(3): 822-832. |
| [23] | Anderw JM, Mitchell L, Shiffman ML, et al. A phase 1b dose-ranging study of 4 weeks of PEG-interfern (IFN) lambda (PEG-rIL-29) in combination with Ribavirin (RBV) in patients with chronic genotype 1 hepatitis C virus (HCV) infection[C]. AASLD. The Liver Meeting in Boston, MA, 2009-11-30. |
| [24] | Ramos EL. Preclinical and clinical development of pegylated interferon-lambda 1 in chronic hepatitis C. J Interf Cytok Res, 2010, 30(8): 591-595. |
| [25] | Bristol-Myers Squibb. Pipeline asset update for PEG-interferon lambda [EB/OL]. [2014-04-21]. http://www.bms.com/research/investigational/hepatitis/Pages/PEG_interferon_lambda.aspx. |
 2015, Vol. 31
2015, Vol. 31




