服务
文章信息
- 李翠萍, 董卫华, 张兴国
- Li Cuiping, Dong Weihua, Zhang Xingguo
- 转番茄GGPS2基因烟草的构建及弱光耐受性分析
- Construction of transgenic tobacco expressing tomato GGPS2 gene and analysis of its low light tolerance
- 生物工程学报, 2015, 31(5): 692-701
- Chin J Biotech, 2015, 31(5): 692-701
- 10.13345/j.cjb.140474
-
文章历史
- Received: October 1, 2014
- Accepted: December 15, 2014
2. 西南大学园艺园林学院 南方山地园艺学教育部重点实验室,重庆 400715
2. Key Laboratory of Horticulture Science for Southern Mountainous Regions, College of Horticulture and Landscape Architecture, Southwest University, Chongqing 400715, China
弱光是作物设施栽培、秋冬季农业生产和连绵阴雨期生长的主要障碍之一[1, 2, 3]。通过常规育种方法,可获得耐弱光的新材料或新品种,但存在资源匮乏、改良困难、选择周期长等局限性。发掘色素合成相关基因,可为作物耐弱光性的改良奠定基础,对解决设施和寡日照地区的作物生产具有重要意义。在植物中,牻牛儿基牻牛儿焦磷酸 (GGPP) 参与叶绿素、类胡萝卜素、维生素E、赤霉素等产物的合成[4, 5, 6, 7],对光合作用、生长发育、产品和品质等有重要影响[8, 9]。该产物由牻牛儿基牻牛儿焦磷酸合成酶 (Geranylgeranyl pyrophosphate synthase,GGPS) 催化合成[10, 11]。植物中编码GGPS的基因最早在甜椒中得到克隆[10],且以多基因家族的形式存在[12]。拟南芥中有5个GGPS基因,其中AtGGPS1和AtGGPS3定位于质体,AtGGPS2和AtGGPS4分布于线粒体,AtGGPS6存在于内质网,分别负责不同亚细胞结构中GGPP的合成[12]。番茄中有2个GGPS基因,GGPS1的mRNA主要出现在叶组织中,而GGPS2在成熟果实和花器官中丰量表达[13]。LeGGPS2基因能使大肠杆菌合成GGPP,从而协助八氢番茄红素基因 (PSY) 和欧文氏菌的八氢番茄红素脱饱含酶基因 (crtI) 合成番茄红素[14];三孢布拉氏霉菌的IPI、GGPS基因能使大肠杆菌合成的β-类胡萝卜素含量增加[15];黄龙丹GGPS基因、蜜柑GGPS基因分别使烟草、猕猴桃类胡萝卜素的含量增加[16, 17]。GGPS基因若能促进类胡萝卜素的合成,将会对植物光合作用产生影响,但能否促进叶绿素合成,增强植物耐弱光性的研究,尚未见报道。本研究拟将CaMV 35S启动子控制下的番茄GGPS2基因整合进烟草基因组,探讨该基因对烟草的叶绿素和类胡萝卜素合成及对光合作用、生长发育的影响,以期明确该基因是否能提高烟草的弱光耐受性,为其他作物耐弱光性改良奠定基础。
1 材料与方法 1.1 材料番茄品种 Solanum lycopersicon L. cv Ailsa Craig由重庆大学陈国平教授惠赠,烟草Nicotiana tabacum L. cv. Wisconsin 38无菌苗由实验室保存。大肠杆菌Escherichia coli菌株XL1-blue、根癌农杆菌Agrobacterium tumefaciens菌株EHA105、Plant RNAzol试剂购自北京鼎国生物技术有限责任公司。载体pET32a(+) 购自Novagen公司,pVCT2024由本实验室构建。SanPrep柱式DNA胶回收试剂盒、柱式质粒小抽提量试剂盒购自上海生工生物工程服务有限公司,并委托该公司合成引物和测序。限制性内切酶、PrimStar HS DNA聚合酶、Taq DNA聚合酶、DNA marker购自TaKaRa公司。其他所需试剂均为国产分析纯。
1.2 植物表达载体的构建SlaGGPS2基因的cDNA序列克隆自英国番茄成熟果实组织,含该基因的双元表达载体由课题组构建[18],命名为pVCT2295。
1.3 烟草的遗传转化将带有35S-SlaGGPS2-Tnos基因表达盒和绿色荧光蛋白报告基因的植物双元表达载体转化至根癌农杆菌EHA105中,利用叶圆盘法转化烟草[19]。不定芽诱导和选择培养基均为MS附加2.5 mg/L的6-BA、0.2 mg/L的NAA、150 mg/L的卡那霉素、300 mg/L的羧苄青霉素、3%蔗糖和0.65%琼脂。生根培养基为MS附加150 mg/L的卡那霉素、300 mg/L的羧苄青霉素、3%蔗糖和0.65%琼脂。
1.4 转基因植株的鉴定 1.4.1 PCR鉴定采用CTAB法提取野生型及抗卡那霉素烟草叶片基因组DNA。以野生烟草gDNA为阴性对照,稀释20×pVCT2295 DNA为阳性对照,分别用引物对P1和P2、P1和P3、P4和P5进行PCR扩增,以排除农杆菌污染造成的假阳性、检测卡那霉素抗性基因和SlaGGPS2目的基因,序列见表1。
| Primer name | Sequences (5′-3′) |
| P1 | GAATTCAGGGAGTCACGTTATGACC |
| P2 | CCCGGCAGCTTAGTTGCCGT |
| P3 | CATGAGCGAAACCCTATAGGAACC |
| P4 | CGGGATCCATATGAGATCTATGAACCTTGT |
| P5 | GCTAGCTTAATTTTGACGATTAGCAATG |
分别将野生型、转基因烟草组培苗根部的培养基清洗干净,尽量不破坏根尖。取1 cm左右的根尖部位,制成临时切片,用荧光显微镜 (D5000B,Leica公司) 分别于白光和470 nm蓝光下观察。
1.5 转基因烟草的耐弱光性检测 1.5.1 弱光处理方法将转基因与野生型烟草组培苗同期繁殖,采用随机排列的方式栽种于人工气候室。盆栽土壤为腐殖质土、粘土、沙土按1∶1∶1比例混匀。测定烟草的光响应曲线,确定光补偿点为20−25 μmol/(m2·s) 后,挑取形态正常、生长良好和整齐一致的3个转基因烟草株系 (TG1、TG2、TG3) 和野生烟草 (WT) 进行弱光处理。每株系处理3株,试验重复3次。
用T5植物生长灯控制光照强度,每天14 h光照/10 h黑暗,环境温度为25 ℃。将烟草苗修剪为三叶一心,以免叶片数不同导致光合能力和生长的差异而影响后期测量。分别于25−30 μmol/(m2·s) 弱光照处理50 d,50−60 μmol/(m2·s) 弱光照继续处理30 d、60 d后,测定叶绿素a、b 含量,类胡萝卜素含量等相关生理指标。
1.5.2 光合速率测定25−30 μmol/(m2·s) 光照处理50 d、 50−60 μmol/(m2·s) 光照继续处理30 d后,选取野生烟草与转基因烟草的第5叶位功能叶,于9:00−11:00使用LI-6400便携式光合仪 (LI-COR,美国) 在实际生长条件下测定净光合速率。测定过程中使用开放气路,光照强度为60 μmol/(m2·s),温度为28 ℃。测定前,应多次匹配,当数据的读数稳定时,进行记录,求3次测定的平均值。
1.5.3 类胡萝卜素和叶绿素含量的测定用6 mm的打孔器在烟草自上而下的第5叶位 (第8叶位、第11叶位) 功能叶主脉两侧中部位置对称取15个叶圆片,浸泡在15 mL 80%的丙酮溶液中,封口,避光放置于摇床上,于25 ℃、125 r/min振荡至叶片变白[20]。当叶片变白时,以UV-1800型分光光度计分别测定波长470 nm、646 nm和663 nm下的吸光度,计算叶绿素a (Ca)、叶绿素b (Cb)、总叶绿素 (CT) 及类胡萝卜素 (Cc) 的质量浓度,计算公式为:
Ca =(12.21·A663-2.81·A646);
Cb =(20.13· A646-5.03·A663);
CT = Ca + Cb;
Cc=(1 000·A470-3.27· Ca -104·Cb)/229。
然后根据C·V/S计算各色素单位面积含量。
其中A为吸光度;C为质量浓度;V为测定液体总体积;S为样品的面积。
1.5.4 生长指标的测定叶数、株高、茎围、单位叶面积重按烟草农艺性状调查标准方法 (YC/T 142-1998) 测定[21];分别剪取根、茎、叶称量鲜重,然后105 ℃杀青20 min,70 ℃烘干后称量干重。于25−30 μmol/(m2·s) 光照处理50 d,50−60 μmol/(m2·s) 光照继续处理90 d后测定烟草的株高、茎粗、植株鲜重、干重等生长指标。
1.5.5 数据处理方法用Excel进行数据处理,计算平均值和作图。采用SPSS19.0软件进行方差分析。
2 结果与分析 2.1 得到整合有SlaGGPS2等基因的烟草植株含有SlaGGPS2等基因的双元载体 (图1A) 经农杆菌介导转化烟草叶片组织,共得到33株Kan抗性植株 (图1B−E)。PCR检测鉴定出9株烟草同时具有Kan抗性基因和目的基因 (图1F−G),且检测的DNA样本无农杆菌污染 (图1H)。荧光检测显示,Kan抗性烟草的根尖表达有GFP蛋白,呈现其特有的绿色荧光 (图1I−L)。证实获得整合nptII、SlaGGPS2和GFP等外源基因的转基因烟草9株。

|
| 图1 SlaGGPS2基因转烟草植株的鉴定 Fig.1 Identification of transgenic tobacco with SlaGGPS2 gene. (A) The structure of T-DNA in binary vector containing SlaGGPS2 gene. (B) The infected tobacco leaves. (C) antibiotic buds. (D) Rooted resistant tobacco. (E) Tobacco after transplanting. (F-H) The PCR products of nptII gene,SlaGGPS2 gene,the left border of T-DNA. (I-J) The root tip of wild tobacco in white and blue light respectively. (K-L) The root tip of transgenic tobacco in white and blue light respectively. Ms: DL2000 DNA marker; Mb: λDNA/EcoRⅠ+ Hind Ⅲ marker; 1-9: the transgenic plants; -: non-transgenic plants as negative control; +: binary vector as positive control; bar=100 μm. |
25−30 mmol/(m2·s) 弱光照处理50 d后,转基因烟草株系TG1和TG2第5功能叶的类胡萝卜素含量分别比野生烟草增加13%、4%,叶绿素总量分别比野生烟草增加19%、12%,而株系TG3的类胡萝卜素含量与野生烟草相当,叶绿素总量比野生烟草增加12%,均未达到差异显著水平;所有转基因烟草株系第5功能叶的光合速率较野生烟草增加25%−35.5%,均达到差异显著水平 (P<0.05) (表2)。
| Lines | Light intensity (mmol/(m2·s)) | Processing time (d) | Carotenoid content (mg/cm2) | Chlorophyll content (mg/cm2) | Photosynthetic rate (mmol CO2/(m2·s)) | |
| WT | 25-30 | 50 | 4.4±0.3 | 28.4±1.9 | 2.6±0.7 | |
| TG1 | 4.9±0.6 | 33.7±5.2 | 3.5±1.2 | |||
| TG2 | 4.6±0.5 | 31.8±4.5 | 3.4±0.4 | |||
| TG3 | 4.4±1.0 | 31.8±5.6 | 3.2±1.2 | |||
| WT | 50-60 | 30 | 4.3±0.4 | 25.2±3.0 | 1.7±0.6 | |
| TG1 | 5.1±0.4 | 31.1±4.2 | 1.9±0.5 | |||
| TG2 | 5.0±0.8 | 31.5±6.6 | 1.9±0.4 | |||
| TG3 | 4.2±0.2 | 24.1±1.2 | 1.7±0.6 | |||
| WT: wild tobacco; TG1,TG2,TG3: different lines of transgenic tobacco; values are $\bar x$±s (n=3); ** and * indicate 1%,5% significant level respectively. | ||||||
50−60 mmol/(m2·s) 弱光照处理30 d后,转基因烟草株系TG1和TG2第5功能叶的类胡萝卜素含量分别比野生烟草增加18%、16%,叶绿素总量分别比野生烟草增加23%、25%,达到差异显著水平 (P<0.05);而株系TG3的类胡萝卜素含量比野生烟草低3%,叶绿素总量比野生烟草低4%,所有转基因烟草株系第5功能叶的光合速率较野生烟草增加1.8%−11.7%,未达到差异显著水平 (表2)。
2.2.2 弱光处理对转SlaGGPS2基因烟草不同部位叶片光合性能的影响50−60 mmol/(m2·s) 弱光照处理60 d后,转基因烟草株系TG1和TG2第5功能叶的类胡萝卜素含量分别比野生烟草增加6%、5%,叶绿素总量分别比野生烟草增加5%、3%,而株系TG3的类胡萝卜素含量、叶绿素总量分别比野生烟草降低4%、8%;所有转基因烟草第5功能叶的光合速率较野生烟草增加2%−8%,均未达到差异显著水平 (表3)。
| Lines | Different location of leaves (from top to bottom) | Carotenoid content (mg/cm2) | Chlorophyll content (mg/cm2 ) | Photosynthetic rate (mmol CO2/(m2·s)) |
| WT | 5 | 5.5±0.3 | 35.0±2.9 | 1.2±0.6 |
| TG1 | 5.8±0.1 | 36.7±1.8 | 1.3±0.4 | |
| TG2 | 5.8±1.0 | 35.9±3.1 | 1.3±0.6 | |
| TG3 | 5.3±0.4 | 32.1±3.3 | 1.2±0.7 | |
| WT | 8 | 5.2±0.5 | 33.9±3.0 | ND |
| TG1 | 6.2±0.3 | 38.5±2.3 | ND | |
| TG2 | 5.4±0.4 | 37.0±2.3 | ND | |
| TG3 | 4.7±0.5 | 29.5±3.5 | ND | |
| WT | 11 | 3.9±0.6 | 24.3±3.4 | ND |
| TG1 | 4.8±0.3 | 29.3±2.1 | ND | |
| TG2 | 4.6±0.1 | 29.1±2.1 | ND | |
| TG3 | 4.4±0.7 | 26.3±3.2 | ND | |
| WT: wild tobacco; TG1,TG2,TG3: different lines of transgenic tobacco; ND: not detected; values are $\bar x$±s (n=3). | ||||
转基因烟草株系TG1和TG2第8功能叶的类胡萝卜素含量分别比野生烟草增加18%、4%,叶绿素总量分别比野生烟草增加14%、9%,而株系TG3的类胡萝卜素含量、叶绿素总量分别比野生烟草降低10%、13%,均未达到差异显著水平 (表3)。
所有转基因烟草株系第11功能叶的类胡萝卜素含量比野生烟草增加13%−23%,叶绿素总量比野生烟草增加8%−21%,差异均不显著 (表3)。
2.2.3 弱光处理对转SlaGGPS2基因烟草生物量积累的影响25−30 mmol/(m2·s) 光照处理50 d,50−60 μmol/(m2·s) 光照处理90 d后,相比野生烟草,转基因烟草株系TG1、TG2的叶片数目分别增加12%、6% (图2A),株高分别增加14%、3% (图2C),而转基因烟草株系TG3的叶片数目减少7%,株高降低5% (图2A,2C),转基因烟草茎比野生烟草粗6%−11%,均未达到差异显著性水平 (图2B)。
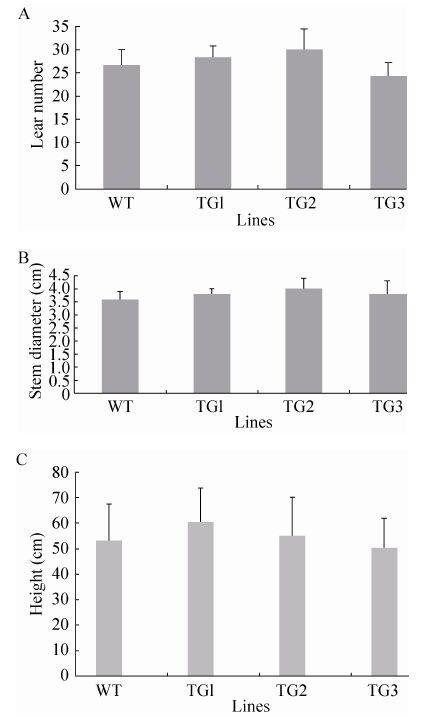
|
| 图2 弱光对转基因烟草叶片数目 (A)、茎粗 (B)、株高 (C) 的影响 Fig.2 The leaf number (A),stem diameter (B),height (C) of transgenic tobacco under low light. |
转基因烟草的单位叶面积比野生烟草重14%−26%,达到差异显著性水平 (P<0.05);叶鲜重比野生烟草低5%−20%,其中株系TG3达到差异显著性水平 (P<0.05);除株系TG3外茎鲜重比野生烟草高2%−16%,差异不显著;根鲜重比野生烟草增加55%−95%,达到差异极显著水平 (P<0.01);株系TG1总鲜重的增加达到差异显著性水平 (P<0.05);烘干后称重,发现相比野生烟草,转基因烟草株系TG1和TG2的叶干重分别增加8%、5%,TG3的叶干重减少1%,差异均不显著;转基因烟草的茎干重、根干重、总干重分别比野生烟草增加16%−47%、39%−67%、9%−26%,达到差异显著性水平 (P<0.05),表明转基因烟草的生物量积累比野生烟草多。
相比野生烟草,转基因烟草的干鲜比增加17%−28%,达到差异极显著性水平 (P<0.01),表明转基因烟草的自由水含量比野生烟草低,造成其叶鲜重偏低、总鲜重不高;转基因烟草的根冠干重比增加28%−37%,达到差异极显著性水平 (P<0.01),表明其积累的生物量更多向根部运输,培养了发达的根系,是烟草壮苗的基础和标志 (表4)。
| Lines | LMA (mg/cm2) | FW of leave (g) | FW of stem (g) | FW of root (g) | FW (g) | DW of leave (g) | DW of stem (g) | DW of root (g) | DW (g) | DW/FW (%) | Ration of root to shoot DW (%) |
| WT | 13.4±1.8 | 90.0± 4.6 | 36.3± 3.0 | 8.6± 0.5 | 134.9± 2.7 | 7.6± 0.2 | 3.2± 0.2 | 1.8± 0.1 | 12.6± 0.2 | 9.3± 0.1 | 17.0±1.3 |
| TG1 | 16.9±3.8 | 85.1± 4.3 | 42.1± 2.0 | 16.8± 0.1** | 147.0± 3.6 | 8.2± 0.3 | 4.7± 0.1** | 3.0± 0.2** | 15.9± 0.2** | 10.8± 0.3** | 23.3±1.7** |
| TG2 | 16.7±2.8 | 83.4± 3.5 | 37.0± 2.7 | 14.2± 0.6** | 134.6± 2.7 | 8.0± 0.4 | 4.4± 0.1** | 2.7± 0.1** | 15.1± 0.4** | 11.2± 0.1** | 21.8±0.4 |
| TG3 | 15.3±1.6 | 72.2± 2.5 | 28.8± 0.7 | 13.3± 0.2** | 114.3± 3.2** | 7.5± 0.2 | 3.7± 0.1 | 2.5± 0.1** | 13.7± 0.3 | 11.9± 0.1** | 22.3±0.6 |
| WT: wild tobacco; TG1,TG2,TG3: different lines of transgenic tobacco; LMA: leaf mass per unit area; FW: fresh weight; DW: dry weight; values are $\bar x$±s(n=3); ** and * indicate 1%,5% significant level respectively. | |||||||||||
弱光是影响作物设施生产的重要因素之一,不仅会限制农作物的种植范围,也会造成农作物减产和品质下降,严重时甚至绝收,因为光照是植物进行光合作用的基础,其强度变化会影响叶绿体光合膜上的色素、色素蛋白复合体的形成、含量及分布,进而影响植物的生长与发育[23, 24]。因此,有效捕获低光照强度下的光能,增强植物光合利用率将是提高植物耐弱光的重要措施之一。GGPS基因编码合成的GGPP是类异戊二烯代谢体系的分支,可通过不同的代谢途径分别合成叶绿素和类胡萝卜素,将该基因转入作物中有望提高耐弱光性。
本研究将构建的带有35S-SlaGGPS2-Tnos基因表达盒和绿色荧光蛋白报告基因的植物双元表达载体 (图1A) 通过农杆菌介导法整合入烟草叶片基因组,结果发现转基因烟草株系TG1和TG2第5功能叶的叶绿素含量、类胡萝卜素含量较野生烟草增加,光合速率增强,尤其是25−30 mmol/(m2·s) 弱光照处理50 d后,光合速率增加25%−35.5%,达到差异极显著性水平 (P<0.01) (表2)。当50−60 mmol/(m2·s) 弱光照处理30 d后,转基因烟草株系TG1和TG2第5功能叶的类胡萝卜素含量较野生烟草分别增加18%、16%,叶绿素总量分别增加23%、25%,达到差异显著水平 (P<0.05) (表3)。表明GGPS基因转烟草后得到表达并发挥了促进类胡萝卜素和叶绿素合成的功能。株系TG3的叶绿素总量、类胡萝卜素含量与野生烟草差异不显著,可能由于基因插入的位置效应造成。Ji等[16]将黄龙丹GGPS基因转入烟草,发现转基因烟草类胡萝卜素含量比野生烟草增加小于20%,该基因对类胡萝卜素含量的影响不及PSY、ZDS基因,但并未对转基因烟草进行耐弱光性分析。Lintig等[22]认为在光形态建成中,叶绿素总量和类胡萝卜素含量是同步增长的,本研究中发现类胡萝卜素与叶绿素含量变化趋势一致,同时对不同部位叶片的类胡萝卜素、叶绿素含量进行分析,发现随着叶片位置的下降,类胡萝卜素、叶绿素含量呈下降趋势,但转基因烟草比野生烟草下降趋势减缓,差异均不显著 (表3),可能与GGPP还参与赤霉素、脱落酸等激素的合成相关。本研究中转基因烟草株系TG1和TG2经25−30 mmol/(m2·s) 光照处理50 d后,在叶绿素指标上不及50−60 mmol/(m2·s) 光照处理30 d后的结果 (表2和表3),表明SlaGGPS基因可能只在较强弱光下发挥作用,而在接近光补偿点的弱光下,其功能有限。因此,导入更多与叶绿素或类胡萝卜素合成相关基因对增强烟草的耐弱光性有重要的研究意义[25]。另外,在后续研究中通过对转基因烟草T1代植株的PCR鉴定,结果表明含目的基因与不含目的基因植株的比例接近3∶1,推测SlaGGPS基因应该为单拷贝插入。
光合作用为植物提供物质代谢和能量转化的最初来源,是决定作物产量的重要因素。弱光影响光合作用的因素包括光合速率、色素含量、细胞器结构、光合酶活性、光合产物的运输与分配等。本研究将色素合成相关基因导入烟草,发现弱光处理后,光合速率增强,单位叶面积增重、总干重增加,可见转基因烟草积累了更多的生物量;同时发现根鲜重、根干重、根冠干重量比增加,证明转基因烟草增加了生物量向根部的分配,培养了发达的根系。由干鲜比的增加可见,转基因烟草的自由水含量少,可能与其耐弱光性增强有关。
番茄SlaGGPS基因能使弱光下转基因烟草叶片的类胡萝卜素含量、叶绿素含量增加,光合速率增强,干物质累积增多,因而推测在用于其他作物的耐弱光改良上可能发挥作用。
| [1] | Barkey KO, Wells R. Response of soybean photosynthesis and chloroplast membrane function to canopy development and mutual shading. Plant Physiol, 1991, 97(1): 245-252. |
| [2] |
Chen QJ, Zhang FM, Wang YJ, et al. Studies of physiologic characteristics of reaction of cucumber to low temperature and poor light. Sci Agric Sin, 2003, 36(1): 77-81 (in Chinese). 陈青君, 张福墁, 王永健, 等. 黄瓜对低温弱光反应的生理特征研究. 中国农业科学, 2003, 36(1): 77-81. |
| [3] |
Ai XZ, Guo YK, Ma XZ, et al. Photosynthetic characteristics and ultrastructure of chloroplast of cucumber under low light intensity in solar green house. Sci Agric Sin, 2004, 37(2): 268-273 (in Chinese). 艾希珍, 郭延奎, 马兴庄, 等. 弱光条件下日光温室黄瓜需光特性及叶绿体超微结构. 中国农业科学, 2004, 37(2): 268-273. |
| [4] | Bartley GE, Scolnik PA. Plant carotenoids: pigments for photoprotection, visual attraction, and human health. Plant Cell, 1995, 7(7): 1027-1038. |
| [5] | Koornneef M, Léon-Kloosterziel KM, Schwartz SH, et al. The genetic and molecular dissection of abscisic acid biosynthesis and signal transduction in Arabidopsis. Plant Physiol Biochem, 1998, 36(1): 83-89. |
| [6] | Andrew LP. Gibberellins in Arabidopsis. Plant Physiol Bioch, 1998, 36: 115-124. |
| [7] | Wettstein DV, Gough S, Kannangara CG. Chlorophyll biosynthesis. Plant Cell, 1995, 7(7): 1039-1057. |
| [8] | Bramley PM. Regulation of carotenoid formation during tomato fruit ripening and development. J Exp Bot, 2002, 531(377): 2107-2113. |
| [9] | Oster U, Rudiger W. The G4 gene of Arabidopsis thaliana encode a chlorophyll synthase of etiolated plants. Bot Acta, 1997, 110(5): 420-423. |
| [10] | Kuntz M, Romer S, Suire C. Identification of a cDNA for the plastid-located geranylgeranyl pyrophosphate synthase from Capsicum annuum: correlative increase in enzyme activity and transcript level during fruit ripening. Plant J, 1992, 2(1): 25-34. |
| [11] |
Wu ZM, Zhang X, Wan JM. Molecular regulation of chlorophyll biosynthesis. Plant Physiol Comm, 2008, 44(6): 1064-1070 (in Chinese). 吴自明, 张欣, 万建民. 叶绿素生物合成的分子调控. 植物生理学通报, 2008, 44(6): 1064-1070. |
| [12] | Okada K, Saito T, Nakagawa T, et al. Five geranylgeranyl diphosphate synthases expressed in different organs are localized into three subcellular compartments in Arabidopsis. Plant Physiol, 2000, 122(4): 1045-1056. |
| [13] | Ament K, Van Schie CC, Bouwmeester HJ, et al. Induction of a leaf specific geranylgeranyl pyrophosphate synthase and emission of (E,E)-4,8,12-trimethyltrideca-1,3,7,11-tetraene in tomato are dependent on both jasmonic acid and salicylic acid signaling pathways. Planta, 2006, 224(5): 1197-1208. |
| [14] |
Chen JY, Pu ZQ, Xiao YW, et al. Lycopene synthesis via tri-cistronic expression of LeGGPS2, LePSY1 and CrtI in Escherichia coli. Chin J Biotech, 2012, 28(8): 823-833 (in Chinese). 陈吉裕, 蒲志群, 肖雅文, 等. 大肠杆菌共表达LeGGPS2、LePSY1和CrtI基因合成番茄红素. 生物工程学报, 2012, 28(7): 823-833. |
| [15] | Sun J, Sun XX, Tang PW, et al. Molecular cloning and functional expression of two key carotene synthetic genes derived from Blakeslea trispora into E. coli for increased β-carotene production. Biotechnol Lett, 2012, 34(11): 2077-2082. |
| [16] | Ji J, Wang G, Wang JH. Functional analysis of multiple carotenogenic genes from Lycium barbarum and Gentiana lutea L. for their effects on β-carotene production in transgenic tobacco. Biotechnol Lett, 2009, 31(2): 305-312. |
| [17] | Kim M, Kim SC, Song KJ, et al. Transformation of carotenoid biosynthetic genes using a micro-cross section method in kiwifruit. Plant Cell Rep, 2010, 29(12): 1339-1349. |
| [18] |
Li CP, Xia BB, Zhai JP, et al. Cloning and expression vector construction of the GGPS2 gene from tomato. J Southwest Univ: Nat Sci Ed, 2010, 32(10): 65-68 (in Chinese). 李翠萍, 夏蓓蓓, 翟军鹏, 等. 番茄GGPS2基因的克隆与表达载体的构建. 西南大学学报: 自然科学版, 2010, 32(10): 65-68. |
| [19] | Horsch RB, Fry JE, Hoffman NL, et al. A simple and general method of transferring genes into plants. Science, 1985, 227(4691): 1229-1231. |
| [20] |
Xu DQ. Several problems in measurement and application of chlorophyll content. Plant Physiol Comm, 2009, 45(9): 896-898 (in Chinese). 许大全. 叶绿素含量的测定及其应用中的几个问题. 植物生理学通讯, 2009, 45(9): 896-898. |
| [21] |
State tobacco monopoly administration. Investigation Methods of Agronomical Character of Tobacco (YC/T 142). Beijing: China Standard Press, 1998 (in Chinese). 国家烟草专卖局. 烟草农艺性状调查方法 (YC/T 142). 北京: 中国标准出版社, 1998. |
| [22] | Lintig JV, Welsch R, Bonk M, et al. Light-dependent regulation of carotenoid biosynthesis occurs at the level of phytoene synthase expression and is mediated by phytochrome in Sinapis alba and Arabidopsis thaliana seedlings. Plant J, 1997, 12(3): 625-634. |
| [23] | Pattanayak GK, Biswal AK, Reddy VS, et al. Light-dependent regulation of chlorophyll b biosynthesis in chlorophyllide a oxygenase overexpressing tobacco plants. Biochem Biophys Res Commun, 2005, 326(2): 466-471. |
| [24] | Tanaka R, Koshino Y, Sawa S, et al. Overexpression of chlorophyllide a oxygenase enlarges the antenna size of photosystem II in Arabidopsis thaliana. Plant J, 2001, 26(4): 365-373. |
| [25] |
Li CP, Pan Y, Chu FT, et al. Construction of co-expression vector containing AtCAO and AtHEMA1 genes from Arabidopsis and transformation into tobacco. China Biotechnol, 2013, 33(4): 54-60 (in Chinese). 李翠萍, 潘宇, 储福堂, 等. 拟南芥AtCAO和AtHEMA1基因共表达载体的构建及转烟草研究. 中国生物工程杂志, 2013, 33(4): 54-60. |
 2015, Vol. 31
2015, Vol. 31




