服务
文章信息
- 王臣, 郭香玲, 李小康, 吴庭才, 李德元, 陈溥言
- Wang Chen, Guo Xiangling, Li Xiaokang, Wu Tingcai, Li Deyuan, Chen Puyan
- 胸腺五肽和法氏囊活性五肽的融合表达及其对禽流感灭活疫苗的佐剂效应
- Expression and adjuvant effects of the fusion peptide TBP5
- 生物工程学报, 2015, 31(5): 648-658
- Chin J Biotech, 2015, 31(5): 648-658
- 10.13345/j.cjb.140467
-
文章历史
- Received: September 28, 2014
- Accepted: December 8, 2014
2. 南京农业大学动物医学院 农业部动物细菌学重点实验室,江苏 南京 210095
2. Key Laboratory of Animal Bacteriology of China’s Department of Agriculture, College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, Jiangsu, China
胸腺是机体免疫系统中重要的中枢免疫器官,是T细胞分化成熟的场所,能分泌多种具有激素样活性的多肽[1]。胸腺五肽 (Thymopentin,TP5) 是胸腺生成素Ⅱ第32-36位氨基酸残基片段,能诱导T细胞分化,并促进T细胞亚群的发育、分化[2]。作为一种免疫增强剂,TP5在临床上主要用于自身免疫性疾病、慢性肝炎、免疫缺陷病、免疫功能低下、外科手术严重感染及肿瘤等的辅助治疗[3]。法氏囊 (Bursa of fabricus,BF) 是禽类独有的中枢体液免疫器官,相当于哺乳动物的骨髓[4]。BF中存在许多生物活性物质,尤其是一些具有免疫调节作用的小肽,能促进禽类淋巴细胞的分化发育及免疫器官的成熟[5, 6, 7, 8, 9]。法氏囊活性五肽 (Bursopentin,BP5) 是从法氏囊中分离所得的一种新的活性小肽,氨基酸序列为CKDVY,能促进T细胞和B细胞的增殖,提高机体体液和细胞免疫,还能平衡Th1和Th2类型的免疫反应[10, 11],且这种免疫平衡作用是一般免疫增强剂所不具备的。虽然免疫活性因子TP5和BP5均能够增强机体的免疫应答,但TP5主要是诱导机体的细胞免疫应答,而BP5则主要调节机体的体液免疫应答。近年来,有关TP5和BP5生物学功能的报道甚多,然而二者在基因水平上的联合应用目前未见报道,本研究根据大肠杆菌偏嗜密码子设计并合成重组融合肽TP5-BP5 (TBP5) 编码序列,构建高效表达TBP5的基因工程菌株,在大肠杆菌中进行融合蛋白的表达,并探讨重组融合肽TBP5的免疫佐剂效应,为新型疫苗佐剂的研究开发奠定基础。
1 材料与方法 1.1 质粒、菌株及毒株TBP5基因及上下游引物,均由华大基因科技股份有限公司化学合成;表达载体pET-32a (+)、Escherichia coli DH5α菌株、E. coli BL21 (DE3) 菌株均为河南科技大学动物科技学院本实验室所保存。禽流感疫苗 (H9N2亚型,SDS696株) 购自乾元浩生物股份有限公司;H9N2亚型禽流感病毒株A/chicken/Jiangsu/NJ07/05 (H9N2) 和pET32a-HA (H9N2) 质粒,由南京农业大学郑其升博士惠赠。
1.2 主要试剂及工具酶DTT、ConA、溴酚蓝、琼脂糖、考马斯亮蓝R-250、淋巴细胞分离液、MTT、胎牛血清 (FBS) 均购自郑州久是生物技术有限责任公司;100 bp DNA marker、PageRuler Plus Prestained Protein Ladder、IPTG、dNTPs、Nucleic acid strain (核酸染料)、质粒快速提取试剂盒、Trizol试剂、HRP标记的山羊抗小鼠IgG抗体、TMB底物显色液均购自郑州鼎国生物技术有限责任公司;小鼠细胞因子含量测定ELISA试剂盒购自武汉华美生物工程有限公司;小量琼脂糖凝胶DNA回收试剂盒、限制性核酸内切酶EcoR I、Xho I、Hind Ⅲ,T4 DNA连接酶、Taq酶均购自TaKaRa公司;Platinum® SYBR® Green qPCR SuperMix-UDG,购自Invitrogen公司。TP5和BP5标准品均由上海科肽生物科技有限公司合成。
1.3 实验动物90只BALB/c小鼠 (4-6周龄,20±2 g),购自河南省实验动物研究中心。
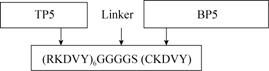
1.4 重组融合肽TBP5的克隆与表达根据大肠杆菌的偏嗜密码子设计重组融合肽TBP5串联融合基因,并针对该融合肽基因设计引物F1、F2和F3 (表1),分别在F1加上EcoRⅠ酶切位点、F3中加上终止密码子和XhoⅠ酶切位点,然后通过柔性Linker (G-G-G-G-S) 基因将TP5和BP5基因串联形成重组融合肽TBP5基因 (图1)。利用F1、F2和F3引物进行重叠PCR方法 (SOE-PCR) 扩增,1%琼脂糖凝胶电泳鉴定PCR产物,并回收重组融合肽TBP5基因。TBP5基因片段和质粒载体pET-32a均用EcoRⅠ和XhoⅠ进行双酶切后再回收,并用T4 DNA连接酶进行连接,连接产物转化至E. coli DH5α感受态细胞。利用质粒快速提取试剂盒提取重组质粒pET32a-TBP5,用Hind Ⅲ进行缺失酶鉴定,并送往华大基因科技股份有限公司测序。将测序正确的重组质粒pET32a-TBP5转化至E. coli BL21 (DE3) 中进行诱导表达,利用SDS-PAGE分析其表达情况。
| Primer name | Primer sequence (5¢-3¢) |
| F1 | CCGGAATTCCGTAAGGACGTATACCGCAAAGATGTCTATAGGAAGGATGTGTACCGTAAAGACGTCTATCGCAAG |
| F2 | GGTGCTGCCGCCGCCGCCGTACACATCTTTCCGATAAACATCCTTGCGATAGACGTCTTT |
| F3 | TGTACGGCGGCGGCGGCAGCACCCCGAACCTGAAACATGGCACCCCGAACCTGAAACATGGCCTCGAGTAA |
| The restriction enzyme sites are marked with underlined. | |
|
| 图1 重组融合肽TBP5的设计图 Fig.1 Design of the fusion peptide TBP5. |
无菌采取4-6周龄BALB/c小鼠 (20±2) g的胸腺、脾脏,将其置于200目不锈钢细胞筛网上用注射器针芯轻轻研压制成细胞悬液,加入Hank’s液中,500 r/min离心5 min,除去红细胞;取上清500 r/min离心5 min,弃上清,以Hank’s液洗涤沉淀2次;用含10% FBS的RPMI-1640培养基将两种淋巴细胞密度均调整为约5×106 cells/mL。其中胸腺淋巴细胞加入ConA至终浓度为5 μg/mL,脾脏淋巴细胞加入PMA至终浓度为300 ng/mL,分别分装到96孔板中,100 μL/孔,并设3个复孔,置于CO2培养箱中37 ℃培养6 h;将不同浓度 (0.2、0.4、0.8、1.6、3.2、6.4 µg/mL) 的重组融合肽TBP5 (经蛋白质Ni柱亲和层析纯化) 加入淋巴细胞中,100 μL/孔,并设对照组 (PBS、1.0 µg/mL大肠杆菌硫氧还蛋白 (Thioredoxin,TRX)、1.0 µg/mL TP5、1.0 µg/mL BP5),继续培养72 h,标准MTT法检测重组融合肽TBP5对胸腺和脾脏淋巴细胞增殖的影响。相对细胞增殖率 (%) = (实验组OD570 /对照组OD570) ×100%。
1.6 动物的分组与免疫将90只4-6周龄BALB/c小鼠随机分为5组,每组18只,第1组作空白对照组 (100 μL PBS);第2-5组分别为禽流感灭活疫苗组 (H9N2亚型SDS696株,107 TCID50/0.1 mL)、H9N2 AIV灭活疫苗 (107 TCID50/0.1 mL) +TP5组 (10 μg)、H9N2 AIV灭活疫苗 (107 TCID50/0.1 mL) +BP5组 (10 μg)、H9N2 AIV灭活疫苗 (107 TCID50/0.1 mL)+重组融合肽TBP5组 (10 μg)。采取肌肉注射 (i.m.) 方式进行两次免疫,每次免疫间隔2周,即所有组分别于0、14 d进行首免和二免。
1.7 血清中HI抗体效价的测定首免后0、7、14、21 d,从免疫小鼠中每组随机抽取5只小鼠进行眼眶静脉丛取血,并分离血清,56 ℃灭活30 min,采用标准HI试验检测小鼠血清中HI抗体效价[12]。检测H9N2型禽流感病毒(A/chicken/Jiangsu/NJ07/05) 的血凝效价,并将其配制成4单位H9N2型AIV抗原。用PBS进行系列倍比稀释后加入96孔微量板中,每孔加50 μL 4单位H9N2型AIV抗原,轻轻混匀,室温下孵育1 h后,每孔加入50 μL 0.5%鸡红细胞悬液,室温下静置1 h,观察各组血凝情况,以可抑制血凝的最高血清稀释度为 待检血清中HI抗体效价。
1.8 血清中HA抗体的测定于首免后7、 21 d分离小鼠血清,并采用ELISA方法检测小鼠血清中的H9N2 HA抗体[11, 13]。以10 μg/mL在大肠杆菌中表达的重组H9N2 HA蛋白[14]包被96孔微量板,4 ℃过夜,次日弃孔内液,用PBS/0.1% Tween-20 (PBST) 洗板3次 (每次静置3 min),以1% BSA于37 ℃封闭2 h,弃孔内液,用PBST洗板3次。用含1% BSA的PBS将小鼠血清稀释为1∶101-1∶105,第1孔作为空白对照,第2孔加100 μL PBS,第3孔开始加1:20稀释的小鼠血清100 μL,于37 ℃放置2 h,弃孔内液,PBST洗板3次,除第1孔外,每孔加1:2 000稀释的HRP酶标记的羊抗鼠IgG抗体100 μL,37 ℃孵育1 h,弃孔内液,PBST洗板3次,除第1孔外,每孔加100 μL TMB显色液,室温避光反应20 min,每孔加100 μL 2 mol/L H2SO4终止反应,测OD450。
1.9 血清中IL-4和IFN-γ的测定于首免后7、21 d分离小鼠血清,采用小鼠细胞因子含量测定ELISA试剂盒检测血清中IL-4和IFN-γ的含量,具体操作按照试剂盒说明书进行。每次分析时,使用对照的重组细胞因子标准品绘制标准曲线,通过标准曲线来计算血清中细胞因子的含量。
1.10 动物免疫保护试验二免2周后 (即首免后28 d),经滴鼻途径对各实验组小鼠 (18只/组) 攻击H9N2型禽流感病毒毒株A/chicken/Jiangsu/NJ07/05 (H9N2) 100 μL (2.5×106 TCID50/0.1 mL),设PBS对照组,攻毒后各组小鼠隔离饲养。于攻毒后3、5、7 d分别从各组随机抽取5只小鼠分离其肺脏,应用SYBR Green荧光定量PCR方法采用Platinum® SYBR® Green qPCR SuperMix-UDG检测各小鼠肺脏中病毒的滴度,具体操作按照试剂盒说明书进行。根据H9N2型禽流感病毒毒株A/chicken/Jiangsu/NJ07/05 (H9N2) 的基因序列 (GenBank Accession No. AY364228) 设计引物,引物序列为HA-F:5ʹ-CTACTGTTGGGAG GAAGAGAATGGT-3ʹ;HA-R:5ʹ-TGGGCGTCTT GAATAGGGTAA-3ʹ。
1.11 数据分析采用SPSS软件对实验数据进行统计学分析,实验数据用$\bar x$±s表示,P<0.05为显著差异,有统计学意义。
2 结果 2.1 重组融合肽TBP5的表达用引物F1、F2和F3对融合肽TBP5的基因进行SOE-PCR扩增,经双酶切、连接并转化至E. coli DH5α感受态细胞,提取重组质粒并用Hind Ⅲ进行缺失酶鉴定,结果显示重组质粒没有被Hind Ⅲ切出相应条带 (图2A),表明重组质粒已经缺失Hind Ⅲ酶切位点。重组质粒测序结果显示,重组融合肽TBP5基因全部插入pET-32a载体中,且TBP5基因与设计完全相符,表明重组表达载体构建成功,将重组质粒命名为pET32a-TBP5。将重组质粒pET32a-TBP5转入E. coli BL21 (DE3) 中进行诱导表达,表达产物经SDS-PAGE分析后,可见重组表达载体pET32a-TBP5诱导后表达约27.0 kDa大小的目的蛋白条带,纯化后条带更为清晰,与预期分子量大小一致,表明重组融合肽TBP5基因在大肠杆菌中获得了表达 (图2B)。

|
| 图2 重组质粒pET32a-TBP5的鉴定及重组融合肽TBP5在大肠杆菌中的表达 Fig.2 (A) Identification of the recombinant plasmid pET32a-TBP5. M: 100-bp DNA marker; 1: the recombinant plasmid pET32a-TBP5 after Hind III enzyme digestion; 2: the recombinant plasmid pET32a-TBP5. (B) The expression of fusion peptide TBP5 in E. coli. M: Page Ruler Plus Prestained Protein Ladder; 1: uninduced recombinant BL21 (DE3)/ pET32a-TBP5; 2: induced recombinant BL21 (DE3)/ pET32a-TBP5; 3: purified recombinant BL21 (DE3)/ pET32a-TBP5. |
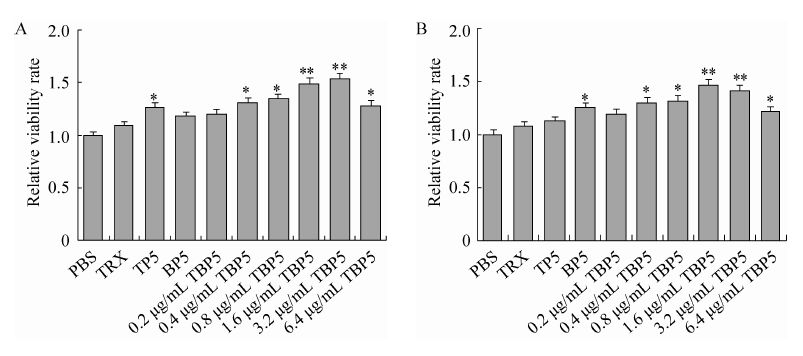
将TBP5重组菌的表达产物经蛋白质Ni柱亲和层析纯化和分光光度计定量后,通过MTT法测定重组融合肽TBP5对小鼠胸腺和脾脏淋巴细胞增殖的影响,结果显示,与PBS组相比,不同浓度 (0.2、0.4、0.8、1.6、3.2、6.4 µg/mL) 的TBP5均可促进胸腺淋巴细胞和脾脏淋巴细胞的增殖。与TP5、BP5相比,TBP5刺激胸腺和脾脏淋巴细胞增殖活性更强,且其浓度为0.4、0.8、6.4 µg/mL时差异显著 (P<0.05),浓度为1.6 µg/mL和3.2 µg/mL时差异极显著 (P<0.01) (图3A和3B)。表明重组融合肽TBP5能够促进小鼠胸腺T淋巴细胞和脾脏B淋巴细胞的增殖。
|
| 图3 重组融合肽TBP5对小鼠淋巴细胞增殖活性的影响 Fig.3 The effects of fusion peptide TBP5 on the proliferation of thymic lymphocytes (A) or splenic lymphocytes (B) from immunized mice. The data presented are$\bar x$±s of five replicates. * P<0.05 and ** P<0.01,compared with mice immunized with PBS. |
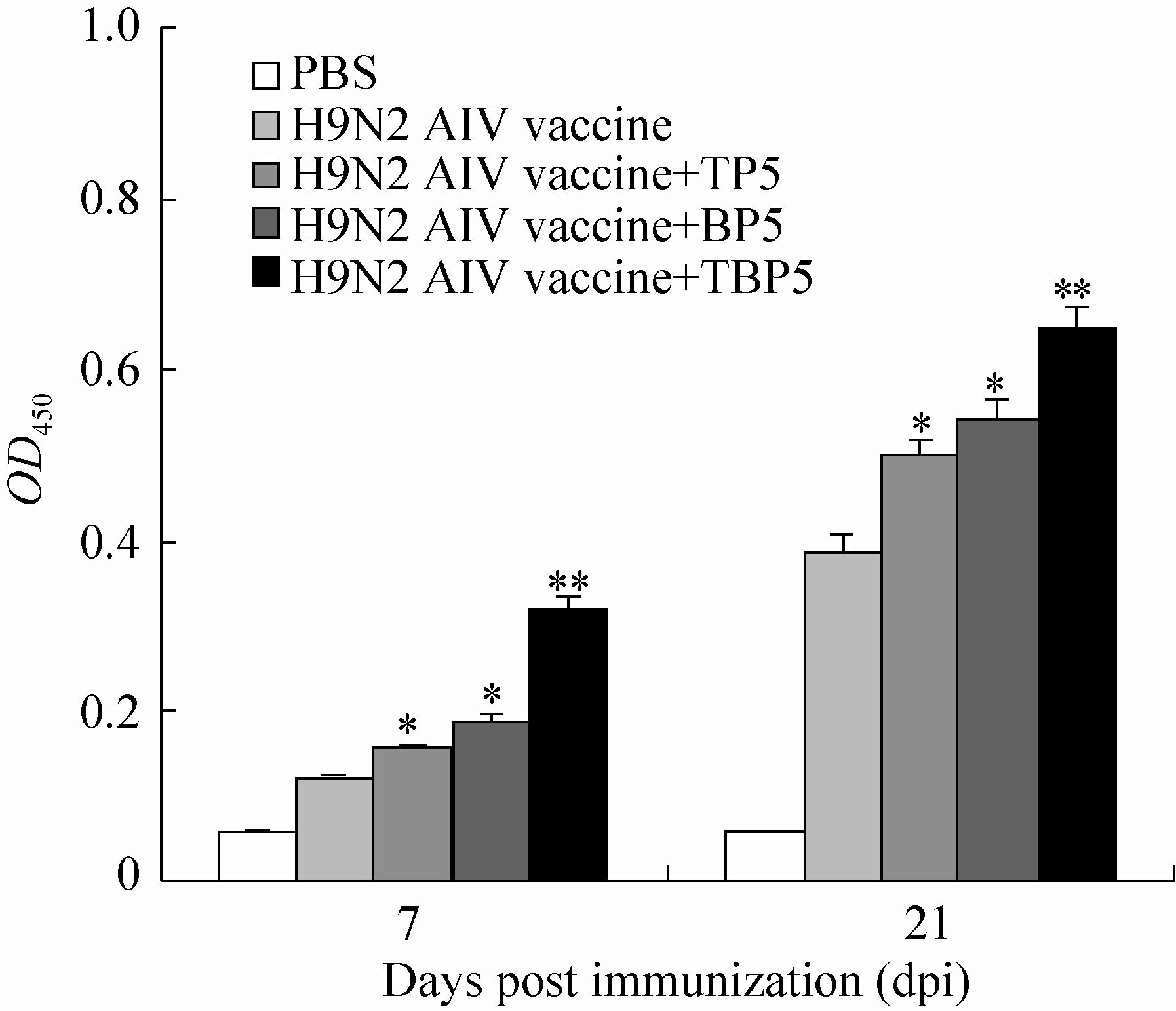
分别于首免后0、7、14、21 d采集各组小鼠血清进行HI抗体检测,如图4所示,除PBS对照组外,各免疫组小鼠首免后7 d均可检测到HI抗体,且首免后14、21 d时各免疫组小鼠HI抗体效价均显著上升,但HI抗体效价存在组间差异。结果显示,首免后7、14、21 d时,疫苗+BP5组和疫苗+TP5组小鼠血清中HI抗体效价均高于单独疫苗组,且疫苗+BP5组HI抗体效价高于疫苗+TP5组,但差异并不显著 (P>0.05),而疫苗+TBP5组小鼠血清中HI抗体效价则显著高于疫苗+BP5组 (P<0.05)。表明重组融合肽TBP5能够显著增强免疫后小鼠的HI抗体水平。

|
| 图4 血清中抗体HI效价检测 Fig.4 HI antibody titers in the immunized mice. Mouse sera (n=5) were collected at 0,7,14 and 21 d post-immunization,and the serum HI titers were analyzed by HI assay. The data presented are $\bar x$±s of five replicates. * P<0.05 and ** P<0.01,compared with mice immunized with H9N2 AIV vaccine. |
于首免后7、21 d分离小鼠血清进行HA抗体检测,结果如图5所示,首免后7 d和21 d时,疫苗+BP5组和疫苗+TP5组小鼠血清中HA抗体效价均显著高于单独疫苗组 (P<0.05),且疫苗+BP5组HA抗体效价稍高于疫苗+TP5组,而疫苗+TBP5组小鼠的HA抗体效价则显著高于疫苗+BP5组 (P<0.05),且首免后21 d时较首免后7 d时各组HA抗体水平均进一步提高。表明重组融合肽TBP5显著提高免疫H9N2型AIV疫苗后小鼠的HA抗体分泌水平。
|
| 图5 血清中抗体HA效价分析 Fig.5 HA antibody titers in the immunized mice. Mouse sera (n=5) were collected at 7 and 21 d post-immunization for HA antibody detection by ELISA. Data shown are representative of five separate experiments. * P<0.05 and ** P<0.01,compared with mice immunized with H9N2 AIV vaccine. |
于首免后7、21 d分离小鼠血清,采用小鼠细胞因子含量测定ELISA试剂盒检测血清中IL-4和IFN-γ的含量,以分析TBP5对H9N2型AIV疫苗免疫后小鼠的细胞免疫水平的影响。从图6可以看出,首免后7 d和21 d时,单独疫苗组的IL-4和IFN-γ的分泌量均高于PBS组;疫苗+TP5组和疫苗+BP5组的IL-4和IFN-γ的分泌量与单独疫苗组相比均显著升高 (P<0.05),且疫苗+TP5组IL-4和IFN-γ的分泌量略高于疫苗+BP5组;而疫苗+TBP5组IL-4和IFN-γ的分泌量显著高于疫苗+TP5组 (P<0.05)。表明重组融合肽TBP5能够提高免疫后小鼠体内细胞因子IL-4和IFN-γ的分泌水平。

|
| 图6 血清中IL-4和IFN-γ的分泌量 Fig.6 The effect of TBP5 on IL-4 and IFN-γ cytokine production in the sera of immunized mice. Mouse sera (n=5) were collected at 7 and 21 d post-immunization,and the IL-4 (A) and IFN-γ (B) were measured by using a sandwich ELISA and a commercial ELISA kit. Data shown are representative of five separate experiments. * P<0.05,compared with mice immunized with H9N2 AIV vaccine. |
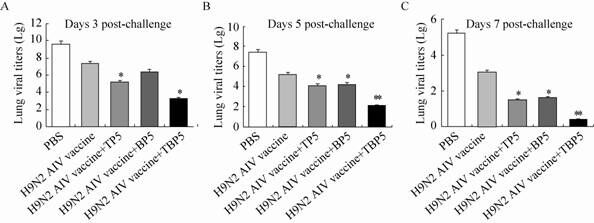
由于H9N2型禽流感病毒毒株A/chicken/Jiangsu/NJ07/05 (H9N2) 不能使小鼠出现明显的临床症状和导致死亡,为有效评价各实验组小鼠免疫保护力的差异,于二免2周后,对小鼠攻击A/chicken/Jiangsu/NJ07/05 (H9N2) 100 μL (2.5×106 TCID50/0.1 mL),同时设PBS对照组,在攻毒后3、5、7 d从各组随机抽取5只小鼠采集其肺脏,采用SYBR Green荧光定量PCR方法检测肺脏中病毒滴度。结果显示 (图7),攻毒后3、5、7 d,疫苗+TP5组和疫苗+BP5组小鼠肺脏中病毒滴度均显著低于单独疫苗组 (P<0.05),而疫苗+TBP5组病毒滴度与疫苗+TP5组和疫苗+BP5组相比显著下降 (P<0.05),且攻毒后7 d时各实验组小鼠肺脏中病毒滴度明显低于攻毒后3 d和5 d时病毒滴度 (P<0.05),其中疫苗+TBP5组在攻毒后7 d时几乎检测不到小鼠肺脏中的病毒粒子。表明重组融合肽TBP5能够有效抑制H9N2型AIV在小鼠肺脏中的复制,促进小鼠肺脏中病毒的清除,从而对小鼠起到免疫保护的效果。
|
| 图7 小鼠肺脏中AIV病毒滴度 Fig.7 AIV titers in the lung of the immunized mice. Lung samples from immunized mice in each group (n=5) were collected at 3,5 and 7 d post-challenge with 2.5×106 TCID50 H9N2 avian influenza virus A/chicken/Jiangsu/NJ07/05 (H9N2) . Each lung sample was diluted to 1 mL with PBS. Lung viral copies are represented as copies (Lg) per mL. The data presented are $\bar x$±s of five replicates. * P<0.05 and ** P<0.01,compared with mice immunized with H9N2 AIV vaccine. |
疫苗对控制人类和动物传染性疾病的流行具有至关重要的作用,而合适的佐剂则能增强
疫苗的免疫原性、提高机体免疫应答水平,使疫苗更有效地发挥免疫保护作用[15, 16]。然而,大多数与抗原联合使用的佐剂有诸多副作用,只有很少一部分在临床上得以应用。因此,新
型疫苗佐剂的开发亟待研究。近年来,大量的研究证实多肽具有免疫佐剂活性,如胸腺素Tα1、囊素BS、囊素样肽BLP等[13, 17, 18]。然而多肽免疫佐剂在临床应用中也存在一些问题:生物活性肽大多是小分子蛋白,分子量小,在生物体内半衰期很短,导致对机体产生的免疫期较短;另外,虽然临床上一些多肽联合使用时效果很好,但多肽的生产成本极高,极大地制约了多肽免疫佐剂在临床上的应用。通过基因工程技术将两种多肽连接制备重组融合肽既可以提高多肽的半衰期,延长免疫期,同时融合肽理论上具有两种多肽的活性,这样可降低多肽免疫佐剂的生产成本。
胸腺五肽TP5具有与胸腺生成素II相似的生物学活性,能够诱导T细胞分化、增殖和成熟,促进T淋巴细胞亚群发育并活化,双向调节失衡的免疫系统[2],而且还具有抗肿瘤和抗氧化功能[19],因而在临床上得以广泛应用。法氏囊活性五肽BP5是从鸡法氏囊中分离获得的一种新的免疫活性肽,能够调节体液免疫和细胞免疫反应,具有免疫佐剂的潜能。由于TP5和BP5均可增强机体的免疫应答,表现出免疫佐剂活性,然而二者融合而形成的重组融合肽TBP5是否也具有免疫增强作用呢?针对这一设想,本研究根据大肠杆菌偏嗜密码子在TP5和BP5之间设计一段Linker (G-G-G-G-S) 通过SOE-PCR方法合成了重组融合肽TP5-BP5 (TBP5) 基因,并将其克隆至pET32a表达载体中,成功构建出重组质粒pET32a-TBP5,对诱导表达产物进行SDS-PAGE发现,重组融合肽TBP5表达产物分子量大小约为27.0 kDa,与预期的分子量大小一致,表明重组融合肽TBP5基因在E. coli BL21中获得表达。
为检测原核表达的重组融合肽TBP5是否具有体外免疫活性,本试验以不同浓度 (0.2-6.4 µg/mL) 的TBP5刺激小鼠胸腺和脾脏淋巴细胞,试验结果显示,TBP5能够显著促进小鼠胸腺T淋巴细胞和脾脏B淋巴细胞的增殖,表明TBP5具有较强的体外免疫活性。为进一步探讨重组融合肽TBP5的免疫佐剂特性,以TBP5联合H9N2型AIV灭活疫苗免疫小鼠,检测免疫后小鼠血清中HI抗体、HA抗体水平及细胞因子IL-4、IFN-γ的分泌情况,结果显示,疫苗+TBP5组免疫后小鼠的HI抗体效价和HA抗体分泌水平显著高于疫苗+BP5组 (P<0.05),疫苗+TBP5组免疫后小鼠体内细胞因子IL-4和IFN-γ的分泌水平显著高于疫苗+TP5组,表明重组融合肽TBP5既可提高H9N2型AIV疫苗免疫后机体的体液免疫水平,又可提高机体的细胞免疫水平。
为进一步分析重组融合肽TBP5对动物攻毒后的免疫保护性作用,本研究在二免2周后对小鼠进行动物免疫保护试验。由于本试验选用的H9N2亚型禽流感病毒毒株A/chicken/Jiangsu/NJ07/05 (H9N2) 不能使小鼠出现明显的流感临床症状和导致死亡,而且,我们之前的研究发现以2.5×106 TCID50的剂量感染小鼠后该病毒主要分布在其肝脏、脾脏和肺脏,其中肺脏中的带毒量最多。因此,为有效评价TBP5诱导的免疫保护作用,本研究采用荧光定量PCR方法检测不同免疫组小鼠肺脏中病毒拷贝数来分析TBP5对小鼠的免疫保护效果[20, 21],结果显示攻毒后3 d TBP5明显有助于小鼠肺脏中病毒的清除,攻毒后7 d时疫苗+TBP5组几乎检测不到小鼠肺脏中的病毒粒子。表明重组融合肽TBP5能够有效抑制H9N2型AIV在小鼠肺脏中的复制,促进小鼠肺脏中病毒的清除,结果进一步提示,TBP5可能通过介导细胞和体液免疫反应发挥免疫保护作用。
总之,本研究成功构建了重组融合肽TP5-BP5 (TBP5) 基因工程菌株,并在大肠杆菌中获得了表达;重组的融合肽TBP5能显著促进小鼠胸腺T淋巴细胞和脾脏B淋巴细胞的增殖,有效提高机体体液和细胞免疫应答,动物免疫保护试验结果显示TBP5有助于小鼠肺脏中H9N2型AIV病毒的清除。本研究提示,重组融合肽TBP5具有良好的免疫佐剂潜能,为进一步开发新型疫苗佐剂奠定了基础。
| [1] |
Ren X, Liao HM, Yang HM, et al. Review on thymic hormones and domestic production status and existing problems of thymopolypeptides preparations. Chin J Biochem Pharm, 2012, 33(2): 204-206 (in Chinese). 任雪, 廖海明, 杨洪淼, 等. 胸腺激素概况及我国胸腺素制剂的生产现状及存在问题. 中国生化药物杂志, 2012, 33(2): 204-206. |
| [2] |
Gao DM. Expression, purification and activities of Tα1-TP5 fusion peptide[D]. Ji’nan: Shandong University, 2009 (in Chinese). 高德民. 胸腺融合肽Tα1-TP5的表达、纯化和活性研究[D]. 济南: 山东大学, 2009. |
| [3] |
Li J. Preparation, in vitro and in vitro immunomodulatory and synergistic anti-tumor activities of thymosin α1-thymopentin fusion peptide and its binding character to TLR2[D]. Ji’nan: Shandong University, 2013 (in Chinese). 李娟. 胸腺素α1-胸腺五肽融合肽的制备、体内外免疫调节与辅助抗肿瘤作用及与TLR2结合性质研究[D]. 济南: 山东大学, 2013. |
| [4] |
Zhang HL, Qian JF, Hao QZ, et al. The research advance on Bursin. J Agri Univ Hebei, 2002, 25(Z1): 243-245 (in Chinese). 张焕铃, 钱建飞, 郝勤宗, 等. 法氏囊活性肽的研究进展. 河北农业大学学报, 2002, 25(Z1): 243-245. |
| [5] | Audhya T, Kroon D, Heavner G, et al. Tripeptide structure of bursin, a selective B-cell-differentiating hormone of the bursa of Fabricius. Science, 1986, 231(4741): 997-999. |
| [6] | Feng XL, Su XD, Wang FQ, et al. Isolation and potential immunological characterization of TPSGLVY, a novel bursal septpeptide isolated from the bursa of Fabricius. Peptides, 2010, 31(8): 1562-1568. |
| [7] | Feng XL, Liu QT, Cao RB, et al. Identification and characterization of a novel immunomodulatory bursal-derived pentapeptide-II (BPP-II). J Biol Chem, 2012, 287(6): 3798-3807. |
| [8] | Feng XL, Liu QT, Cao RB, et al. A bursal pentapeptide (BPP-I), a novel bursal-derived peptide, exhibits antiproliferation of tumor cell and immunomodulator activity. Amino Acids, 2012, 42(6): 2215-2222. |
| [9] | Liu XD, Feng XL, Zhou B, et al. Isolation, modulatory functions on murine B cell development and antigen-specific immune responses of BP11, a novel peptide from the chicken bursa of Fabricius. Peptides, 2012, 35(1): 107-113. |
| [10] | Li DY, Geng ZR, Zhu HF, et al. Immunomodulatory activities of a new pentapeptide (Bursopentin) from the chicken bursa of Fabricius. Amino Acids, 2011, 40(2): 505-515. |
| [11] | Li DY, Xue MY, Wang C, et al. Bursopentine as a novel immunoadjuvant enhances both humoral and cell-mediated immune responses to inactivated H9N2 avian influenza virus in chickens. Clin Vaccine Immunol, 2011, 18(9): 1497-1502. |
| [12] | Haan L, Verweij WR, Holtrop M, et al. Nasal or intramuscular immunization of mice with influenza subunit antigen and the B subunit of Escherichia coli heat-labile toxin induces IgA- or IgG-mediated protective mucosal immunity. Vaccine, 2001, 19(20/22): 2898-2907. |
| [13] | Wang C, Wen WY, Su CX, et al. Bursin as an adjuvant is a potent enhancer of immune response in mice immunized with the JEV subunit vaccine. Vet Immunol Immunopathol, 2008, 122(3/4): 265-274. |
| [14] |
Zheng QS, Liu HL, Zhang XY, et al. Prokaryotic expression and the establishment of a putative indirect ELISA assay for the HA gene of avian influenza virus H9N2 subtype. Virol Sin, 2005, 20(3): 293-297 (in Chinese). 郑其升, 刘华雷, 张晓勇, 等. H9N2亚型AIV HA基因的原核表达及间接ELISA方法的建立.中国病毒学, 2005, 20(3): 293-297. |
| [15] |
Tan W, Xie LJ, Xie ZX. Research updates of vaccines against avian influenza virus. J South Agri, 2014, 45(8): 1492-1497 (in Chinese). 谭伟, 谢丽基, 谢芝勋. 禽流感病毒疫苗研究进展. 南方农业学报, 2014, 45(8): 1492-1497. |
| [16] |
Zhou Y, Geng XC, Wang JF, et al. Recent development in vaccine adjuvant research. Chin J New Drugs, 2013, 22(1): 34-42 (in Chinese). 周洋, 耿兴超, 汪巨峰, 等. 疫苗佐剂最新研究进展. 中国新药杂志, 2013, 22(1): 34-42. |
| [17] |
Li WY, Lu HM, Guo Q, et al. Effects of thymosin alpha1 on immune effector molecules of mouse. J Sichuan Univ: Med Ed, 2014, 45(3): 400-404 (in Chinese). 李炜晔, 陆慧敏, 郭强, 等. 胸腺肽α1对小鼠机体免疫系统的影响. 四川大学学报: 医学版, 2014, 45(3): 400-404. |
| [18] | Cai MH, Zhu F, Wu HC, et al. A new recombinant hybrid polypeptide and its immunologic adjuvant activity for inactivated infectious bursal disease vaccine. Biotechnol Lett, 2014, 36(7): 1431-1437. |
| [19] |
Chang H. The antitumor and antioxidant effects of thymopentin (TP5) [D]. Lanzhou: Lanzhou University, 2007 (in Chinese). 常惠. 胸腺五肽抗肿瘤和抗氧化作用的研究[D]. 兰州: 兰州大学, 2007. |
| [20] |
Wang C. Studies on immune regulation mechanism of Bursin-like peptide in mammals[D]. Nanjing: Nanjing Agricultural University, 2008 (in Chinese). 王臣. 囊素样肽在哺乳动物中免疫调节机制研究[D]. 南京: 南京农业大学, 2008. |
| [21] | Wang C, Li XK, Wu TC, et al. Bursin-like peptide (BLP) enhances H9N2 influenza vaccine induced humoral and cell mediated immune responses. Cell Immunol, 2014, 292(1/2): 57-64. |
 2015, Vol. 31
2015, Vol. 31




