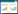服务
文章信息
- 李国辉, 李芒芒, 周倩, 胡朝阳, 唐琦, 姚勤
- Li Guohui, Li Mangmang, Zhou Qian, Hu Zhaoyang, Tang Qi, Yao Qin
- 利用优化改造的家蚕杆状病毒表达系统提高NS1表达产量
- Modified baculovirus system for high expression of Bombyx mori bidensovirus NS1 in silkworm
- 生物工程学报, 2015, 31(4): 591-602
- Chin J Biotech, 2015, 31(4): 591-602
- 10.13345/j.cjb.140403
-
文章历史
- Received: August 4, 2014
- Accepted: September 29, 2014
杆状病毒-昆虫细胞表达系统 (BEVS) 是通过制备携带有外源基因的重组杆状病毒,感染昆虫或昆虫细胞进行外源蛋白的表达,表达产物具有正确的空间折叠和糖基化等修饰,其生物活性接近其对应的天然产物。在BEVS中,常用苜蓿丫纹夜蛾核多角体病毒 (AcNPV) 或者家蚕核型多角体病毒 (BmNPV) 用作重组病毒构建的载体,而在表达外源蛋白时,我们倾向选择家蚕杆状病毒-昆虫细胞表达系统,这与我国的家蚕资源丰富及大规模养殖密切相关[1],容易获得大量的靶蛋白。家蚕杆状病毒具有容纳外源大片段DNA或同时表达多个外源基因的能力;另外,家蚕杆状病毒不感染人、畜等脊椎动物,表达外源蛋白所需时间周期也远短于动物或植物系统,可通过昆虫或细胞培养对外源蛋白进行大规模生产,这些特性使BEVS成为目前最有效、应用最广泛的一种真核表达 系统[2]。
尽管BEVS系统有诸多优势以及技术上的不断改进,但在实践中还是面临着一些挑战,比如在培养的昆虫细胞中表达外源蛋白,其生产成本较为昂贵[3];BEVS系统中缺乏有效的荧光信号,难以对转染的细胞中是否产生感染性的重组病毒粒子进行快速判定,影响外源蛋白表达的进程;另外,与原核表达系统相比,利用BEVS系统表达的外源蛋白,其产量相对较低,尤其是感染后的细胞最终会裂解,致使靶蛋白的表达水平及其修饰还未达到最佳状态[4],而外源蛋白的表达量和翻译后修饰水平较低,会在很大程度上限制BEVS的应用。研究表明:通过增强启动子的活性、胞内共表达分子伴侣Hsp70等其他蛋白、抑制胞内一些蛋白酶的活性以及延迟细胞裂解等策略,都可提高BEVS中外源基因的表达产量[5, 6, 7]。
家蚕杆状病毒基因组大小为128 kb,理论预计有143个开放阅读框[8],其中几丁质酶和半胱氨酸蛋白酶基因紧挨排列在一起,其间隔序列有48 bp。序列分析表明:几丁质酶基因全长1 659 bp,编码一个由552个氨基酸组成的蛋白质;半胱氨酸蛋白酶基因全长972 bp,编码一个由323个氨基酸组成的蛋白质,研究表明几丁质酶能水解家蚕内外表皮、中肠及围食膜组织中的几丁质,促进虫体液化,而半胱氨酸蛋白酶与细胞裂解直接相关,能降解宿主体内蛋白[9, 10, 11]。因此,本文通过同源重组技术,对家蚕杆状病毒穿梭载体中Chitinase和Cystein Protease基因进行缺失,以缺失后的Bm-bacmid为分子载体,构建能表达家蚕二分浓核病毒NS1蛋白的重组病毒,从而延迟细胞裂解及虫体液化的时间,以期提高家蚕血液中NS1蛋白的表达产量。
1 材料与方法 1.1 质粒、菌株、病毒和试剂 家蚕杆状病毒穿梭载体Bm-bacmid、pUC119、pFastHTB-Pie1-
| Primer name | Primer sequence (5‘-3‘) | Enzyme digestion site |
| US-F | GCAAGCTTCGTATGCGTTTTGCTCGT | Hind Ⅲ |
| US-R | AACTGCAGCGCGCCAAGTTGGAACT | PstⅠ |
| Cm-F | AACTGCAGCTTCGAATAAATACCTGTGA | PstⅠ |
| Cm-R | AATCTAGAAACCAGCAATAGACATAAGC | XbaⅠ |
| Pie1-egfp-SV40-F | GCTCTAGAGTAGGTTATTGATAAAATGAAC | XbaⅠ |
| Pie1-egfp-SV40-R | CGAGCTCGATCCAGACATGATAAGATACATTG | SacⅠ |
| DS-F | GCGAGCTCGGAATTGATTAATCTGTCG | SacⅠ |
| DS-R | AGAGCTCAGCAGTAGACGCAAGTTCG | SacⅠ |
| ns1-F | ATACTAGTATGGAATCGAAGTCAAATTT | SpeⅠ |
| ns1-R | TACTCGAGCTACCCATAATATTTATTATATACG | XhoⅠ |
| Underlined letters indicate restriction enzyme digestion sites. | ||
通过软件Primer Premier 5.0设计4对特异性引物,首先通过US-F和US-R从Bm-bacmid中扩增长度为551 bp的US片段,对US片段与pUC119质粒分别进行Hind Ⅲ和PstⅠ双酶切,将酶切后的产物进行连接,获得pUC119-US重组质粒;其次通过Cm-F和Cm-R,从pKOV-Cm质粒中扩增长度为1 039 bp的Cm表达盒,对其进行PstⅠ和XbaⅠ双酶切,将酶切后的Cm表达盒与pUC119-US进行连接,获得pUC119-US-Cm;通过Pie1-egfp-SV40-F和Pie1-egfp-SV40-R从pFastHTB-Pie1-
通过US-F和DS-R引物对,从pUC119-US- Cm-Pie1-
通过转座,将多角体启动子控制的ns1表达盒定点插入到改造后的Bm-bacmid (ChiA-/CP-)中,具体实施流程如下:通过ns1-F和ns1-R从家蚕二分浓核病毒基因组中扩增ns1基因,对扩增片段进行SpeⅠ和XhoⅠ双酶切,将酶切后的纯化片段与经同样双酶切的pFastHTB质粒进行连接,产生重组质粒pFastHTB-ns1 。
采用氯化钙方法[12],制备含有Bm-bacmid及辅助质粒的大肠埃希菌DH10B感受态细胞,将5 ng的重组质粒pFastHTB-ns1添加到DH10B感受态细胞中,42 ℃热激45 s后,将800 μL SOC培养基加入到转化后的溶液中,在37 ℃、225 r/ min振荡培养2 h,取100 μL培养液与40 μg/mL IPTG和20 mg/mL X-gal混合,分别涂布于含三抗K+T+G+ (50 μg/mL卡那霉素,5 μg/mL四环素,7 μg/mL庆大霉素) LB平板上,37 ℃培养36-48 h,对平板上较大的白色单菌落进行PCR鉴定。理论上,在转座酶的作用下,重组质粒pFastHTB-ns1中Tn7L-Tn7R之间的序列,可定点插入到Bm-bacmid (ChiA-/CP-) 中,从而获得可表达BmBDV NS1蛋白的重组Bm-bacmid-ns1 (ChiA-/CP-)。
1.5 制备重组病毒上清从DH10B大肠杆菌细胞中抽提重组Bm-bacmid-ns1 (ChiA-/CP-),在Cellfectin® (Invitrogen) 的介导下,将这重组杆状病毒载体转染BmN细胞,对转染后的细胞进行荧光显微观察,转染96 h后,对能观察到荧光的转染孔中,收集其孔中的细胞转染上清,将收集的转染上清感染BmN细胞,对感染后的BmN细胞进行荧光显微观察,收集感染96 h后的病毒上清,从而获得表达BmBDV NS1的病毒vBm- bacmid-ns1 (ChiA-/CP-);另外,将本实验室保存的vBm-bacmid-ns1 (不缺失Chitinase和Cystein Protease基因) 病毒感染BmN细胞,收集感染96 h后的vBm-bacmid-ns1上清溶液。
1.6 Western blotting分析和ELISA测定从皮下注射5 μL vBm-bacmid-ns1 (ChiA-/CP-) 病毒液到4龄家蚕 (306品系,易感品种) 体内,共注射30头易感品系家蚕;另外,从皮下分别注射5 μL vBm-bacmid-ns1病毒液到30头4龄同品系的家蚕中,每天给它们添饲新鲜的桑叶,于27 ℃的室温条件下自然生长,通过体式荧光显微镜对感染病毒的家蚕进行荧光观察,可对病毒在家蚕体内的增殖动态过程进行实时了解,收集两种病毒感染后的家蚕血液,并对家蚕血液中表达的NS1蛋白进行Western blotting检测。通过ELISA实验对两种家蚕血液中的NS1蛋白浓度进行测定,将待检测的抗原固定于酶标孔中,每孔100 μL于4 ℃孵育12 h,加入5%脱脂奶粉于37 ℃封闭2 h,倾去孔中的溶液并用PBS-T洗涤3次,每次3 min,加入NS1单克隆抗体于37 ℃孵育1 h,接着加入羊抗小鼠IgG-HRP于37 ℃孵育0.5 h,倾去孔中溶液并洗涤3次,加入OPD底物显色,37 ℃湿盒温育30 min,通过2 mol/L H2SO4终止显色反应,利用酶标仪测定其在492 nm波段处的吸光值,以系列浓度的BSA与其对应的OD值做标准曲线用作参考。
2 结果 2.1 重组质粒pUC119-US-Cm-Pie1- 为获得同源四联体片段US-Cm- Pie1-
|
|
图1
重组质粒pUC119-US-Cm-Pie1- |
鉴于该重组质粒中酶切位点的复杂性,通过多轮PCR对该质粒进行反复鉴定,通过US-F/US-R引物对扩增长度为551 bp的US片段 (图2,泳道1);通过Cm-F/Cm-R引物对扩增长度为1 079 bp的 Cm表达盒 (图2,泳道2);通过Pie1-egfp-SV40-F/Pie1-egfp-SV40-R引物对扩增长度为1 544 bp的 egfp表达盒 (图2,泳道3);通过DS-F/DS-R引物对扩增长度为514 bp的DS片段 (图2,泳道4);通过US-F/Cm-R引物对扩增长度为1 630 bp的US+Cm表达盒 (图2,泳道5);通过US-F/Pie1-egfp-SV40-R引物对扩增长度为3 174 bp的US+Cm表达盒+egfp表达盒 (图2,泳道6);通过US-F/DS-R引物对扩增长度为3 688 bp的US+Cm表达盒+egfp表达盒+DS片段 (图2,泳道7);通过Cm-F/Pie1-egfp-SV40-R引物对扩增长度为 2 623 bp的Cm表达盒+egfp表达盒 (图2,泳道8);通过Cm-F/DS-R引物对扩增长度为3 137 bp的Cm表达盒+egfp表达盒+DS片段 (图2,泳道9);通过Pie1-egfp-SV40-F/DS-R引物对扩增长度为2 058 bp的egfp表达盒+DS片段 (图2,泳道10),对扩增产物进行DNA凝胶电泳,结果与理论预计一致,将PCR鉴定的重组质粒进行序列测定,结果表明测定序列与理论序列完全一致。

|
|
图2
重组质粒pUC119-US-Cm-Pie1- |
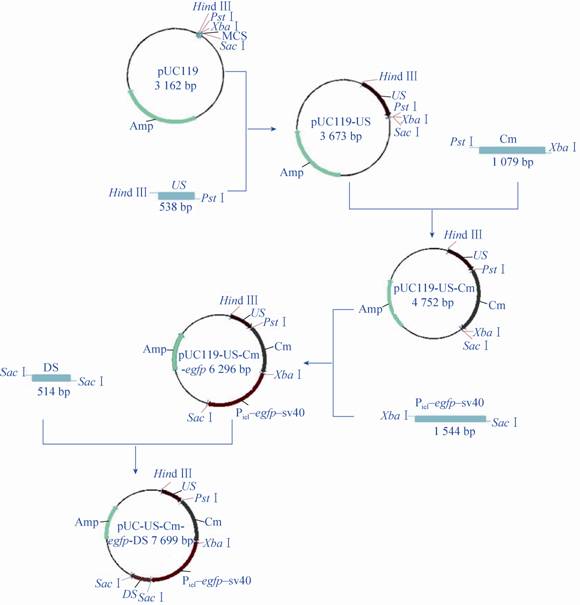
重组Bm-bacmid (ChiA-/CP-) 和野生型Bm-bacmid如图3A所示,通过同源重组,使串联的Cm和egfp表达盒替换串联的Chitinase和Cystein Protease基因中的部分DNA片段。利用不同的引物对在重组Bm-bacmid (ChiA-/CP-) 和野生型Bm-bacmid上所处的位置 (图3B) 不同,分别从野生型和缺失型Bm-bacmid中进行PCR扩增,对扩增产物进行琼脂糖凝胶电泳分析 (图3C)。泳道1、3、5、7、9:以缺失型Bm-bacmid (ChiA-/CP-) 为模板,分别通过Cm-F/Cm-R扩增Cm基因表达盒、Pie1-egfp-SV40-F/Pie1-egfp-SV40-R扩增egfp基因表达盒、Cm-F/Pie1-egfp-SV40-R扩增Cm与egfp基因表达盒、US-F/Cm-R扩增US与Cm表达盒,以及US-F/DS-R扩增包括US、Cm表达盒、egfp基因表达盒与DS 4个DNA片段;泳道2、4、6、8、10:以野生型Bm-bacmid为模板,以Cm-F/Cm-R、Pie1-egfp-SV40-F/Pie1-egfp-SV40-R、Cm-F/Pie1-egfp-SV40-R、US-F/Cm-R及US-F/DS-R为引物对进行扩增,扩增产物用作阴性对照,电泳结果与理论预计相一致,表明已成功获得重组Bm-bacmid (ChiA-/CP-),可用作表达外源基因的分子载体。
|
| 图3 缺失型重组Bm-bacmid (ChiA-/CP-) 的构建流程示意图和PCR鉴定 Fig.3 Strategy for construction of Bm-bacmid (ChiA-/CP-) and confirmation by PCR analysis. M: DNA marker; 1,3,5,7,9: deleted Bm-bacmid; 2,4,6,8,10: wt Bm-bacmid. |
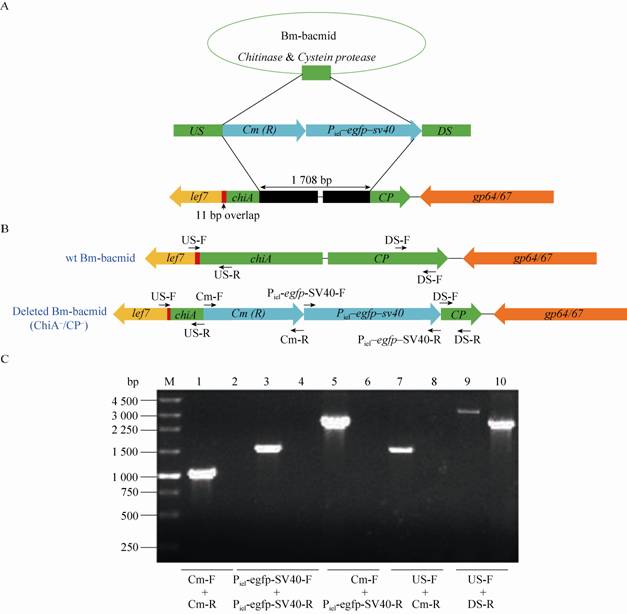
为鉴定缺失的Bm-bacmid (ChiA-/CP-) 能否产生具有感染性的病毒粒子,对重组Bm-bacmid (ChiA-/CP-) 转染的细胞进行荧光显微观察,结果如图4 A所示:转染24 h后,在细胞之中能观察到一些零星的绿色荧光,转染48 h后,发现在视野中能观察到的绿色荧光信号越来越多,到转染96 h后,80%的视野中都布满了绿色荧光。为鉴定转染上清中是否产生了感染性的病毒粒子,将转染96 h后的细胞上清与培养的BmN细胞孵育1 h,弃上清并添加含10%胎牛血清的细胞培养基,对感染后的BmN细胞进行荧光显微观察,结果如图4 B所示:在感染24-96 h时间段,发现细胞中能观察到的绿色荧光越来越多,说明转染后的上清中能产生具有感染性的病毒粒子,具有启动下一轮感染的能力。该结果表明:缺失Chitinase和Cystein Protease的重组Bm-bacmid (ChiA-/CP-),不会影响感染性病毒粒子的产生,以该缺失型杆粒作分子载体,可用作高效表达外源基因的重组病毒载体。

|
| 图4 转染或感染的BmN细胞中不同时间点的荧光显微观察 Fig.4 Fluorescence micrographs of BmN cells transfected with bacmids or infected with virus at different time points. |
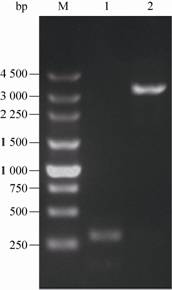
利用鉴定的Bm-bacmid (ChiA-/CP-) 为分子载体,通过转座,将多角体启动子控制的ns1基因表达盒定点插入到该载体的转座位点,利用M13-F/M13-R引物对,对发生转座后的白色克隆进行PCR鉴定,未发生转座的Bm-bacmid中扩增产物为280 bp左右,而发生转座的Bm-bacmid中扩增产物为3 200 bp左右,电泳结果如图5所示,其结果与理论预计相一致,表明ns1基因表达盒已成功地插入到Bm-bacmid (ChiA-/CP-) 转座位点。
|
| 图5 重组Bm-bacmid-ns1 (ChiA-/CP-) 的PCR鉴定 Fig.5 Identification of the recombinant Bm-bacmid-ns1(ChiA-/CP-) by PCR. |
抽提重组Bm-bacmid-ns1 (ChiA-/CP-),通过脂质体的介导,将其转染培养的BmN细胞,对转染后的细胞进行绿色荧光显微观察,收集有荧光的孔中上清溶液,将其再次感染培养的BmN细胞,收集感染96 h后的细胞上清,从而获得重组病毒vBm-bacmid-ns1 (ChiA-/CP-) 溶液,可用于下一步的家蚕感染实验中。
2.5 两种重组病毒感染的家蚕血液中NS1蛋白的鉴定分别收集vBm-bacmid-ns1 (ChiA-/CP-) 和vBm-Bacmid-ns1病毒感染的家蚕血液,以vBm-Bacmid病毒感染的家蚕血液为空白对照 (图6泳道1),对收集的家蚕血液蛋白浓度进行测定,对等量的家蚕血液蛋白进行Western blotting分析,以NS1单克隆抗体为一抗进行孵育,偶联有碱性磷酸酶的马抗小鼠IgG为二抗,通过BCIP/NBT碱性磷酸酯酶试剂盒对其进行显色,结果表明:重组病毒vBm-bacmid-ns1 (ChiA-/CP-) 和vBm-bacmid-ns1病毒感染的家蚕血液中,都能够鉴定到NS1的表达,但它们的表达量有明显的差异,在vBm-bacmid-ns1 (ChiA-/CP-) 病毒感染的家蚕血液中,其靶蛋白NS1 (图6泳道3)的表达量明显多于对照组 (图6泳道2)。利用ELISA方法对家蚕血液中NS1蛋白浓度进行测定,结果发现vBm-bacmid-ns1 (ChiA-/CP-) 病毒感染的家蚕血液中,NS1蛋白浓度大约是对照组的3倍,该结果表明:以缺失几丁质酶和半胱氨酸蛋白酶基因的病毒为载体,能有效地提高BmBDV NS1的表达。

|
| 图6 病毒感染的家蚕血液中NS1蛋白鉴定 Fig.6 Western blotting analysis of BmBDV NS1 protein from the hemocyte of silkworms. |
家蚕是我国一种具有重要经济价值的昆虫,主要以桑叶为食,只需要一些简单的设备就可对家蚕进行大规模饲养,其生产的蚕丝是我国农业经济的重要组成部分,在改善民生和可持续发展中起着重要的作用。2009年已完成家蚕全基因组序列的测定和分析[13],其遗传背景清楚,饲养成本低廉,在家蚕体内表达外源蛋白所需时间较短,容易对靶蛋白进行大规模生产,是一种非常优良的生物反应器,也是实现基因工程产业化的理想载体。另外,Luckow 等和Possee等[14, 15]建立了一种高效、快速的用来构建重组病毒的筛选体系,剔除了多轮空斑筛选的繁琐程序,提高重组病毒的阳性得率,由此,极大地简化了家蚕重组杆状病毒的构建、分离、鉴定以及定量,由此使家蚕杆状病毒表达系统的应用得到了推广。自1985年利用该系统首次成功表达人干扰素-α以来[1],截止到目前为止,已通过BEVS在家蚕体内成功地表达了乙型肝炎表面抗原、人酸性/碱性成细胞生长因子、荧光素酶以及纤维素酶等上千种具有重要功能的重组蛋白[16, 17, 18, 19, 20]。
尽管BEVS系统有诸多优势以及技术上的不断改进,但在实践中还是面临着一些挑战,比如在培养的昆虫细胞中表达外源蛋白,其生产成本较为昂贵[21];其次,BEVS系统中缺乏有效的荧光信号,难以对转染的细胞中是否产生感染性的重组病毒粒子作出快速判定,影响外源蛋白表达的进程;最关键的是,与原核表达系统相比,在BEVS中所表达的外源蛋白,其产量相对较低,尤其是感染后的细胞最终会裂解,致使靶蛋白的表达水平及其修饰还未达到最佳状态[22],这些不足之处在一定程度上都限制了BEVS系统的使用。
为优化家蚕杆状病毒-昆虫细胞表达系统,本文对家蚕杆状病毒穿梭载体上的一些序列进行改造,通过同源重组技术,使串联的Cm基因表达盒和egfp表达盒成功地替换家蚕杆状病毒载体中的Chitinase和Cystein Protease,通过荧光显微观察,证实这两个基因的缺失并不影响家蚕杆状病毒的增殖,可用作表达外源基因的分子载体;同时,在家蚕杆状病毒载体中引入绿色荧光信号,也极大地简化了转染或感染细胞中重组病毒粒子的鉴定,缩短了外源蛋白表达所需的时间。Lee等也曾构建Chitinase基因缺失的病毒,利用该缺失载体来构建可表达纤维素酶的重组病毒,结果发现在感染的家蚕幼虫中,纤维素酶的表达量提高了17%[23];另外,通过抑制组织蛋白酶的表达,可提高绿色荧光蛋白3倍的表达量[24]。在本研究中,利用Chitinase和Cystein Protease基因同时缺失的Bm-bacmid为分子载体,缺失有效地提高了BmBDV NS1的表达产量。由此可知,通过缺失Chitinase和Cystein Protease基因,延长病毒感染的昆虫细胞存活时间,抑制靶蛋白的降解,确实显著地提高了ns1的表达量,为NS1蛋白的功能与结构研究奠定基础,同时也为大规模表达其他功能蛋白提供参考。
| [1] | Maeda S, Kawai T, Obinata M, et al. Production of human alpha-interferon in silkworm using a baculovirus vector. Nature, 1985, 315(6020): 592-594. |
| [2] | Kato T, Kajikawa M, Maenaka K, et al. Silkworm expression system as a platform technology in life science. Appl Microbiol Biotechnol, 2010, 85(3): 459-470. |
| [3] | Tiwari P, Saini S, Upmanyu S, et al. Enhanced expression of recombinant proteins utilizing a modified baculovirus expression vector. Mol Biotechnol, 2010, 46(1): 80-89. |
| [4] | Ikonomou L, Schneider YJ, Agathos SN. Insect cell culture for industrial production of recombinant proteins. Appl Microbiol Biotechnol, 2003, 62(1): 1-20. |
| [5] | Pijlman GP, de Vrij J, van den End FJ, et al. Evaluation of baculovirus expression vectors with enhanced stability in continuous cascaded insect-cell bioreactors. Biotechnol Bioeng, 2004, 87(6): 743-753. |
| [6] | Kost TA, Condreay JP, Jarvis DL. Baculovirus as versatile vectors for protein expression in insect and mammalian cells. Nat Biotechnol, 2005, 23(5): 567-575. |
| [7] | Fath-Goodin A, Kroemer J, Martin S, et al. Polydnavirus genes that enhance the baculovirus expression vector system. Adv Virus Res, 2006, 68: 75-90. |
| [8] | Gomi S, Majima K, Maeda S. Sequence analysis of the genome of Bombyx mori nucleopolyhedrovirus. J Gen Virol, 1999, 80 (Pt 5): 1323-1337. |
| [9] | Hawtin RE, Zarkowska T, Arnold K, et al. Liquefaction of autographa californica nucleopolyhedrovirus-infected insects is dependent on the integrity of virus-encoded chitinase and cathepsin genes. Virology, 1997, 238(2): 243-253. |
| [10] | Hodgson JJ, Arif BM, Krell PJ. Interaction of Autographa californica multiple nucleopolyhedrovirus cathepsin protease progenitor (proV-CATH) with insect baculovirus chitinase as a mechanism for proV-CATH cellular retention. J Virol, 2011, 85(8): 3918-3929. |
| [11] | Kadono-Okuda K, Yamamoto M, Higashino Y, et al. Baculovirus-mediated production of the human growth hormone in larvae of the silkworm, Bombyx mori. Biochem Biophys Res Commun, 1995, 213(2): 389-396. |
| [12] | Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: A Laboratory Manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989: 20-25. |
| [13] | Xia Q, Guo Y, Zhang Z, et al. Complete resequencing of 40 genomes reveals domestication events and genes in silkworm (Bombyx). Science, 2009, 326(5951): 433-436. |
| [14] | Luckow VA, Lee SC, Barry GF, et al. Efficient generation of infectious recombinant baculoviruses by site-specific transposon-mediated insertion of foreign genes into a baculovirus genome propagated in Escherichia coli. J Virol, 1993, 67(8): 4566-4579. |
| [15] | Possee RD, Hitchman RB, Richards KS, et al. Generation of baculovirus vectors for the high-throughput production of proteins in insect cells. Biotechnol Bioeng, 2008, 101(6): 1115-1122. |
| [16] | Likhoradova OA, Bachurina EIu, Azimova ShS. Biosynthesis of recombinant human hepatitis B M-HBsAg in silkworm larvae. Mol Biol (Mosk), 2004, 38(4): 717-722. |
| [17] | Wu X, Kamei K, Sato H, et al. High-level expression of human acidic fibroblast growth factor and basic fibroblast growth factor in silkworm (Bombyx mori L.) using recombinant baculovirus. Protein Expr Purif, 2001, 21(1): 192-200. |
| [18] | Palhan VB, Sumathy S, Gopinathan KP. Baculovirus mediated high-level expression of luciferase in silkworm cells and larvae. Biotechniques, 1995, 19(1): 97-98. |
| [19] | Lee KS, Je YH, Woo SD, et al. Production of a cellulase in silkworm larvae using a recombinant Bombyx mori nucleopolyhedrovirus lacking the virus-encoded chitinase and cathepsin genes. Biotechnol Lett, 2006, 28(9): 645-650. |
| [20] | Jarvis DL, Fleming JA, Kovacs GR, et al. Use of early baculovirus promoters for continuous expression and efficient processing of foreign gene products in stably transformed lepidopteran cells. Biotechnology, 1990, 8(10): 950-955. |
| [21] | Tiwari P, Saini S, Upmanyu S, et al. Enhanced expression of recombinant proteins utilizing a modified baculovirus expression vector. Mol Biotechnol, 2010, 46(1): 80-89. |
| [22] | Ikonomou L, Schneider YJ, Agathos SN. Insect cell culture for industrial production of recombinant proteins. Appl Microbiol Biotechnol, 2003, 62(1): 1-20. |
| [23] | Lee KS, Je YH, Woo SD, et al. Production of a cellulase in silkworm larvae using a recombinant Bombyx mori nucleopolyhedrovirus lacking the virus-encoded chitinase and cathepsin genes. Biotechnol Lett, 2006, 28(9): 645-650. |
| [24] | Kim EJ, Kramer SF, Hebert CG, et al. Metabolic engineering of the baculovirus-expression system via inverse "shotgun" genomic analysis and RNA interference (dsRNA) increases product yield and cell longevity. Biotechnol Bioeng, 2007, 98(3): 645-654. |
 2015, Vol. 31
2015, Vol. 31