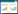服务
文章信息
- 谢利, 王芬, 曾瑞珍, 郭和蓉, 周玉亮, 张志胜
- Xie Li, Wang Fen, Zeng Ruizhen, Guo Herong, Zhou Yuliang, Zhang Zhisheng
- 农杆菌介导的墨兰遗传转化
- Agrobacterium-mediated transformation of Cymbidium sinensis
- 生物工程学报, 2015, 31(4): 542-551
- Chin J Biotech, 2015, 31(4): 542-551
- 10.13345/j.cjb.140358
-
文章历史
- Received: July 7, 2014
- Accepted: October 14, 2014
墨兰Cymbidium sinense香气浓郁、花枝挺俊、叶姿矫健,由于其在春节期间开花,已成为年宵花的重要种类之一,也是出口量最大的国兰之一。因此,加快墨兰新品种的选育对推动我国兰花产业的发展,提高兰花产业的核心竞争力具有重要意义[1]。
墨兰新品种选育多采用引种驯化结合选择育种的方法,但该方法不仅造成对兰花资源的破坏,而且难以获得突破性的品种。近年来杂交育种已成为墨兰育种的主要方法,但由于杂交育种年限长,目前采用该方法培育出的墨兰新品种也比较少,不能满足产业发展对新品种的要求。因此进一步研究墨兰育种方法对加快墨兰新品种选育,培育出有良好产业化前景的墨兰新品种具有重要意义。
转基因育种是快速培育观赏植物新品种的有效途径,迄今通过转基因方法已实现对观赏植物的株型、花色、花型、花期、观赏期、货架期、抗性等主要育种目标性状的有效改良,获得了50多种转基因观赏植物[2]。农杆菌介导法是转基因育种的主要方法[3],在兰科Orchidaceae植物中,采用农杆菌介导法已对兰属Cymbidium[4, 5, 6]、蝴蝶兰 Phalaenopsis[7, 8, 9, 10, 11]、石斛兰Dendrobium[12, 13, 14, 15, 16]、卡特兰Catteleya[17]和文心兰Oncidium[18]等进行了遗传转化,但尚未见到农杆菌介导墨兰遗传转化的研究报道。本试验以‘企剑白墨’墨兰C. sinensis cv. ‘Qijianbaimo’根状茎为受体材料,研究了预培养时间、乙酰丁香酮 (Acetosyringone,AS) 的添加方式及浓度、工程菌液浓度 (OD600)、侵染时间和共培养时间对墨兰遗传转化的影响,旨在建立农杆菌介导的墨兰遗传转化体系,为利用转基因方法培育墨兰新品种奠定基础。
1 材料与方法 1.1 材料转基因受体材料为‘企剑白墨’墨兰 (下称白墨) 茎尖培养形成的根状茎 (图1A),由课题组诱导和继代培养产生。根癌农杆菌菌株为EHA105,供试质粒为pCAMBIA 1305,启动子为35S启动子,T-DNA区含有潮霉素磷酸转移酶基因hpt和β-葡萄糖苷酸酶基因gus,农杆菌菌株和质粒由华南农业大学刘向东教授课题组惠赠。

|
| 图1 墨兰遗传转化体系 Fig.1 The genetic transformation system of C. sinensis. (A) Rhizomes for transformation. (B) Screening transformed rhizomes. (C) Bud differentiation of transformed rhizomes. (D) Transformed plantlet (arrow). |
挑取已活化的单菌落接种于含有50 mg/L Kan (硫酸卡那霉素) 和50 mg/L Rif (利福平) 的YEB液体培养基中,于28 ℃、150 r/min条件下振荡培养24-36 h,待菌液OD600值约为1.0左右时,室温7 000 r/min离心10 min,收集菌体,用配制好的悬浮培养基 (YEB液体培养基:MS液体培养基(V∶V)=1∶2,pH 5.2) 重新悬浮至OD600为0.9左右时备用。
1.3 影响白墨遗传转化效率的因素选取生长旺盛、带有幼嫩茎尖的根状茎,在继代培养基中进行预培养,选择生长良好的根状茎,在无菌条件下将其前端约1.0 cm长的幼嫩根状茎尖切下,并在其表面轻轻划出伤痕,然后将其浸入制备好的工程菌液中进行侵染 (期间不断振荡使菌液与根状茎充分接触),倒掉菌液,取出根状茎,用无菌滤纸吸干根状茎尖表面的多余菌液,转入铺有滤纸的共培养基中,在黑暗条件下进行共培养。共培养基为:MS+6-BA 2.0 mg/L+NAA 1.0 mg/L+蔗糖30 g/L+卡拉粉7.5 g/L,pH值为5.8。
1.3.1 预培养时间将预培养0、36、37、39和41 d的根状茎在添加200 μmol/L AS、OD600值为0.8的工程菌液中侵染35 min后,转入添加200 μmol/L AS的共培养基中培养7 d后统计GUS瞬时表达率。
1.3.2 工程菌液浓度将预培养39 d的根状茎在添加200 μmol/L AS、OD600值分别为0.2、0.4、0.6、0.9和1.2的工程菌液中侵染35 min,转入添加200 μmol/L AS的共培养基中培养7 d后统计GUS瞬时表 达率。
1.3.3 侵染时间将预培养39 d的根状茎在添加200 μmol/L AS、OD600值为0.7的工程菌液中分别侵染15、25、30、35、40和45 min后,转入添加200 μmol/L AS的共培养基中培养7 d后统计GUS瞬时表 达率。
1.3.4 AS的添加方式及浓度将预培养39 d的根状茎在添加不同浓度AS、OD600值为0.8的工程菌液中侵染35 min后,转入添加不同浓度AS的共培养基中培养 7 d后统计GUS瞬时表达率。
1.3.5 共培养时间将预培养39 d的根状茎在添加200 μmol/L AS、OD600值为0.7的工程菌液中侵染35 min后,转入添加200 μmol/L AS的共培养基中分别培养3、5、6、7和9 d后统计GUS瞬时表达率。
1.4 GUS瞬时表达率在共培养完成后,每个处理随机取40 条根状茎,用水洗净表面沾粘的菌丝,吸干水分,浸泡于X-gluc染液中,37 ℃黑暗条件下处理 18 h,然后用现配的卡诺液 (无水乙醇∶冰乙酸=3∶1) 脱色,观测染色情况,并统计GUS瞬时表达率,以无菌水处理的根状茎作为阴性对照。GUS瞬时表达率 (%)=(显色根状茎数)/(检测总根状茎数)×100。
1.5 白墨的遗传转化 1.5.1 侵染和共培养将预培养39 d的白墨根状茎在添加 200 μmol/L AS、OD600约为0.9的工程菌液中侵染35 min,然后转入添加200 μmol/L AS的共培养基中培养7 d。
1.5.2 脱菌筛选培养用含有250 mg/L头孢霉素的无菌水将经过共培养的根状茎冲洗3-4次,吸干多余水分后,将根状茎转接到筛选培养基MS+6-BA 2.0 mg/L+NAA 1.0 mg/L+头孢霉素250 mg/L+潮霉素B 50 mg/L+蔗糖30 g/L+卡拉粉7.5 g/L (pH 5.8,下同) 中进行脱菌培养和转化体筛选,每两周转接1次,转接时切除褐化及坏死的根状茎部分。筛选2-3次后,将根状茎转接到分化培养基1/2 MS+6-BA 5.0 mg/L+NAA 1.0 mg/L+头孢霉素250 mg/L+椰子汁200 mL/L+蔗糖 40 g/L+卡拉粉7.5 g/L中分化成苗,将株高1.5 cm左右的小苗接种于生根培养基1/2 MS+6-BA 5.0 mg/L+NAA 1.0 mg/L+香蕉80 g/L+蔗糖 40 g/L+卡拉粉7.5 g/L上进行生根壮苗培养。
1.6 转化植株的鉴定 1.6.1 PCR鉴定设计出检测gus基因 (371 bp) 的1对引物,上游序列为5′-ACGTCCTGTAGAAACCCCAAC C-3′,下游序列为5′-TCCCGGCAATAACATACG GCGT-3′,由北京奥科生物技术有限责任公司合成。采用改良CTAB法提取白墨试管苗叶片基因组DNA,以此为模板进行PCR扩增,以质粒DNA为阳性对照、未经农杆菌侵染的植株叶片为阴性对照。PCR扩增采用20 μL反应体系:10× PCR缓冲液2 μL,dNTPs 0.2 μL,上下游引物各1.5 μL,5 U Taq酶 0.2 μL,模板DNA 2 μL,超纯水补齐。反应程序为:94 ℃预变性5 min;94 ℃变性45 s,60 ℃退火45 min,72 ℃延伸 1 min 30 s,35个循环;最后72 ℃延伸10 min,4 ℃保存。PCR扩增结束后,吸取5 μL PCR反应产物于1.5%琼脂糖凝胶中进行电泳,电泳结束后在紫外凝胶成像仪上成像并拍照。共检测400株经抗性筛选的组培苗,按下述公式计算转化率:转化率 (%)=(PCR阳性的苗数)/(检测的苗数)x100。
1.6.2 GUS组织化学染色法检测在无菌条件下,切取少量经PCR检测为转基因植株的叶片和根尖,放入2.0 mL离心管中,加入X-gluc染液,盖紧盖子,37 ℃水浴18 h;倒掉X-gluc染液,加入卡诺固定液脱色;数小时后,观察染色情况,在Olympus PM-20型体视镜下进行镜检,并拍照。
2 结果 2.1 影响白墨根状茎遗传转化效率的因素 2.1.1 预培养时间预培养时间对白墨根状茎的GUS瞬时表达率有显著影响 (表1)。预培养39 d时瞬时表达率最高,为6.67%;预培养36、37和41 d的瞬时表达率与对照差异不显著。因此,在白墨的遗传转化中,预培养时间以39 d为宜。
| Pre-culture time (d) | No. of detected rhizomes | GUS transient expression rate (%) |
| 0 | 40 | 0.00±0.00b |
| 36 | 40 | 1.67±0.83b |
| 37 | 40 | 4.17±0.83ab |
| 39 | 40 | 6.67±2.20a |
| 41 | 40 | 2.50±1.44ab |
| Note: a,b in a column mean significant difference in different samples (P<0.05). | ||
AS的添加方式及浓度对白墨根状茎的GUS瞬时表达率有显著影响 (表2)。工程菌液和共培养基中均不添加AS时,瞬时表达率为0;仅在工程菌液中添加AS时,瞬时表达率与不添加AS无显著差异;在工程菌液和共培养基中均添加200 μmol/L AS时,瞬时表达率最高,而添加300 μmol/L AS时,瞬时表达率显著下降。因此,在白墨的遗传转化中,在工程菌液和共培养基中均添加200 μmol/L AS可提高转化效率。
| Concentration of AS in infection bacteria fluid (μmol/L) | Concentration of AS in co-culture medium (μmol/L) | No. of detected rhizomes | GUS transient expression rate (%) |
| 0 | 0 | 40 | 0.00±0.00b |
| 100 | 0 | 40 | 0.83±0.83b |
| 200 | 0 | 40 | 4.17±2.20ab |
| 100 | 100 | 40 | 3.33±2.20ab |
| 200 | 200 | 40 | 7.50±1.44a |
| 300 | 300 | 40 | 1.67±0.83b |
| Note: a,b in a column mean significant difference in different samples (P<0.05). | |||
工程菌液浓度对白墨根状茎的GUS瞬时表达率有显著影响 (表3)。OD600为0.2时瞬时表达率为0;OD600为0.2-0.9时,瞬时表达率随OD600值的增大而增大;OD600为0.9时,瞬时表达率最高,为11.67%。因此,农杆菌介导白墨的遗传转化中,工程菌液的OD600值为0.9左右比较合适。
| Bacterium concentration (OD600) | No. of detected rhizomes | GUS transient expression rate (%) |
| 0.2 | 40 | 0.00±0.00c |
| 0.4 | 40 | 1.67±0.83c |
| 0.6 | 40 | 4.17±2.20bc |
| 0.9 | 40 | 11.67±0.83a |
| 1.2 | 40 | 8.33±2.20ab |
| Note: a,b and c in a column mean significant difference in different samples (P<0.05). | ||
侵染时间对白墨根状茎的GUS瞬时表达率影响显著 (表4)。侵染时间为15 min时,瞬时表达率为0;随着侵染时间的延长,瞬时表达率逐渐升高;侵染时间为35 min和40 min时,瞬时表达率无显著差异;当侵染时间为40 min时,瞬时表达率最高,为10.0%;当侵染时间为 45 min时,瞬时表达率显著下降。因此,在白墨的遗传转化中,侵染时间为35-40 min比较 适宜。
| Infection time (min) | No. of detected rhizomes | GUS transient expression rate (%) |
| 15 | 40 | 0.00±0.00c |
| 25 | 40 | 1.67±0.83c |
| 30 | 40 | 2.50±0.00bc |
| 35 | 40 | 6.67±2.20ab |
| 40 | 40 | 10.00±1.44a |
| 45 | 40 | 3.33±1.67bc |
| Note: a,b and c in a column mean significant difference in different samples (P<0.05). | ||
共培养时间对白墨根状茎的GUS瞬时表达率有显著影响 (表5)。共培养3 d时,瞬时表达率为0;随着共培养时间的延长,瞬时表达率逐渐升高;共培养7 d时,瞬时表达率最高;共培养6-9 d时,瞬时表达率差异不明显。但共培养时间越长,根状茎受到的毒害越大。因此,在白墨的遗传转化中,共培养时间以7 d为宜。
| Co-culture time (d) | No. of detected rhizomes | GUS transient expression rate (%) |
| 3 | 40 | 0.00±0.00c |
| 5 | 40 | 2.50±0.00bc |
| 6 | 40 | 5.00±1.44ab |
| 7 | 40 | 7.50±1.44a |
| 9 | 40 | 5.83±2.20ab |
| Note: a,b and c in a column mean significant difference in different samples (P<0.05). | ||
取预培养39 d的根状茎 (图1A),表面轻轻划伤后浸入添加200 μmol/L AS、OD600为0.9的工程菌液中侵染35 min,转入添加200 μmol/L AS的培养基中共培养7 d,经转化体筛选 (图1B)、芽分化 (图1C) 和植株再生,获得了1批转化植株 (图1D)。
2.2.2 转基因植株的检测从转化植株中随机选取400株进行转基因检测,有3株扩增出与阳性对照同样大小的目的条带 (371 bp),其余植株未扩增出目的条带 (图2)。对3株PCR扩增为阳性的植株叶片和根尖进行GUS染色,转化植株叶片的切口边缘 (图3A) 及根尖 (图3B) 均呈现蓝色,表明gus基因在转化植株中已表达。

|
| 图2 墨兰转基因植株gus基因的PCR检测 Fig.2 PCR analysis of transformed plantlets of C. sinensis for gus gene. M: marker; 1: positive control; 2-4: target gene amplified; 5-8: target gene unamplified; 9-10: negative control. |

|
| 图3 墨兰转基因植株的GUS染色检测 Fig.3 The GUS histochemical staining of transformed plantlets of C. sinensis. (A) The leaf. 1,7: control; 2-6: transformed plantlets. (B) The root tip. 1: the control; 2-4: transformed plantlets. |
墨兰是具有重要的观赏价值、经济价值和文化价值的国兰之一,市场前景广阔,但新品种选育滞后限制了其产业高效可持续发展。本研究首次以‘企剑白墨’墨兰根状茎为受体,建立了农杆菌介导的墨兰遗传转化技术体系,成功地将gus基因转入‘企剑白墨’墨兰中。这为今后利用转基因技术培育墨兰新品种奠定了基础,对其他以根状茎为受体的国兰遗传转化研究也有重要的参考价值。
在兰花的遗传转化中,受体材料多为类原球茎 (PLBs),而以根状茎为受体的研究报道较少。Chen等[6]用OD600值为1.0的LBA4404菌液侵染玉花兰C. niveo-marginatum的根状茎,瞬时表达率高达100%,经过15个月的继代培养,根状茎的GUS表达率为31.3%,芽分化培养中芽的GUS表达率为58.3%,但未获得转基因植株。墨兰是兰花中较难进行组织培养的种类之一,不管是种子萌发还是茎尖培养最后均形成根状茎[19],由于墨兰根状茎的增殖速度慢、分化成苗难,且对农杆菌侵染不敏感,因此较难进行遗传转化。本研究结果也表明,用OD600值为0.9的EHA105菌液侵染墨兰根状茎,GUS瞬时表达率最高为11.67%,但转化效率仅为0.75%,遗传转化效率偏低。
影响农杆菌介导遗传转化效率的因素包括农杆菌菌株及其生长状态和菌液浓度、载体、受体材料及其生长状态、Vir基因的活化、侵染方式、共培养时间和温度、pH值、培养基成分、超声波处理和表面活性剂处理等[20, 21, 22, 23, 24, 25, 26, 27, 28]。本研究结果表明,受体的预培养时间、工程菌液浓度、侵染时间和共培养时间均对白墨根状茎的GUS瞬时表达率有显著影响,受体材料不进行预培养、工程菌液浓度低、侵染时间和共培养时间短均不利于墨兰的遗传转化。这与Chen等[6]在玉花兰上获得的适宜侵染时间为0.5-1.5 h,共培养时间对转化效率影响不明显的结果不一致,其可能的原因是与材料不同、菌株不同等有关。本研究结果还表明在工程菌液中不添加AS,GUS瞬时表达率为0,说明添加AS对Vir基因进行活化是墨兰遗传转化所必需的,在工程菌液和共培养基中同时添加200 μmol/L AS时,墨兰根状茎的GUS瞬时表达率最高,表明200 μmol/L AS有利于墨兰的遗传转化,这与在文心兰遗传转化[18]中使用的AS浓度一致,而与在玉花兰[6]、大花蕙兰[5]、蝴蝶兰 [9]、石斛兰[14]、卡特兰[17]等中使用的100 μmol/L浓度不同。选择合适的农杆菌菌株与高效的表达载体是农杆菌转化中至关重要的因素[14, 28]。本研究选用了对单子叶植物转化效率高的EHA105侵染白墨根状茎,并没有获得高的遗传转化效率,这是由于品种敏感性不同造成的,还是其他方面的原因有待进一步研究。
由于墨兰根状茎苗分化能力弱,导致部分转化的细胞未能分化出植株;同时根状茎表面粗糙且通常有大量根毛状物生长 (图1A和1B),会减弱农杆菌在根状茎上的附着;再加上在继代和芽分化培养时根状茎极易褐化,也会影响农杆菌对墨兰根状茎的转化。因此,选择苗分化能力强的受体材料、对受体根状茎进行真空或超声波处理、在侵染过程中使用表面活性剂以及在共培养基中添加抗氧化剂可能是进一步提高墨兰根状茎遗传转化效率的有效 措施。
| [1] |
Wang MG, Zeng RZ, Xie L, et al. In vitro polyploid induction and its identification in Cymbidium sinense. Chin Agric Sci Bull, 2011, 27(2): 132-136 (in Chinese). 王木桂, 曾瑞珍, 谢利, 等. 墨兰多倍体的离体诱导和鉴定. 中国农学通报, 2011, 27(2): 132-136. |
| [2] | Chandler SF, Sanchez C. Genetic modification; the development of transgenic ornamental plant varieties. Plant Biotechnol J, 2012, 10(8): 891-903. |
| [3] |
Wang GL, Fang HJ. Plant Genetic Engineering. Beijing: Science Press, 2009 (in Chinese). 王关林, 方宏筠. 植物基因工程. 北京: 科学出版社, 2009. |
| [4] |
Wang W, Yang XL, Yang J, et al. Study on Agrobacterium tumefaciens-mediated transformation of Cymbidium hybridum. Acta Bot Bor-Occid Sin, 2011, 31(1): 27-32 (in Chinese). 王微, 杨晓伶, 杨婧, 等. 根癌农杆菌介导大花蕙兰遗传转化的研究. 西北植物学报, 2011, 31(1): 27-32. |
| [5] | Chin DP, Mishiba K, Mii M. Agrobacterium- mediated transformation of protocorm-like bodies in Cymbidium. Plant Cell Rep, 2007, 26(6): 735-743. |
| [6] | Chen L, Hatano T, Niimi Y. High efficiency of Agrobacterium-mediated rhizome transformation in Cymbidium. Lindleyana, 2002, 17(3): 130-134. |
| [7] | Belarmino MM, Mii M. Agrobacterium-mediated genetic transformation of a Phalaenopsis orchid. Plant Cell Rep, 2000, 19(5): 435-442. |
| [8] | Chai ML, Xu CJ, Senthil KK, et al. Stable transformation of protocorm-like bodies in Phalaenopsis orchid mediated by Agrobacterium tumefaciens. Sci Hortic, 2002, 96(1): 213-224. |
| [9] | Mishiba K, Chin DP, Mii M. Agrobacterium- mediated transformation of Phalaenopsis by targeting protocorms at an early stage after germination. Plant Cell Rep, 2005, 24(5): 297-303. |
| [10] | Semiarti E, Indrianto A, Purwantoro A, et al. High-frequency genetic transformation of Phalaenopsis amabilis orchid using tomato extract-enriched medium for the pre-culture of protocorms. J Hort Sci Biotechnol, 2010, 85(3): 205–210. |
| [11] |
Hao YS, Du JZ, Sun Y. Study on the Agrobacterium-mediated transformation in Phalaenopsis. J Shanxi Agric Univ: Nat Sci, 2010, 30(3): 205-208 (in Chinese). 郝曜山, 杜建中, 孙毅. 农杆菌介导转化蝴蝶兰遗传体系的研究. 山西农业大学学报: 自然科学版, 2010, 30(3): 205-208. |
| [12] |
Zhang MB, Liang QZ, Xiao H, et al. Study on Agrobacterium-mediated transformation of Dendrobium. Acta Hortic Sin, 2008, 35(4): 565-570 (in Chinese). 张妙彬, 梁擎中, 肖浩, 等. 农杆菌介导石斛兰遗传转化的研究. 园艺学报, 2008, 35(4): 565-570. |
| [13] | Yu H, Yang SH, Goh CJ. Agrobacterium-mediated transformation of a Dendrobium orchid with the class 1 knox gene DOH1. Plant Cell Rep, 2001, 20(4): 301-305. |
| [14] | Men SZ, Ming XT, Liu RW, et al. Agrobacterium- mediated genetic transformation of a Dendrobium orchid. Plant Cell Tissue Organ Cult, 2003, 75(1): 63-71. |
| [15] |
Chen ZL, Duan J, Zeng SJ, et al. Agrobacterium- mediated transformation of Dendrobium orchid by targeting protocorms. Acta Sci Nat Univ Suny, 2007, 46(1): 86-90 (in Chinese). 陈之林, 段俊, 曾宋君, 等. 原球茎为转化受体的农杆菌介导石斛遗传转化. 中山大学学报: 自然科学版, 2007, 46(1): 86-90. |
| [16] | Sreeramanan S, Razip S, Midrarullah, et al. Preliminary factors influencing transient expression of Gusa in Dendrobium savin white protocorm- like bodies (PLBs) using Agrobacterium-mediated transformation system. World Appl Sci J, 2009, 7(10): 1295–1307. |
| [17] | Zhang L, Chin DP, Mii M. Agrobacterium- mediated transformation of protocorm-like bodies in Cattleya. Plant Cell Tissue Organ Cult, 2010, 103(1): 41-47. |
| [18] | Liau CH , You SJ, Prasad V, et al. Agrobacterium tumefaciens-mediated transformation of an Oncidium orchid. Plant Cell Rep, 2003, 21(10): 993-998. |
| [19] |
Zhang ZS, Ou XJ. Tissue culture of Cymbidium sinense. Acta Hortic Sin, 1995, 22 (3): 303-304 (in Chinese). 张志胜, 欧秀娟. 墨兰的组织培养. 园艺学报, 1995, 22(3): 303-304. |
| [20] | Villemont E, Dubois F, Sangwan RS, et al. Role of the host cell cycle in the Agrobacterium-mediated genetic transformation of Petunia: evidence of an S-phase control mechanism for T-DNA transfer. Planta, 1997, 201(2): 160-172. |
| [21] | Beranová M, Rakousky S, Vávrová Z, et al. Sonication assisted Agrobacterium-mediated transformation enhances the transformation efficiency in flax (Linux usitatissimum L.). Plant Cell Tissue Organ Cult, 2008, 94(3): 253-259. |
| [22] | Kim MJ, Baek K, Park CM. Optimization of conditions for transient Agrobacterium-mediated gene expression assays in Arabidopsis. Plant Cell Rep, 2009, 28(8): 1159-1167. |
| [23] |
Liu SQ, Yu PT. Influencing factors of Agrobacterium-mediated higher plants transformation. Chin J Nat, 2003, 25(1): 16-21 (in Chinese). 刘石泉, 余沛涛. 农杆菌介导高等植物基因转化的影响因素. 自然杂志, 2003, 25(1): 16-21. |
| [24] |
Ye XG, Wang XM, Wang K, et al. A review of some assisted strategies for improving the efficiency of Agrobacterium-mediated plant transformation. Sci Agric Sin, 2012, 45(15): 3007-3019 (in Chinese). 叶兴国, 王新敏, 王轲, 等. 提高植物农杆菌转化效率辅助策略研究进展. 中国农业科学, 2012, 45(15): 3007-3019. |
| [25] |
Dong XC, Du JZ, Wang AL, et al. Role of acetosyringone in plants transformation researcher. Chin Agric Sci Bull, 2011, 27(5): 292-299 (in Chinese). 董喜才, 杜建中, 王安乐, 等. 乙酰丁香酮在植物转基因研究中的作用. 中国农学通报, 2011, 27(5): 292-299. |
| [26] |
Zhang SZ, Rong TZ. Advance of Agrobaterium- mediated genetic transformation system of maize (Zea mays L.). Hereditas, 2008, 30(10): 1249–1256 (in Chinese). 张素芝, 荣廷昭. 农杆菌介导的玉米遗传转化系统研究进展. 遗传, 2008, 30(10): 1249-1256. |
| [27] | Tanaka Y, Katsumoto Y, Brugliera F, et al. Genetic engineering in floriculture. Plant Cell Tissue Organ Cult, 2005, 80(1): 1–24. |
| [28] |
Zhang J, Zhou Y. Advance and some strategies of monocotyledons transformation mediated by Agrobacterium tumefaciens. Biotechnol Bull, 2013, (5): 7–14 (in Chinese). 张洁, 周岩. 根癌农杆菌转化单子叶植物的研究进展与对策. 生物技术通报, 2013, (5): 7–14. |
 2015, Vol. 31
2015, Vol. 31