服务
文章信息
- 李凤, 马江锋, 吴明科, 冀亚亮, 陈吴方, 任心怡, 姜岷
- Li Feng, Ma Jiangfeng, Wu Mingke, Ji Yaliang, Chen Wufang, Ren Xinyi, Jiang Min
- 重组大肠杆菌利用蔗糖及糖蜜发酵生产丁二酸
- Succinic acid production from sucrose and sugarcane molasses by metabolically engineered Escherichia coli
- 生物工程学报, 2015, 31(4): 534-541
- Chin J Biotech, 2015, 31(4): 534-541
- 10.13345/j.cjb.140364
-
文章历史
- Received: July 9, 2014
- Accepted: October 27, 2014
丁二酸 (Succinic acid) 是一些原核和真核微生物的主要中间代谢产物,作为重要的C4平台化合物广泛应用于食品、农业和制药行业[1, 2, 3]。与化学合成法相比,生物转化法生产丁二酸具有利用可再生资源、能耗低、污染小且在发酵过程中可固定温室气体CO2等优点[4, 5]。
目前利用廉价废弃生物质作为碳源发酵生产丁二酸成为研究热点,木质纤维素原料如秸秆[6]、玉米芯[7]、甘蔗渣[8]等经过处理后得到的水解液中含有大量可发酵糖如木糖、葡萄糖、阿拉伯糖等。利用水解液作为生产丁二酸的原料,能够降低生产成本并减少废弃生物质对环境造成的污染。制糖工业中主要的副产物甘蔗糖蜜,与秸秆等木质纤维素原料相比,不需要进行预处理即含有大量的可发酵糖,其中绝大多数为蔗糖,同时含有无机盐、维生素等成分,可提供微生物生长代谢所需的营养物质,是十分具有潜力的廉价生物质资源[9, 10]。
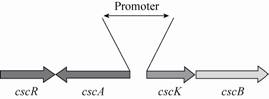
产琥珀酸厌氧螺菌Anaerobiospirillum succiniciproducens[11]、产琥珀酸放线杆菌Actinobacillus succinogenenes[12]等野生菌可以利用蔗糖生产较高浓度的丁二酸,但因甲酸、乙酸等副产物积累较多,且其发酵原料成本较高,其工业化进程受到了阻碍。大肠杆菌由于遗传背景清晰、易操作、培养基要求简单和生长迅速等优点,被广泛研究来获得产丁二酸优秀菌 株[13, 14, 15]。但是目前报道的大多数大肠杆菌不能利用蔗糖。Lee等[16]通过外源引入来自产琥珀酸曼氏杆菌Mannheimia succiniciproducens的sacC使Escherichia coli K12具有代谢蔗糖的能力。scrK、Y、A、B、R基因共同组成PTS蔗糖利用系统。通过导入质粒PUR400 (包含scrK、Y、A、B、R基因),E. coli HD701可以通过PTS蔗糖利用系统代谢蔗糖生产氢气[17]。Wang等[18]也将PTS蔗糖代谢途径引入过量表达丙酮酸羧化酶的E. coli SBS550MG中,结果表明重组菌以蔗糖为碳源发酵产丁二酸32.65 g/L,生产强度达到0.34 g/(L·h)。除了PTS蔗糖利用系统,蔗糖的代谢途径还包含非PTS蔗糖利用系统[19],该系统包含cscB、cscA、cscK、cscR基因及其自身的启动子 (图1),基因cscR编码阻遏蛋白会影响蔗糖的利 用[20],所以csc基因簇克隆表达时,只克隆cscB、cscA、cscK 三个基因。Olson 等[21]将E. coli ATCC 13281的cscBKA引入产酪氨酸的大肠杆菌中,使其能够以蔗糖为碳源合成酪氨酸,减少生产酪氨酸的成本。
|
| 图1 E. coli W中csc蔗糖利用系统及其自身启动子 Fig.1 csc sucrose-utilization operon and their native promoter in E. coli W. |
本研究通过引入来自E. coli W的非PTS蔗糖利用系统,得到重组菌E. coli AFP111/pMD19T- cscBKA,使原先不能利用蔗糖生长代谢的AFP111具备代谢蔗糖生产丁二酸的能力,其代谢途径如图2所示。并考察重组菌利用廉价废弃甘蔗糖蜜作为碳源经济高效制备丁二酸的可行性。

|
| 图2 AFP111/pMD19T-cscBKA蔗糖代谢途径 Fig.2 Mechanism of sucrose metabolism in AFP111/pMD19T-cscBKA. |
菌株E. coli W (ATCC 9637) 由本实验室保藏;菌株E. coli AFP111 [F+ λ-rpoS396(Am) rph-1 ∆(pflAB::Cam) ∆(ldhA::Kan) ∆ptsG],由南伊利诺伊卡本代尔大学Clark教授惠赠,作为宿主菌和对照菌。质粒pMD19-T购自TaKaRa公司。
1.1.2 主要试剂氨苄青霉素、氯霉素、硫酸卡那霉素为上海生工生物工程技术服务有限公司产品;基因组提取试剂盒、质粒小量快速提取试剂盒和琼脂糖凝胶DNA回收试剂盒为北京天根生化科技有限公司产品;加A试剂盒、限制性内切酶、Pyrobest DNA聚合酶和SolutionⅠ连接酶为大连宝生物有限公司产品;酵母提取物和胰蛋白胨为Oxoid公司产品;CO2气体购自南京上元工业气体厂;甘蔗糖蜜购自广州甘蔗糖业研究所;其他试剂为国产分析纯。
1.2 方法 1.2.1 cscBKA基因簇的克隆引物设计:参照cscBKA基因簇序列 (来源于E. coli W基因组,cscB、cscK、cscA对应的GenBank Accession No.分别为ECW_m2594、 ECW_m2595、ECW_m2596),设计不带酶切位点的引物,并由南京金斯瑞生物技术有限公司合成。引物序列见表1。
| Primer name | Primer sequence (5ʹ-3ʹ) | Primer size (bp) |
| Forward | CCGGTTGAGGGATATAGAGCTATCGAC | 27 |
| Reverse | CTGTTGATCCGTTGTTCCACCTGAT | 25 |
PCR反应体系:模板DNA (E. coli W基因组) (200 ng/μL) 0.5 μL,上下游引物 (50 μmol/L)各1 μL,dNTPs (10 mmol/L) 4 μL,10×Pyrobest 缓冲液Ⅱ5 μL,Pyrobest DNA聚合酶 (2.5 U/μL) 1 μL,ddH2O 37.5 µL。总体积50 μL。
PCR反应条件:94 ℃预变性5 min;94 ℃ 45 s,60 ℃ 45 s,72 ℃ 4 min,30个循环;72 ℃ 10 min。
1.2.2 重组质粒的构建加“A”反应体系:10×A-Tailing缓冲液5 μL,dNTPs 4 μL,PCR回收产物 (末端平滑DNA片段260 ng/μL) 10 μL,A-Tailing酶0.5 μL,ddH2O 30.5 µL。总体积50 µL。72 ℃反应20 min,最终片段平滑末端分别加“A”碱基。
经过加A反应后的片段,与pMD19-T载体在SolutionⅠ的作用下16 ℃连接过夜,获得重组质粒pMD19T-cscBKA并转化于E. coli AFP111感受态中。涂布于含氨苄青霉素、氯霉素和硫酸卡那霉素的LB平板上,37 ℃培养12 h后挑选单菌落,提取质粒后进行限制性内切酶Hind Ⅲ单酶切鉴定。
1.2.3 培养基种子培养基的配方为:蛋白胨10 g/L,酵母粉5 g/L,NaCl 5 g/L,氯霉素、硫酸卡那霉素和氨苄青霉素添加终浓度分别为25、30、100 μg/mL。
发酵培养基的配方为:柠檬酸3 g/L,Na2HPO4·12H2O 4 g/L,KH2PO4 8 g/L,(NH4)2HPO4 8 g/L,NH4Cl 0.2 g/L,(NH4)2SO4 0.75 g/L,MgSO4·7H2O 1 g/L,CaCl2·2H2O 10.0 mg/L,ZnSO4·7H2O 0.5 mg/L,CuCl2·2H2O 0.25 mg/L,MnSO4·H2O 2.5 mg/L,CoCl2·6H2O 1.75 mg/L,H3BO3 0.12 mg/L,Al2(SO4)3 1.77 mg/L,Na2MoO4·2H2O 0.5 mg/L,柠檬酸铁16.1 mg/L,20.0 mg/L VB1,2.0 mg/L生物素,氯霉素、硫酸卡那霉素和氨苄青霉素添加终浓度分别为25、30、100 μg/mL,根据需要补加蔗糖或糖蜜。
1.2.4 培养方法有氧摇瓶培养:将保存于−80 ℃的菌种在加有相应抗生素的LB平板上活化,挑单菌落到5 mL LB试管,37 ℃、200 r/min培养过夜,1%接种量接种到含有50 mL LB培养基的500 mL三角瓶中,37 ℃、200 r/min培养6−8 h。
厌氧血清瓶发酵:10%的菌液转接到含有16 g/L碱式碳酸镁和20 g/L蔗糖的发酵培养基中,通入过滤除菌后的CO2气体2 min,保证血清瓶中为厌氧环境,37 ℃、200 r/min厌氧发酵,发酵周期72 h。
3 L发酵罐两阶段发酵:将种子液以10%的接种量接入装有1.5 L发酵培养基的3 L发酵罐 (BioFlo 110 fermenter;New Brunswick Scientific Co.,Edison,N.J.)。初糖浓度为30 g/L,20% NaOH调节pH 6.8,37 ℃有氧培养至初糖耗尽;厌氧阶段,无菌过滤条件下通CO2气体,通气量0.5 L/min,20%的Na2CO3调节pH 6.6,37 ℃、200 r/min厌氧发酵30 h。
1.2.5 发酵及代谢物分析细胞生长量用紫外可见分光光度计于波长600 nm处测定吸光度值,细胞干重 (Dry cell weight,DCW) 由OD600换算得到,换算公式为:DCW (g/L)=0.4×OD600。发酵过程中糖及有机酸用高效液相色谱法 (HPLC) 检测。色谱柱BP-100Pb++用来分析发酵过程中的蔗糖、葡萄糖及果糖,流动相为ddH2O,流速0.4 mL/min,柱温80 ℃,示差折光检测器检测。色谱柱Prevail Organic Acid用来分析发酵过程中的有机酸,流动相为25 mmol/L KH2PO4 (pH 2.5),流速1.0 mL/min,柱温25 ℃,紫外检测器检测,检测波长215 nm。
2 结果与分析 2.1 csc基因簇的克隆与表达PCR扩增后得到的cscBKA基因片段经过加A反应与载体pMD19-T进行连接,构建重组质粒pMD19T-cscBKA。
重组质粒pMD19T-cscBKA经Hind Ⅲ酶切后得到的条带为6 575 bp (图3),结果与预期一致。测序结果显示目的片段与公布的序列100%匹配。

|
| 图3 重组质粒pMD19T-cscBKA的单酶切鉴定 Fig.3 Identification of pMD19T-cscBKA by enzyme digestion. M: DNA marker; 1: pMD19T-cscBKA digested with Hind Ⅲ. |
以蔗糖为唯一碳源进行纯厌氧血清瓶发酵,比较出发菌株AFP111和重组菌株AFP111/pMD19T-cscBKA利用蔗糖生产丁二酸的能力,结果如表2所示。
| Strains | DCW (g/L) | Sucrose consumed (g/L) | Glucose residue (g/L) | Fructose residue (g/L) | Succinic acid (g/L) | Acetic acid (g/L) | Productivity (g/(L·h)) |
| AFP111 | 0.24±0.02 | ND | ND | ND | ND | ND | ND |
| AFP111/pMD19T-cscBKA | 1.51±0.04 | 20.48±0.20 | 2.01±0.10 | 2.91±0.10 | 12.00±0.16 | 1.19±0.09 | 0.17±0.01 |
ND: not detected. Each value is the mean of three parallel replicates±standard deviation ( ±s). ±s).
| |||||||
72 h纯厌氧发酵结束后,出发菌株AFP111细胞干重仅为0.24 g/L,没有蔗糖消耗且没有丁二酸的积累,表明该菌株不能利用蔗糖生产丁二酸;而AFP111/pMD19T-cscBKA通过外源引入非PTS蔗糖利用系统,细胞干重达到1.51 g/L,丁二酸产量为12 g/L,丁二酸得率为1.1 mol/mol单糖 (葡萄糖或者果糖),表明重组菌株具有了代谢蔗糖并积累丁二酸的能力。
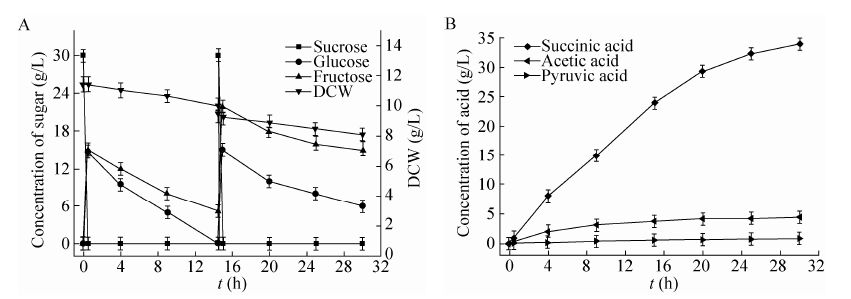
2.3 3 L发酵罐中AFP111/pMD19T-cscBKA利用蔗糖发酵制备丁二酸大肠杆菌作为兼性厌氧菌,其在有氧条件下生长速度及细胞密度均高于厌氧,因此采用先有氧快速培养获得高密度菌体,进而厌氧发酵生产丁二酸的两阶段发酵模式,可大幅提高丁二酸的生产速率。有氧阶段以30 g/L蔗糖为碳源培养重组菌株AFP111/pMD19T-cscBKA细胞干重达到12 g/L,然后通入无菌CO2转成厌氧发酵阶段。发酵结果如图4所示。厌氧发酵30 h后,丁二酸浓度达到34 g/L,丁二酸的得率为1.16 mol/mol单糖,丁二酸的生产强度为1.13 g/(L·h)。
|
| 图4 E. coli AFP111/pMD19T-cscBKA在3 L发酵罐中以蔗糖为碳源厌氧发酵阶段的细胞干重、糖 (A) 及产物 (B) 浓度 Fig.4 DCW,the concentrations of sugars (A) and the organic acids (B) in E. coli AFP111/pMD19T-cscBKA from sucrose after transition to anaerobic-phase fermentation in a 3 L fermentor. |
非PTS蔗糖利用系统中,蔗糖通透酶 (CscB) 将胞外的蔗糖转运至胞内,胞内的蔗糖被蔗糖水解酶 (CscA) 水解为葡萄糖和果糖,理论上胞外没有单糖的存在。重组菌株AFP111/pMD19T-cscBKA生长及发酵的过程中,显现出很高的分解蔗糖的能力,当DCW达到12 g/L时,30 g/L的蔗糖30 min内全部分解为单糖,细胞外即培养基中检测到大量的葡萄糖和果糖 (图4A)。并且外源引入PTS蔗糖代谢途径的E. coli SBS550MG pHL413 pUR400在发酵过程中培养基里也有单糖的存在。这是由于外源引入蔗糖利用系统的重组菌株蔗糖分解的速度高于葡萄糖和果糖的利用速率,胞内积累的单糖渗透到胞外[18]。
2.4 3 L发酵罐中AFP111/pMD19T-cscBKA利用糖蜜发酵制备丁二酸在3 L发酵罐中考察重组菌AFP111/pMD19T-cscBKA以甘蔗糖蜜作为碳源发酵产丁二酸的情况。经HPLC测定,糖蜜中糖的组分为355 g/L蔗糖、84 g/L葡萄糖、84 g/L果糖,设定发酵初始糖浓度为30 g/L,其中20.4 g/L蔗糖、4.8 g/L葡萄糖、4.8 g/L果糖,发酵结果见图5。

|
| 图5 E. coli AFP111/pMD19T-cscBKA在3 L发酵罐中以糖蜜为碳源厌氧发酵阶段的细胞干重、糖 (A) 及产物 (B) 浓度 Fig.5 DCW,the concentrations of sugars (A) and the organic acids (B) in E. coli AFP111/pMD19T-cscBKA from molasses after transition to anaerobic-phase fermentation in a 3 L fermentor. |
发酵过程中,糖蜜中的单糖没有影响蔗糖的分解,与纯蔗糖发酵过程相似,糖蜜中的蔗糖快速分解为葡萄糖和果糖,葡萄糖和果糖被同步利用,这由于宿主菌AFP111的磷酸转移酶系统 (PTS) 的ptsG基因自发突变,解除了碳分解代谢物阻遏现象,因此重组菌在利用葡萄糖和果糖时不存在顺序性。厌氧发酵30 h,丁二酸浓度达到30 g/L,丁二酸的得率为1.13 mol/mol单糖,丁二酸的生产强度为1.0 g/(L·h)。通过甘蔗糖蜜与蔗糖发酵结果对比可知,以甘蔗糖蜜为碳源发酵制备丁二酸的生产强度略低于纯蔗糖发酵,这可能由于未经处理的糖蜜中含有金属离子、胶体等,这些物质不利于菌体生长代谢[22]。
3 结论Bruschi等[23]以pCR2.1为载体克隆来自 E. coli W中cscBKA 3个基因及其自身启动子,使重组菌株能够以蔗糖为碳源生长。本研究证明pMD19-T也可以作为载体克隆表达cscBKA三个基因,且蔗糖利用系统转入到产丁二酸优秀菌株AFP111中,重组大肠杆菌AFP111/pMD19T- cscBKA具有利用蔗糖和廉价糖蜜发酵制备丁二酸的能力。厌氧摇瓶中,以20 g/L蔗糖为初始糖浓度,72 h产生12 g/L丁二酸。采用有氧厌氧两阶段发酵,厌氧发酵30 h后,以蔗糖为碳源时产生了34 g/L丁二酸,丁二酸的得率为1.16 mol/mol单糖,丁二酸的生产强度为1.13 g/(L·h);以糖蜜为碳源时产生了30 g/L丁二酸,丁二酸的得率为 1.13 mol/mol单糖,丁二酸的生产强度为1.0 g/(L·h)。
| [1] | Jang YS, Kim B, Shin JH, et al. Bio-based production of C2-C6 platform chemicals. Biotechnol Bioeng, 2012, 109(10): 2437-2459. |
| [2] |
Wang QZ, Wu W, Zhao XM. Market analysis for bioconversion of succinic acid and its derivatives. Chem Ind Eng Prog, 2004, 23(7): 794-798 (in Chinese). 王庆昭, 吴巍, 赵学明. 生物转化法制取琥珀酸及其衍生物的前景分析. 化工进展, 2004, 23(7): 794-798. |
| [3] | McKinlay JB, Vieille C, Zeikus GJ. Prospects for a bio-based succinate industry. Appl Microbiol Biotechnol, 2007, 76(4): 727-740. |
| [4] | Cukalovic A, Stevens CV. Feasibility of production methods for succinic acid derivatives: a marriage of renewable resources and chemical technology. Biofuels Bioprod Biorefin, 2008, 2(6): 505-529. |
| [5] | Xi YL, Chen KQ, Li J, et al. Optimization of culture conditions in CO2 fixation for succinic acid production using Actinobacillus succinogenes. J Ind Microbiol Biotechnol, 2011, 38(9): 1605-1612. |
| [6] | Zheng P, Dong JJ, Sun ZH, et a1. Fermentative production of succinic acid from straw hydrolysate by Actinobacillus succinogenes. Bioresour Technol, 2009, 100(8): 2425-2429 |
| [7] | Liang LY, Liu RM, Li F, et al. Repetitive succinic acid production from lignocellulose hydrolysates by enhancement of ATP supply in metabolically engineered Escherichia coli. Bioresour Technol, 2013, 143: 405-412. |
| [8] | Wang D, Li Q, Yang MH, et al. Efficient production of succinic acid from corn stalk hydrolysates by recombinant Escherichia coli with ptsG mutation. Process Biochem, 2011, 46(1): 365-371. |
| [9] | Liang L, Zhang Y, Zhang L, et al. Study of sugarcane pieces as yeast supports for ethanol production from sugarcane juice and molasses. J Ind Microbiol Biotechnol, 2008, 35(12): 1605-1613. |
| [10] | Kotzamanidis CH, Roukas T, Skaracis G. Optimization of lactic acid production from beet molasses by Lactobacillus delbrueckii NCIMB 8130. World J Microb Biotechnol, 2002, 18(5): 441-448. |
| [11] | Davis CP, Cleven D, Brown J, et al. Anaerobiospirillum, a new genus of spiral-shaped bacteria. Int J Syst Bacteriol, 1976, 26(4): 498-504. |
| [12] | Jiang M, Dai WY, Xi YL, et al. Succinic acid production from sucrose by Actinobacillus succinogenes NJ113. Bioresour Technol, 2014, 153: 327-332. |
| [13] | Wu H, Li ZM, Zhou L, et al. Improved succinic acid production in the anaerobic culture of an Escherichia coli pflB ldhA double mutant as a result of enhanced anaplerotic activities in the preceding aerobic culture. Appl Environ Microbiol, 2007, 73(24): 7837-7843. |
| [14] | Vemuri GN, Eiteman MA, Altman E. Effects of growth mode and pyruvate carboxylase on succinic acid production by metabolically engineered strains of Escherichia coli. Appl Environ Microbiol, 2002, 68(4): 1715-1727. |
| [15] | Jiang M, Liu SW, Ma JF, et al. Effect of growth phase feeding strategies on succinate production by metabolically engineered Escherichia coli. Appl Environ Microbiol, 2010, 76(4): 1298-1300. |
| [16] | Lee JW, Choi S, Park JH, et al. Development of sucrose-utilizing Escherichia coli K-12 strain by cloning beta-fructofuranosidases and its application for L-threonine production. Appl Microbiol Biotechnol, 2010, 88(4): 905-913. |
| [17] | Penfold DW, Macaskie LE. Production of H2 from sucrose by Escherichia coli strains carrying the pUR400 plasmid, which encodes invertase activity. Biotechnol Lett, 2004, 26(24): 1879-1883. |
| [18] | Wang J, Zhu J, Bennett GN, et al. Succinate production from different carbon sources under anaerobic conditions by metabolic engineered Escherichia coli strains. Metab Eng, 2011, 13(3): 328-335. |
| [19] | Sabri S, Nielsen LK, Vickers CE. Molecular control of sucrose utilization in Escherichia coli W, an efficient sucrose-utilizing strain. Appl Environ Microbiol, 2013, 79(2): 478-487. |
| [20] | Arifin Y, Sabri S, Sugiarto H, et al. Deletion of cscR in Escherichia coli W improves growth and poly-3-hydroxybutyrate (PHB) production from sucrose in fed batch culture. J Biotechnol, 2010, 156(4): 275-278. |
| [21] | Olson MM, Templeton LJ, Suh W, et al. Production of tyrosine from sucrose or glucose achieved by rapid genetic changes to phenylalanine-producing Escherichia coli strains. Appl Microbiol Biotechnol, 2007, 74(5): 1031-1040. |
| [22] | Calabia BP, Tokiwa Y. Production of D-lactic acid from sugarcane molasses, sugarcane juice and sugar beet juice by Lactobacillus delbrueckii. Biotechnol Lett, 2007, 29(9): 1329-1332. |
| [23] | Bruschi M, Boyes SJ, Sugiarto H, et al. A transferable sucrose utilization approach for non-sucrose-utilizing Escherichia coli strains. Biotechnol Adv, 2012, 30(5): 1001-1010. |
 2015, Vol. 31
2015, Vol. 31