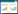服务
文章信息
- 杨藩, 王亚娴, 杜丽霞, 王华岩
- Yang Fan, Wang Yaxian, Du Lixia, Wang Huayan
- 猪ESRRB启动子克隆及其调控活性检测
- Cloning and regulation of pig estrogen related receptor β gene (ESRRB) promoter
- 生物工程学报, 2015, 31(4): 491-500
- Chin J Biotech, 2015, 31(4): 491-500
- 10.13345/j.cjb.140368
-
文章历史
- Received: July 14, 2014
- Accepted: October 27, 2014
2. 西北农林科技大学创新实验学院,陕西 杨凌 712100
2. Innovation Experimental College, Northwest A&F University, Yangling 712100, Shaanxi, China
多能干细胞的自我更新需要相关信号通路和各种转录因子调控来维持,其中ERK、GSK、LIF等通路和Oct4、Sox2、Nanog等因子,在其中起着关键作用[1]。目前,小鼠胚胎干细胞 (ESCs) 可以在添加2i/LiF的培养基中稳定传代[2],其中2i通过抑制ERK和GSK3通路发挥维持ESCs自我更新和多能性的作用。GSK3通过β-catein对许多基因起着负调控的作用,这其中就包括c-Myc[3, 4]。同时,遗传分析表明β-catein通过Tcf3协同作用负调控ESCs的自我更新[5]。为了明确Tcf3的下游靶基因,Simth研究团队敲除了干细胞的Tcf3基因,并结合Tcf3的调控位点发现雌激素相关受体b (Esrrb)是Tcf3的下游靶基因,对干细胞自我更新的维持起着重要的作用[6]。Chambers研究团队在分析Nanog的下游靶基因时发现,Nanog可以激活Esrrb的表达并维持干细胞的自我更新[7]。同时,Esrrb或者Nanog的过表达可以在不添加LIF的条件下维持干细胞的自我更新。
雌激素相关受体 (Estrogen related receptor) 属于核受体家族。目前己发现3种亚型,即Esrra[8]、Esrrb[8]、Esrrg[9]。雌激素受体基因包含有相对保守的结构区域:配体结合域 (LBD) 和DNA结合域 (DBD)[8, 10]。该家族基因可以不经过相应激素配体的刺激而直接入核并调控基因的表达。相对于Esrra和Esrrg,Esrrb的时空表达特异性较高。Esrrb在小鼠胚胎发育到5.5 d时出现,并随着胚胎的进一步发育而逐渐消失,其缺失会导致胚胎发育不正常[11, 12]。因此,开展对该基因启动子的研究,有助于揭示多能干细胞的自我更新维持和多向分化能力的调控机制。本研究为揭示猪ESRRB基因在分子调控机理,分子克隆了启动子片段,并对启动子上的调控位点进行了系统分析,通过对猪ESRRB启动子缺失,用双荧光素酶表达载体验证了潜在转录因子对ESRRB的调控。本研究为进一步探索ESRRB对猪多能干细胞自我更新的维持和调控机理奠定了基础。
1 材料与方法 1.1 菌种、载体和细胞感受态大肠杆菌DH5α、质粒pEGFP-1、pEGFP-C1、pGL3-Basic、pMX-OCT4、pMX-CMYC、pCDNA-LIF、pEGFPC1-SMAD2、pEGFPC1- SMAD3、pEGFPC1-SMAD7、人胚肾细胞 (293T)、人宫颈癌细胞 (Hela)、小鼠成肌细胞 (C2C12) 和猪胎儿成纤维细胞 (PEF) 由陕西省干细胞工程技术研究中心保存。载体pGEM-T Easy及荧光素酶检测试剂盒Dual-Luciferase® Reporter Assay System均购自Promega公司。猪各组织器官采集于陕西万盛肉类加工有限公司的屠宰场。
1.2 试剂及耗材总RNA提取试剂盒、基因组提取试剂盒、质粒提取试剂盒、凝胶回收试剂盒、DNA marker均购自天根公司;限制性内切酶、T4 DNA连接酶、反转录试剂盒和Taq 聚合酶均购自Fermentas公司;高保真DNA聚合 (PhantaTM HS Super-Fidelity DNA Polymerase) 购自Vazyme公司;定量PCR Mix (Power 2xSYBR Real-time PCR Premixture) 购自于Bioteke公司;脂质体 (Lipofectamine 2 000)、Opti-MEM和DMEM培养基均购自Invitrogen公司;非必需氨基酸 (NEAA)、L-谷氨酰胺 (L-Glu)、β-巯基乙醇 (β-ME) 购自Gibco公司;胎牛血清 (FBS) 购自Hyclone公司;PCR 引物由华大基因科技服务有限公司合成。
1.3 ESRRB启动子的克隆与载体构建参照血液/细胞/组织基因组DNA提取试剂盒 (天根公司),从PEF细胞中提取猪基因组DNA。从UCSC (http://genome.ucsc.edu/) 网站下载猪ESRRB的5‘上游序列,设计带有酶切位点Hind Ⅲ和XhoⅠ的启动子上下游引物,并扩增3.3 kb启动子片段。产物用琼脂糖凝胶DNA回收试剂盒进行回收,并与pGEM-T Easy载体连接,连接产物转化到大肠杆菌DH5α中。挑取阳性克隆提取质粒,经限制性内切酶XhoⅠ、Hind Ⅲ双酶切鉴定。酶切鉴定正确的质粒送华大生物工程有限公司测序。测序正确的质粒通过Hind Ⅲ和XhoⅠ与pEGFP-1和pGL3-Basic连接,并分别命名为pE3.3和pL3.3。以pE3.3为模板,分别设计带有酶切位点XhoⅠ和Hind Ⅲ的上下游引物,扩增2 093 bp、1 503 bp、876 bp、575 bp和308 bp的启动子片段,亚克隆到pGL3-Basic报告载体中,分别命名为pL2.0、pL1.5、pL0.8、pL0.5和pL0.3。引物序列见表1。
| Primer name | Primer sequence (5‘-3‘) | Size (bp) |
| F3.3 F/R | F-CCGCTCGAGACCTGGAAAACCACGGGAA | 3 307 |
| R-CCCAAGCTTGGTAGCCGAGAGGGTCCG | ||
| F2.0 F/R | F-CCGCTCGAGCTCGGCACCTGGAGAAAC | 2 093 |
| R-CCCAAGCTTGGTAGCCGAGAGGGTCCG | ||
| F1.5 F/R | F-CCGCTCGAGTGGCAGGTAAGTTCCTTGTTGTA | 1 503 |
| R-CCCAAGCTTGGTAGCCGAGAGGGTCCG | ||
| F0.8 F/R | F-CCGCTCGAGAGCCACAGCCACAGCAACTC | 876 |
| R-CCCAAGCTTGGTAGCCGAGAGGGTCCG | ||
| F0.5 F/R | F-CCGCTCGAGGAGTCTTTCCACCCCTGAGTCC | 575 |
| R-CCCAAGCTTGGTAGCCGAGAGGGTCCG | ||
| F0.3 F/R | F-CCGCTCGAGTAGGGTTAGTGGGCTCCAAGTC | 308 |
| R-CCCAAGCTTGGTAGCCGAGAGGGTCCG | ||
| qGAPDH F/R | F-GCAAAGTGGACATTGTCGCCATCA | 160 |
| R-TCCTGGAAGATGGTGATGGCCTTT | ||
| qESRRB F/R | F-AGGGAGCTCGTGGTCATCAT | 62 |
| R-CCCCAGAGAGAGGTTGGAGAA |
293T、Hela和C2C12细胞用含有10%胎牛血清的DMEM培养液,在37 ℃、含有5% CO2 的细胞培养箱内培养。按照Lipofectine 2 000使用说明书,首先将pE3.3启动子 分别转入293T、Hela和C2C12细胞,转染后48 h在荧光显微镜下观察绿色荧光。同时,将293T细胞按2.4×104/孔接种于48孔培养板中,待细胞完全贴壁覆盖率至50%−60%时,将pL3.3、pL2.0、pL1.5、pL0.8、pL0.5和pL0.3等启动子荧光报告载体 (500 ng) 和pCMV-Renilla表达载体 (20 ng) 共同转入细胞,48 h后收集细胞并进行荧光素酶活性检测。每个启动子做3次独立实验,每次3个重复。
1.5 荧光定量PCR按照总RNA提取试剂盒说明书 (天根公司) 提取组织总RNA,按照RevertAidTM Frist Strand cDNA Synthesis Kit相关说明进行反转录获得cDNA,并设计qESRRB和qGAPDH引物。荧光定量PCR反应体系如下:2×SYBR Green Mix 10 μL,25 mmol/L dNTPs 1 μL,上、下游引物各0.5 μL (10 μmol/L),模板cDNA 1 μL,去离子水7 μL,共20 μL。每个样本设3个重复。反应条件为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环。实时荧光定量PCR引物序列见表1。
1.6 统计学分析所有数据均用平均值±标准偏差表示,并经双尾t-test检验差异是否具有统计学意义。*表P<0.05,**表示P<0.01。
2 结果与分析 2.1 猪ESRRB启动子克隆及生物学分析本研究从猪的基因组中克隆获得了3 307 bp的ESRRB基因5‘端上游片段 (图1A)。用生物信息学的方法发现序列上存在很多与多能性转录因子结合的位点,如:KLF4、MYC、SMAD和STAT3等 (图1B)。但是在转录起始位点上游缺乏经典的TATA-box (TATAAA)。

|
| 图1 ESRRB 3 kb启动子克隆及生物信息学分析 Fig.1 ESRRB promoter clone and potential regulatory sequences prediction. (A) PCR amplification of 3.3 kb ESRRB promoter. M: DNA marker Ⅳ; 1: 3 307 bp ESRRB promoter. (B) Prediction of the 3.3 kb ESRRB promoter potential regulatory sequence. The transcription start site (TSS) is highlighted by red colour. |
通过在线启动子分析软件JASPAR (http://jaspar.genereg.net/) 分析猪ESRRB启动子,发现KLF4 (-2 582,-1 488,-1 059,-860,-591,-123);MYC (-1 759,-1 288);STAT3 (-2 944,-2 067,-2 052,-1 316,-801)和SMAD(-2 723,-1 924,-1 414,-599) 等的可能结合位点。但是,未发现OCT4和SOX2的结合位点(图2A)。通过将构建好的pL3.3分别与pMX-CMYC、pCDNA-LIF、pEGFPC1-SMAD2、pEGFPC1-SMAD3和pEGFPC1-SMAD2+ pEGFPC1-SMAD3共转染293T细胞,发现这些因子都能一定程度地激活ESRRB启动子,其中SMAD2 + SMAD3的作用最为明显,是只加入pL3.3的对照组的2.7倍 (图2B)。因为没有SOX2的结合位点,pEGFP-SOX2并未提高ESRRB的表达水平。

|
| 图2 多能性基因对猪ESRRB启动子的调控 Fig.2 Pluripotency related gene regulation on ESRRB. (A) Prediction of pluripotency related gene binding sites on the 3.3 kb pig ESRRB promoter. (B) Pluripotency related gene regulation on ESRRB promoter confirmed by dual luciferase assay. |
通过实时定量PCR对胸腺、脂肪、皮肤、肌肉、心脏、肝脏、脑、睾丸、卵巢、脾脏、肾脏和猪成纤维细胞中ESRRB的表达情况进行了测定。结果显示ESRRB在肾脏表达最高,在与生殖相关的组织如睾丸卵巢中也有表达。而在脂肪、皮肤和肌肉等组织中的表达较低 (图3A)。这个结果与人和鼠的报道相似[13, 14]。对携带3.3 kb ESRRB启动子片段的pE3.3进行 Hind Ⅲ和XhoⅠ酶切鉴定,结果表明插入片段正确(图3B)。将pE3.3报告载体分别转入C2C12、Hela和293T细胞,48 h后在荧光显微镜下观察细胞表达GFP情况。结果显示,在293T细胞中有GFP的表达,而在C2C12与Hela细胞中没有GFP的表达 (图3C)。这一结果印证了ESRRB启动子在肾脏细胞中的高表达特性 (图3A)。
|
| 图3 定量检测ESRRB的组织特异性表达 Fig.3 ESRRB tissues expression pattern analysis and the activation of promoter-directed vector pE3.3 in 293T,Hela and C2C12 cells. (A) Pig ESRRB tissues expression pattern. Fold difference was calculated with respect to thymus. Bars represent the means standard errors of three independent experiments. **P < 0.01. (B) Identification of recombinant plasmid pE3.3 with XhoⅠand Hind Ⅲ digestion. M= DNA marker Ⅳ; 1: 3 307 bp. (C) 293T,Hela and C2C12 cells were transfected with pE3.3 constructs. Scale bars=200 μm. |
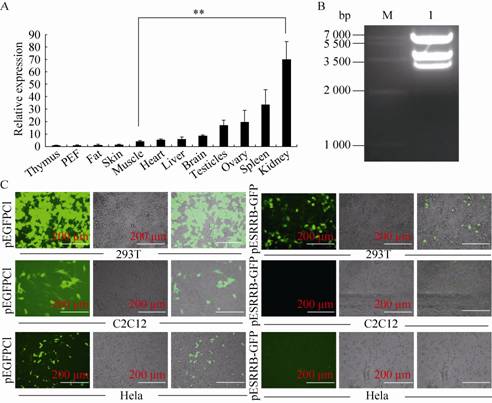
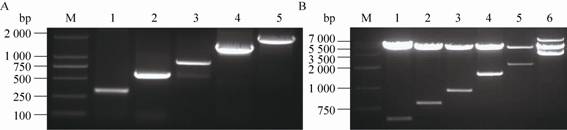
以重组质粒pE3.3为模板用不同的引物对ESRRB启动子5ʹ端上游序列进行缺失,获得 2 093 bp、1 503 bp、876 bp、575 bp和308 bp等片段,经琼脂糖凝胶电泳分析验证,PCR扩增产物与预期片段大小相符(图4A)。分别将这些片段插入到pGL3-basic质粒,构建pL2.0、pL1.5、pL0.8、pL0.5和pL0.3报告载体,并经限制性内切酶Hind Ⅲ和XhoⅠ双酶切鉴定 (图4B)。检测结果表明酶切目的片段大小与预期吻合,载体构建正确。
|
| 图4 ESRRB启动子的PCR缺失及相应的荧光素酶报告载体构建 Fig.4 PCR amplification of various length deletion fragments of ESRRB promoter (A) and identification of recombinant plasmids with deleted fragments (B). M: DNA marker; 1: 308 bp; 2: 575 bp; 3: 876 bp; 4: 1 503 bp; 5: 2 093 bp; 6: full length ESRRB promoter. |
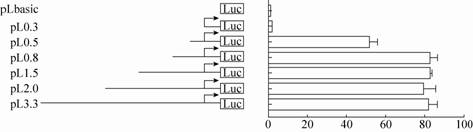
将携带不同启动子片段的质粒pL3.3、pL2.0、pL1.5、pL0.8、pL0.5和pL0.3等,瞬时转染293T细胞48 h后,对报告基因荧光素酶活性进行检测。结果显示,pL0.3没有启动子活性,而pL0.5的启动子活性与对照组相比提高了约50倍。pL0.5相比于pL0.3多出了-269 bp至-25 bp之间的序列,表明该段序列存在一个正调控域是该启动子的核心调控区域。进一步测定显示pL0.8、pL1.5、pL2.0和pL3.3的活性比pL0.5的又提高了近70%,说明在启动子-0.5至-0.8 bp之间的序列,还存在一个正调控域 (图5)。这两个调控域的调控元件和生物学功能还有待进一步探索研究。
|
| 图5 猪ESRRB不同长度启动子的活性检测 Fig.5 Results of ESRRB promoter fragments analysed by dual-luciferase reporter system in 293T cells. The pGL3-basic (pLbasic) was used as control. |
雌激素家族相关受体基因β是维持ESCs自我更新的重要转录因子,抑制其表达会直接导致ESCs的分化[15]。研究发现Esrrb能够与其他多能转录因子相互作用,在ESCs中与Oct4、Sox2、Nanog和Klf4拥有共同的结合位点[16];同时,Esrrb启动子上存在Oct4、Nanog和Tcf3的结合位点[6]。本研究克隆了猪ESRRB启动子,经生物信息学分析表明启动子上存在潜在的LIF、KLF4、MYC和SMAD的结合位点。通过双荧光素酶报告载体实验发现,这些转录因子都能够一定程度地激活猪ESRRB启动子活性。
其中SMAD2/3的效果最为显著。SMAD2/3所介导的信号通路Nodal/Activn能够促进小鼠胚胎干细胞的增殖和自我更新[17]。该结果也表明ESRRB通过与不同基因和通路的协同作用实现对自我更新的维持[18]。
通过实时定量PCR,我们发现ESRRB主要在肾脏、脾脏、卵巢和睾丸中表达。将pE3.3分别转入到人胚肾细胞293T、宫颈癌细胞Hela和小鼠成肌细胞C2C12中,ESRRB表现出组织特异性表达,只在肾脏来源的293T中有绿色荧光表达。对比ESRRB的组织表达谱研究表明,人的ESRRB主要分布在肾脏和睾丸[19];而小鼠的Esrrb主要分布于肾脏和心脏[20];大鼠的ESRRB分布要广泛一些,在肾脏、心脏、睾丸和神经内分泌相关的组织中均检测到表达[8]。通过比较猪、人、小鼠和大鼠ESRRB的组织表达谱发现,ESRRB在物种间表达有一定的差异,同时肾脏是ESRRB表达的一个重要器官。ESRRB可能在其中参与调节肾脏分泌固醇类激素[21]。
有报道通过对猪UroplakinⅡ(UPII)[22]、PAQR6[23]和P53[24]等基因的启动子进行缺失发现了相应的核心启动子。为了进一步分析ESRRB启动子的核心调控区域,我们对其3.3 kb启动子进行了缺失。结果发现位于5ʹ端上游-25 bp和-269 bp序列区有两个转录调控域,能够明显调控启动子活性。进一步分析发现,ESRRB不存在TATA box,是TATA-less基因。事实上TATA box作为典型的核心启动子元件并非存在于所有的基因中。相反,大多数基因在转录的时候不需要TATA box[25]。
本文通过对猪ESRRB组织特异表达的检测和对ESRRB启动子核心调控区的测定,初步揭示了该基因的表达和调控特点,为进一步确定ESRRB的调控机制及其对多能性的维持机理奠定了基础。同时,构建的pE3.3报告载体也可以用于示踪细胞重编程,为开展猪诱导多能干细胞的建系提供了新的手段。
| [1] | Boyer LA, Lee TI, Cole MF, et al. Core transcriptional regulatory circuitry in human embryonic stem cells. Cell, 2005, 122(6): 947-956. |
| [2] | Ying QL, Wray J, Nichols J, et al. The ground state of embryonic stem cell self-renewal. Nature, 2008, 453(7194): 519-523. |
| [3] | Doble BW, Woodgett JR. GSK-3: tricks of the trade for a multi-tasking kinase. J Cell Sci, 2003, 116(7): 1175-1186. |
| [4] | Singh AM, Dalton S. The cell cycle and Myc intersect with mechanisms that regulate pluripotency and reprogramming. Cell Stem Cell, 2009, 5(2): 141-149. |
| [5] | Guo G, Huang Y, Humphreys P, et al. A PiggyBac-based recessive screening method to identify pluripotency regulators. PLoS ONE, 2011, 6(4): e18189. |
| [6] | Martello G, Sugimoto T, Diamanti E, et al. Esrrb is a pivotal target of the Gsk3/Tcf3 axis regulating embryonic stem cell self-renewal. Cell Stem cell, 2012, 11(4): 491-504. |
| [7] | Festuccia N, Osorno R, Halbritter F, et al. Esrrb is a direct Nanog target gene that can substitute for Nanog function in pluripotent cells. Cell Stem cell, 2012, 11(4): 477-490. |
| [8] | Giguère V, Yang N, Segui P, et al. Identification of a new class of steroid hormone receptors. Nature, 1988, 331(6151): 91-94. |
| [9] | Heard DJ, Norby PL, Holloway J, et al. Human ERR gamma, a third member of the estrogen receptor-related receptor (ERR) subfamily of orphan nuclear receptors: tissue-specific isoforms are expressed during development and in the adult. Mol Endocrinol, 2000, 14(3): 382-392. |
| [10] | Vanacker JM, Bonnelye E, Chopin-Delannoy S, et al. Transcriptional activities of the orphan nuclear receptor ERR alpha (estrogen receptor-related receptor-alpha). Mol Endocrinol, 1999, 13(5): 764-773. |
| [11] | Mitsunaga K, Araki K, Mizusaki H, et al. Loss of PGC-specific expression of the orphan nuclear receptor ERR-beta results in reduction of germ cell number in mouse embryos. Mech Dev, 2004, 121(3): 237-246. |
| [12] | Percharde M, Lavial F, Ng JH, et al. Ncoa3 functions as an essential Esrrb coactivator to sustain embryonic stem cell self-renewal and reprogramming. Genes Dev, 2012, 26(20): 2286-2298. |
| [13] | Guiguen Y, Baroiller JF, Ricordel MJ, et al. Involvement of estrogens in the process of sex differentiation in two fish species: the rainbow trout (Oncorhynchus mykiss) and a tilapia (Oreochromis niloticus). Mol Reprod Dev, 1999, 54(2): 154-162. |
| [14] | Cheng G, Weihua Z, Mäkinen S, et al. A role for the androgen receptor in follicular atresia of estrogen receptor beta knockout mouse ovary. Biol Reprod, 2002, 66(1): 77-84. |
| [15] | Xie CQ, Jeong Y, Fu M, et al. Expression profiling of nuclear receptors in human and mouse embryonic stem cells. Mol Endocrinol, 2009, 23(5): 724-733. |
| [16] | Chen X, Xu H, Yuan P, et al. Integration of external signaling pathways with the core transcriptional network in embryonic stem cells. Cell, 2008, 133(6): 1106-1117. |
| [17] | Ogawa K, Saito A, Matsui H, et al. Activin-Nodal signaling is involved in propagation of mouse embryonic stem cells. J Cell Sci, 2007, 120(Pt 1): 55-65. |
| [18] | Papp B, Plath K. Pluripotency re-centered around Esrrb. EMBO J, 2012, 31(22): 4255-4257. |
| [19] | Zhou W, Liu Z, Wu J, et al. Identification and characterization of two novel splicing isoforms of human estrogen-related receptor beta. J Clin Endocrinol Metab, 2006, 91(2): 569-579. |
| [20] | Pettersson K1, Svensson K, Mattsson R, et al. Expression of a novel member of estrogen response element-binding nuclear receptors is restricted to the early stages of chorion formation during mouse embryogenesis. Mech Dev, 1996, 54(2): 211-223. |
| [21] | Di Micco S, Renga B, Carino A, et al. Structural insights into estrogen related receptor-β modulation: 4-methylenesterols from Theonella swinhoei sponge as the first example of marine natural antagonists. Steroids, 2014, 80: 51-63 |
| [22] | Kwon DN, Park MR, Park JY, et al. Characterization of a putative cis-regulatory element that controls transcriptional activity of the pig uroplakin II gene promoter. Biochem Biophys Res Commun, 2011, 410(2): 264-269. |
| [23] | Zhao X, Mo D, Li A, et al. Characterization and transcriptional regulation analysis of the porcine PAQR6 gene. DNA Cell Biol, 2011, 30(11): 947-954. |
| [24] | Tao H, Mei S, Zhang X, et al. Transcription factor C/EBP beta and 17beta-estradiol promote transcription of the porcine p53 gene. Int J Biochem Cell Biol, 2014, 47: 76-82. |
| [25] | Goodrich JA, Tjian R. Unexpected roles for core promoter recognition factors in cell-type-specific transcription and gene regulation. Nat Rev Genet, 2010, 11(8): 549-558. |
 2015, Vol. 31
2015, Vol. 31