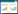服务
文章信息
- 王金丹, 张光亚
- Wang Jindan, Zhang Guangya
- 多酶共固定化的研究进展
- Progress in co-immobilization of multiple enzymes
- 生物工程学报, 2015, 31(4): 469-480
- Chin J Biotech, 2015, 31(4): 469-480
- 10.13345/j.cjb.140346
-
文章历史
- Received: June 25, 2014
- Accepted: October 28, 2014
多酶固定化技术是指将多种酶同时固定在同一个载体中或将多种酶通过交联的方式形成共交联酶聚集体的一种技术。众所周知,在生物体或微生物细胞内的代谢途径中,所有物质代谢都由多酶共同作用来完成。如:三羧酸循环途径 (Tricarboxylic acid cycle),该过程需要丙酮酸脱氢酶、柠檬酸合成酶等9个酶的共同催化完成;此外,在生物体内催化反应过程中,酶可以形成复杂的多酶复合体 (Multi-enzyme complexes),其催化的反应高度有序,能极大提高酶催化效率[1, 2, 3]。正是由于多酶复合体这一优点,促使研究者们在体外人工制备多酶反应体系,提高酶的催化效率,从而出现了多酶共反应或多酶固定化等方式[4, 5]。
生物反应过程通常由多步连续反应且需要多种酶的共同作用,解决此问题的一个方法是多酶共反应,即将多种酶置于同一反应器中进而得到目标产物,与体内代谢途径相比,其复杂性大为降低[6]。Zou研究小组[7]通过3种酶共反应以葡萄糖/半乳糖、ATP、UTP为底物成功合成尿苷二磷酸半乳糖 (UDP-Gal)、尿苷二磷酸葡萄糖 (UDP-Glc) 及其衍生物。多酶共反应后酶的分离回收较困难,重复利用率低,稳定性较差。另一种解决途径是多酶共固定化,就是通过多点共价结合、共包埋、共吸附、特异性结合等方式固定化多酶。多酶共固定化可以提高酶的稳定性,提高酶的重复利用率,增加反应的局部浓度从而有利于提高产品的收率[2, 8, 9]。Singh等[10]以聚苯胺 (PANI) 薄膜为载体共价共固定化胆固醇酯酶 (ChEt) 和胆固醇氧化酶 (ChOx),制备了胆固醇生物传感器,可连续使用6周。但是,由于酶高级结构对酶活力影响较大,目前研究者们正致力于研究制备高度可控的固定化多酶,利用蛋白质、RNA或DNA作为支架共定位固定化多酶,这种方法可以与酶特异性的结合,较好保持酶的空间构象,减少酶活损失。此外,这种方法固定化的多酶,其酶与酶之间的距离较近,可减少传质阻力从而提高酶的催化效率[11, 12, 13]。例如,Niemeyer等[14]首次通过DNA杂交技术共固定化烟酰胺腺嘌呤二核苷酸 (NADH) 辅酶、黄素单核苷酸 (FMN) 氧化还原酶和荧光素酶,结果显示其总酶活得到显著提升。本文主要从多酶固定化的不同方式,即非特异性共价共固定化、非特异性非共价共固定化、非共价包埋固定化以及位点特异性固定化等4个方面介绍有关固定化多酶制备方法的最新研究进展。
1 多酶的非特异性共价共固定化 1.1 有载体共价固定化酶可以共价结合在不溶性的载体上形成固定化酶,其理论依据是蛋白质表面具有丰富的功能基团,能提供丰富的酶与载体的结合位点。最常见的共价结合是酰胺反应。即:蛋白质上的氨基如赖氨酸与载体上的羧基反应,如碳化二亚胺可促进反应形成稳定的酰胺键。在某些情况下,由于酶分子中赖氨酸的含量较大,通过这种方式固定化酶的活性会受到显著影响。这时可选用蛋白质表面上的其他反应基团,如半胱氨酸,它可通过形成二硫键固定化酶。这种制备方法能显著提高共固定化多酶的稳 定性[15, 16]。
Torabi等[17]将胆固醇氧化酶 (COD) 和辣根过氧化物酶 (POD) 共价共固定化于珍珠岩表面。研究结果表明,固定化双酶pH值稳定性高于游离酶,最适pH值降低;固定化胆固醇氧化酶的热稳定性相比于游离酶提高了2倍,但固定化辣根过氧化物酶的热稳定性比游离酶低;共固定化多酶在重复使用20次以后其酶活回收率为65%,这表明固定化酶具有良好的重复利用率。尽管固定化多酶的稳定性有较大提高,但其活性有不同程度的降低,分别为游离酶的50%和11%。
1.2 无载体共价固定化有载体的共价固定化最大的缺点是:会引入大量的非催化基团,同时载体的价格也较昂贵。为了克服这一缺点,衍生出一种新的方法来固定化多酶,即无载体交联固定化酶[18]。交联酶晶体 (CLECs) 和交联酶聚集体 (CLEAs) 已成功应用于单酶固定化,这种方法也可应用于多酶固定化,这种固定化多酶称为共交联酶聚合体 (Combi-CLEAs)。
Taboada-Puig等[19]以戊二醛作为交联剂共聚集多功能过氧化物酶 (VP) 和葡萄糖氧化酶 (GOX),得到共交联酶聚合体。葡萄糖氧化酶可持续制备过氧化氢 (H2O2),多功能过氧化物酶可以消除副产物对反应的影响。Talekar等[20]制备了三功能酶聚合体。他们将α-淀粉酶、葡糖淀粉酶和支链淀粉酶用戊二醛交联形成共交联酶聚合物 (图1),扫描电镜分析结果显示聚合物为球形结构。将交联酶聚集体与游离酶直接混合反应比较,其酶活回收率分别为100%、60%和40%,相比游离酶有所降低,但酶的热稳定性得到提高。此外,固定化多酶在重复利用5次后,性能未发生明显变化。
通过共价结合的固定化多酶,在某些情况下,由于制备条件较为剧烈,导致酶活回收率较低。这时,可选择物理吸附的方式固定化多酶。物理吸附可通过疏水作用、离子相互作用、静电作用等方式固定化酶。这种方法的主要优点为操作简单,反应条件温和,不易引起酶失活或变性,具有可逆性,载体可重复利用[21, 22]。
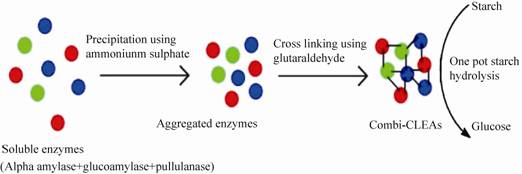
李桂江等[23]用蒙脱石作为载体,通过吸附共固定化糖化酶和α-淀粉酶,固定化双酶的最适反应温度为55 ℃,最适反应pH为5.5,且具有良好的稳定性。Pescador等[24]将葡萄糖氧化酶 (GOX) 和辣根过氧化物酶 (HRP) 共固定化于二氧化硅微粒表面的聚电解质层,通过静电作用将酶吸附于载体表面 (图2),其结果显示,将两种酶固定于同一静电层其总体酶活高于将酶固定于不同的静电层和游离酶。
为了尽可能提高酶活回收率,并保持酶分子结构的完整性,此时可选择包埋法固定化酶。根据不同的包埋方法,包埋酶可以制备成珠状、纤维状、薄膜状等。由于包埋过程不涉及酶的修饰,不需要酶的氨基酸残基参与反应,因而基本不改变酶的活性中心及高级结构,酶活损失较少。但其缺点是:酶包埋在载体中,由于扩散限制从而影响酶的催化效率。此方法比较适用于以小分子物质作为底物的酶,底物容易扩散进入固定化酶的活性部位。目前,研究者正致力于研究多酶共包埋的方法来提高酶联反应的催化效率。常用的包埋材料有硅溶胶-凝胶、反胶束、脂质体、病毒粒子等[2, 25, 26]。
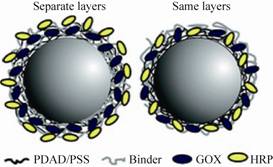
孙玉英等[27]用海藻酸钠包埋共固定化壳聚糖酶和β-D-氨基葡萄糖苷酶,固定化多酶的酶活回收率和相对活力分别为54%和38.5%,其酶活力相比于游离酶有所下降,但其酶的热稳定性相比于游离酶有所提高。Betancor等[28]将硝基苯硝基还原酶与葡萄糖-6-磷酸脱氢酶共包埋于二氧化硅粒子中,实现连续催化硝基苯生成苯基羟胺,并伴随NADPH辅酶的再生。Patterson等[29]将半乳糖激酶 (GALK)、葡萄糖激酶 (GLUK) 以及β-葡糖苷酶 (CelB) 共包埋于P22类病毒颗粒 (VLP),其原理如图3所示。三种酶通过基因融合的方式与T7外套蛋白和支架蛋白共表达,再共包埋于类病毒颗粒上。其酶活与单酶包埋于病毒颗粒相比无明显差别,同时研究显示耦合酶的活性依赖于精确的动力学平衡关系,因而在设计方案的时候需结合酶的特性。
上述方法都在一定程度上使酶分子之间的距离缩短,但其只能有限地控制酶分子结构与空间取向。共价结合以及吸附通常需要与酶分子的基团相互作用,反应是非特异性的,因而会影响酶的活性[30]。虽然包埋固定化酶没有影响酶分子的结构,但酶分子之间的相对距离仍然较远,且由于扩散效应影响酶的催化效 率[16, 31]。因此,为了更好地提高酶催化效率,酶分子与载体的结合需要定向,以防止酶活性中心的氨基酸残基与载体反应结合进而影响酶活,多种酶之间的相对位置需要精确控制,以便于更高效地催化反应[2]。因此,衍生出特异性固定化酶的制备方法,出现了许多不同的特异性结合标签,如聚组氨酸、蛋白质和DNA等。
4.1 组氨酸作为标签适当的亲和标签可以特异性地结合酶蛋白分子。最常用的亲和标签是组氨酸标签,酶与镍可通过组氨酸标签特异性的结合。组氨酸标签一般为6个组氨酸,通常位于蛋白质的N端或C端,其对蛋白质整体结构几乎没有影响[32]。Liu等[33]将这一技术用于生物合成半乳糖,这一过程包含7个酶,每种酶单独表达并固定化于镍琼脂糖珠,研究结果显示固定化酶催化效率高于游离酶。
4.2 纤维素结合区域 (Cellulose binding domain,CBD) 作为标签许多厌氧纤维素分解菌可产生被称为纤维小体的细胞外大分子复合物。在纤维小体中,多种纤维素酶共固定于支架蛋白上,支架蛋白包括粘连模块 (Cohesins) 和对接模块 (Dockerin),支架蛋白可通过CBD特异性结合纤维素固定于纤维素上[34]。根据这一原理,可以在体外人工构建纤维小体固定化纤维素酶。
Mitsuzawa等[35]构建了包含4种不同纤维素酶的纤维小体,称为罗塞塔小体 (Rosettasome),具有耐热性,其结构如图4所示,图中显示了两种不同结构的罗塞塔小体,研究显示相比于游离酶,纤维小体中总酶活有一定程度的 提高。
大量研究表明,多酶体系中酶的空间排列以及方向在酶的催化反应中直接影响酶的活性。天然的多酶复合体是酶与酶之间通过亚基或者多肽形成复杂的三级结构或四级结构,使酶分子的催化中心彼此靠近。与游离酶相比,多酶复合体中反应的中间产物可以迅速转移从而减少扩散损失,提高了中间产物的局部浓度,因而提高了酶的催化效率[36]。相比于其他固定化方法,以DNA作为支架的固定化酶可精确控制酶分子的空间排列以及方向,降低传质阻力从而提高酶的催化效率,因而引起了研究者的广泛关注。多酶之间的相对位置可以由不同标记的DNA和不同序列长度的DNA进行调控。利用DNA杂交技术制备固定化多酶的关键是:两条互补的单链DNA (ssDNA) 分子如何在温和条件下成功配对,形成螺旋结构。该方法的优点是可提高酶稳定性以及最大可能地保持酶活性[37]。目前,DNA折纸术 (DNA origami) 作为一种新型的DNA自组装方法在固定化多酶中显示出独特的优越性,通过将一条长的DNA单链 (通常为基因组DNA) 与一系列经过设计的短DNA片段进行碱基互补,能够可控地构造出高度复杂的纳米图案或结构,以有效控制酶分子间的距离[38]。
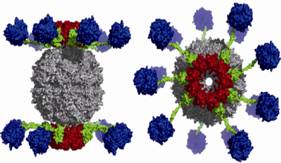
Yan[39]和Fan[40]两个研究小组均以葡萄糖氧化酶 (GOX) 和辣根过氧化物酶 (HRP) 作为固定化的模型酶,分别利用DNA折纸纳米粒子以及DNA纳米管制备了固定化多酶。研究表明,当酶分子之间的距离为10 nm时,级联反应中酶的整体活性可超出游离酶的15倍。Wilner等[41]利用同样的方法固定了这两种酶,设计了两种不用六角形的DNA支架,结构如图5所示,结果表明:相比于游离酶直接混合的反应器,固定化后的多酶能更有效地催化反应。
类弹性蛋白 (Elastin-like polypeptides,ELPs)、刀豆秋蛋白A、抗生物素蛋白等都可以作为特异性结合标签固定化多酶。ELPs作为非色谱纯化标签在蛋白质分离纯化中有广泛的应用价值。本课题组[42]利用ELPs相变的特性,以ELPs 相变聚集成的颗粒作为固定化酶进行分离纯化,酶的分离纯化与固定化可以同步进行,该方法纯化后木聚糖酶的回收率约为21.2%,纯化倍数约为3.2。刀豆秋蛋白A可与糖基化酶特异性结合;抗生物素蛋白可与生物素化的酶特异性结合,这些结合标签都可以开发制备固定化多酶。Yu等[43]将唾液酸转移酶固定化于生物素标记的功能化磁性纳米颗粒上,该固定化酶在重复利用10次后酶活回收率约为50%。
本课题组设计了一种新型类弹性蛋白多肽ELPs,在一定条件下,ELPs可同木聚糖酶一起自组装形成不溶性纳米颗粒,经分离后仍具催化能力,其对底物的亲和性略劣于游离酶,但其稳定性有显著提高[44]。目前,我们正尝试将其作为标签固定化木聚糖酶和地衣多糖酶。ELPs与酶分子通过分子粘合剂 (SpyTag和SpyCatcher) 连接,SpyTag和SpyCatcher可以自发地形成异肽键,反应可以在温和的条件下进行。ELPs在高温下相变聚集为固定化多酶颗粒,颗粒通过可逆相变循环 (Inverse transition cycling,ITC) 回收利用,只需离心等简单的操作步骤就可以实现酶的回收利用,这种固定化多酶方法具有操作简单、反应条件温和、固定化与分离纯化可同步进行等特点,是一种新型固定化多酶的方法。
5 固定化多酶的应用固定化多酶在生物传感器、食品加工和生物医学等方面都具有很大的应用前景。如Doong等[45]用凝胶-溶胶法共固定化谷氨酸脱氢酶和乙酰胆碱酯酶及辣根过氧化物酶,利用固定化多酶制备了可同时监测血液样品中乙酰胆碱、谷氨酸盐、H2O2和β-淀粉样蛋白 (β-amyloid) 的生物传感器,其可在临床上作为阿兹海默症诊断的依据。Yotova等[46]通过共价法共固定化乙酰胆碱酯酶和胆碱氧化酶于纳米膜上制备了光纤维生物传感器,该传感器可用于杀虫剂的检测。Javier等[47]用琼脂糖小球共固定化甲酸脱氢酶和NADH氧化酶及过氧化物酶,该多酶系统可将溶液中的酚类物质氧化为固体物质同时实现辅因子的再生,可应用于污水处理系统中。杨安树等[48]用交联法共固定化双蛋白酶水解鱼鳞胶原蛋白,利用该固定化多酶制备的抗氧化活性肽可以作为天然抗氧化剂添加到食品、药品以及化妆品中。李鑫[49]将苏氨酸脱氨酶和亮氨酸脱氢酶固定化于可逆溶解性pH敏感的高分子载体上,同样的方法制备固定化醇氧化酶、甲醛脱氢酶和甲酸脱氢酶。该双固定化多酶体系可以用来生产L-2-氨基丁酸,利用可逆溶解的特性可简单快速地分离固定化酶与产物,同时实现固定化酶的重复利用,该方法生产的L-2-氨基丁酸的光学纯度高于98%,反应物转化率大于96%。目前,基 于葡萄糖异构酶的共固定化多酶已实现商品化生产,该类固定化多酶可以直接利用淀粉或者纤维素生产果 糖浆[50]。
6 总结与展望酶作为高效的生物催化剂广泛应用于科学研究以及工业生产上。生物体内广泛存在的多酶复合体极大提高了酶的催化效率,促使研究者们在体外制备固定化多酶以提高酶稳定性及催化效率。在过去几十年里,研究者们已经发展了多种固定化多酶的方法,拓展了其应用领域,固定化多酶在辅酶回收、生物传感器、生物芯片等领域均具有良好的应用前景。上述多酶固定化方法都有各自的优缺点,在实际应用时,需要根据酶的特性选择合适的固定化方法。表1列举了一些已报道的固定化多酶体系,大部分是以GOX-HRP为模型酶,可为选择合适的多酶固定化方法提供参考。
| Method | Platform | Enzymes | Conversion enhancement vs. free enzymes | Reference |
| Biotin-streptavidin/covalent binding | Bi-functionalized PS nanoparticles | GOX, HRP | Up to 2 fold | [51] |
| Biotin-streptavidin/covalent binding | Magnetic nanoparticles | GOX, HRP | - | [52] |
| Cross-linking | Pore glass (CPG) beads | GOX, HRP | - | [53] |
| Physical adsorption | PLQD micelles | GOX, HRP | Up to 2 fold | [54] |
| Physical entrapment | Carbon nanotubes | GOX, HRP | - | [55] |
| Physical entrapment | Shell in shell polyelectrolyte particles | GOX, HRP | - | [56] |
| Physical entrapment | Organic-inorganic hybrid nanoflowers | GOX, HRP | Up to 4 fold | [57] |
| Layer-by-layer polyelectrolyte | Silica microparticles | GOX, HRP | Up to 2.5 fold | [24] |
| DNA directed self-assembly | Polystyrene microplate surface | GOX, HRP | - | [58] |
| DNA directed self-assembly | Aptamer circular DNA nanostructures | GOX, HRP | Up to 6 fold | [59] |
| Cross-linking | BSA | β-Glu, GOX, HRP | - | [60] |
| Covalent binding | Microfluidic devices | INV, GOX, HRP | - | [61] |
另外,在选择固定化酶方法的时候,可同时结合多种方法共固定化多酶,如van Dongen等[62]同时使用共价结合、包埋及疏水作用共固定化多酶,其制备流程如图6所示,该多酶以双亲分子PS-PIAT嵌段共聚物为载体,葡萄糖氧化酶 (GOX) 包埋于微囊内,脂肪酶 (LPS) 利用疏水作用固定于微囊壁中,通过叠氮反应将辣根过氧化物酶 (HRP) 接于微囊表面。这种分隔式固定化多酶可有效提高酶催化效率,提高底物传递效率。
总之,为了达到更好固定化多酶催化效果,在多酶固定化时需充分考虑以下几个因素:1) 共固定化过程中,需要充分考虑每个酶的结构和功能;2) 根据酶的特性选择合适的连接方式以及载体;3) 多酶固定化时,可根据单酶固定化的结果优化固定化条件,以获得更高酶活的固定化多酶。在过去的几十年里,可控的多酶固定化方法不断涌现,一方面,为减弱多酶混合时酶分子间的相互抑制作用,可根据不同的作用方式将酶固定于多尺寸载体的不同层面,制备分隔式固定化多酶,以有效控制酶的相对位置;另一方面,以DNA、蛋白质为支架的可控多酶固定化方法极大缩短了酶分子间的距离,能有效减少中间产物的传递距离,受到研究者的广泛关注。随着多酶共固定化技术的不断发展,相信制备的固定化多酶将会越来越接近于天然的多酶复合体,并具有更强的催化效率。可重复利用和连续催化反应的固定化多酶必将会成为新一代生物催化剂,广泛应用于生物工程各领域。
目前,共固定化多酶在工业上的应用还很少,其原因是共固定化多酶成本较高。目前,固定化多酶的研究仍主要集中于共固定化方法的改进与开发,以获得高催化效率、低成本的固定化多酶。相信随着研究的不断深入,固定化多酶将会工业生产中发挥巨大的作用。
| [1] | Lopez-Gallego F, Schmidt-Dannert C. Multi- enzymatic synthesis. Curr Opin Chem Biol, 2010, 14(2): 174-183. |
| [2] | Schoffelen S, van Hest JC. Multi-enzyme systems: bringing enzymes together in vitro. Soft Matter, 2012, 8(6): 1736-1746. |
| [3] | Zhang YH. Substrate channeling and enzyme complexes for biotechnological applications. Biotechnol Adv, 2011, 29(6): 715-725. |
| [4] | Xue R, Woodley JM. Process technology for multi-enzymatic reaction systems. Bioresour Technol, 2012, 115: 183-195. |
| [5] | Ricca E, Brucher B, Schrittwieser JH. Multi-enzymatic cascade reactions: overview and perspectives. Adv Synth Catal, 2011, 353(13): 2239-2262. |
| [6] | Santacoloma PA, Sin G, Gernaey KV, et al. Multienzyme-catalyzed processes: next-generation biocatalysis. Org Process Res Dev, 2011, 15(1): 203-212. |
| [7] | Zou Y, Xue M, Wang W, et al. One-pot three-enzyme synthesis of UDP-Glc, UDP-Gal, and their derivatives. Carbohydr Res, 2013, 373: 76-81. |
| [8] | Bhattacharyya RP, Reme′nyi A, Yeh BJ, et al. Domains, motifs, and scaffolds: the role of modular interactions in the evolutionand wiring of cell signaling circuits. Annu Rev Biochem, 2006, 75: 655-680. |
| [9] | Schoffelen S, van Hest JC. Chemical approaches for the construction of multi-enzyme reaction systems. Curr Opin Struct Biol, 2013, 23(4): 613-621. |
| [10] | Singh S, Solanki PR, Pandey MK, et al. Covalent immobilization of cholesterol esterase and cholesterol oxidasev on polyaniline films for application to cholesterol biosensor. Anal Chim Acta, 2006, 568(1/2): 126-132. |
| [11] | Kim H, Sun Q, Liu F, et al. Biologically assembled nanobiocatalysts. Top Catal, 2012, 55(16-18): 1138-1145. |
| [12] | Idan O, Hess H. Engineering enzymatic cascades on nanoscale scaffolds. Curr Opin Biotechnol, 2013, 24(4): 606-611. |
| [13] | Hirakawa H, Haga T, Nagamune T. Artificial protein complexes for biocatalysis. Top Catal, 2012, 55(16-18): 1124-1137. |
| [14] | Niemeyer CM, Koehler J, Wuerdemann C. DNA-directed assembly of bienzymic complexes from in vivo biotinylated NAD(P)H:FMN oxidoreductase and luciferase. Chembiochem, 2002, 3(2/3): 242-245. |
| [15] | Hernandez K, Fernandez-Lafuente R. Control of protein immobilization: coupling immobilization and site-directed mutagenesis to improve biocatalyst or biosensor performance. Enzyme Microb Technol, 2011, 48(2): 107-122. |
| [16] | Brady D, Jordaan J. Advances in enzyme immobilization. Biotechnol Lett, 2009, 31(11): 1639-1650. |
| [17] | Torabi SF, Khosro K, Ghasempur S, et al. Covalent attachment of cholesterol oxidase and horseradish peroxidase on perlite through silanization: activity, stability and co-immobilization. J Biotechnol, 2007, 131(2): 111-120. |
| [18] | Roessl U, Nahalka J, Nidetzky B. Carrier-free immobilized enzymes for biocatalysis. Biotechnol Lett, 2010, 32(3): 341-350. |
| [19] | Taboada-Puig R, Junghanns C, Demarche P, et al. Combined cross-linked enzyme aggregates from versatile peroxidase and glucose oxidase: production, partial characterization and application for the elimination of endocrine disruptors. Bioresour Technol, 2011, 102(11): 6593-6599. |
| [20] | Talekar S, Pandharbale A, Ladole M, et al. Carrier free co-immobilization of alpha amylase, glucoamylase and pullulanase as combined cross-linked enzyme aggregates (combi-CLEAs): a tri-enzyme biocatalyst with one pot starch hydrolytic activity. Bioresour Technol, 2013, 147: 269-275. |
| [21] | Jesionowski T, Zdarta J, Krajewska B. Enzyme immobilization by adsorption: a review. Adsorption, 2014, 20(5/6): 801-821. |
| [22] | Betancor L, Luckarift H. Co-immobilized coupled enzyme systems in biotechnology. Biotechnol Genet Eng Rev, 2010, 27(1): 95-114. |
| [23] |
Li GJ, Zhou SX, Lü YH. Study on immobilization of α-amylase and glucoamylase on montmorillonite. Food Sci Technol, 2011, 36(5): 54-58 (in Chinese). 李桂江, 周仕学, 吕英海. 蒙脱石固定化α-淀粉酶和糖化酶的研究. 食品科技, 2011, 36(5): 54-58. |
| [24] | Pescador P, Katakis I, Toca-Herrera JL, et al. Efficiency of a bienzyme sequential reaction system immobilized on polyelectrolyte multilayer-coated colloids. Langmuir, 2008, 24(24): 14108-14114. |
| [25] | Betancor L, Luckarift HR. Bioinspired enzyme encapsulation for biocatalysis. Trends Biotechnol, 2008, 26(10): 566-572. |
| [26] | Sheldon RA, van Pelt S. Enzyme immobilisation in biocatalysis: why, what and how. Chem Soc Rev, 2013, 42(15): 6223-6235. |
| [27] |
Sun YY, Zhang JQ. Comparative study of crude enzyme immobilization by cross-linking and entrapment methods. J Huaihai Ins Technol, 2013, 22(3): 82-88 (in Chinese). 孙玉英, 张继泉. 吸附交联法和包埋法固定化混合酶研究. 淮海工学院学报, 2013, 22(3): 82-88. |
| [28] | Betancor L, Berne C, Luckarift HR, et al. Coimmobilization of a redox enzyme and a cofactor regeneration system. Chem Commun, 2006, (34): 3640-3642. |
| [29] | Patterson DP, Schwarz B, Waters RS, et al. Encapsulation of an enzyme cascade within the bacteriophage P22 virus-like particle. ACS Chem Biol, 2014, 9(2): 359-365. |
| [30] | Garcia-Galan C, Berenguer-Murcia á, Fernandez- Lafuente R, et al. Potential of different enzyme immobilization strategies to improve enzyme performance. Adv Synth Catal, 2011, 353(16): 2885-2904. |
| [31] | Cantone S, Ferrario V, Corici L, et al. Efficient immobilization of industrial biocatalysts: criteria and constraints for the selection of organic polymeric carriers and immobilization methods. Chem Soc Rev, 2013, 42(15): 6262-6276. |
| [32] | Ley C, Holtmann D, Mangold KM, et al. Immobilization of histidine-tagged proteins on electrodes. Colloids Surf B Biointerfaces, 2011, 88(2): 539-551. |
| [33] | Liu Z, Zhang J, Chen X, et al. Combined biosynthetic pathway for de novo production of UDP-galactose: catalysis with multiple enzymes immobilized on agarose beads. Chembiochem, 2002, 3(4): 348-355. |
| [34] | Fontes CM, Gilbert HJ. Cellulosomes: highly efficient nanomachines designed to deconstruct plant cell wall complex carbohydrates. Annu Rev Biochem, 2010, 79: 655-681. |
| [35] | Mitsuzawa S, Kagawa H, Li Y, et al. The rosettazyme: a synthetic cellulosome. J Biotechnol, 2009, 143(2): 139-144. |
| [36] | Oroz-Guinea I, García-Junceda E. Enzyme catalysed tandem reactions. Curr Opin Chem Biol, 2013, 17(2): 236-249. |
| [37] | Jia F, Narasimhan B, Mallapragada S. Materials-based strategies for multi-enzyme immobilization and co-localization: a review. Biotechnol Bioeng, 2014, 111(2): 209-222. |
| [38] | Rothemund PW. Folding DNA to create nanoscale shapes and patterns. Nature, 2006, 440(7082): 297-302. |
| [39] | Fu J, Liu M, Liu Y, et al. Interenzyme substrate diffusion for an enzyme cascade organized on spatially addressable DNA nanostructures. J Am Chem Soc, 2012, 134(12): 5516-5519. |
| [40] | Fu Y, Zeng D, Chao J, et al. Single-step rapid assembly of DNA origami nanostructures for addressable nanoscale bioreactors. J Am Chem Soc, 2013, 135(2): 696-702. |
| [41] | Wilner OI, Weizmann Y, Gill R, et al. Enzyme cascades activated on topologically programmed DNA scaffolds. Nat Nanotechnol, 2009, 4(4): 249-254. |
| [42] |
Fu XP, Wang WY, Zhang GY. Construction of an expression vector with elastin-like polypeptide tag to purify xylanase. Acta Microbiol Sin, 2012, 52(1): 90-95 (in Chinese). 付晓平,王文研,张光亚. 以类弹性蛋白多肽为标签的表达质粒构建及其用于木聚糖酶的非色谱纯化. 微生物学报, 2012, 52(1): 90-95. |
| [43] | Yu CC, Kuo YY, Liang CF, et al. Site-specific immobilization of enzymes on magnetic nanoparticles and their use in organic synthesis. Bioconjug Chem, 2012, 23(4): 714-724. |
| [44] | Li CC, Zhang GY. The fusions of elastin-like polypeptides and xylanase self-assembled into insoluble active xylanase particles. J Biotechnol, 2014, 177: 60-66. |
| [45] | Doong RA, Lee PS, Anitha K. Simultaneous determination of biomarkers for Alzheimer's disease using sol–gel-derived optical array biosensor. Biosens Bioelectron, 2010, 25(11): 2464-2469. |
| [46] | Yotova L, Medhat N. Coimmobilization of acetylcholinesterase and choline oxidase on new nanohybrid membranes obtained by sol gel technology. Biotechnol Equip, 2012, 26(3): 3039-3043. |
| [47] | Javier RM, Susana VL, José MG, et al. Oxidation of phenolic compounds catalyzed by immobilized multi-enzyme systems with integrated hydrogen peroxide production. Green Chem, 2014, 16: 303-311. |
| [48] |
Yang AS, Chen HB, Wu ZH, et al. A method in preparation of antioxidant peptides by using co-immobilized bi-enzyme to hydrolyze fish scale collagen protein: CN 102533913. 2013-07-31 (in Chinese). 杨安树, 陈红兵, 吴志华, 等. 一种采用共固定化双酶水解鱼鳞胶原蛋白制备抗氧化活性肽的方法: 中国, 102533913. 2013-07-31. |
| [49] |
Li X. A method of production L-2-aminobutyric acid by bi-immobilized multi-enzyme system: CN 102517351. 2012-06-27 (in Chinese). 李鑫. 一种双固定化多酶体系生产L-2-氨基丁酸的方法: 中国, 102517351. 2012-06-27. |
| [50] | DiCosimo R, McAuliffe J, Poulose AJ, et al. Industrial use of immobilized enzymes. Chem Soc Rev, 2013, 42(15): 6437-6474. |
| [51] | Jia F, Narasimhan B, Mallapragada SK. Biomimetic multienzyme complexes based on nanoscale platforms. AIChE J, 2013, 59(2): 355-360. |
| [52] | Garcia J, Zhang Y, Taylor H, et al. Multilayer enzyme-coupled magnetic nanoparticles as efficient, reusable biocatalysts and biosensors. Nanoscale, 2010, 3(9): 3721-3730. |
| [53] | Vojinovi′c V, Calado CR, Silva AI, et al. Micro-analytical GO/HRP bioreactor for glucose determination and bioprocess monitoring. Biosens Bioelectron, 2005, 20(10): 1955-1961. |
| [54] | Jia F, Zhang Y, Narasimhan B, et al. Block copolymer-quantum dot micelles for multienzyme colocalization. Langmuir, 2012, 28(50): 17389-17395. |
| [55] | Zhu L, Yang R, Zhai J, et al. Bienzymatic glucose biosensor based on co-immobilization of peroxidase and glucose oxidase on a carbon nanotubes electrode. Biosens Bioelectron, 2007, 23(4): 528-535. |
| [56] | Kreft O, Prevot M, Möhwald H, et al. Shell-in-shell microcapsules: a novel tool for integrated, spatially confined enzymatic reactions. Angew Chem Int Ed Engl, 2007, 46(29): 5605-5608. |
| [57] | Sun J, Ge J, Liu W, et al. Multi-enzyme co-embedded organic–inorganic hybrid nanoflowers: synthesis and application as a colorimetric sensor. Nanoscale, 2014, 6(1): 255-262. |
| [58] | Müller J, Niemeyer CM. DNA-directed assembly of artificial multienzyme complexes. Biochem Biophys Res Commun, 2008, 377(1): 62-67. |
| [59] | Wang ZG, Wilner OI, Willner I. Self-assembly of aptamer-circular DNA nanostructures for controlled biocatalysis. Nano Lett, 2009, 9(12): 4098-4102. |
| [60] | Bäumler H, Georgieva R. Coupled enzyme reactions in multicompartment microparticles. Biomacromolecules, 2010, 11(6): 1480-1487. |
| [61] | Logan TC, Clark DS, Stachowiak TB, et al. Photopatterning enzymes on polymer monoliths in microfluidic devices for steady-state kinetic analysis and spatially separated multi-enzyme reactions. Anal Chem, 2007, 79(17): 6592-6598. |
| [62] | van Dongen SFM, Nallani M, Cornelissen JJLM, et al. A three-enzyme cascade reaction through positional assembly of enzymes in a polymersome nanoreactor. Chem Eur J, 2009, 15(5): 1107-1114. |
 2015, Vol. 31
2015, Vol. 31