服务
文章信息
- 薄芳芳, 许召贤, 孙朱贞, 曹长虹, 夏军, 徐虹, 冯小海
- Bo Fangfang, Xu Zhaoxian, Sun Zhuzhen, Cao Changhong, Xia Jun, Xu Hong, Feng Xiaohai
- 氧载体对小白链霉菌发酵生产ε-聚赖氨酸的影响
- Effect of oxygen-vectors on the production of ε-poly-L-lysine
- 生物工程学报, 2015, 31(3): 431-435
- Chin J Biotech, 2015, 31(3): 431-435
- 10.13345/j.cjb.140354
-
文章历史
- Received: July 4, 2014
- Accepted: October 14, 2014
2. 南京工业大学食品与轻工学院,江苏 南京 210009
2. College of Food Science and Light Industry, Nanjing University of Technology, Nanjing 210009, Jiangsu, China
ε-聚赖氨酸 (ε-poly-L-lysine,简称ε-PL) 是由人体必需氨基酸L-赖氨酸的ε-氨基与α-羧基通过酰胺键连接而成的L-赖氨酸同聚物[1, 2]。ε-PL有广谱的抑菌性,是一种高效安全的食品防腐剂。此外,ε-PL在化妆品、吸水树脂、药物缓释材料等方面也有广泛应用。ε-PL作为生物防腐剂已获得美国食品与药品管理局 (FDA) 批准,并进入日本、欧洲和韩国等市场[3, 4]。中国卫计委2014年第5号文 (2014年4月29日) 也将ε-PL批准用于食品添加剂。ε-PL主要通过微生物发酵方法得到,本课题组在前期工作中筛选得到一株高产ε-PL的白色链霉菌菌株,命名为Streptomyces albulus PD-1,并且在其发酵液中发现另一种聚氨基酸聚二氨基丙酸(PDAP)[5]。我们发现在S. albulus PD-1发酵过程中溶氧是影响ε-PL生产的关键因素之一。ε-PL合成时期发酵液粘稠,溶氧水平较低,菌体生长和ε-PL产量受到明显的影响。
传统提高发酵液中溶氧水平的方法有提高搅拌转速和增大通气量等,但这会造成剪切应力过大、泡沫增多、不易控制等现象的发生。增大搅拌转速和提高通气量也会增加运行费用和设备成本[6]。目前许多其他有效的方法被用来改善发酵中菌体对氧气需求的问题,如将携带氧的基因血红蛋白基因克隆到目的菌株中[7];向发酵液中加入分子氧底物[8];菌株和藻类共培养[9]。利用氧载体提高发酵过程中的氧传递效率也是一种目前应用较广泛的方法。朱艳等[10]在发酵液中添加氧载体提高了番茄红素的产量;颜日明等[11]添加正十二烷进行双液相发酵,其发酵生物量和油脂产量分别提高了25.3%和41.8%;张丹等[12]通过添加氧载体也提高了另外一种聚氨基酸γ-聚谷氨酸的产量。为了探讨不同种类的氧载体对S. albulus PD-1生产ε-PL的影响,本实验中选取了常见的几种氧载体进行研究,以期望为实现ε-PL产业化生产奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株小白链霉菌Streptomyces albulus PD-1,本实验室筛选保藏。
1.1.2 培养基培养基参照文献[13]。
1.2 方法 1.2.1 摇瓶发酵方法参照文献[5]。
1.2.2 发酵罐发酵采用5 L搅拌式发酵罐 (KoBio Tech Co. Ltd.,Korea)。初始装液量2.7 L,接种量10%。采用两阶段pH控制工艺进行ε-PL批次补料发酵:第一阶段即菌体生长阶段,控制较高pH值(约6.0);第二阶段即产物合成阶段,控制较低pH值 (4.0)。当发酵液中葡萄糖含量低于10 g/L时,通过流加补料的方式维持葡萄糖含量为10 g/L。
1.2.3 ε-PL与PDAP的含量检测方法参照文献[5]。
1.2.4 菌体干重测定和发酵液中葡萄糖含量测定方法参照文献[13]。
2 结果与讨论 2.1 溶氧水平对发酵体系的影响在5 L发酵罐中进行批次不补料发酵,维持其他条件不变,通过改变通气量来调节发酵液中的溶氧水平,对S. albulus PD-1发酵生产ε-PL进行研究。结果表明ε-PL的产量随着溶氧水平的提高而增加,在30%的溶氧水平下达到最高产量4.3 g/L。同时,S. albulus PD-1发酵液中一种主要副产物PDAP的产量在较高溶氧水平时减少。
2.2 氧载体的筛选在发酵初始阶段添加各种不同浓度的氧载体,研究其对细胞生长和产物合成的影响。以不添加氧载体为对照,在装液量100 mL/1 000 mL的三角瓶中培养72 h,取样测定发酵参数,结果见表1。
| Sample | Addition volume (%) | ε-PL (g/L) | PDAP (g/L) | DCW (g/L) |
| n-Hexane | 0.5 | 0.743 | 0.032 | 5.82 |
| n-Heptane | 1.5 | 0.764 | 0.035 | 6.53 |
| n-Dodecane | 0.5 | 0.893 | 0.017 | 6.03 |
| n-Hexadecane | 0.2 | 0.719 | 0.043 | 6.45 |
| Acetic ether | 1.0 | 0.800 | 0.028 | 6.40 |
| Oleic acid | 0.2 | 0.742 | 0.029 | 6.17 |
| Control | 0.0 | 0.613 | 0.047 | 5.50 |
由表1可知,不同种类的氧载体对ε-PL的产量和S. alublus PD-1菌体干重均有显著影响,其中添加正十二烷效果最为显著。在摇瓶发酵中添加0.5% (V/V) 正十二烷,ε-PL产量可以提高45%。并且S. alublus PD-1在以正十二烷作为唯一碳源的培养基中不生长,说明菌体并不能利用正十二烷。最终从对ε-PL的促进效果以及经济性考虑,本实验选取正十二烷为最适氧载体,0.5% (V/V) 为最适添加比例。
2.3 正十二烷添加时间对ε-PL生产的影响在摇瓶发酵的0、12、24、36、48 h时分别添加0.5% (V/V) 的正十二烷,根据测定ε-PL的产量,确定氧载体的最佳添加时间。由实验数据可知,在0 h添加氧载体,ε-PL产量提高最多,同时副产物PDAP可以较大程度被抑制。
2.4 5 L发酵罐中添加氧载体对ε-PL生产的影响我们在5 L发酵罐中添加0.5% (V/V) 的正十二烷进行批次补料发酵,并对ε-PL和PDAP产量、菌体干重和溶氧水平等参数进行考察。由图1可知,添加0.5% (V/V) 的正十二烷以后,在ε-PL合成阶段发酵液中的溶氧水平从23.8%提高到32%,说明添加正十二烷对发酵液中溶氧不足的现象有很大的缓解作用。添加正十二烷后ε-PL产量达到30.8 g/L,和对照相比提高了31.6%;菌体干重最终达到33.8 g/L,和对照相比提高了20.7%,说明适量氧载体的添加对菌体干重和ε-PL的合成有很大的提高作用。Yamanaka等[14, 15]在对聚赖氨酸合成酶 (Pls) 的转录表达与动力学研究中指出胞内ATP水平是ε-PL合成代谢的关键调控因素。发酵液中溶氧水平的提高,会促进细胞呼吸作用的增强,导致胞内ATP水平的提高,ATP水平的提高,不仅为细胞生产提供了能量,而且有利于聚赖氨酸合成酶催化L-赖氨酸合成ε-PL。同时添加0.5% (V/V) 正十二烷后,S. albulus PD-1发酵液中一种副产物PDAP合成受到抑制,PDAP的产量从4.32 g/L降低到2.98 g/L,与对照相比降低31%。副产物产量降低,底物转化率提高,也是添加正十二烷促进ε-PL产量提高的另外一种原因。
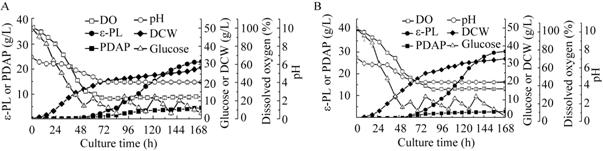
|
| 图1 5 L发酵罐中添加正十二烷对发酵的影响 Fig.1 Effects of addition of n-dodecane on fermentation in a 5 L bioreactor. (A) Control. (B) With 0.5 % (V/V) n-dodecane in broth. |
细胞比生长速率和产物比合成速率是表征发酵过程的重要参数。根据比生长速率的定义,μ=dCx/(Cxdt),我们应用Origin 8.0软件,通过曲线拟合的方法来近似计算S. albulus PD-1培养过程中的比生长速率和ε-PL比合成速率。
分析结果表明,两种情况下细胞比生长速率和ε-PL比合成速率的变化趋势相同 (图2),但是添加正十二烷后,在一定时间范围内,S. albulus PD-1菌体比生长速率及ε-PL比合成速率均较对照组大。两组菌体均在16 h到达最大细胞比生长速率 (图2A),对照组为0.015 h-1,添加十二烷后,达到0.18 h-1,在90 h后两种情况下均趋于平衡,此时菌体生长基本出现停滞。从ε-PL比合成速率 (图2B) 可以看出,对照组菌体在100 h达到最大ε-PL比合成速率0.013 h-1;添加正十二烷后,菌体在110 h达到最大ε-PL比合成速率0.018 h-1,并且在80 h后ε-PL比合成速率就已经大于对照组。同时,从图中可以看出在培养过程时微生物次级代谢产物 (ε-PL) 的合成要落后于细胞的生长,在细胞生长的减慢期或静止期才有次级代谢产物的大量积累。正十二烷的加入可以促进前期菌体的生长,对后期ε-PL的合成也有很明显的提高作用。
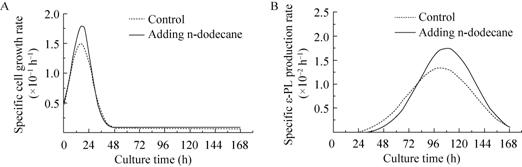
|
| 图2 5 L 发酵罐中添加正十二烷对发酵动力学参数的影响 Fig.2 Effects of addition of 0.5% (V/V) n-dodecane on process parameters in a 5 L bioreactor. (A) Specific cell growth rate. (B) Specific ε-PL production rate. |
本文将6种氧载体添加到S. albulus PD-1的发酵培养基中,均对ε-PL的产量起到促进作用,其中正十二烷的效果最好。在5 L发酵罐中进行批次补料发酵时,在发酵初始时期加入0.5% (V/V) 的正十二烷,ε-PL合成时期发酵液中溶氧水平从23.8%提高到32%,S. albulus PD-1的ε-PL产量和生物量分别达到30.8 g/L和33.8 g/L,和对照相比分别提高了31.6%和20.7%,同时适宜的溶氧水平可以抑制主要副产物PDAP的生成。氧载体的加入对发酵液中的溶氧水平有很大的提高作用,对高耗氧发酵体系的构建具有重要意义。
| [1] | Shima S. Polylysine produced by Streptomyces. Agric Biol Chem, 1977, 41(9): 1807-1809. |
| [2] | Shima S, Sakai H. Poly-L-lysine produced by Streptomyces. Part III. Chemical studies. Agric Biol Chem, 1981, 45(11): 2503-2508. |
| [3] | Yoshida T, Nagasawa T. ε-Poly-L-lysine: microbial production, biodegradation and application potential. App1 Microbio1 Biotechno1, 2003, 62(1): 21-26. |
| [4] | Shih IL, Shen MH, Van YT. Microbial synthesis of poly (ε-lysine) and its various applications. Bioresour Technol, 2006, 97(9): 1148-1159. |
| [5] | Xia J, Xu H, Feng X, et al. Poly (l-diaminopropionic acid), a novel non-proteinic amino acid oligomer co-produced with poly (ε-l-lysine) by Streptomyces albulus PD-1. App1 Microbio1 Biotechno1, 2013, 97(17): 7597-7605. |
| [6] | Kahar P, Kobayashi K, Iwata T, et al. Production of ε-polylysine in an airlift bioreactor (ABR). J Biosci Bioeng, 2002, 93(3): 274-280. |
| [7] |
Wen Y, Song Y. Effects of the expression of Vitreoscilla hemoglobin in Cinnamon sreptomyces on cell growth and the antibotics production. Chin J Biotech, 2001, 17(1): 24-28 (in Chinese). 文莹, 宋渊. 透明颤菌血红蛋白在肉桂地链霉菌中的表达对其细胞生长及抗生素合成的影响. 生物工程学报, 2001, 17(1) : 24-28. |
| [8] |
Li SL, Jiao P, Cao ZA. Effects of H2O2 addition on oxygen supply and metabolism of microorganisms. Acta Microbiol Sin, 2002, 42(1): 129-132 (in Chinese). 李书良, 焦鹏, 曹竹安. 流加H2O2对提高供氧及菌体代谢的影响. 微生物学报, 2002, 42(1): 129-132. |
| [9] | Adlercreutz P, Holst O, Mattiasson B. Oxygen supply to immobilized cells: 2. Studies on a coimmobilized algae-bacteria preparation with in situ oxygen generation. Enzyme Microb Technol, 1982, 4(6): 395-400. |
| [10] |
Zhu Y, Yuan QP, Wang H. Enhancement of lycopene production by Blakeslea trispora using oxygen-vectors and surface active agents. Microbiol China, 2006, 33(1): 90-93 (in Chinese). 朱艳, 袁其朋, 王航. 添加氧载体及表面活性剂对番茄红素发酵的影响. 微生物学通报, 2006, 33(1): 90-93. |
| [11] |
Yan RM, Ai ZZ, Wang Y, et al. Improving production of microbial lipids in a two-liquid phase fermentation system. Chin J Biotech, 2013, 29(4): 536-539 (in Chinese). 颜日明, 艾佐佐, 汪涯, 等. 双液相体系强化氧传递促进微生物油脂生产. 生物工程学报, 2013, 29(4): 536-539. |
| [12] | Zhang D, Feng XH, Li S, et al. Effects of oxygen vectors on the synthesis and molecular weight of poly (γ-glutamic acid) and the metabolic characterization of Bacillus subtilis NX-2. Process Biochem, 2012, 47(12): 2103-2109. |
| [13] | Zhang Y, Feng X, Xu H, et al. ε-Poly-L-lysine production by immobilized cells of Kitasatospora sp. MY 5-36 in repeated fed-batch cultures. Bioresour Technol, 2010, 101(14): 5523-5527. |
| [14] | Yamanaka K, Kito N, Imokawa Y, et al. Mechanism of ε-poly-l-lysine production and accumulation revealed by identification and analysis of an ε-poly-l-lysine-degrading enzyme. Appl Environ Microbiol, 2010, 76(17): 5669-5675. |
| [15] | Yamanaka K, Maruyama C, Takagi H, et al. Epsilon-poly-L-lysine dispersity is controlled by a highly unusual nonribosomal peptide synthetase. Nat Chem Biol, 2008, 4(12): 766-772. |
 2015, Vol. 31
2015, Vol. 31