服务
文章信息
- 沈凤英, 吴伟刚, 张艳杰, 寇宏达, 冀红柳, 李亚宁, 刘大群
- Fengying Shen, Weigang Wu, Yanjie Zhang, Hongda Kou, Hongliu Ji, Yaning Li, Daqun Liu
- 玫瑰黄链霉菌Men-myco-93-63nsdAmgh基因阻断突变株的构建
- Construction of nsdAmgh gene disruption mutant in Strempomyces roseoflavus Men-myco-93-63
- 生物工程学报, 2015, 31(12): 1741-1752
- Chin J Biotech, 2015, 31(12): 1741-1752
- 10.13345/j.cjb.150053
-
文章历史
- Received: January 25, 2015
- Accepted: June 12, 2015
2. 河北北方学院,河北 张家口 075000
3. 河北农业大学国际合作处,河北 保定 071001
2. North University of Hebei, Zhangjiakou 075000, Hebei, China
3. International Cooperation Department, Agricultural University of Hebei, Baoding 071001, Hebei, China
nsdA (Negative regulator of Streptomyces differentiation) 是普遍存在于大多数链霉菌中的全局性负调控基因[1],对链霉菌抗生素的合成和产孢形态分化具有负调控作用。该基因最先在天蓝色链霉菌中发现,nsdA基因被阻断后,天蓝色链霉菌的放线紫红素 (Act) 等4种抗生素的产量明显提高,孢子产量也明显提高,突变株产孢量是天蓝色链霉菌M 145的20倍[2]。在变铅青链霉菌ZX64中,nsdA基因的阻断可激活沉默的放线紫红素生物合成基因簇的表 达[3]。阿维链霉菌NRRL8165中阻断该基因后,HPLC分析表明突变株阿维菌素的效价提高了约3−5倍[4]。肉桂地链霉菌nsdA中断菌株BIB309与出发菌株相比,莫能菌素产量提高了2.7倍[5]。
玫瑰黄链霉菌Men-myco-93-63是分离自马铃薯疮痂病自然衰退土壤中的一株拮抗菌。该菌株及其发酵液对棉花黄萎病菌、瓜类白粉病菌等多种重要的植物病原菌具有很强的抑制作用,有良好的生防应用潜力[6]。本实验室已克隆得到玫瑰黄链霉菌Men-myco-93-63中的与天蓝色链霉菌M 145 nsdA同源的基因——nsdAmgh[7]。为进一步明确该基因在玫瑰黄链霉菌Men-myco-93-63抗生素合成代谢途径中起到的作用,本文利用基因破坏策略,以pKC 1139为载体构建重组质粒,阻断nsdAmgh基因,对比nsdAmgh基因阻断突变株与玫瑰黄链霉菌Men-myco-93-63野生型菌株的抑菌活性,从而探明nsdAmgh基因对玫瑰黄链霉菌Men-myco-93-63抗生素生物合成的调控作用。
1 材料与方法 1.1 菌株和质粒玫瑰黄链霉菌Streptomyces roseoflavus Men-myco-93-63,质粒pMDNA1500、pUC119::Kmr、pKC1139、pSRNA1500由河北农业大学生物防治实验室保存。天蓝色链霉菌Streptomyces coelicolor M 145由中国科学院微生物所谭华荣教授惠赠。
1.2 载体、限制性内切酶和试剂DNA Blunting KitⅠ试剂盒、DNA回收试剂盒、酶类均购自TaKaRa公司;DNA分子量标准物购自北京泽星公司;DIG High Prime DNA Labeling and Detection Starter KitⅠ购自Roche公司。NC膜购自上海生物工程有限公司。其他常规试剂参见文献[8]和[9]。
1.3 培养基和抗生素大肠杆菌培养基为LA和LB,玫瑰黄链霉菌Men-myco-93-63与大肠杆菌ET12567 (pUZ8002,pSRNA2500) 的接合转移选用MS培养基,发酵培养基采用PDA液体培养基不加琼脂粉。棉花黄萎病菌培养基采用Czapek培养基,链霉菌液体培养基为YEME。LB中氨苄青霉素 (Ampicillin,Amp) 使用量为100 µg/mL;安普霉素 (Apramycin,Am) 为50 µg/mL;氯霉素 (Chloramphenicol,Cm) 为25 µg/mL;卡那霉素 (Kanamycin,Km),储存浓度25 mg/mL,在链霉菌中的使用浓度是25 μg/mL,在大肠杆菌中是50 μg/mL;接合转移培养基中安普霉素使用量为每平板1 000 μg。
1.4 基因阻断载体pSRNA2500的构建方法用Hind Ⅲ和XbaⅠ双酶切pMDNA1500质粒,产生1.5 kb的Hind Ⅲ-XbaⅠDNA片段,其中包含了完整的nsdAmgh基因,回收该片段并克隆到pKC1139的Hind Ⅲ和XbaⅠ位点上构建成pSRNA1500质粒。在pSRNA1500质粒上nsdAmgh基因中找到单一的ScaⅠ酶切位点,用ScaⅠ酶切pSRNA1500,回收该8.0 kb大小的片段;同时用BamHⅠ和EcoRⅠ双酶切重组质粒pUC119::Kmr,回收约1.0 kb的卡那霉素抗性基因片段;用DNA Blunting KitⅠ试剂盒使卡那霉素抗性基因片段末端平滑化,然后连接以上两个DNA片段,将连接产物转化E. coli DH5α,从转化子中提取质粒,进行酶切验证,获得用于基因阻断的质粒pSRNA2500。
1.5 基因中阻断菌株的获得用热激的方法将pSRNA2500转入E. coli ET12567 (pUZ8002) 以获得接合转移供体 E. coli ET12567 (pUZ8002/ pSRNA2500),在含有安普霉素和卡那霉素的LB平板上筛选转化子,对转化子进行质粒提取、酶切验证。然后再通过接合转移的方法转化玫瑰黄链霉菌Men-myco-93-63的孢子,在含有安普霉素和卡那霉素的MS平板上筛选转化子,对转化子进行质粒提取、酶切验证。
将转化子转接至含有卡那霉素和/或安普霉素的PDA培养基上,28 ℃培养7 d,制备孢子悬液。经适当稀释后,以每个平皿104个孢子的浓度涂布在含有卡那霉素的基本培养基平板上,于42 ℃高温培养。将生长出来的菌落同时影印到PDA/Km和PDA/Am平板上,筛选发生双交换 (KmrAms) 的nsdAmgh基因阻断突变株。随机选择3株nsdAmgh基因阻断突变株接种于无任何选择压力的基本培养基上,28 ℃下培养,传3代后重新转接至分别含有卡那霉素和安普霉素的基本培养基上,验证其稳定性。
1.6 nsdAmgh 基因阻断株的PCR验证将nsdAmgh基因阻断突变株接种至含有卡那霉素的YEME培养基中,28 ℃、250 r/min培养48 h后提取基因组DNA。用引物nsdAWZ-R、nsdAWZ-L进行扩增验证。
1.6.1 PCR反应中所用引物PCR反应中所用引物[10]由上海生工生物工程有限公司合成 (表1)。
| Primer name | Primer sequence (5′-3′) |
| nsdAWZ-R | GTGAGTGGCAACGGCGGAAGC |
| nsdAWZ-L | TCAGACCGCTTCGGCGGTCTCC |
95 ℃预变性8 min,94 ℃变性1 min,复性 55 s,72 ℃延伸10 min,30个循环。PCR 反应中所用的酶均为LA Taq DNA聚合酶,缓冲液为2 × GC Ⅰ。
1.7 基因阻断株的杂交验证 1.7.1 探针制备参照Roche公司试剂盒所示方法,将酶切片段用Digoxigenin-dUTP标记。
用含有卡那霉素 (Km) 基因片段的质粒 pUC119:Kmr 合成探针,质粒pUC119::Kmr经BamHⅠ和 EcoRⅠ双酶切和琼脂糖电泳后,回收约1.0 kb卡那霉素抗性基因片段,经1%琼脂糖电泳分析初步确定回收产物的含量。然后按探针标记试剂盒标明的方法标记探针,标记好的探针经梯度稀释后,取1 μL稀释溶液准备在杂交膜上点样使用,标记探针于-20 ℃保存。
用含有nsdAmgh基因片段的质粒pMDNA 1500合成探针,用Hind Ⅲ-Xba Ⅰ双酶切产生1.5 kb的DNA片段,其中包含了完整的nsdAmgh基因,回收该片段,经1%琼脂糖电泳分析初步确定回收产物的含量。然后按探针标记试剂盒标明的方法标记探针,标记好的探针经梯度稀释后取1 μL稀释溶液准备在杂交膜上使用,标记探针于-20 ℃保存。
1.7.2 Dot blotting杂交杂交点样、预杂交、Dot blotting杂交及显色方法参考文献[11]。将nsdAmgh基因阻断突变株和玫瑰黄链霉菌Men-myco-93-63野生型菌株分别接种至含有卡那霉素的TSB培养基中,28 ℃、250 r/min培养48 h后提取染色体DNA点NC膜。试验中用玫瑰黄链霉菌Men-myco-93-63染色体 DNA作为阴性对照。pUC119::Kmr质粒上含1.0 kb的Kmr抗性基因DNA片段,因此选用pUC119::Kmr质粒为阳性对照,以pUC119::Kmr质粒上1.0 kb的Kmr抗性基因DNA片段为探针,进行Dot blotting杂交验证。
1.7.3 Southern blottingSouthern转移、预杂交、杂交及显色方法参考文献[12]和[13]。将nsdAmgh基因阻断突变株和玫瑰黄链霉菌Men-myco-93-63野生型菌株分别接种至含有卡那霉素的TSB培养基中,28 ℃、250 r/min培养48 h后提取染色体DNA,Hind Ⅲ和XbaⅠ双酶切nsdAmgh基因阻断突变株和玫瑰黄链霉菌Men-myco-93-63野生型菌株的染色体DNA,电泳,EB染 色,照相,转移DNA,紫外照射使DNA与膜交联;试验中用玫瑰黄链霉菌Men-myco-93-63野生型菌株中1.5 kb的DNA片段作为阳性对照,以pSRNA1500质粒上 1.5 kb的Hind Ⅲ-XbaⅠDNA片段为探针,进行Southern blotting验证。
1.8 基因阻断株的稳定性挑取nsdAmgh基因突变株单菌落接种到不含卡那霉素的PDA培养基上生长,连续传代3次,再挑取100个单菌落分别转接到含有卡那霉素的PDA培养基上,观察是否有抗性消失的菌落。
1.9 抑菌试验以棉花黄萎病菌Verticillium dahlia V41为检测菌株,测定菌株代谢产物的生物活性。将玫瑰黄链霉菌Men-myco-93-63和nsdAmgh基因阻断突变株分别接种在发酵培养基中,28 ℃培养5 d后,将发酵液离心,菌丝沉淀以丙酮萃取过夜,40 ℃减压蒸馏,最后用5 mL甲醇溶解。以纸碟法进行抑菌 试验,取棉花黄萎病菌孢子悬浮液0.1 mL涂布于Czapek培养基上,把抗生素粗品定量滴加到滤纸片上,将滤纸片置于涂布有指示菌的平板上,培养3 d后观察结果,检测抑菌圈大小。
2 结果 2.1 nsdAmgh基因的PCR扩增用引物nsdAWZ-R和nsdAWZ-L,以玫瑰黄链霉菌Men-myco-93-63基因组DNA为模板进行PCR扩增,在紫外透射仪观察电泳结果,与标准DNA分子量相比,在约1.5 kb处各可见一特异性条带,与模式菌株天蓝色链霉菌 M 145、变铅青链霉菌TK54中预期片段大小一致,而基因阻断载体pKC1139质粒中不含有此片段 (图1)。

|
| 图1 nsdAmgh基因的扩增 Fig.1 PCR amplification of the gene related to nsdAmgh. M: DL2 000 marker; 1: PCR product using pKC1139 plamid DNA as template; 2: PCR product from Men-myco-93-63 genomic DNA; 3: PCR product from M145 genomic DNA; 4: PCR product from TK54 genomic DNA as template. |
在pSRNA1500质粒上nsdAmgh基因中找到单一的ScaⅠ酶切位点,将该基因切成了730 bp 和773 bp两段作为交换臂,交换臂中间插入约1.0 kb的卡那霉素抗性基因片段作为筛选nsdAmgh基因阻断突变株的抗性标记,用温度敏感型质粒pKC1139为载体构建得到正确的重组质粒,将其命名为pSRNA2500,即为用于nsdAmgh 基因双交换的重组质粒,构建过程见图2。
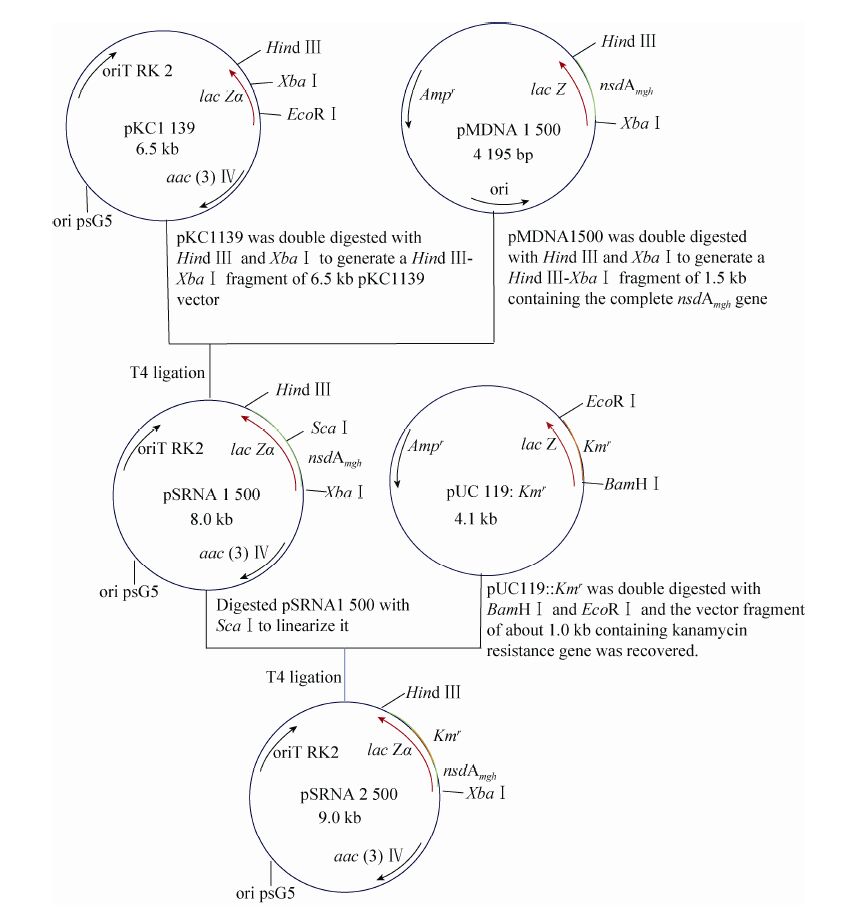
|
| 图2 nsdAmgh 基因阻断双交换载体的构建流程图 Fig.2 Flowchart of construction of nsdAmgh gene double cross disruption vector. |
将 pSRNA2500 质粒转入E. coli ET12567(pUZ8002) 获得接合转移供体E. coli ET12567 (pUZ8002/pSRNA2500),经对转化子进行质粒提取、酶切验证,证实pSRNA2500已转入E. coli ET12567 (pUZ8002) 中,共得到约150个转化子。接着转化玫瑰黄链霉菌Men-myco-93-63的孢子,在含有安普霉素和卡那霉素的MS平板上共得到约20个转化子,对转化子进行了质粒提取和酶切验证,证实pSRNA2500已转入到玫瑰黄链霉菌Men-myco-93-63中。
将玫瑰黄链霉菌Men-myco-93-63转化子于42 ℃高温培养。质粒pKC1139具有温度敏感型复制子,高于34 ℃条件下不能正常复制。因此pSRNA2500在42 ℃时不能自主复制,只有pSRNA2500上nsdAmgh基因侧翼序列与玫瑰黄链霉菌Men-myco-93-63染色体发生了同源重组单交换或双交换的菌株才能在含有卡那霉素的PDA基本培养基上生长。若发生了双交换,则 Kmr正确地插入到nsdAmgh基因内部,此时菌落表现为KmrAms。将生长出来的菌落同时影印到 PDA/Km和PDA/Am平板上,约90%的菌落为KmrAms,说明转化子是发生了双交换的nsdAmgh 基因阻断突变株 (图3)。将nsdAmgh基因阻断突变株接种于无任何选择压力的基本培养基上,传3代后重新转接至分别含有卡那霉素和安普霉素的基本培养基上,结果仍然是KmrAms,说明通过双交换得到的这些nsdAmgh基因阻断突变株在遗传上是稳定的。

|
| 图3 nsdAmgh 基因双交换及酶切位点示意图 Fig.3 Construction of nsdAmgh gene disruption via double crossover and the sketch map of the restriction sites. |
将nsdAmgh基因阻断突变株接种至含有卡那霉素的YEME培养基中,因为nsdAmgh基因阻断突变株nsdAmgh基因中插入1.0 kb的Kmr抗性基因,扩增预期片段为2 503 bp,而玫瑰黄链霉菌Men-myco-93-63野生型菌株中仍为 1 503 bp。扩增结果与预期一致 (图4)。
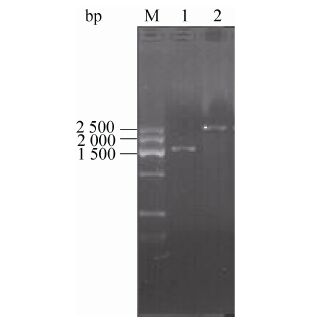
|
| 图4 nsdAmgh阻断突变株的PCR验证结果 Fig.4 Verification of the nsdAmgh disruption by PCR M: DNA markerⅦ (300-2 500 bp); 1: PCR products of wild type strain; 2: PCR products of disrupted mutants. |
在pUC119::Kmr质粒中含有1.0 kb的Hind Ⅲ和EcoRⅠ之间的DNA片段,该DNA片段是卡那抗性基因片段。利用Hind Ⅲ和EcoRⅠ双酶切pUC119::Kmr,用DEAE回收1.0 kb的Kmr抗性基因片段 (图5),用非放射性地高辛将其标记为基因克隆用探针。

|
| 图5 用作探针的DNA片段的琼脂糖凝胶电泳 Fig.5 A garose gel electrophoresis of probe DNA. M: marker DL2 000; 1: 1.0 kb DNA fragment from pUC119::kmr. |
将nsdAmgh基因阻断突变株1-1、1-2、1-3分别接种至含有卡那霉素的TSB培养基中,提取染色体DNA点NC膜 (图6行2)。玫瑰黄链霉菌Men-myco-93-63染色体DNA为阴性对照 (图6行1),pUC119::Kmr 质粒为阳性对照 (图6行3),以pUC119::Kmr质粒上1.0 kb的Kmr抗性基因DNA片段为探针,进行Dot blotting杂交验证。因为pUC119::Kmr质粒上含有作为探针的1.0 kb的卡那抗性基因DNA片段,所以应显示出阳性杂交信号;而玫瑰黄链霉菌Men-myco-93-63染色体DNA不含有1.0 kb的卡那霉素抗性基因DNA片段,故应无杂交信号。玫瑰黄链霉菌Men-myco-93-63中nsdAmgh基因阻断突变株若存在1.0 kb的Kmr抗性基因,则应显示出斑点杂交信号。结果表明,杂交信号与上述预期值一致,说明卡那霉素抗性基因已插入到玫瑰黄链霉菌Men-myco-93-63的nsdAmgh基因中,这3株nsdAmgh基因阻断突变株都是经过正确同源交换而得到的 (图6)。

|
| 图6 nsdAmgh基因阻断突变株中卡那霉素的Dot blotting验证 Fig.6 Dot blotting of kmr from chromosome DNA of nsdAmgh disruption mutants. 1: plasmid of pUC119::kmr; 2: chromosome DNA from nsdAmgh disruption mutants; 3: chromosome DNA from Men-myco-93-63. |
通过Dot blotting验证卡那霉素抗性基因正确插入到了nsdAmgh基因内部,为了进一步在分子水平上验证nsdAmgh基因阻断突变株1-1、1-2、1-3的正确性,通过Southern blotting杂交对nsdAmgh基因阻断突变株进行验证。
将nsdAmgh基因阻断突变株1-1、1-2、1-3和玫瑰黄链霉菌Men-myco-93-63野生型菌株分别接种至含有卡那霉素的TSB培养基中,28 ℃、250 r/min培养48 h后提取染色体DNA,用 Hind Ⅲ和XbaⅠ双酶切nsdAmgh基因阻断突变株和玫瑰黄链霉菌Men-myco-93-63野生型菌株的染色体DNA,以1.5 kb的Hind Ⅲ-XbaⅠDNA片段为探针,进行Southern blotting验证。从理论上推测,玫瑰黄链霉菌Men-myco-93-63野生型染色体DNA经Hind Ⅲ-XbaⅠ双酶切后,1.5 kb的DNA片段应给出阳性杂交信号,而nsdAmgh基因阻断突变株染色体DNA经相同酶切后,由于在nsdAmgh基因中插入了1.0 kb大小的Kmr基因,故杂交信号应在2.5 kb处。杂交结果显示,nsdAmgh基因阻断突变株1-1、1-2、1-3杂交信号均与预期值一致,这3株nsdAmgh基因阻断突变株都是经过正确同源重组得到的 (图7)。
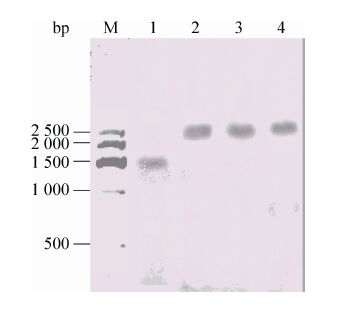
|
| 图7 nsdAmgh阻断突变株的Southern blotting验证 Fig.7 Southern blotting of chromosome DNA from nsdAmgh disruption mutants. M: DNA markerⅦ (300- 2 500 bp); 1: hybridization signal of wild type strain; 2-4: hybridization signal of nsdAmgh gene disruptted strains 1-1,1-2 and 1-3. |
为了检测nsdAmgh基因阻断突变株的稳定性,挑取nsdAmgh基因阻断突变株单菌落接种到不含卡那霉素的PDA培养基上,待产孢后,转接到不含卡那霉素的PDA培养基上,连续传代3次,再挑取单菌落转接到含有卡那霉素的PDA培养基上,未发现抗性消失的菌落。表明nsdAmgh 基因阻断突变株可以稳定遗传。
2.7 nsdAmgh 基因阻断突变株代谢产物的生物活性检测以棉花黄萎病菌Verticillium dahlia V41为指示菌,测定玫瑰黄链霉菌Men-myco-93-63野生菌株与nsdAmgh基因阻断突变株代谢产物的生物活性。玫瑰黄链霉菌Men-myco-93-63野生菌株对棉花黄萎病菌的抑菌圈直径约为1.6 cm,而nsdAmgh基因阻断突变株对棉花黄萎病菌的抑菌圈直径约为3.5 cm。结果表明,在同样条件下,nsdAmgh基因阻断突变株和玫瑰黄链霉菌Men-myco-93-63野生型菌株均能抑制棉花黄萎病菌的生长,nsdAmgh基因阻断突变株的抑菌活性高于野生株 (图8)。
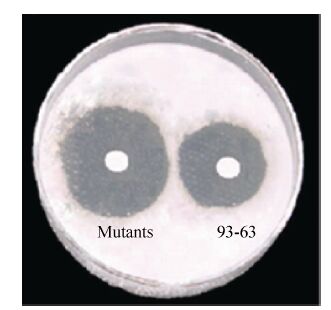
|
| 图8 nsdAmgh阻断突变株和玫瑰黄链霉菌Men-myco-93-63野生型菌株对棉花黄萎病菌的抑制作用对比 Fig.8 Antibiotics assay of nsdAmgh disruption mutants,genetically complement nsdAmgh disruption mutants and wild-type strain Men-myco-93-63 against Verticillium. |
基因置换载体的构建是实现基因阻断的关键步骤之一。经典方法是在目的基因序列中选择合适的酶切位点,然后将标记基因插入其中,以构建该基因的阻断载体。对于链霉菌而言,这种依赖于酶切、酶连反应的构建方法受诸多因素制约。首先,插入抗性标记可能会引起极性效应 (Polar effect),使位于被阻断基因下游的共转录基因的表达受到影响。其次,链霉菌的高G+C含量使选择合适的酶切位点变得困难,而且,如果选择的酶切位点靠近基因的3′端,还可能造成基因阻断的不彻底。另外,链霉菌的同源重组频率与交换片段的长度有关,一般同源臂的长度应不短于500 bp,且两同源臂的长度应大致相等,否则会对双交换菌株的筛选造成困难[14, 15, 16, 17]。本实验在pSRNA1500质粒上nsdAmgh基因中找到单一的ScaⅠ酶切位点,将该基因切成了730 bp和773 bp两段作为交换臂,交换臂中间插入约1.0 kb的卡那霉素抗性基因片段作为筛选突变株的抗性标记。用温度敏感型质粒pKC1139为载体构建得到正确的重组质粒。
抗生素生物合成基因簇是由含有各自独立调控元件的多个基因簇合并而成的,其代谢途径能够使用不同的初级代谢产物作为合成的起始物质,因此需要复杂的调控体系[18, 19, 20, 21]。多肽部分某些基因破坏后可能会导致某个抗生素组分肽链合成受阻或种类变化,研究nsdAmgh基因阻断突变株发现,在抑菌试验中,突变株比出发菌株对棉花黄萎病菌的抑制圈明显增大,即突变株代谢发生变化,对棉花黄萎病菌的抑制能力提高,这表明nsdAmgh基因在玫瑰黄链霉菌抗生素的生物合成中可能起到重要的负调控作用。需要进一步通过对抗生素组分进行高效液相色谱分析,比较基因阻断对抗生素代谢的影响,从而更加明确nsdAmgh基因在玫瑰黄链霉菌抗生素代谢中的调控作用。
| [1] |
Yu Z, Wang Q, Deng ZX, et al. Activation of silent antibiotic synthesis in Streptomyces lividans by disruption of a negation regulator nsdA, a gene conserved in Streptomyces. Chin J Biotech, 2006, 22(5): 757-762 (in Chinese). 余贞, 王茜, 邓子新. 负调节基因nsdA在链霉菌中同源性及激活沉默抗生素合成基因簇的研究. 生物工程学报, 2006, 22(5): 757-762. |
| [2] | Takano E, Tao M, Long F, et al. A rare leucine codon in adpA is implicated in the morphological defect of bldA mutants of Streptomyces coelicolor. Mol Microbiol, 2006, 50: 475-486. |
| [3] | Li W, Ying X, Guo Y, et al. Identification of a gene negatively affecting antibiotic production and morphological differentiation in Streptomyces coelicolor A3(2). J Bacteriol, 2006, 188: 8368-8375. |
| [4] |
Wang Q. Application of nsdA, a negative regulator of Streptomyces differention in antibiotic breeding[D]. Wuhan: Huazhong Agricultural University, 2004 (in Chinese). 王茜. 链霉菌分化负调节基因nsdA在抗生素高产育种上的应用[D]. 武汉: 华中农业大学, 2004. |
| [5] |
Chen F, Xiong W, Min Y, et al. Construction of the conjugal transfer system of Streptomyces cinnamonensis and effect of PCR-mediated nsdA gene disruption on its secondary metabolism. J Agric Biotechnol, 2007, 15(6): 1042-1047 (in Chinese). 陈芬, 熊伟, 闵勇, 等. 肉桂地链霉菌接合转移体系的构建及nsdA基因中断对其次级代谢的影响. 农业生物技术学报, 2007, 15(6): 1042-1047. |
| [6] | Liu DQ. Biological control of Streptomyces scabies and other plant pathogens. Minneapolis: The University of Minnesota, 1992. |
| [7] |
Shen FY, Liu LQ, Wu WG, et al. Cloning and sequence analysis of nsdAmgh gene in Streptomyces roseoflavus Men-myco-93-63. Acta Agric Boreali-Sin, 2009, 24(5): 77-80 (in Chinese). 沈凤英, 刘力强, 吴伟刚, 等. 玫瑰黄链霉菌 Men-myco-93-63 负调控基因nsdAmgh的克隆及序列分析. 华北农学报, 2009, 24(5): 77-80. |
| [8] | Tobias K, Bibb MJ, Mark JB, et al. Practical Streptomyces Genetics. Norwich: The John Innes Foundation, 2000. |
| [9] | Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: A Laboratory Manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989. |
| [10] |
Chen F. Construction of the conjugal transfer system of Streptomyces cinnamonensis and effect of PCR-mediated nsdA gene disruption on yield of monensin[D]. Wuhan: Huazhong Agricultural University, 2007 (in Chinese). 陈芬. 肉桂地链霉菌接合转移体系的构建及 nsdA基因中断对莫能菌素产量的影响[D]. 武汉: 华中农业大学, 2007. |
| [11] |
Shen FY, Wu WG, Ji HL, et al. The validation of nsdAmgh gene in Streptomyces roseoflavus Men-myco-93-63. Henan Agric Sci, 2010, 39(3): 59-62 (in Chinese). 沈凤英, 吴伟刚, 冀红柳, 等. 玫瑰黄链霉菌Men-myco-93-63 nsdAmgh 基因的验证. 河南农业科学, 2010, 39(3): 59-62. |
| [12] |
Wang XF, Chen XY, Zhang XM, et al. Molecular characteristics and specific PCR detection of transgenic rice containing Cry1Ab. Hereditas, 2012, 34(2): 208-214 (in Chinese). 汪小福, 陈笑芸, 张小明, 等. 转Cry1Ab基因水稻分子特征及其特异性PCR检测方法. 遗传, 2012, 34(2): 208-214. |
| [13] |
Shen S, Wang JJ, Tong YM. et al. Cloning and functional analysis of StAC gene in Setosphaeria turcica. Sci Agric Sin, 2013, 46(5): 881-888 (in Chinese). 申珅, 王晶晶, 佟亚萌, 等. 玉米大斑病菌腺苷酸环化酶基因的克隆与功能分析. 中国农业科学, 2013(5): 881-888. |
| [14] | Schauwecker F, Pfennig F, Schro DW. Molecular Cloning of the actinomycinsynthetase gene cluster from Streptomyces chrysomallus and functional heterologous expression of the gene encoding actinomycin synthetase II. J Bacteriol, 1998, 180(9): 2468-2474. |
| [15] |
Zhu HJ, Liang YX, Zhou JC, et al. Effects of bkdAB interruption on avermectin Biosynthesis. Chin J Biotech, 2004, 20(2): 269-273 (in Chinese). 朱浩军, 梁运祥, 周俊初, 等. 阿维链霉菌bkdAB的基因中断对阿维菌素合成的影响. 生物工程学报, 2004, 20(2): 269-273. |
| [16] |
Liu ZY, Guo MJ, Qian JC, et al. Disruption of zwf2 gene to improve oxytetraclyline biosynthesis in Streptomyces rimosus M4018. Acta Mocrobiol Sin, 2008, 48(1): 21-25 (in Chinese). 刘志勇, 郭美锦, 钱江潮, 等. 龟裂链霉菌zwf2基因阻断提高土霉素生物合成. 微生物学报, 2008, 48(1): 21-25. |
| [17] |
Liao YL, Liu ZY, Tang ZY, et al. Effects of zwf2 gene knock-in and disruption on oxytetracycline biosynthesis in Streptomyces rimosus M4018. Food Drug, 2009, 11(1): 7-10 (in Chinese). 廖瑜玲, 刘志勇, 唐振宇, 等. 龟裂链霉菌zwf2基因敲入及阻断对土霉素合成的影响. 食品与药品, 2009, 11(1): 7-10. |
| [18] |
Cui QQ. Construction of genetic engineering Metarhizium anisopliae for Plutella xylostella control[D]. Beijing: Chinese Academy of Agricultural Sciences, 2013 (in Chinese). 崔倩倩. 防治小菜蛾高效绿僵菌工程菌的构建[D]. 北京: 中国农业科学院, 2013. |
| [19] |
Gu MZ. Gene knockout of Saccharopolyspora erythraea and function research on SACE_0069[D]. Shanghai: East China University of Science and Technology, 2013 (in Chinese). 古明珠. 红色糖多孢菌基因敲除和SACE_0069基因功能研究[D]. 上海: 华东理工大学, 2013. |
| [20] |
Zuo Q, Zhao XQ, Liu HJ, et al. Development of genetically stable recombinant Saccharomyces cerevisiae strains using combinational chromosomal integration. Chin J Biotech, 2014, 30(4): 669-673 (in Chinese). 左颀, 赵心清, 刘海军. 等. 稳定遗传的染色体组合整合酿酒酵母重组菌株的构建. 生物工程学报, 2014, 30(4): 669-673. |
| [21] |
Liu JL, Zhang XB, Jia SS, et al. Construction of genetic engineering strain of introduction extra nodD into native Rhizobium japonicum. J Nat Sci Heilongjiang Univ, 2012, 29(1): 121-129 (in Chinese). 刘金玲, 张喜波, 贾珊珊, 等. nodD基因的克隆及其导入大豆根瘤菌工程菌株的构建. 黑龙江大学自然科学学报, 2012, 29(1): 121-129. |
 2015, Vol. 31
2015, Vol. 31




