服务
文章信息
- 杨刚刚, 马诚凯, 张全义, 史世会, 王泽, 吕中原, 王绪洋, 许晓亚, 崔晴晴, 张继红, 张瑞刚, 徐存拴
- Ganggang Yang, Chengkai Ma, Quanyi Zhang, Shihui Shi, Ze Wang, Zhongyuan Lü, Xuyang Wang, Xiaoya Xu, Qingqing Cui, Jihong Zhang, Ruigang Zhang, Cunshuan Xu
- 豹蛙抗瘤酶的毕赤酵母高效表达、纯化及活性测定
- Expression, purification and characterization of recombinant onconase expressed in Pichia pastoris
- 生物工程学报, 2015, 31(11): 1632-1642
- Chin J Biotech, 2015, 31(11): 1632-1642
- 10.13345/j.cjb.140616
-
文章历史
- Received: December 13, 2014
- Accepted: March 3, 2015
2. 河南新乡华星药厂,河南 新乡 453007;
3. 河南省-科技部共建细胞分化国家重点实验室培育基地 生物工程药物河南省工程实验室,河南 新乡 453007
2. Henan Xinxiang Hua Xing Pharmaceutical Factory, Xinxiang 453007, Henan, China;
3. State Key Laboratory Cultivation Base for Cell Differentiation Regulation, Henan Engineering Laboratory for Bioengineering and Drug Development, Henan Normal University, Xinxiang 453007, Henan, China
豹蛙抗瘤酶 (Onconase,ONC) 在北极豹蛙早期胚胎中首次发现,最早命名为P30蛋白,属于核糖核酸酶A的家族成员[1],对体内外多种肿瘤有很强的杀伤作用,是第一个进入抗肿瘤临床试验的核糖核酸酶,也是当前全球重点研究的100种新药之一[2, 3]。ONC由104个氨基酸组成,分子量约11.8 kDa,等电点为9.3,熔解温度(Tm) 值为90 ℃[4]。ONC的结构非常稳定,含4个α-螺旋、7个β-折叠、4个β-转角和4对二硫键。它通过静电作用结合到细胞膜表面,再通过膜流和内吞作用进入细胞内[5]。在细胞内,它通过特异性降解tRNA而抑制蛋白质合成,导致细胞凋亡[6]。同时,它还通过促进Caspase9与细胞色素 C (cyt c) 结合,活化Caspase 3和启动细胞凋亡级联反应,导致细胞凋亡[7]。刘默芳课题组[8]研究发现ONC能特异性降解miRNA前体,而对miRNA的成熟链无明显作用,这为ONC抗肿瘤的作用机制提供了新的思路。研究表明,ONC在有效作用剂量下,主要作用于对数生长期的肿瘤细胞,而对生长中的正常细胞没有明显作用[9],同时,它还具有机体不良反应少、免疫原性低、不易产生耐药性等优点,是一种极具潜力的抗肿瘤药物。1996年以来,Tamir公司 (前身为Alfacell公司) 相继开展了对非小细胞肺癌和其他实体肿瘤的Ⅰ期或Ⅱ期临床试验,其对恶性间皮瘤的效果要好于阿霉素,现已在欧美国家上市[10]。
天然ONC的主要来源为北极豹蛙的卵细胞,纯化工艺主要包括:豹蛙体内受精、卵母细胞提纯、阴离子交换层析、阳离子交换层析和体积排阻等[11],过程繁琐、耗时久、产量低且代价昂贵,难以满足产业化要求。
利用基因工程手段来进行豹蛙抗瘤酶的表达已取得一些研究进展,但在rONC的表达量、生物活性等方面仍存在一些不足,例如:原核系统由于自身缺乏修饰功能,表达的rONC不能正确折叠,产物为包涵体形式,需用变性、复性和去除N端Met等方法进行后加工处理,工艺繁琐,活性难以保证,不利于产业化[11, 12, 13];毕赤酵母系统表达的ONC在蛋白修饰上较原核有较大优势,但表达量与原核相比较低,纯化多采用多步柱层析方法来捕获rONC,虽然保证了活性与纯度,但存在收率低 (50%−60%)、成本高等缺点[14]。
本文选用毕赤酵母表达系统,根据密码子使用频率优化密码子并去除糖基化位点,使用去除pro肽的酵母α因子为信号肽[14],人工合成基因后构建多种载体-受体菌组合,筛选高表达菌株,优化表达条件来进一步提高rONC的表达量。同时,采用双水相萃取偶联G50凝胶层析,获得纯度大于95%、收率高于90%、能杀伤多种癌细胞的rONC,有效降低生产成本,为ONC的产业化奠定了基础。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒和基因大肠杆菌Escherichia coli DH5α菌株购自武汉晶赛生物工程技术有限公司。毕赤酵母X-33、GS115、SMD1168菌株,分泌型酵母表达载体pPIC9、pPIC9K、pPICZα-A购自Invitrogen公司。ONC优化基因委托上海捷 瑞生物工程有限公司合成。人肝癌细胞株7402、HeLa、RH-35细胞株菌购自中国医学科学院基础医学研究所细胞资源中心 (北京)。
1.1.2 试剂和工具酶DMEM、RPMI-1640培养基、青霉素、链霉素购自Invitrogen公司。胎牛血清购自杭州天杭生物科技有限公司。MTT、DMSO购自Geneview公司。质粒快速提取试剂盒均购自鼎国生物技术有限公司。酵母基因组快速提取试剂盒购自北京博迈德科技发展有限公司。限制性内切酶SacⅠ、BamHⅠ、BstBⅠ、EcoRⅠ购自MBI公司。Protein ladder购自北京康为世纪生物科技有限公司和赛默飞世尔科技有限公司。ONC一抗购自武汉博士德生物工程有限公司。其他试剂为国产分析纯。
1.1.3 培养基及基础培养条件常用培养基:LB、YPD、BMGY、PTM1、PTM2等培养基参考Invitrogen公司的酵母表达手册。
基础盐培养基 (Basic salt medium,BSM)(g/L):硫酸钾14.3,硫酸镁11.7,盐酸胍6,氢氧化钾3.9,硫酸钙0.9,甘油40,磷酸 23.5 mL/L。
低盐基础培养基 (LBSM)(g/L):硫酸钾4.55,硫酸镁3.73,氢氧化钾1.03,硫酸钙0.23,六偏磷酸钠6.5,甘油40。
摇瓶培养条件:温度28 ℃,培养转速 300 r/min,诱导转速200 r/min,诱导7 d。
发酵罐发酵条件:发酵开始至12 h:温度28 ℃,转速400 r/min,通气量0.2 Nm3/h。
12 h至开始诱导:温度28 ℃,转速 750 r/min,通气量1 Nm3/h。
开始诱导至诱导7 d:温度23 ℃,转速 750 r/min,通气量1 Nm3/h。
1.1.4 主要仪器高速低温离心机和紫外分光光度计 (NANO Drop 2000) 购自上海赛默飞世尔科技公司。全温振荡培养箱 (211B) 购自上海智城分析仪器制造有限公司。细胞电转化仪购自Invitrogen公司。10 L微生物全自动发酵罐 (Bio-10JS) 和甲醇检测流加控制器 (FC2002) 购自上海保兴生物设备有限公司。XK26层析柱、Typhoon FLA 7 000 IP激光扫描成像仪和ImageQuant LAS 4 000mini超灵敏化学发光成像仪购自美国GE公司。ELx800酶标仪购自美国Biotek reader公司。
1.2 方法 1.2.1 ONC基因的序列优化与载体构建通过NCBI查询ONC基因序列(AF332139.1),分析该基因毕赤酵母密码子偏好性,利用在线序列优化工具(http://www. evolvingcode.net) 对ONC核苷酸序列进行设计,按何庆方法[14]采用去除pro肽的α交配因子为信号肽,根据毕赤酵母密码子的碱基使用频率优化密码子组成序列并提高GC含量,序列全长 (α交配因子pre肽+ONC) 为598 bp,优化序列由上海捷瑞生物工程有限公司进行全基因合成,并分别构建3种分泌型毕赤酵母表达载体pPIC9/ONC、pPIC9K/ONC、pPICZα-A/ONC。
1.2.2 工程酵母菌的制备与筛选分别提取pPIC9/ONC、pPIC9K/ONC、pPICZα-A/ONC重组质粒,SacⅠ酶切进行线性化,电转化至新鲜制备的酵母感受态细胞,其中将pPICZα-A/ONC转至毕赤酵母X-33感受态细胞,将pPIC9/ONC、pPIC9K/ONC分别转至毕赤酵母GS115、SMD1168 和X-33中,方法参考Invitrogen公司毕赤酵母表达手册进行。其中含抗性载体为pPIC9K (G418) 和pPICZα-A (博来霉素,Zeocin),组氨酸缺陷型宿主菌为GS115和SMD1168,载体与宿主菌株进行组合后需要至少一方具有抗性或筛选标记方可进行阳性克隆筛选,实际共得到7种载体-宿主组合,依次为:pPICZα-A/X-33、pPIC9/GS115、pPIC9K/ GS115、pPICZα-A/GS115、pPIC9/SMD1168、pPIC9K/SMD1168、pPICZα-A/SMD1168。转化后菌液涂布不同抗性平板进行筛选,其中转化pPIC9、pPIC9K的菌液涂布组氨酸缺陷型平板,pPICZα-A涂于含100 μg/mL博来霉素、pH 7.5的YPD平板。28 ℃倒置培养3 d,挑取单克隆进行扩大培养,分别提取基因组DNA进行PCR鉴定,PCR产物送苏州金唯智生物科技有限公司进行测序验证。
随机挑选7个组合鉴定正确的菌种分别接种到10 mL YPG/50 mL三角瓶中,于28 ℃、 250 r/min振荡培养18−24 h,当OD600值达到10时,按1%接种至100 mL BMGY /1 L三角瓶中,继续于28 ℃、280 r/min培养24 h后,加入终浓度为1% (V/V) 的甲醇进行诱导培养,培养条件更改为23 ℃、200 r/min。每12 h补加一次甲醇,补加量为发酵液体积的1% (V/V)。诱导7 d后,发酵液于12 000 r/min离心10 min后保留上清,Bradford法测定上清蛋白浓度,取1 mL上清TCA处理后进行15% SDS-PAGE检测 (下同),用Typhoon FLA 7 000 IP激光扫描成像仪对蛋白条带进行灰度扫描,软件Image Quant TMTL分析目的条带所占比例进行定量,确定表达量最高的载体-受体菌组合。
1.2.3 摇瓶发酵的最优条件实验取上述表达量最高组合的菌株活化后接种至10 mL YPG /50 mL三角瓶,于28 ℃、 250 r/min培养18−24 h。当OD600达到10时,按1%接种至100 mL BMGY/1 L三角瓶中。培养基的pH分别为5.0、5.5、6.0。在28 ℃、 300 r/min培养24 h后,加入终浓度为1% (V/V) 的甲醇开始诱导。诱导温度分别设置为20 ℃、23 ℃、26 ℃,每12 h补加一次甲醇,转速调整为200 r/min。诱导7 d后取上清测定蛋白浓度,终浓度10% TCA处理1 mL上清进行SDS-PAGE,检测rONC的表达情况,蛋白条带进行灰度扫描和定量,实验重复3次。
1.2.4 10 L发酵的最适培养基实验取上述表达量最高组合的菌株活化后接种至10 mL YPG/50 mL三角瓶,于28 ℃、250 r/min培养18−24 h。当OD600值达到10时,按1%接种到200 mL YPG /1 L三角瓶中。当OD600值达到20时,取400 mL菌液分别加入5 L BSM培养基和5 L LBSM培养基的10 L发酵罐中,培养基中分别加入5 mL PTM1,依据摇瓶优化得到的最佳发酵条件进行条件设定,流加氨水和磷酸控制pH为5.5,调节通气量控制溶氧,按发酵罐初始培养条件培养,当初始培养基甘油耗尽时按DO关联进行甘油补加,当菌体密度达到600左右时停止补甘油。饥饿1 h后开始甲醇诱导,每升甲醇含20 mL PTM2培养基,诱导过程中控制DO为20%,温度23 ℃,甲醇浓度0.25%,诱导7 d后测定上清蛋白浓度,取50 μL上清进行SDS-PAGE,蛋白条带进行灰度扫描和定量,检测rONC的表达情况。
1.2.5 rONC的分离纯化以下步骤非特殊要求,均在4 ℃或冰上进行,优化后纯化条件如下:
双水相萃取:取10 L罐诱导7 d发酵液,于4 ℃、4 000×g离心30 min收集上清,每升上清加入308 g K2HPO4,搅拌至K2HPO4完全溶解后边搅拌边缓慢加入372 mL无水乙醇,将混合体系置于分液漏斗中−20 ℃过夜,形成上、中、下3层,上层经0.22 μm滤膜过滤,5 kDa膜包超滤后进行G50凝胶过滤层析。
凝胶过滤层析:层析柱型号XK26,层析填料Sephadex G50,装填量为150 mL,取50 mL浓缩蛋白上样 (约25 mg),以1 mL/min的流速上样至平衡 (20 mmol/L Na2HPO4溶液,pH 9.5) 后的G50凝胶过滤层析柱 (2.6 cm×20 cm),用20 mmol/L Na2HPO4溶液 (pH 9.5) 进行洗脱,紫外检测仪监控全程,SDS-PAGE分析各组分。
1.2.6 Western blotting分析取不同组合菌株诱导7 d的rONC上清进行SDS-PAGE,用电转仪将所测蛋白从凝胶转移至PVDF膜上,转膜结束后用脱脂奶粉封闭过夜,与ONC兔抗人一抗室温孵育1 h,TBST洗涤3次,再与辣根过氧化物酶 (HRP) 标记的山羊抗兔二抗室温孵育1 h,TBST洗涤3次,超敏ECL底物发光显色,用ImageQuant LAS 4000mini扫描仪进行扫描分析。
1.2.7 SRB法测定rONC对癌细胞活性的影响人肝癌7402细胞的培养基为RPMI-1640培养基,HeLa和RH-35细胞的培养基为DMEM培养基,均含10%的胎牛血清、青霉素 (100 U/mL) 和链霉素 (100 U/mL),用0.25%胰蛋白酶消化对数生长期的细胞,将细胞稀释至5×104个/mL,接种于96孔板中,每孔100 μL,于37 ℃、5% CO2、饱和湿度条件下培养24 h,弃去培养基,分别加入200 μL含不同浓度rONC的培养基,设置无药物处理的对照组和不接种细胞的调零组。于药物处理细胞24 h后,保留培养基的基础上每孔加入50 μL、4 ℃预冷的三氯醋酸溶液 (终浓度10%) 进行固定。静置5 min放入4 ℃冰箱1 h,注意保持平板水平。弃去上清液,用去离子水充分清洗至少5次,甩干水分,充分干燥至少12 h。室温避光条件下,每孔加入100 μL 4%的SRB溶液 (0.2 g SRB粉末溶于50 mL 1%醋酸),锡纸包裹平板放置15 min。弃去上清液,1%醋酸清洗5遍以上,要求将多余的染料洗净为止,继续放置空气中充分干燥,干燥时间至少24 h,实验全过程注意防止灰尘污染。每个孔加入 10 mmol/L Tris溶液 (pH 10.5) 150 μL,置于振荡器上轻轻振荡,保证其充分溶解,室温放置5 min,上述操作均需锡纸包裹,避光操作。置酶标仪于波长490 nm检测各孔吸光度值 (A值)。每个实验组设置3个复孔,实验重复3次。
2 结果与分析 2.1 重组质粒pPIC9/ONC、pPIC9K/ONC、pPICZα-A/ONC的鉴定对pPIC9/ONC、pPIC9K/ONC、pPICZα-A/ ONC重组质粒进行酶切、PCR和测序鉴定,结果表明,pPIC9/ONC、pPIC9K/ONC用SacⅠ单酶切后出现一个10 000 bp左右条带 (图1A),pPICZα-A/ONC用SacⅠ单酶切后出现一个 3 500 bp左右条带 (图1B)。pPIC9/ONC、pPIC9K/ONC用BamH Ⅰ和EcoR Ⅰ双酶切后出现一个9 000 bp和一个312 bp左右条带 (图1A),pPICZα-A/ONC用BstB Ⅰ和EcoR Ⅰ双酶切后出现一个3 000 bp和一个312 bp左右条带 (图1B)。利用载体通用引物进行PCR扩增,产物理论大小为598 bp,测序结果表明,结果与预期基因序列一致。

|
| 图1 重组质粒的鉴定 Fig.1 Identification of recombinant plasmids pPIC9/ONC and pPIC9K/ONC (A),pPICZα-A/ONC (B). (A) 1−4: identification of recombinant plasmids pPIC9/ONC; 1: recombinant plasmid; 2: enzyme with Sac I; 3: double enzyme digestion with BamH I and EcoR I; 4: PCR; 5−8: identification of recombinant plasmids pPIC9K/ONC. 5: recombinant plasmid; 6: enzyme with Sac I; 7: double enzyme digestion with BamH I and EcoR I; 8: PCR. (B) 1−4: recombinant plasmids pPICZα-A/ONC’s digest; 1: recombinant plasmid; 2: enzyme with Sac I; 3: double enzyme digestion with BamH I and EcoR I; 4: PCR; M: DNA molecular weight standard (DL10 000). |
用电转化方法将线性化的pPIC9/ONC、pPIC9K/ONC、pPICZα-A/ONC质粒分别转入X-33、GS115、SMD1168感受态细胞,经过涂板-培养-筛选等过程获得单克隆。扩大培养后提取酵母基因组DNA,分别以基因组DNA进行PCR扩增,通过琼脂糖凝胶电泳验证PCR产物的正确性,结果如图2所示,重组菌株的模板均能扩增出598 bp的特异条带和2 200 bp的酵母自身条带 (图2A)。测序结果表明,特异条带的序列与预期一致,表明ONC已成功整合入毕赤酵母基因组中。每个组合随机挑取若干单克隆进行摇瓶诱导表达,取诱导7 d发酵液上清进行SDS-PAGE检测发现,在11.8 kDa左右有高表达蛋白条带 (图2B)。用Western blotting检测发现,该条带呈现ONC阳性 (图2C)。

|
| 图2 rONC的菌株鉴定图 Fig.2 Identification of rONC strains. (A) Genome PCR electrophoresis. (B) SDS-PAGE result of the rONC. (C) Western blotting of rONC. |
选取表达量最高组合 (pPICZα-A/X-33/ ONC) 菌株在1 L摇瓶规模进行不同培养基pH和诱导温度的表达条件优化,结果如图3所示,诱导7 d时,rONC的最佳表达条件为:23 ℃、pH 5.5,经蛋白浓度测定和灰度扫描确定最高表达量达到13 mg/L。

|
| 图3 不同pH和温度对rONC表达量的影响 Fig.3 Effect of different pH and the induction temperature on the expression of rONC. |
取表达量最高菌株进行活化和扩大培养,当OD600值达到20时,分别取400 mL扩大培养的菌液,接种到分别含5 L BSM和5 L LBSM 的10 L发酵罐中,培养基pH设定5.5。待菌体密度达到600左右时进行开始补甲醇,诱导7 d后,取50 μL发酵液上清进行SDS-PAGE检测。结果表明,诱导7 d时,rONC在LBSM培养基的表达量高于BSM培养基 (图4),rONC定量后达到180 mg/L。

|
| 图4 不同培养基对rONC表达量的影响 Fig.4 Effect of different medium on the expression of rONC. |
取诱导7 d发酵液,于4℃、4000×g离心30 min,收集上清,上清经双水相萃取后形成上、中、下3层,用SDS-PAGE分别检测3层的蛋白分布情况 (图5B)。取上层 (rONC所在层) 进行0.22 μm过滤和5 kDa超滤。样品经G50凝胶层析进一步分离纯化,如图5A所示,在凝胶层析过程出现2个蛋白洗脱峰 (P1和P2)。SDS-PAGE结果显示,rONC主要分布在洗脱液峰2里,灰度扫描后进行定量分析,rONC的纯度大于95%,收率高于90% (图5B)。

|
| 图5 rONC凝胶过滤层析的检测谱图(A)及SDS-PAGE纯度鉴定(B) Fig.5 The molecular exclusion of the purified recombinant ONC (A) and SDS-PAGE result of the purified rONC (B). M: protein ladder; P1: the first peak; P2: the second peak; 1: the total proteins of the supernatant fermented; 2: total proteins in the upper of aqueous two-phase; 3: total proteins in the middle of aqueous two-phase; 4: total proteins in the lower of aqueous two-phase; 5: samples. |
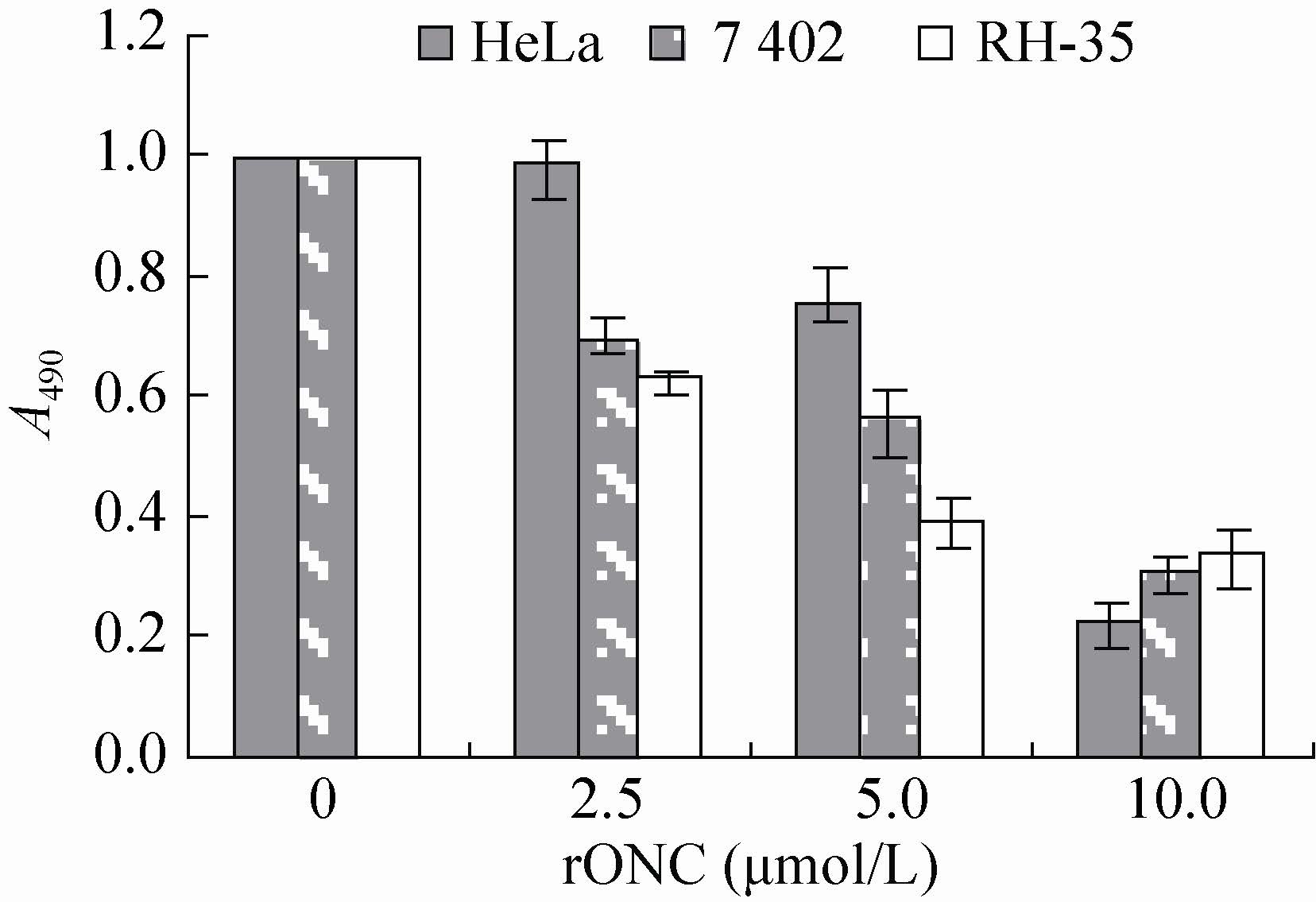
|
| 图6 rONC对RH-35、7402、HeLa细胞的抑制 作用 Fig.6 The inhibition effect of ONC on RH-35,7402 and HeLa cells. |
不同浓度的rONC处理细胞后,SRB法检测细胞的活力,结果表明,2.5−10 μmol/L的rONC处理RH-35、7402和HeLa细胞后24 h,细胞活力受到明显抑制,表明rONC对多种肿瘤细胞具有杀伤作用,且杀伤作用与剂量依赖效应,对RH-35、7402、HeLa细胞的IC50依次为:7.78、6.55、2.33 μmol/L。
3 讨论长期的进化过程使得不同物种在各自的进化史中形成了自己独特的符合其基因组的密码子使用法则。当外源蛋白在受体生物内表达时,首先要考虑外源基因密码子与宿主基因密码子的使用差异,这种差异容易引起基因的甲基化,从而造成基因沉默或蛋白表达量很低,要针对宿主物种密码子的使用偏好性对外源基因进行优化,以便于外源蛋白的高表达[15, 16, 17],通过密码子优化来提高外源基因在不同宿主内表达效率的研究也屡见不鲜[18, 19, 20, 21]。
为获得高表达和高活性的rONC,本文首先依据毕赤酵母密码子的使用频率优化ONC基因的密码子构成并提高GC含量,突变ONC内部的糖基化位点,避免表达过程中的过度糖基化问题。同时采用去除pro信号肽的酵母通用信号肽方法来提高rONC的表达量,并避免出现蛋白信号肽切割不完全问题。本文分别构建表达载体pPIC9/ONC、pPIC9K/ONC、pPICZα-A/ ONC,转染毕赤酵母X-33、GS115、SMD1168,筛选得到7种载体-受体菌组合,诱导后发现rONC表达量最高的载体-受体菌组合为pPICZα-A/X-33,不同载体受体菌组合对蛋白的表达量有较大影响。首先pPICZα-A载体较小,长度仅为pPIC9、 pPIC9K的1/3,转化操作和染色体的整合相对较易;同时X-33为野生型菌株,对外源蛋白具有更强的分泌和适应能力[22],外源蛋白的高表达可能为两种因素综合作用的结果。表达产物经SDS-PAGE和Western blotting鉴定表达正确。
以筛选的高表达菌株为研究对象,在1 L摇瓶规模下研究不同pH和诱导温度对rONC的表达水平的影响,确定pH 5.5、诱导温度23 ℃为rONC最优表达条件,诱导7 d时的表达量最高达到13 mg/L,较优化前提高了40%。
依据摇瓶表达条件进行10 L规模下不同培养基的发酵,由于培养基无机盐成分差别较大,因此,考察培养基对重组蛋白的表达影响十分必要,LBSM表达量要高于BSM培养基,诱导7 d达到180 mg/L,高于已有文献报道[14]的最高量150 mg/L。由于培养基成分较复杂,影响外源蛋白表达的原因尚不明确,所以针对不同外源蛋白的表达进行培养基的选择十分必要。
Ariel[23]曾利用乙醇/磷酸氢二钾双水相体系对溶菌酶、胰凝乳蛋白酶原、DNA聚合酶等模式蛋白进行萃取,取得了很好的分离效果,蛋白的生物活性也得到了较好的保证。与传统纯化技术相比,双水相萃取具有操作条件温和、时间短、可连续操作、易回收、易放大等显著优势,具有很好的工业化前景。本文首次对发酵液中的rONC采用双水相方法萃取,萃取后的rONC主要集中在上层,菌体和绝大部分杂蛋白分布在中下层,取得了极佳的纯化效果,同时有效去除了大部分色素和蛋白酶,可避免蛋白酶等对重组蛋白的降解[24, 25]。根据萃取后样品特点选择G50凝胶过滤层析进一步纯化,去除样品中剩余少量杂蛋白、残存乙醇、磷酸盐以及色素等,最终得到了收率高于90%、纯度≥95%的rONC,相比传统的多步提纯方法显著提高了纯化效率和蛋白收率。
本文用SRB法测定rONC对多种癌细胞增殖的影响,结果发现rONC能显著杀伤多种癌细胞,与文献报道结果一致[10, 11, 12, 13, 14],具有良好的生物学活性,为进一步研究rONC的生物学作用奠定了基础。
| [1] | Porta C, Paglino C, Mutti L. Ranpirnase and its potential for the treatment of unresectable malignant mesothelioma. Biologics, 2008, 2(4): 601-609. |
| [2] | Darzynkiewicz Z, Carter SP, Mikulski SM, et al. Cytostatic and cytotoxic effects of Pannon (P-30 protein), a novel anticancer agent. Cell Tissue Kinet, 1988, 21(3): 169-182. |
| [3] | Ardelt W, Mikulski SM, Shogen K, et al. Amino acid sequence of an anti-tumor protein from Rana pipiens oocytes and early embryos. Homology to pancreatic ribonucleases. J Biol Chem, 1991, 266(1): 245-251. |
| [4] | Ardelt W, Shogen K, Darzynkiewicz Z. Onconase and amphinase, the antitumor ribonucleases from Rana pipiens oocytes. Curr Pharm Biotechnol, 2008, 9(3): 215-225. |
| [5] | Johnson RJ, Chao TY, Lavis LD, et al. Cytotoxic ribonucleases: the dichotomy of coulombic forces. Biochemistry, 2007, 46(36): 10308-10316. |
| [6] | Chang CH, Gupta P, Michel R, et al. Ranpirnase (frog RNase) targeted with a humanized, internalizing, anti-Trop-2 antibody has potent cytotoxicity against diverse epithelial cancer cells. Mol Cancer Ther, 2010, 9(8): 2276-2286. |
| [7] | Iordanov MS, Ryabinina OP, Wong J, et al. Molecular determinants of apoptosis induced by the cytotoxic ribonuclease onconase: evidence for cytotoxic mechanisms different from inhibition of protein synthesis. Cancer Res, 2000, 60(7): 1983-1994. |
| [8] | Qiao M, Zu LD, He XH, et al. Onconase downregulates microRNA expression through targeting microRNA precursors. Cell Res, 2012, 22(7): 1199-1202. |
| [9] | Makarov AA, Ilinskaya ON. Cytotoxic ribonuclease: molecular weapons and their targets. FEBS Lett, 2003, 540(1/3): 15-20. |
| [10] |
Tian X, Wang QC, Shen RL, et al. Latest advances in the research and development of onconase. Chin J Cell Biol, 2010, 32(6): 927-934 (in Chinese). 田雪, 王庆诚, 沈如凌, 等. Onconase研究与开发的最新进展. 中国细胞生物学报, 2010, 32(6): 927-934. |
| [11] |
Hu XJ. Expression of ribonuclease-onconase and its fusion proteins[D]. Shanghai: East China University of Science and Technology, 2012 (in Chinese). 胡晓珺. 核糖核酸酶Onconase及其融合蛋白的表达[D]. 上海: 华东理工大学, 2012. |
| [12] |
Wang N, Tang XJ, Xiong SP, et al. Preparation and characterization of recombinant ranpirnase. Acta Univ Med Nanjing: Nat Sci, 2013, 33(8): 1034-1038 (in Chinese). 汪楠, 唐小军, 熊四平, 等. 重组豹蛙酶的制备及其生物学特性分析. 南京医科大学学报: 自然科学版, 2013, 33(8): 1034-1038. |
| [13] |
Guo H, Xu DS, Wang QC. Study on optimization of dilution renaturation condition of RNase onconase. Chem Bioeng, 2013, 30(10): 57-60 (in Chinese). 郭红, 徐殿胜, 王庆诚. 核糖核酸酶Onconase的稀释复性条件优化研究. 化学与生物工程, 2013, 30(10): 57-60. |
| [14] |
He Q. Sectrtory expression of glycosylated and aglycosylated mutein of onconase from Pichia pastoris using different sectrtion signals and their purification and characterization[D]. Beijing: Academy of Military Medical Sciences, 2009 (in Chinese). 何庆. 糖基化和非糖基化Onconase在巴斯德毕赤酵母中的分泌表达、纯化与活性鉴定[D]. 北京: 中国人民解放军军事医学科学院, 2009. |
| [15] | Mellitzer A, Weis R, Glieder A, et al. Expression of lignocellulolytic enzymes in Pichia pastoris. Micro Cell Fact, 2012, 11: 61. |
| [16] | Sygmund C, Gutmann A, Krondorfer I, et al. Simple and efficient expression of Agaricus meleagris pyranose dehydrogenase in Pichia pastoris. Appl Microbiol Biotechnol, 2012, 94(3): 695-704. |
| [17] | Abad S, Nahalka J, Winkler M, et al. High-level expression of Rhodotorula gracilis D-amion acid oxidase in Pichia pastoris. Biotechnol Lett, 2011, 33(3): 557-563. |
| [18] |
Zhou ZL, Lin ZM, Geng LL, et al. Comparison of codon optimizations of cry1Ah1 gene in rice. Chin J Biotech, 2012, 28(10): 1187-1194 (in Chinese). 周宗梁, 林智敏, 耿丽丽, 等. 水稻中cry1Ah1基因密码子优化方案的比较. 生物工程学报, 2012, 28(10): 1184-1194. |
| [19] | Zelasko S, Palaria A, Das A. Optimizations to achieve high-level expression of cytochrome P450 proteins using Escherichia coli expression systems. Protein Expr Purif, 2013, 92(1): 77-87. |
| [20] | Spatz SJ, Volkening JD, Mullis R, et al. Expression of chicken parvovirus VP2 in chicken embryo fibroblasts require codon optimization for production of naked DNA and Vecored meleagrid herpesvirus type 1 vaccine. Virus Genes, 2013, 47(2): 259-267. |
| [21] | Park S, Pack SP, Lee J. Expression of codon-optmiazed phosphoenolpyruvate carboxylase gene from Glaciecola sp. HTCC2999 in Escherichia coli and its application for C4 chemical production. Appl Biochem Biotech, 2012, 167(7): 1845-1853. |
| [22] |
Cao MC, Xu JY, Luo LC, et al. Cloning of Glucoamylase(glaA) gene from A. niger and its expression in P. pastoris X-33. J Anhui Agri Sci, 2011, 39(14): 8226-8230, 8306 (in Chinese). 曹慕琛, 徐健勇, 罗立超, 等. 黑曲霉糖化酶基因的克隆及其在毕赤酵母X-33中的表达. 安徽农业科学, 2011, 39(14): 8226-8230, 8306. |
| [23] | Louwrier A. Model phase separations of proteins using aqueous/ethanol components. Biotechnol Tech, 1998, 12(5): 363-365. |
| [24] |
Tian MY. Aqueous two-phase extraction of serum albumin and enzymes[D]. Dalian: Dalian University of Technology, 2009 (in Chinese). 田明玉. 双水相萃取白蛋白和酶的初步研究[D].大连: 大连理工大学, 2009. |
| [25] |
Zhang F. The integration process of aqueous two-phase extraction and chromatography for seperation and purification of recombinant human serum albumin[D]. Dalian: Dalian University of Technology, 2011 (in Chinese). 张帆. 双水相萃取偶联柱层析分离纯化重组白蛋白[D]. 大连: 大连理工大学, 2011. |
 2015, Vol. 31
2015, Vol. 31




