服务
文章信息
- 雍子涵, 张栩, 谭天伟
- Yong Zihan, Zhang Xu, Tan Tianwei
- 糠醛对粘红酵母生长与油脂积累的影响
- Effects of furfural on the growth and lipid production of oleaginous yeast Rhodotorula glutinis
- 生物工程学报, 2012, 31(10): 1484-1491
- Chin J Biotech, 2012, 31(10): 1484-1491
- 10.13345/j.cjb.150026
-
文章历史
- Received: November 17, 2014;
- Accepted: January 30, 2015
在面临能源短缺与环境污染这两个巨大挑战的今天,生物质资源受到了国际社会的广泛关注[1]。我国作为一个传统的农业大国,纤维素原料非常丰富,仅小麦秸秆,每年产量就可达1.1亿t[2]。纤维素水解液中含有丰富的可发酵性糖,尤其是葡萄糖和木糖,可用于微生物产油脂[3, 4]。微生物油脂在脂肪酸组成上与植物油非常相似,是生产工业用油和生物柴油的潜在原料[5]。据文献报道,粘红酵母Rhodotorula glutinis属产油菌株中油脂含量较高的,其油脂含量可达72%[1, 6]。
然而,纤维素原料在预处理过程中会产生以乙酸、糠醛、五羟甲基糠醛等为代表的多种发酵抑制物阻碍微生物的正常生长[7, 8, 9, 10]。前期的研究多集中在以酿酒酵母Saccharomyces cerevisiae为代表的多种脱毒方法和一些相关机理[11, 12, 13, 14],近年来也有学者探究了纤维素水解液培养发酵性丝孢酵母Trichosporon fermentans[15, 16, 17, 18]、弯曲隐球菌Cryptococcus curvatus[19]以及圆红冬孢酵母Rhodosporidium toruloides[20]等产油酵母的情况,而关于纤维素水解液发酵抑制物糠醛对产油酵母粘红酵母Rhodotorula glutinis生长的影响则鲜见报道。
本文在此基础上着重探究了纤维素水解液发酵抑制物之一糠醛对粘红酵母生长和油脂积累的影响,以及对葡萄糖和木糖利用的影响,从而为优化纤维素水解液培养基提供实验支持,并为深入探究糠醛对产油微生物的抑制机理和基因改良抗性高产油脂酵母提供科学依据。
1 材料与方法 1.1 材料 1.1.1 菌种本实验所用菌种粘红酵母Rhodotorula glutinis (CGMCC No. 2258) 由北京化工大学、国家能源生物炼制研发中心保藏,系从中国食品发酵所购买的粘红酵母菌株经过多次诱变 所得。
1.1.2 主要仪器全波长酶标扫描仪 (Thermo Labsystems Multiskan Spectrum)、摇床、台式离心机、高效液相色谱仪 (Thermo Fisher Sciencetific,Utimate 3 000,USA)、电子天平、电热恒温水浴锅、烘箱、紫外超净台、pH计、自动蒸汽灭菌锅、气相色谱仪。
1.1.3 培养基葡萄糖基础培养基 (g/L):葡萄糖40,KH2PO4 7,Na2SO4 2,(NH4)2SO4 2,MgSO4·7H2O 1.5,酵母粉1.5。
木糖基础培养基 (g/L):木糖34,KH2PO4 7,Na2SO4 2,(NH4)2SO4 2,MgSO4·7H2O 1.5,酵母粉1.5。
混合糖基础培养基 (g/L):葡萄糖20,木糖17,KH2PO4 7,Na2SO4 2,(NH4)2SO4 2,MgSO4·7H2O 1.5,酵母粉1.5。
根据实验设置,在相应基础培养基中添加糠醛至相应浓度。
1.2 方法 1.2.1 培养方法本实验采用500 mL摇瓶,1/5装液量,10%种子液接种量,摇床培养条件为200 r/min、30 ℃。
1.2.2 分析方法采用高效液相色谱仪测定葡萄糖和木糖的条件为:Aminex HPX-87H柱 (300 mmx7.8 mm,Bio-Rad Corp.,USA),65 ℃示差检测器,流动相为 0.005 mol/L H2SO4,流速为0.6 mL/min。糠醛的测定条件为:C18有机酸柱 (250 mmx 4.6 mm,Thermo Fisher Corp.,USA),35 ℃,紫外检测 器,220 nm,流动相为水与甲醇的混合液 (75∶25,V/V),流速为0.5 mL/min。
生物量:将培养液稀释一定浓度后,在波长为600 nm下测其吸光度,通过标准曲线计算其生物量。
油脂产量采用磷酸香草醛法测定,参照文献[21]。
采用氯仿-甲醇法提取出油脂后 (参照文献[22]),采用气相测定油脂组分,参照文献[23]。
2 结果与分析 2.1 不同的糠醛浓度对粘红酵母生长与油脂积累的影响添加了糠醛的培养基中粘红酵母生长速率明显下降,且糠醛浓度越高,抑制现象越明显 (图1A)。结合糖耗曲线与糠醛浓度变化曲线 (图1B和图1C),可以发现,当糠醛浓度降为0时,粘红酵母才开始大量利用葡萄糖快速生长。当初始糠醛浓度达到1.5 g/L时,粘红酵母在96 h之后才开始大量生长,即对照组的酵母已经由对数期转入稳定期时,1.5 g/L糠醛处理的酵母才开始由延迟期进入对数期。从最大生物量积累来看,添加了糠醛的培养基中生物量最高仅 8 g/L (糠醛浓度为0.1 g/L时),约占正常培养基生物量 (14 g/L) 的57%。值得一提的是,不同糠醛浓度下,粘红酵母最终的生物量积累几乎相当。另外,在初始糠醛浓度为0.1 g/L的培养基中,前48 h的生物量积累情况与对照组不相上下。这说明,糠醛浓度越低,粘红酵母的延迟期越短。0.1 g/L的糠醛前期对粘红酵母的延迟期影响并不大,但其生长活力受到限制,主要表现为48 h 之后,生物量便不再积累,进入稳定期,而对照中的生物量仍继续增加。
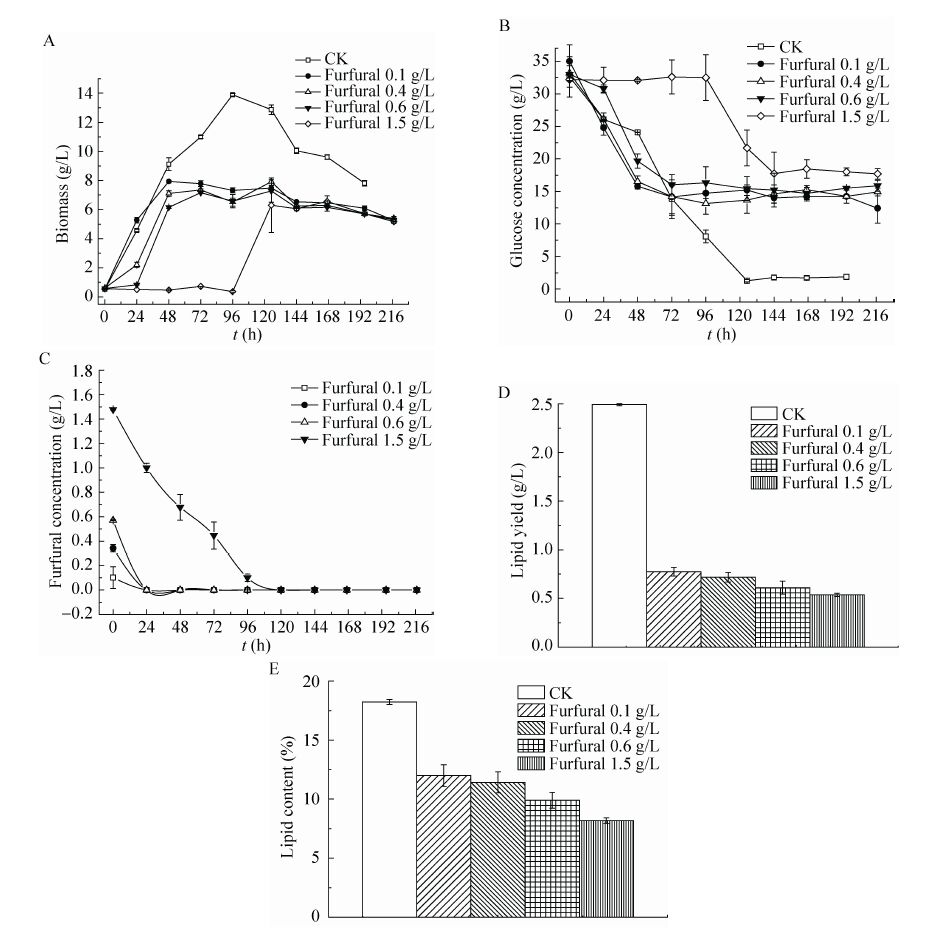
|
| 图1 不同糠醛浓度对粘红酵母生长与油脂积累的影响 Fig.1 Effects of different furfural concentrations on the growth and lipid production of R. glutinis. (A) Biomass accumulation. (B) Sugar consumption. (C) Variations of furfural concentrations. (D) Lipid yield. (E) Lipid content. |
就葡萄糖利用情况而言 (图1B),糠醛浓度越高,葡萄糖消耗速度越慢,而且所消耗糖量也越来越少。当糠醛浓度达到1.5 g/L时,直到第4天,粘红酵母才开始大量利用葡萄糖,但持续时间仅48 h左右,发酵至216 h时残糖仍高达17.7 g/L。
从糠醛浓度变化上看 (图1C),24 h之后,0.1 g/L、0.4 g/L、0.6 g/L实验组的糠醛浓度几乎降为0,120 h之后,1.5 g/L实验组的糠醛浓度也几乎降为0。结合生物量积累 (图1A) 和糖耗情况 (图1B),不难发现,培养基中粘红酵母的生长速率和糖耗速率与糠醛的浓度变化密切相关。
从油脂产量和油脂含量来看,糠醛浓度越高,其对油脂合成的抑制程度越大 (图1D和1E)。当糠醛浓度达1.5 g/L时,粘红酵母油脂产量远远低于对照组中的油脂产量,而油脂含量与未添加糠醛的基础培养基情况相比,降低了约50%。
综上分析,糠醛对粘红酵母在葡萄糖培养基中的生长和油脂积累均存在着明显的抑制作用,并且抑制程度与糠醛浓度呈正相关。糠醛浓度降为0之后粘红酵母才开始大量利用葡萄糖进行生长,但即使是0.1 g/L的初始糠醛浓度下,其残糖也高达12.4 g/L。当糠醛浓度达 1.5 g/L时,粘红酵母的延迟期延长至96 h,残糖高达17.7 g/L,生物量积累最高6.6 g/L,仅为正常积累量的47%,油脂含量也减少了约50%,糠醛的抑制作用已经相当严重了。
2.2 糠醛对粘红酵母不同单一碳源利用的影响基于2.1的研究结果,选取1.0 g/L的糠醛浓度,探究了糠醛对粘红酵母不同单一碳源利用的影响。从生物量积累来看 (图2A),发酵前24 h,添加糠醛的不同碳源培养基中,酵母几乎都没有生长,处于适应调整阶段,24 h之后才开始大量生长,进入对数生长期,48 h后便进入稳定生长期,并且持续相当长一段时间。整体比较,各培养基最大生物量表现为,对照组:葡萄糖 (13.7 g/L) >混合糖 (12.2 g/L) >木糖 (11.6 g/L),处理组:混合糖~葡萄糖 (5.6 g/L) >木糖 (4.8 g/L)。处理组中等比例混合碳源与单一葡萄糖 (六碳糖) 培养基中的粘红酵母生长情况相当,这说明糠醛对木糖利用的抑制程度小于对葡萄糖利用的抑制程度。
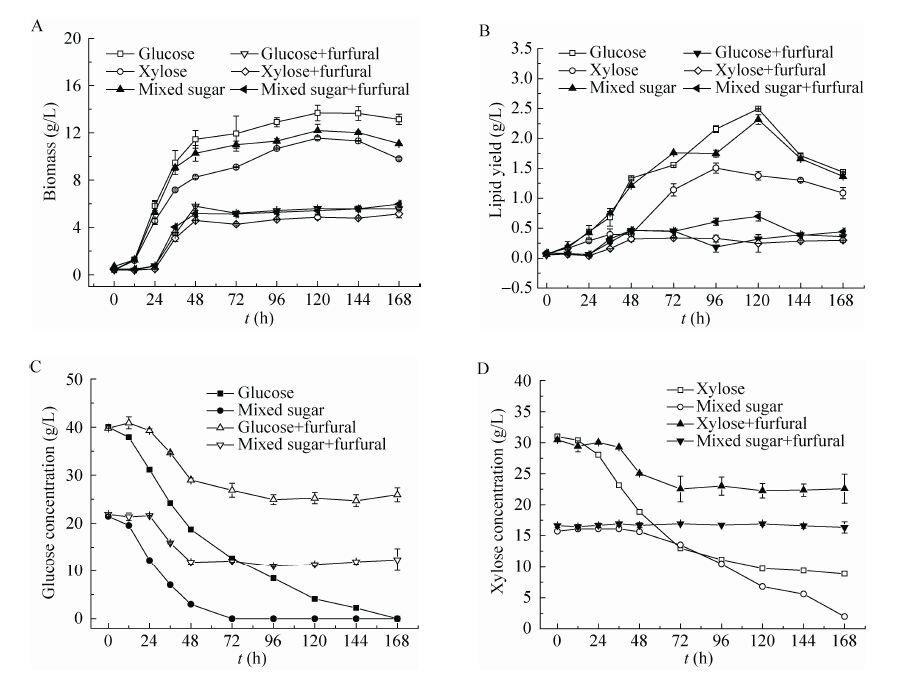
|
| 图2 糠醛对粘红酵母不同单一碳源利用的影响 Fig.2 Effects of furfural on the utilization of different carbon sources. (A) Biomass accumulation. (B) Lipid yield. (C) Glucose consumption. (D) Xylose consumption. |
从油脂积累来看 (图2B),对照组在稳定期的中后期 (96−120 h)油脂逐渐达到最高值,而处理组在前24 h油脂几乎没有积累,这与其在此期间生物量没有积累的情况相一致,24−48 h油脂逐渐积累到最大值,48 h之后油脂产量保持稳定,这也与其在48 h之后生物量保持稳定的情况相一致。总体比较,对照组培养基中的最大油脂积累情况为:葡萄糖 (2.5 g/L) >混合糖 (2.3 g/L) >木糖 (1.5 g/L),处理组培养基中的最大油脂积累情况为:混合糖 (0.7 g/L) >葡萄糖 (0.45 g/L) >木糖 (0.33 g/L),这也在一定程度上说明了木糖为碳源时糠醛对粘红酵母的抑制程度小于对葡萄糖为碳源时的抑制程度。
从葡萄糖消耗情况来看 (图2C),添加糠醛的葡萄糖培养基与混合糖培养基中,前24 h葡萄糖几乎都没有消耗,24 h之后才开始大量消耗,但是72 h之后葡萄糖浓度便几乎不再变化,葡萄糖利用率仅为30%−35%。而对照组中,葡萄糖则表现为持续消耗,直至最终消耗完毕。
图2D为木糖浓度的变化情况,对照组中,木糖培养基中的木糖浓度表现为持续下降,其中前72 h下降较快,72 h之后相对缓慢。混合糖培养基中木糖在前48 h几乎不变化,72 h之后才开始大量消耗,这是因为混合糖培养基中的葡萄糖浓度在72 h时已消耗完毕,在葡萄糖消耗完之后粘红酵母才开始大量利用木糖。处理组中,木糖培养基中的木糖浓度在前24 h几乎没有变化,24 h之后才开始消耗木糖,但72 h之后便几乎不再利用木糖,木糖浓度稳定在 22 g/L左右,木糖利用率仅21%−31%。混合糖培养基中的木糖几乎没有消耗,这与葡萄糖没有消耗完的情况相一致,因为在葡萄糖和木糖共同存在时,粘红酵母在利用完葡萄糖之后才会开始大量利用木糖。
2.3 不同碳源下糠醛对粘红酵母油脂主要组分的影响由图3可知,在不同碳源的培养基中,粘红酵母所产的主要脂肪酸种类是一致的,分别为16碳的软脂酸 (16∶0)和18碳的硬脂酸 (18∶0)、油酸 (18∶1)、亚油酸 (18∶2),但相应的比例有所差别。

|
| 图3 糠醛对不同碳源下粘红酵母所产油脂的主要成分相对含量影响 Fig.3 Effects of furfural on the main lipid profile in different carbon sources. |
基础培养基中,葡萄糖为碳源时粘红酵母倾向于积累大量的油酸 (68%),其次是软脂酸 (16%)、亚油酸 (11%)和硬脂酸 (5%)。木糖为碳源时,粘红酵母倾向于积累大量的硬脂酸 (44%),其次是油酸 (34%)、亚油酸 (13%) 和软脂酸 (8%)。混合糖为碳源时,相应的油脂含量则介于二者之间。
添加糠醛后,葡萄糖为碳源时粘红酵母倾向于生成更多的18碳脂肪酸 (其中油酸含量仍然是最高的),16碳的软脂酸含量有所下降 (约占11%)。木糖为碳源时情况则相反,其软脂酸含量有所上升 (约占15%),硬脂酸含量明显下降 (约占25%),其他的成分含量均上升了,其中油酸含量上升为最大 (约占41%)。混合糖为碳源时,变化幅度介于二者之间,整体变化趋势与葡萄糖为碳源时一致。
总体而言,添加糠醛后,不同碳源的培养基中,粘红酵母产生的主要脂肪酸不仅种类不变,相应的含量分配也趋于一致,由高到低分别为:油酸、硬脂酸、亚油酸、软脂酸,18碳的脂肪酸占85%−92%,其中油酸的比重占41%−55%。这说明,在糠醛存在的逆境中,粘红酵母倾向于生成更多的长链脂肪酸或长链不饱和脂肪酸以抵御逆境。这可能与糠醛的抑制机理相关,具体原因还有待进一步探究。
3 结论综上分析,糠醛明显抑制粘红酵母的生长和油脂积累,并且其抑制程度与糠醛浓度呈正相关。糠醛对粘红酵母的抑制作用主要体现在延迟期的延长和对数生长期的缩短、生物量积累的减少、油脂积累的减少、糖利用能力下降等多方面。糠醛对葡萄糖利用的抑制程度大于对木糖利用的抑制程度。从油脂的主要成分与比例分配上来看,糠醛存在时,粘红酵母倾向于生成更多的18碳长链脂肪酸或18碳长链不饱和脂肪酸以抵御逆境。关于糠醛对粘红酵母的抑制机制还有待进一步探究。
| [1] |
Li Q. Study on the Lipid Synthesis and Pentose Sugar Metabolism of Oleaginous Yeast. Beijing: Beijing University of Chemical Technology, 2007 (in Chinese). 李堑. 产油酵母油脂合成与戊糖代谢的研究. 北京: 北京化工大学, 2007. |
| [2] | Yong DY, Pang YZ, Yuan HR, et al. Enhancing biogas production from anaerobically digested wheat straw through ammonia pretreatment. Chin J Chem Eng, 2014, 22(5): 576-582. |
| [3] | Huang C, Zong M, Wu H, et al. Microbial oil production from rice straw hydrolysate by Trichosporon fermentans. Bioresour Technol, 2009, 100(19): 4535-4538. |
| [4] | Huang C, Chen X, Xiong L, et al. Microbial oil production from corncob acid hydrolysate by oleaginous yeast Trichosporon coremiiforme. Biomass Bioenergy, 2013, 49: 273-278. |
| [5] | Xing X. Study of sugar contained wastewater for microbial lipid production[D]. Beijing: Beijing University of Chemical Technology, 2009 (in Chinese). 邢旭. 含糖废水发酵生产微生物油脂[D]. 北京:北京化工大学, 2009. |
| [6] |
Pan LX, Yang DF, Shao L, et al. Screening, identification and fermention characters of oleaginous yeasts by utilizing sugar cane bagasse hemicellulose hydrolysates. Microbiol China, 2008, 35(8): 1176-1181 (in Chinese). 潘丽霞, 杨登峰, 邵利, 等. 利用蔗渣半纤维素水解液产油酵母的筛选、鉴定及发酵实验. 微生物学通报, 2008, 35(8): 1176-1181. |
| [7] |
Wang XF, Zhang J, Xin XJ, et al. Furfural degradation by filamentous fungus Amorphotheca resinae ZN1. Chin J Biotech, 2012, 28(9): 1070-1079 (in Chinese). 王晓凤, 张建, 辛秀娟, 等. 丝状真菌Amorphotheca resinae ZN1的糠醛降解代谢分析. 生物工程学报, 2012, 28(9): 1070-1079. |
| [8] | Palmqvist E, Hahn-H?gerdal B. Fermentation of lignocellulosic hydrolysates. I: inhibition and detoxification. Bioresour Technol, 2000, 74(1): 17-24. |
| [9] |
Wang D, Wang HH, Wang J, et al. Effects of furfural and 5-hydroxymethylfurfural on succinic acid production by Escherichia coli. Chin J Biotech, 2013, 29(10): 1463-1472 (in Chinese). 王丹, 王洪辉, 王競, 等. 糠醛和5-羟甲基糠醛对大肠杆菌产丁二酸的影响. 生物工程学报, 2013, 29(10): 1463-1472. |
| [10] |
Wu J, Cheng KK, Li WY, et al. Effect of acetic acid, furfural and 5-hydroxymethylfurfural onproduction of 2,3-butanediol by Klebsiella oxytoca. Chin J Biotech, 2013, 29(3): 350-357 (in Chinese). 吴晶, 程可可, 李文英, 等. 乙酸、糠醛和5-羟甲基糠醛对产酸克雷伯氏菌发酵生产2,3-丁二醇的影响. 生物工程学报, 2013, 29(3): 350-357. |
| [11] | Almeida JRM, Modig T, Petersson A, et al. Increased tolerance and conversion of inhibitors in lignocellulosic hydrolysates by Saccharomyces cerevisiae. J Chem Technol Biot, 2007, 82(4): 340-349. |
| [12] | Palmqvist E, Hahn-H?gerdal B. Fermentation of lignocellulosic hydrolysates II: inhibitors and mechanisms of inhibition. Bioresour Technol, 2000, 74(1): 25-33. |
| [13] | Taherzadeh MJ, Gustafsson L, Niklasson C, et al. Conversion of furfural in aerobic and anaerobic batch fermentation of glucose by Saccharomyces cerevisiae. J Biosci Bioeng, 1999, 87(2): 169-174. |
| [14] | Delgenes JP, Moletta R, Navarro JM. Effects of lignocellulose degradation products on ethanol fermentations of glucose and xylose by Saccharomyces cerevisiae, Zymomonas mobilis, Pichia stipitis, and Candida shehatae. Enzyme Microb Technol, 1996, 19(3): 220-225. |
| [15] | Huang C, Wu H, Li R, et al. Improving lipid production from bagasse hydrolysate with Trichosporon fermentans by response surface methodology. New Biotechnol, 2012, 29(3): 372-378. |
| [16] | Huang C, Wu H, Smith TJ, et al. In vivo detoxification of furfural during lipid production by the oleaginous yeast Trichosporon fermentans. Biotechnol Lett, 2012, 34(9): 1637-1642. |
| [17] | Huang C, Wen P, Wu H, et al. Evaluating the effect of acetic acid, furfural and catechol on the growth and lipid accumulation of Trichosporon fermentans by response surface methodology. Afr J Microbiol Res, 2012, 6(24): 5266-5275. |
| [18] | Huang C, Wu H, Liu Q, et al. Effects of aldehydes on the growth and lipid accumulation of oleaginous yeast Trichosporon fermentans. J Agric Food Chem, 2011, 59(9): 4606-4613. |
| [19] | Yu X, Zeng J, Zheng Y, et al. Effect of lignocellulose degradation products on microbial biomass and lipid production by the oleaginous yeast Cryptococcus curvatus. Process Biochem, 2014, 49(3): 457-465. |
| [20] | Zhao X, Peng F, Du W, et al. Effects of some inhibitors on the growth and lipid accumulation of oleaginous yeast Rhodosporidium toruloides and preparation of biodiesel by enzymatic transesterification of the lipid. Bioproc Biosyst Eng, 2012, 35(6): 993-1004. |
| [21] | Izard J, Limberger RJ. Rapid screening method for quantitation of bacterial cell lipids from whole cells. J Microbiol Meth, 2003, 55(2): 411-418. |
| [22] | Bligh EG, Dyer WJ. A rapid method of total lipid extraction and purification. Can J Biochem Phys, 1959, 37(8): 911-917. |
| [23] | Li Z, Jiang F, Li Y, et al. Simultaneously concentrating and pretreating of microalgae Chlorella spp. by three-phase partitioning. Bioresour Technol, 2013, 149: 286-291. |
 2012, Vol. 31
2012, Vol. 31