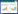服务
文章信息
- 宋叶华, 沈宏伟, 杨薇, 杨晓兵, 龚志伟, 赵宗保
- Song Yehua, Shen Hongwei, Yang Wei, Yang Xiaobing, Gong Zhiwei, Zhao Zongbao
- 酿酒酵母工程菌高密度培养生产香紫苏醇
- High cell density culture of an engineered yeast strain for sclareol production
- 生物工程学报, 2015, 31(1): 147-151
- Chin J Biotech, 2015, 31(1): 147-151
- 10.13345/j.cjb.140137
-
文章历史
- Received: February 25, 2014
- Accepted: April 9, 2014
2. 中国科学院大学,北京 100049
3. 营口理工学院化学工程系,辽宁 营口 115000
2 University of Chinese Academy of Sciences,Beijing 100049,China
3. Department of Chemical Engineering,Yingkou Institute of Technology,Yingkou 115000,Liaoning,China
香紫苏醇是一种半日花烷型二萜二叔醇,常用于化妆品和香水的香料成分及食品调味材料。它是唯一实用的天然龙涎香代用品降龙涎醚化学合成的原料。因此,香紫苏醇具有较高经济价值。此外,香紫苏醇还是潜在抗肿瘤药物,对人类多种癌细胞如白血病细胞[1]、肿瘤细胞和结肠癌细胞[2]均有细胞毒性。目前香紫苏醇主要从植物中提取,但植物生长周期长,生长易受土地、环境及气候等因素影响。而且植物中香紫苏醇含量较低,从1 000 kg干草中仅可获得15 kg香紫苏醇,难以满足工业化需求[3]。
利用微生物生产植物源萜类化合物非常具有潜力。通过异源表达相关基因或构建人工合成途径,已成功实现萜类化合物如紫杉醇前体[4]、番茄红素[5]、次丹参酮二烯[6]等的微生物生产。Schalk等[7]以大肠杆菌为宿主,过表达真核生物的甲羟戊酸途径及香紫苏醇生物合成关键酶,结合高密度发酵技术,香紫苏醇产量达到1.5 g/L。相对于大肠杆菌,酿酒酵母生物安全性好,异戊二烯代谢途径活跃,可有效供给萜类化合物生物合成前体,并且酿酒酵母可更好地兼容其他植物源基因以及细胞色素P450氧化酶,有利于复杂萜类化合物的人工合成途径构建。杨薇等[8]构建了表达焦磷酸赖百当烯二醇酯合酶和香紫苏醇合酶的酿酒酵母工程菌株,摇瓶培养条件下,香紫苏醇产量达到8.9 mg/L。
高密度培养是提高微生物代谢产物产量的重要手段。次丹参酮二烯的酵母工程菌在摇瓶培养条件下产量为22.7 mg/L,但采用批式补料高菌体密度培养策略,在15 L发酵罐规模条件下,次丹参酮二烯产量达到365 mg/L[6]。利用大肠杆菌工程菌进行碳源和氮源限制下批式补料培养,菌体密度和紫穗槐二烯分别达到90 g/L和27.4 g/L[9]。
本文以一株产香紫苏醇的酿酒酵母工程菌为材料,选择合适的培养基提高质粒稳定性,考察工程菌的生长及代谢特点,进而研究以葡萄糖、乙醇和葡萄糖/乙醇混合物为碳源高密度培养,以期提高香紫苏醇的产量。研究结果对优化酿酒酵母细胞工厂,高效生产萜类化合物具有重要参考价值。
1 材料与方法 1.1 材料 1.1.1 菌株酿酒酵母工程菌为二倍体菌株S7,构建方法如下:以菌株BY4741L为出发菌株,分别电转化p424-tHMG1和pSclareol-4 [8],将构建所得菌株再与BY4742融合即得到菌株S7。
1.1.2 培养基YPD和SD液体培养基参见文献[8]。SD固体培养基在SD液体培养基基础上加入15 g/L琼脂粉。
摇瓶合成培养基 (g/L)[10]:葡萄糖19,(NH4)2SO4 15,KH2PO4 8,MgSO4·7H2O 6.2,痕量元素储液 10 mL/L,维生素储液12 mL/L。用0.5 mol/L琥珀酸缓冲液 (pH 5.0) 调节pH。
发酵罐初始培养基 (g/L):葡萄糖20,(NH4)2SO4 5,其他成分同摇瓶培养基。葡萄糖补料碳源 (g/L):葡萄糖溶液800;葡萄糖/乙醇混合补料碳源 (g/L):葡萄糖480,95%乙醇330 mL/L;乙醇补料碳源:95%乙醇。补料营养元素溶液 (g/L):(NH4)2SO4 260 g,KH2PO4 32 g,MgSO4·7H2O 24.6 g,痕量元素储液40 mL/L,维生素储液48 mL/L (共250 mL)。
1.2 方法 1.2.1 种子液制备摇瓶培养基种子液:挑取SD平板上酿酒酵母工程菌S7单菌落,于25 mL SD液体培养基中,30 ºC,200 r/min培养24 h。
发酵罐培养种子液:1 mL菌株S7冻存菌 (含20%甘油) 于25 mL SD培养基中,摇床培养45 h,取1 mL接种于100 mL SD培养基中,30 ºC,200 r/min培养24 h。
1.2.2 培养方法摇瓶培养在250 mL三角瓶中进行,按5% (V/V)接种量将种子液接种到48 mL发酵培养基中。30 ºC,200 r/min培养96 h。
发酵罐培养在3 L搅拌式生物反应器中进行,培养基初始体积0.9 L,按10% (V/V) 的接种量接种,温度30 ºC,通气量100 L/h,3 mol/L NaOH溶液控制pH在5.0左右,通过调整搅拌转数控制溶解氧大于20%。发酵液中葡萄糖及生成的乙醇消耗完后开始用800 g/L葡萄糖溶液补料,在46 h时均加入 200 mL正十二烷,进行原位萃取。48 h时OD600值达到50左右,采用补料-溶氧联动方式分别补加不同碳源,并控制发酵液中碳源在较低浓度 (小于 1 g/L)。补料过程中分批加入250 mL营养元素溶液。
1.2.3 产物提取摇瓶实验中,50 mL发酵液加入等体积正己烷,于30 ºC,200 r/min的摇床上处理30 min。分离有机相,蒸去溶剂,用正十二烷溶解,并加入香紫苏内酯 (购自Sigma) 作为内标,待测。
发酵罐实验中,发酵液不含正十二烷时,将约5 mL发酵液离心5 min,菌体加入玻璃珠漩涡振荡 3 min,破碎细胞,再与上清混合,加入等体积正己烷,按摇瓶实验相同方法提取。含有正十二烷的发酵液取5 mL离心,有机相加入内标后检测。菌体用去离子水洗涤,加入玻璃珠漩涡振荡3 min破碎细胞,加入10 mL正己烷,按摇瓶实验相同方法提取。
1.2.4 分析方法质粒稳定性检测:取培养一定时间的菌液稀释,分别涂布到SD平板、含20 mg/L组氨酸的SD平板、含20 mg/L尿嘧啶的SD平板和同时含20 mg/L组氨酸及20 mg/L尿嘧啶的SD平板。统计4种平板上的菌落形成单位 (CFU) 。
生物量测定:将菌液适当稀释,在600 nm处测量其吸光值。湿菌体于105 ºC烘干至恒重,以g干菌体/L发酵液表示。
残糖和乙醇测定:取适当稀释的发酵液上清,采用山东省科学院生产的SBA-40D生物传感器分析仪进行检测。
香紫苏醇测定:利用气相色谱(GC7890F) 分析。采用SE-54型毛细管色谱柱(30 m × 0.25 mm × 0.25 μm),分析条件为:初始柱温150 ºC维持5 min,升温速率为10 ºC/min升温到250 ºC维持10 min,进样器温度270 ºC,检测器温度280 ºC,载气流速1.6 mL/min。进样量1 μL。
2 结果与讨论 2.1 培养基的选择工程菌的质粒稳定性对于大规模发酵生产至关重要,选择合适的培养基可提高质粒稳定性[11]。 S. cerevisiae工程菌S7携带两个质粒p424-tHMG1和pSclareol-4,在生长增殖过程中可能发生质粒丢失现象。由于质粒合成给宿主造成一定的额外负荷,在底物充足时,不含质粒的细胞比含质粒的生长速率快[11]。实验发现,用YPD培养基培养48 h,培养液酵母细胞同时携带两个质粒的为总细胞数的58.0%。而且,质粒pSclareol-4比p424-tHMG1更易丢失。值得注意的是,由于香紫苏醇合成的结构基因插入在质粒pSclareol-4上,丢失该质粒的细胞将完全丧失生产能力。相同条件下用合成培养基,48 h时后72.8%细胞携带两个质粒。因此,用合成培养基比YPD更有利于质粒稳定。
2.2 工程菌在摇瓶上的生长及代谢特点为了解工程菌在培养过程中的生长及代谢特点,摇瓶培养条件下考察了葡萄糖消耗、菌体生长、乙醇生成及消耗和香紫苏醇生成情况(图1)。
|
| 图1 酵母工程菌在摇瓶上的发酵曲线 Fig.1 Fermentation curve of the engineered S. cerevisiae in shake-flasks. |
对数生长期葡萄糖迅速消耗,菌体密度和乙醇浓度快速增加,20 h后葡萄糖完全消耗,乙醇浓度达到0.98% (V/V)。随后,乙醇逐渐减少,菌体密度仍在增加,但增加速率较前期慢,直到84 h乙醇被消耗完,菌体浓度不再增加。0−20 h菌体OD600增加了7.0,而随后20−84 h仅增加了11.6,说明 S. cerevisiae工程菌S7利用乙醇生长比利用葡萄糖慢,葡萄糖依然是工程菌生长的优势碳源。工程菌S7这种快速利用葡萄糖合成乙醇,再利用乙醇为碳源生长的现象已有报道[12]。在较高浓度葡萄糖条件下培养酿酒酵母,即使氧气供应充足也会产生乙醇,而当葡萄糖耗尽后一些基因表达被激活,导致乙醇作为碳源被利用[13]。实验发现香紫苏醇浓度随发酵时间延长而增加,在96 h时达到 (15.2±0.2) mg/L。菌体密度与香紫苏醇浓度增长速度非常相近,24−96 h菌体OD600增加了2.2倍,香紫苏醇浓度增加了2.5倍,可见香紫苏醇合成与菌体生长密切关联。
2.3 不同碳源高密度发酵因香紫苏醇生成与菌体生长关联,所以为提高产量可采用高密度发酵。采用溶氧-补料联动方式补料,使底物维持在较低水平,避免由于培养基中葡萄糖过剩导致乙醇产生,对酵母细胞产生一定毒性[14]。文献报道,酵母工程菌中可用乙醇为碳源,生产皮质醇[15]和青蒿酸[10]。图1的结果也表明,工程菌S7可较好利用乙醇为碳源生长并产生香紫苏醇。因此,分别采用葡萄糖、乙醇及葡萄糖和乙醇混合物为碳源补料培养工程菌S7,研究其生产性能的差异。
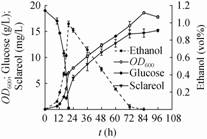
2.3.1 菌体生长情况3种补料条件下菌体生长情况如图2所示,初始 (0−40 h) 菌体生长缓慢,延滞期较长,在50−70 h细胞生长最快,随后菌体密度变化不大。
|
| 图2 不同碳源补料培养工程菌S7的细胞生长曲线 Fig.2 Time courses of S. cerevisiae S7 cell growth under fed-batch culture conditions with different carbon sources. |
3种条件下菌体密度相似,OD600均达到300左右。葡萄糖补料,混合补料和乙醇补料,在122 h时细胞干重分别为102.9 g/L、117.7 g/L和72.6 g/L,3种补料方式均达到高密度生产。
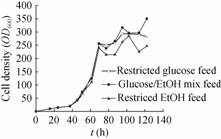
2.3.2 香紫苏醇总产量及其在胞内和有机相中分配情况工程菌S7培养过程中香紫苏醇逐步积累 (图3)。在菌体快速生长阶段,香紫苏醇总产量也快速增加;菌体生长速率降低后,香紫苏醇浓度增长变缓 (图3A)。葡萄糖补料、乙醇补料和混合补料的最高产量分别为253 mg/L、386 mg/L和408 mg/L,相应底物碳转化生成香紫苏醇的摩尔百分数 (Cmol%) 分别为0.119 Cmol%、0.229 Cmol%和0.222 Cmol%。显然,以乙醇为底物获得了较高碳得率。乙醇有利于香紫苏醇产生,这可能是乙醇增加了异戊二烯代谢途径的前体供给或提高了关键酶的活性[10, 16]。在虾青素发酵研究中,Yamane等[17]也发现采用葡萄糖和乙醇两阶段培养,比仅用葡萄糖培养虾青素产量高2.2倍。酿酒酵母在以葡萄糖和乙醇混合物为碳源时,两者的相对比例对胞内一些酶的活性和代谢有影响。乙醇可以上调异柠檬酸裂合酶、苹果酸合酶、磷酸烯醇式丙酮酸羧激酶和果糖1,6-二磷酸酶表达,有利于生成乙酰-CoA,促进脂肪酸和一些氨基酸合成[18]。Westfall等[10]用酿酒酵母工程菌生产紫穗槐二烯,发现以乙醇为碳源比用葡萄糖为碳源产量提高近20倍,达到41 g/L。Gu等[16]报道乙醇为碳源时,红发夫酵母异戊二烯代谢途径关键酶HMG-CoA还原酶活性较高,促进了类胡萝卜素合成。
|
| 图3 不同碳源补料培养工程菌 S7 生产香紫苏醇 Fig.3 Time courses of sclareol production by S. cerevisiae S7 under fed-batch culture conditions with different carbon sources. (A) Total sclareol. (B) Intracellular sclareol. (C) Sclareol in dodacane. |
因香紫苏醇难溶于水,所以发酵液中香紫苏醇主要存在于细胞内和有机相中,胞内产量随培养进行而逐渐增加 (图3B)。葡萄糖补料、乙醇补料和混合补料均在发酵后期胞内达到最高产量,分别为 113 mg/L、145 mg/L和191 mg/L。由于70 h后菌体密度变化较小,但胞内香紫苏醇含量增加显著,说明细胞合成的香紫苏醇未有效分泌到胞外。正十二烷中香紫苏醇浓度变化规律表现为持续升高 (图3C),说明已分泌到胞外的香紫苏醇被有效萃取到正十二烷中。3种培养条件下,胞内产物占总香紫苏醇的百分比逐步升高。以葡萄糖补料培养为例,61 h时仅有约10%的香紫苏醇留在胞内,而发酵终点时超过40%的产物留在胞内。葡萄糖补料、乙醇补料和混合补料培养113 h时,胞内香紫苏醇分别为 0.39 mg/L/OD600、0.55 mg/L/OD600和0.64 mg/L/OD600,说明培养后期产物分泌能力下降。因此,需要探索有利于产物分泌的培养条件或进一步提高溶剂的萃取性能。
3 结论本文研究了培养条件对酵母工程菌S7产香紫苏醇的影响,确定了有利于质粒稳定的培养基,发现培养过程中葡萄糖被快速转化为乙醇,随后利用乙醇生长,并且产物生成与菌体生长偶联的代谢特征。采用正十二烷原位萃取,葡萄糖/乙醇混合碳源,补料-溶氧联动方式高密度批式培养,香紫苏醇产量达到408 mg/L。研究结果对优化酿酒酵母细胞工厂,高效生产萜类化合物具有重要参考价值。
| [1] | Dimas K, Kokkinopoulos D, Demetzos C, et al. The effect of sclareol on growth and cell cycle progression of human leukemic cell lines. Leuk Res, 1999, 23(3): 217-234. |
| [2] | Mahaira LG, Tsimplouli C, Sakellaridis N, et al. The labdane diterpene sclareol (labd-14-ene-8, 13-diol) induces apoptosis in human tumor cell lines and suppression of tumor growth in vivo via a p53-independent mechanism of action. Eur J Pharmacol, 2011, 666(1/3): 173-182. |
| [3] | Caissard JC, Olivier T, Delbecque C, et al. Extracellular localization of the diterpene sclareol in clary Sage (Salvia sclarea L., Lamiaceae). PLoS ONE, 2012, 7(10): e48253. |
| [4] | Ajikumar PK, Xiao WH, Tyo KE, et al. Isoprenoid pathway optimization for taxol precursor overproduction in Escherichia coli. Science, 2010, 330(6000): 70-74. |
| [5] | Yoon SH, Kim JE, Lee SH, et al. Engineering the lycopene synthetic pathway in E. coli by comparison of the carotenoid genes of Pantoea agglomerans and Pantoea ananatis. Appl Microbiol Biotechnol, 2007, 74(1): 131-139. |
| [6] | Zhou YJ, Gao W, Rong Q, et al. Modular pathway engineering of diterpenoid synthases and the mevalonic acid pathway for miltiradiene production. J Am Chem Soc, 2012, 134(6): 3234-3241. |
| [7] | Schalk M, Pastore L, Mirata MA, et al. Towards a biosynthetic route to sclareol and amber odorants. J Am Chem Soc, 2012, 134(46): 18900-18903. |
| [8] |
Yang W, Zhou YJ, Liu WJ, et al. Engineering Saccharomyces cerevisiae for sclareol production. Chin J Biotech, 2013, 29(8): 1185-1192 (in Chinese). 杨薇, 周雍进, 刘武军, 等. 构建酿酒酵母工程菌合成香紫苏醇. 生物工程学报, 2013, 29(8): 1185-1192. |
| [9] | Tsuruta H, Paddon CJ, Eng D, et al. High-level production of amorpha-4,11-diene, a precursor of the antimalarial agent artemisinin in Escherichia coli. PLoS ONE, 2009, 4(2): e4489. |
| [10] | Westfall PJ, Pitera DJ, Lenihan JR, et al. Production of amorphadiene in yeast, and its conversion to dihydroartemisinic acid, precursor to the antimalarial agent artemisinin. Proc Natl Acad Sci USA, 2012, 109(3): E111-E118. |
| [11] | Friehs K. Plasmid copy number and plasmid stability. Adv Biochem Eng, 2004, 86: 47-82. |
| [12] | Fiechter A, Fuhrmann GF, K?ppeli O. Regulation of glucose metabolism in growing yeast cells. Adv Microbial Physiol, 1981, 22: 123-183. |
| [13] | Daran-Lapujade P, Jansen MLA, Daran JM, et al. Role of transcriptional regulation in controlling fluxes in central carbon metabolism of Saccharomyces cerevisiae. J Biol Chem, 2004, 279(10): 9125-9138. |
| [14] | Yang KM, Lee NR, Woo JM, et al. Ethanol reduces mitochondrial membrane integrity and thereby impacts carbon metabolism of Saccharomyces cerevisiae. FEMS Yeast Res, 2012, 12(6): 675-684. |
| [15] | Szczebara FM, Chandelier C, Villeret C, et al. Total biosynthesis of hydrocortisone from a simple carbon source in yeast. Nat Biotechnol, 2003, 21(2): 143-149. |
| [16] | Gu WL, An GH, Johnson EA. Ethanol increases carotenoid production in Phaffia rhodozyma. J Ind Microbiol Biotechnol, 1997, 19(2): 114-117. |
| [17] | Yamane Y, Higashida K, Nakashimada Y, et al. Astaxanthin production by Phaffia rhodozyma enhanced in fed-batch culture with glucose and ethanol feeding. Biotechnol Lett, 1997, 19(11): 1109-1111. |
| [18] | De Jong-Gubbels P, Vanrolleghem P, Heijnen S, et al. Regulation of carbon metabolism in chemostat cultures of Saccharomyces cerevisiae grown on mixtures of glucose and ethanol. Yeast, 1995, 11(5): 407-418. |
 2015, Vol. 31
2015, Vol. 31