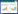服务
文章信息
- 庄秀园, 黄英明, 张道敬, 陶黎明, 李元广
- Zhuang Xiuyuan, Huang Yingming, Zhang Daojing, Tao Liming, Li YuanGuamg
- 小球藻高附加值生物活性物质“小球藻热水提取物”的研究现状与展望
- Research status and prospect on hot water extract of Chlorella: the high value-added bioactive substance from Chlorella
- 生物工程学报, 2015, 31(1): 24-42
- Chin J Biotech, 2015, 31(1): 24-42
- 10.13345/j.cjb.140178
-
文章历史
- Received: March 24, 2014
- Accepted: May 30, 2014
2. 中国生物技术发展中心,北京 100039
3. 华东理工大学 药学院,上海 200237
2. China National Center for Biotechnology Development,Beijing 100039,China
3. School of Pharmacy,East China University of Science and Technology,Shanghai 200237,China
能源是维系人类社会发展的基础。目前地球正面临化石能源枯竭、全球气候变暖等困境,因此寻找新的清洁、可再生能源已经受到了社会各界的关注。由于多种因素的制约,风能、太阳能等可再生资源还无法替代石油等传统化石能源,液体燃料仍具有不可替代性。微藻能源被誉为第3代生物能源[1],目前人们特别关注利用微藻生产生物液体燃料。与传统能源作物相比,微藻具有生长周期短、生物质产率高、二氧化碳固定能力强、单位土地生产效率高且不与粮争地等优势,发展微藻能源在节能减排等方面潜力巨大[2]。虽然目前微藻能源的产业化研究已经进入中试阶段,但仍困难重重,其中最主要的问题是成本高。
小球藻Chlorella,俗称绿藻,是国内外正在大力发展和培育的微藻能源与微藻固碳这一战略性新兴产业的主要藻种之一。已知小球藻能够在20h内分裂增长4倍以上[3],光合效率极高,蛋白含量一般可高于40%,在饥荒时期,曾经被认为是一种理想的谷物替代食品[4]。早在20世纪中叶,德、美、日等国家已经开始小球藻的大规模培养研究[5],但传统的培养方法不能满足微藻能源的需求。笔者所在研究室于前期工作中首创了微藻培养领域的一项崭新的平台技术——“异养-稀释-光诱导”串联培养[6],能够在大规模制备微藻藻粉的同时提升油脂产量。最近,该技术已成功用于蛋白核小球藻 Chlorella pyrenoidosa的工业化生产。
在开发小球藻规模化培养技术的同时,笔者所在实验室亦致力于小球藻高附加值生物活性物质的研究与开发,以期降低微藻能源产业化的经济成本。由于小球藻本身是一种营养丰富又安全的食物[4],在免疫调节等许多方面具有功效,近年来已成为畅销全球的功能食品,其中蛋白核小球藻于2012年被我国卫生部公布为新资源食品[7],而高产油的蛋白核小球藻S106被美国食品药品监督管理局 (FDA) 认证为一般公认安全 (GRAS) 食品[8]。目前市场上已有小球藻藻片、饮料和提取物等功能食品在售。其中最引人注目的是一种被称为“小球藻生长因子 (CGF)”或者“绿藻精”的热水提取物。据报道,“CGF”具有促进细胞生长和病人康复,增强免疫功能等一系列神奇功效[9, 10]。由于“CGF”是多种非脂溶性物质的混合物,从富含油脂的小球藻中提取油脂后,“CGF”将仍然保留在提取油脂后的藻渣中。因此,若从提取油脂之后的藻渣中也能提取到类似“CGF”的高附加值产品,则会大幅降低以小球藻为藻种的微藻能源的生产成本,进一步推动微藻能源产业化的进程。
然而“CGF”这个名称在学术研究领域并不多见。鉴于“CGF”是利用沸水提取的,人们一般称之为小球藻热水提取物 (CE)。CE含有丰富的营养物质[11],研究者认为CE中包含“CGF”以及其他一些无机或有机有效成分。
本文以早期 (1980年之前) 研究发现的“CGF”的神奇功效作为切入点,对近年来CE的活性研究现状进行综述,重点探讨CE研究中存在的问题,为今后从提取油脂后的藻渣中开发类似“CGF”的小球藻高附加值产品提供科学依据。
1 关于“CGF”的早期报道 1.1 “CGF”的发展历程直径3−12 μm的小球藻已经在地球上生存了约几十亿年[12]。自从1890年荷兰微生物学家Beijerinck发现并命名了小球藻,世界各国逐渐展开了各种针对小球藻的研究。由于二战后人口膨胀,20世纪中叶,德、美、日等国家将高蛋白含量的小球藻作为缓解世界粮食紧张问题的“超级食品”进行研究[4]。
1957年日本政府于东京设立日本绿藻研究所,Fujimaki教授在加热后的小球藻细胞悬液中提取到了一种水溶性生物活性物质[10],成为“CGF”发展历程中重要的里程碑 (图1)。由于该物质能够显著促进细胞生长[9, 10],并使乳酸菌 呈4倍增殖[13],因此被命名为“小球藻生长因 子——CGF” [14]。研究发现“CGF”中含有蛋白质、多糖、核苷酸、多肽、维生素和微量元素等多种物质[15],对高血糖[16]、高血压[17]以及重金属中毒患者[18, 19]的身体状况具有显著改善作用。此后,“CGF”相关产品逐渐问世。
小球藻及“CGF”产品在日本、美国和我国台湾地区大受欢迎。“CGF”产品中具有代表性的有日本SUN CHLORELLA公司的“CGF”蜂蜜饮料“Chlorella Wakasa”、美国Shoko’s Natural Products生产的“Crypto Power”“CGF”胶囊、我国台湾绿藻工业公司的“绿寶CGF”以及我国广东绿安奇公司的“绿藻精”系列产品等。
1.3 “CGF”的惊人功效在Fujimaki教授发现“CGF”后,关于小球藻及“CGF”的生物活性研究在日本如火如荼地开展了起来,研究者通过大量基础和临床研究,发现小球藻和“CGF”对人体具有多种显著的调节功能。时至今日,小球藻系列功能食品在日本数以千计的健康食品中排名一直居于前列。
早期研究中“CGF”功能和实例列举如下:
1) 促进生长:1965年Okuda等发现“CGF”能够促进四膜虫生长[21],随后他们又报道了“CGF”对酵母[22]以及溶藻弧菌[23]生长的促进作用;而Takada等发现“CGF”能提高酵母在高盐环境中的生存能力 (1984年)[24];Nakashima发现“CGF”能够使乳酸菌等有益菌成倍生长[20]。
2) 增强免疫:1962年Takuma报道了一例牛奶过敏婴儿的案例,使用小球藻作为非乳蛋白源可以医治婴儿脸部和颈部的湿疹[25];1972年Kojima等发现“CGF”中的糖蛋白能够增强免疫力,并促进大鼠网状系统对细菌吞噬的作用[26]。
3) 解毒:1975年Ichimura使用小球藻治疗受镉污染影响的日本“痛痛病”患者,发现食用小球藻能够有效排除人体内的重金属[18];同年Ichimura用小球藻治疗我国台湾地区砷中毒的“乌脚病”患者,食用小球藻3个月后,患者病况明显改善[19]。
4) 降血糖、血压:1977年台北医学院生化科研究室发现小球藻对糖尿病花鼠有降血糖作用[16];1978年日本近畿大学医学研究小组Okamoto等发现小球藻碱性提取物[17]及“CGF”中腺苷或低聚肽[27]有良好的降血压效果。
1.4 对惊人功效的质疑虽然前期日本曾有大量报道称食用小球藻和“CGF”有益于人体健康,但由于“CGF”中功能成分不确定、作用机制不详,小球藻和“CGF”产品的开发仍然缺乏扎实的科学依据。此外,商业宣传和研究论文中经常提到,“CGF”能使乳酸菌呈4倍增殖[13]。但笔者追溯其原文,发现该篇由Lin等发表于J Formos Med Assoc的科研论文并未涉及乳酸菌研究[28]。
2 关于CE的国内外研究现状为考察“CGF”活性的科学性,本文对近年来被Elsevier、PubMed、Springer和Wiley等几大数据库收录的相关文献进行了查阅和梳理。如图2所示,从1980年起,陆续有CE活性研究报道刊出,尤其是2010年之后,文献数量逐渐增多,但总体数量未超过百篇 (图2A)。在研究主题上,以免疫调节和抗肿瘤活性研究居多,近年来关于代谢综合征的研究呈增加趋势。在CE活性成分的筛选研究中,常用抗氧化和调节免疫活性为检测指标 (图2B)。全球范围内仅有为数不多的几个CE活性研究团队在上述数据库所收录的期刊上发表过研究论文,其中亚洲是CE研究的集中地。在2000年之前日本研究者开展了较多CE增强小鼠免疫功能的研究;2010年之后,韩国学者的论文逐渐增多 (图2C)。

|
| 图2 近年来国外几大数据库所收录CE研究型报告的年份 (A)、研究主题 (B) 和国家及地区分布 (C). Fig.2 Distribution of recent CE research publications classified in time (A),function (B),and country and region (C). Data were collected from Elsevier,PubMed,Springer,and Wiley. |
国内数据库中关于小球藻生物活性物质的文献较多涉及小球藻多糖和蛋白质分离纯化,但少有文献涉及CE以及小球藻多糖、蛋白质的活性研究。
2.1 活性物质CE的提取和分离纯化CE一般采用热水进行提取。但不同团队所采用的提取条件差异极大。如提取温度,低的采用80 ℃[29],高的可达200 ℃[30];提取时间也从15 min[31]到5 h[30]不等。此外,提取原料的处理方式也存在差异。不少研究者直接用藻粉进行提取[29],也有专利和科研报道提到,他们在提取CE时,事先将藻粉经过了超声[32]、碾磨、冻融[15]、酶解[33]或者高压[31]等预处理。如2004年韩士群的专利中,藻粉经历了温水浸泡、果胶酶-纤维素酶破壁等预处理[33]。东莞市绿安奇生物工程有限公司在将浓缩藻液置于“压力破壁器”后,采用加压后骤然减压的方法,使藻细胞壁破裂[34],而Song等[31]则于121 ℃高压萃取15 min。
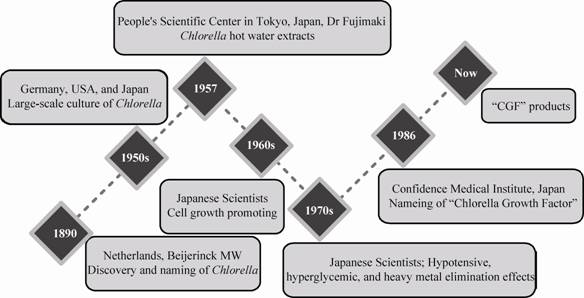
CE主要功能成分至今不明确,功能成分分离纯化研究有待深入。在能查到的资料中,以多聚糖、糖蛋白的纯化研究为主,而纯化方法一般为通用方法;组分分析一般研究总糖、总蛋白含量,或单糖和氨基酸组成等。目前除了加拿大Suárez等报道了3种多糖结构 (图3)[35, 36, 37]外,未见其他相关报道。
小球藻的免疫调节作用一直是研究者们关注的焦点。早期关于CE免疫调节活性的研究多在动物水平展开,以研究CE对体内杀菌、免疫应答以及免疫细胞数的影响为主。近期多在细胞水平展开,以研究CE和多聚糖等物质对各种免疫相关细胞因子水平的影响以及干预免疫应答的机制为主。但许多研究结果互相矛盾,小球藻的调节作用是免疫激活还是免疫抑制至今没有定论。
2.2.1 动物水平研究上世纪90年代,日本和巴西的专家进行了大量有关CE作为一种生物反应调节剂对细菌感染小鼠的免疫保护作用。以Hasegawa为代表的日本研究团队将10% (W/V) 的藻粉在100 ℃煮沸20 min制备CE。据称经口给予这种CE能够增强小鼠骨髓细胞和脾细胞数目,并有效杀灭通过腹腔注射进小鼠体内的大肠杆菌[38];增强正常小鼠和艾滋小鼠对单增李斯特菌感染的抵御能力[39, 40],通过提高众多 细胞因子的表达水平增强小鼠细胞免疫功能[41],并通过产生干扰素-γ (γ-IFN) 加强T辅助细胞1 (Th1) 型免疫应答[42]。巴西学者Queiroz等使用Hasegawa提供的CE进行研究,发现CE能够增强小鼠骨髓祖细胞的集落刺激活性;同时能够恢复单增李斯特菌感染鼠的骨髓粒-巨噬祖细胞数目,并增强其集落刺激活性[43];改善铅诱导的骨髓抑制,提高单增李斯特菌致死剂量下小鼠的存活 率[44];恢复铅处理小鼠骨髓细胞结构和细胞因子的产生能力[45]。
韩士群等采用酶解法制备了CE,发现CE可以明显增强二硝基氟苯引起的小鼠迟发型超敏反应,恢复造血功能,并增强单核-巨噬细胞的吞噬功能[46]。2010年韩国学者An构建了“蛋白-能量营养不良”小鼠模型,以研究CE的免疫调节作用。结果CE喂饲组血清中总蛋白、清蛋白、葡萄糖和γ-IFN等参数上升,脾和浅表淋巴结免疫细胞数目增加[47]。2013年韩国Bae等发现CE能够阻断大鼠腹膜肥大细胞对胞外Ca2+的吸收,阻止细胞脱落和组胺释放;同时CE对变态反应具有抑制作用,在CE治疗下,卵清蛋白免疫的BALB/c小鼠,其γ-IFN和白细胞介素-12 (IL-12) 水平上升,免疫球蛋白E (IgE) 的过剩表达得到抑制[48]。
小球藻多聚糖是CE中颇受关注的成分。2003年Guzmán等以角叉菜胶诱导大鼠足肿胀模型,发现从超声破碎的小球藻C. stigmatophora悬液中制备的多糖具有抗炎活性,而体内外迟发型超敏反应和噬菌活性检测表明,该多糖具有免疫抑制作用[49]。2005年施瑛[50]发现蛋白核小球藻多糖剂量依赖性地调节小鼠的免疫功能,而加拿大Kralovec等[51]将CE经透析、层析处理后得到一种含有25%蛋白质的蛋白聚糖,将该蛋白聚糖用于卵清蛋白诱导的小鼠过敏性气道炎模型,结果在卵清蛋白致敏和刺激过程中,该蛋白聚糖能够显著降低小鼠在体气道嗜酸性细胞、嗜中性粒细胞渗透。而中国台湾Hsu等[52]称小球藻水溶性多聚糖能够增加脂多糖诱导的C57BL/6J小鼠肿瘤坏死因子-α (TNF-α) 和IL-1β血清分泌。
2.2.2 细胞水平研究加拿大学者从事了大量CE有效成分分离纯化及免疫调节活性的研究。Ewart等将藻粉于80 ℃水提1 h后,取分子质量大于12 kDa的上清液制备CE,结果该CE能刺激正常人外周血单核细胞引起一种Th1式细胞因子应答和强烈的抗炎调节细胞因子应答,细胞因子IL-10水平显著增加,同时Th1相关的γ- IFN和TNF-α强烈激活,而Th2的典型因子IL-4和IL-13减少[29],与Hasegawa等[42]动物水平的研究结果一致。2005年Kralovec等[51]用CE中含有25%蛋白质的蛋白聚糖组分处理小鼠骨髓源肥大细胞18 h,结果该组分显著抑制三硝基-牛血清白蛋白诱导的IL-5的产生,并抑制人脐带血源肥大细胞中IgG依赖性的粒-巨噬细胞集落刺激因子形成。2007年,他们发现CE中能够有效刺激小鼠B细胞增殖并活化巨噬细胞的多数免疫刺激活性物质存在于多聚糖/蛋白复合物中,且分子质量一般大于100 kDa[53],但该团队至今未公布该复合物的具体组成。而学者Suárez致力于具有免疫刺激活性的蛋白核小球藻多糖的分离纯化,2005年分离表征了阿拉伯半乳聚糖,并对其结构进行了鉴定[35];2008年得到一种环状葡聚糖[36];2010年研究了磷酸化多聚糖 (图3)[37]。其工作重心为多糖的分离鉴定,在得到了几种重复单位明确的化合物后,运用Griess法间接检测产物对巨噬细胞Raw264.7产生一氧化氮 (NO) 的影响,从而推测其免疫刺激活性。遗憾的是,上述多糖的免疫刺激活性均不高。
中国台湾和韩国学者也报道过CE增强细胞免疫调节功能的研究。与Ewart等[29]不同,2010年韩国An等[47]检测了CE对人T淋巴细胞株MOLT-4和原代脾细胞中细胞因子生成的影响,结果CE作用下两者的IL-2和IL-4生成增加,但对γ-IFN的生成无明显影响。Hsu等[52]在2010年发表的论文中较为深入地报道了蛋白核小球藻多聚糖体外免疫调节信号转换的分子机制。该文研究了小球藻水溶性多聚糖对巨噬细胞J774A.1中细胞因子产生、人白细胞抗原表达和共刺激分子表达的影响,证明多聚糖通过Toll样受体4 (TLR4) 介导的蛋白激酶信号通路引起巨噬细胞IL-1β分泌,从而起到了免疫调节的作用。
2013年王凌等[54]报道,小球藻粗多糖能够有效增加巨噬细胞Raw264.7的增殖能力和吞噬能力,并提高细胞外NO水平。
2.3 CE的抗肿瘤活性 2.3.1 动物水平研究动物水平研究发现,采用Hasegawa方法制备的CE具有显著的肿瘤抑制作用。1984年日本Tanaka所在的研究团队将CE注射到小鼠肿瘤区域或肿瘤附近的皮下组织,通过测量肿瘤直径大小来判断抑癌能力,结果发现无论预防还是治疗,注射CE后肿瘤的生长均受到显著抑制。在无胸腺裸鼠以及注射了巨噬细胞阻断剂的小鼠中,CE的抑癌作用受到抑制或削弱,表明小球藻增加小鼠抗癌能力需要T淋巴细胞和巨噬细胞的参与[55]。1985年他们继续研究CE的抗肿瘤活性,发现接种同源性Meth-A肿瘤细胞的BALB/c小鼠,在腹腔注射CE后存活时间明显延长。而正常小鼠注射CE 24 h后,其富含分叶核白细胞的腹膜流出细胞对小鼠具有抗肿瘤作用,且这种作用在T细胞或巨噬细胞缺失的状态下仍然完好无损[56]。2001年,他们又发现在肿瘤内注射CE对肿瘤自发的和实验诱导的转移均具有显著抑制作用,而皮下注射还能预防抗癌药物引起的骨髓抑制和内部感染[57]。
2.3.2 细胞水平研究与动物水平的研究成果相比,细胞水平的机制研究存在较多问题有待解决。如与一般肿瘤抑制剂相比,CE的有效浓度过高。Wu等[58]将20 mg/mL的藻粉悬液搅拌30 min提取CE,发现CE对肝癌细胞株HepG2的增殖抑制作用十分微弱,未能检测到半致死浓度 (IC50)。马来西亚Yusof研究团队采用Hasegawa的方法制备CE,2006年他们报道了马来西亚小球藻提取物和日本小球藻提取物对HepG2的抑制作用,前者IC50为1.6 mg/mL,后者基本上没有抑制作用,且正常肝细胞WRL68的生长也受到了严重抑制 (IC50约1.7 mg/mL)[59];2010年,他们在前期研究浓度的基础上进一步研究了CE对HepG2细胞的抗增殖和凋亡诱导作用,称CE剂量依赖性地减少HepG2的活细胞数量 (IC50仍为1.6 mg/mL),加剧DNA损伤,提高细胞凋亡率,并推测CE可能通过增加凋亡相关基因P53、Bax和caspas-3的表达,降低Bcl-2的表达而诱导凋亡级联信号,进而引起DNA损伤和细胞凋亡[60]。此外,汪炬等[61]以动物移植性肿瘤肉瘤S180、肝癌HCA腹水瘤为模型,发现CE能够在体内、体外有效抑制上述两种肿瘤,与环磷酰胺也有良好的联合作用。
1996年Hasegawa研究团队发现,从小球藻培养液中提取的ARS-2是一个分子质量63.1 kDa的糖蛋白,其中蛋白质组分是其具有抗肿瘤活性的关键[62]。2002年他们研究了ARS-2对TLR2或TLR4功能基因敲除鼠产生IL-12 p40亚基的影响,发现前者的p40水平受到显著抑制,而后者反而升高,推测水溶性小球藻糖蛋白的抗肿瘤活性至少部分涉及TLR2[63]。2008年魏文志[12]以体外筛选化学预防剂的转基因细胞模型为工具,发现CE中分子质量约63.7 kDa的糖 蛋白具有肿瘤预防作用,其最佳浓度在 200 μg/mL,且存在剂量效应关系。
2.4 CE对代谢综合征的改善作用2011年谭成玉等[64]使用索氏提取器从10%藻粉悬液中制备CE,发现该CE对α-葡萄糖苷酶的活性具有一定的抑制作用,其IC50为3.14 mg/mL[64]。2004年Hidaka等[11]对大鼠进行了卵巢切除以模拟妇女绝经后的生理状态,发现卵巢切除组大鼠在自由饮用日本MIYABI有限公司的“Miyabi Chlorella 900 CGF solution”7周后,其甘油三酯等血脂水平趋于正常,体重增加也得到了有效控制,认为饮食添加CE可能有益于绝经后妇女体重的控制和脂质代谢的平衡。而韩国Ko等[65]使用碱性蛋白酶对海洋椭圆小球藻的蛋白质进行水解,得到分子质量467.2 Da,氨基酸序列为Val-Glu-Gly-Tyr的片段,该片段对血管紧张素转换酶的IC50为128.4 μmol/L。
在临床试验方面,2001年Merchant等[9]发现饮食中添加小球藻能够改善高血压患者的症状。他们给受试者每日服用SUN CHLORELLA公司的固体藻片和“Wakasa Gold”饮料2个月后,检测了患者的落座舒张压和血脂水平,发现小球藻日常饮食补充能够降低血压和血清胆固醇水平。
2.5 CE的抗氧化活性据报道,不仅小球藻中的亲脂化合物具有显著的抗氧化活性,小球藻水溶性提取物中的多糖、多肽等也具有一定的抗氧化活性。2009年日本Kitada等[30]通过改变提取温度和压力,研究产物的得率和活性,发现随着提取压力增大、温度提高,CE得率得到提高,其抗氧化性也随温度的升高而增强。马来西亚Makpol等[66]在研究过氧化氢 (H2O2) 引起的人成纤维细胞DNA损伤时发现,无论是预防还是治疗,采用Hasegawa方法制备的CE均能降低这种损伤,且对年轻或年老成纤维细胞的氧化损伤具有不同的保护机制:CE对年轻来源的成纤维细胞具有生物保护作用,能使其免遭自由基攻击;而对年老来源的成纤维细胞更多的是生物修复作用。魏文志从CE中分离得到了相对分子质量为63.7 kDa的糖蛋白,其清除羟自由基 (˙OH) 能力高于维生素C,但还原能力、清除超氧阴离子自由基 (O2̅˙)、DPPH自由基 (DPPH˙) 和烷基自由基的能力均低于维生素C[12]。2012年韩国Ko等[67]对海洋椭圆小球藻蛋白进行酶解,通过连续色谱层析分离,制备了一种氨基酸序列为Leu-Asn-Gly-Asp-Val-Trp (702.2 Da) 的新型抗氧化肽,该抗氧化肽能够清除H2O2、DPPH˙和˙OH,IC50分别为0.02、0.92、1.42 mmol/L,并增强自由基引发剂AAPH损伤下正常猴肾细胞的存活率,减少AAPH引起的细胞凋亡和坏 死率。
2.6 CE的抗紫外 (UV) 损伤活性中国台湾学者报道了CE及CE中有关组分在抵御UV损伤和光老化方面的作用。1998年Hsu等使用凝胶迁移率分析从DEAE纤维素层析和肝素亲和层析分离得到CE组分,发现CE中分子质量约为72、80和90 kDa的3个多肽对UV诱导的DNA损伤具有识别结合活性[68]。2008年Shih等[69]将10%成熟鲜小球藻的藻粉于100 ℃提取30 min,得到的CE对皮肤纤维原细胞具有潜在保护作用,能使UVB诱导下培养液中表达增加的基质金属蛋白酶-1 (MMP-1) 水平有效降低,并使表达下降的弹性蛋白和前胶原蛋白mRNA水平正常化。2011年Chen等[70]将皮肤原纤维细胞经UVB照射后,用CE中分子质量430−1 350 kDa的小球藻肽进行处理,发现该小球藻肽能够通过抑制转录因子活化蛋白-1和信号分子富半胱氨酸61的mRNA表达,降低单核细胞趋化蛋白-1水平,从而抑制UVB诱导的MMP-1表达增加,发挥其抗衰老的作用。
2.7 CE影响微生物生长的作用 2.7.1 促进有益菌生长2001年韩士群等[71]研究了CE对微生物生长及生理活动的影响,发现CE具有增加啤酒酵母菌和乳酸菌细胞分裂速度、促进生长的作用 (分别为14.98倍和2.2倍),还能增加啤酒产气量、调节乳酸杆菌与链球菌比例、延长乳酸制品保质期,改善其品质等。2005年胡开辉等[15]使用不同的破壁方法提取CE,同样发现CE具有促进啤酒酵母生长繁殖、加速发酵进程等功能。日本Kanno等[72]从小球藻CK-5藻株中分离得到的642.9 Da的糖蛋白能够促进酵母菌生长。
2.7.2 抑制有害菌陈晓清[73]研究了海水小球藻中粗多糖与粗蛋白的体外抑菌活性,发现多糖提取物抗菌谱比蛋白质提取物抗菌谱广,对中华根霉与稻瘟病菌有极强的抗菌活性;而蛋白质提取物对产黄青霉和中华根霉有较强的抑制作用,对金黄色葡萄球菌和肠炎病原菌也有抑制作用,但其抗真菌活性比抗细菌活性大。
日本Tanaka等[74]发现腹膜、静脉或皮下注射小球藻水溶性高分子量片段 (CE-A),能够提高小鼠对腹膜接种进入体内的大肠杆菌的抵御能力,CE-A的皮下注射还能预防环磷酰胺导致的小鼠对大肠杆菌抵御能力的减弱。而Hasegawa等曾报道口服CE能够减少大肠杆菌感染小鼠各器官中的细菌数[75],增加小鼠白细胞数[38];增强小鼠对单增李斯特菌感染的抵御能力[39]。
2.8 CE的重金属螯合作用2003年,巴西学者Queiroz等[44]使用Hasegawa提供的CE进行研究,发现CE对铅诱导的单增李斯特菌感染小鼠的骨髓抑制具有保护作用。铅诱导同时给予CE的小鼠,其血铅水平在第10天时能够下降至铅对照组的66.03%,而铅诱导之后给予CE则效果明显降低,在第3天和第10天分别降低了13.5%和17.5%。
2.9 CE的护肠作用为佐证小球藻饮食添加在改善溃疡性肠炎患者体征和症状中的潜力,2001年美国Merchant等[9]在弗吉尼亚联邦大学医学院进行了双盲、安慰剂、随机临床试验。该试验中,患者每日服用10 g SUN CHLORELLA公司的纯小球藻片和100 mL含有CE、苹果酸、果糖、柠檬香精和水的“Wakasa Gold”饮料。在连续服用2个月后,评估了溃疡性肠炎患者的疾病活性指数,发现小球藻日常饮食补充能够加速伤口愈合。
韩国Song等[31]研究了CE对正常大鼠肠内皮细胞增殖和相应信号通路的影响,发现CE能增加胰岛素样生长因子的表达,促进粘附斑激酶和蛋白激酶的磷酸化,引起丝裂原-活化蛋白激酶通路和磷酸肌醇3-激酶/Akt通路活化。
2.10 CE的保肝作用慢性肝纤维症若得不到有效控制,可能发展成肝硬化。抑制活化的肝星状细胞 (HSC) 增殖并诱导其凋亡,是一种较为有效的治疗肝纤维化的手段。2005年中国台湾Wu等[58]研究了CE对HSC生长的影响,发现CE能够有效抑制HSC增殖。此外,CE对四氯化碳 (CCl4) 诱导的急性肝损伤具有保护作用。2009年孟楠等[76] CCl4诱导大鼠急性肝损伤模型,研究CE对急性肝损伤的防治作用,结果CE显著降低大鼠血清中丙氨酸氨基转移酶和天冬氨酸氨基转移酶活性,降低肝组织中丙二醛水平,提高肝组织中谷胱甘肽过氧化酶 (GSH-Px) 活性及GSH含量。2013年韩国Li等[77]也研究了CE对CCl4诱导的小鼠急性肝损伤的影响及机制,发现CCl4处理显著增加小鼠血清转氨酶水平和脂质过氧化水平,上调细胞色素P450-2E1表达,并降低GSH浓度和一系列细胞氧化防御系统中酶的活性;而以CE进行预防后上述现象显著扭转。2011年伊朗Sahebkar等[78]通过一项随机临床试验,研究了小球藻膳食补充作为非酒精脂肪肝病人辅助疗法的优点。患者每天联合服用CE (1 200 mg)、二甲双胍 (750 mg) 和维生素E (200 mg) 3个月后,其血清转氨酶、甘油三酯和胰岛素敏感指数水平均得到有效改善。
2.11 CE的其他活性也有学者研究过CE的其他生物活性。例如日本Hasegawa等使小鼠目击其同类被足击,从而造成心理紧张状态,而口服CE能够显著抑制小鼠血清肾上腺酮水平的增加,对小鼠心理紧张所致胸腺细胞凋亡具有预防作用[79]。韩国Kim和An等[80, 81]研究了CE的抗疲劳和增强体质作用。2010年Kim等[80]发现用小球藻麦芽水解产物处理12 d,能显著减少ICR小鼠游泳静止时间,降低血浆中血尿氮水平,而An等[81]也发现,在每天口服CE (0.05−0.15 g/kg) 7 d后,小鼠的游泳静止时间缩短,血尿氮、肌酸激酶和乳酸脱氢酶指标下降。
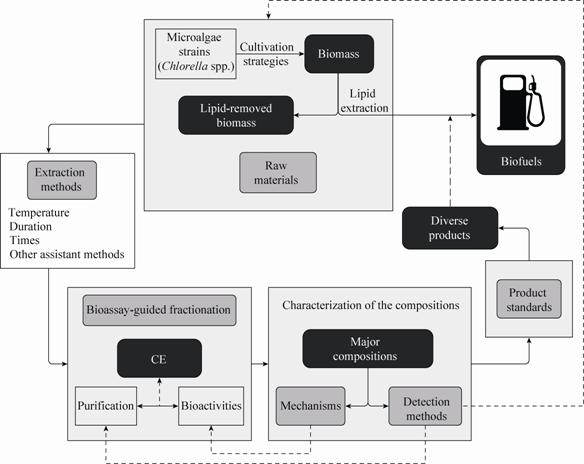
3 CE研究中的主要问题及策略国内外研究表明,CE具有多方面的生物调节功能,是一种值得开发的活性物质。然而,目前国内外的研究水平,与CE以及油脂提取后类似CE的小球藻高附加值生物活性物质的规模化生产和应用之间差距较大。笔者归纳了目前CE研究中需要解决的6个方面的主要问题,包括原料来源、提取方法、活性跟踪筛选技术、主成分活性机制、主成分检测方法以及产品质量标准 (图4)。其中一般CE研究采用的藻粉原料可不经过油脂提取步骤,而若以开发能够平衡微藻能源成本的高附加值产品为目标,则建议研究不同油脂提取工艺对CE及活性的影响。
|
| 图4 CE研究的一般线路图及研究中存在的主要问题 Fig.4 Roadmap and the main problems in CE research. |
不同小球藻来源的CE,其产率和活性也存在差异,如马来西亚学者Saad等[59]曾经报道,日本和马来西亚小球藻来源CE,其抗肿瘤活性存在差异。因此,藻种来源和培养方式对CE的积累也具有较大影响。在小球藻生产过程中,如何控制光照、温度、pH、混合方式以及碳源、氮源、微量元素等条件,从而在积累油脂的同时尽可能多的积累高附加值活性物质,以及不同油脂提取工艺对CE得率和活性的影响等,都是需要深入研究的课题。
3.2 CE提取方法需要统一和改进目前CE提取方法种类繁多,造成了产物活性差异大,难以确定主组分等情况。因此在开发小球藻高附加值产品前,必须对众多CE提取方法进行比较,从中筛选出一种适于工业化生产的方法。例如,由于坚韧细胞壁的存在,从小球藻中提取有效成分存在着是否破壁的问题。Kitada等[30]发现,提取压力和温度对产物得率和活性具有显著影响。纵览国内外文献可以发现,不同研究者提取CE的方法、条件各异:有学者未采用破壁手段;而采用破壁手段的研究者中,有人用酶解破壁、超声破壁,也有人用高压破壁,所得活性物质的成分、含量和功能必然存在差异。
此外,由于小球藻对人体作用十分温和,众多CE药理学研究一直存在着浓度瓶颈,绝大部分报道停留在每毫升数毫克的浓度范围内。例如2008年Shih等[69]发现小球藻组分能够保护UVB诱导的皮肤纤维原细胞损伤,但是该报道中所用的提取物达到了20 mg/mL的极高浓 度。因此,如何改善提取方法从而提高CE的活性是亟待解决的一个问题。
3.3 CE活性跟踪筛选方案有待完善在日本学者进行的大量动物水平和临床研究中,小球藻和CE均具有显著地抑制肿瘤的作用。但Yusof等学者发表的论文中,CE对HepG2的IC50达到1.6 mg/mL[59, 60]。这固然存在提取方法的问题,但活性跟踪筛选过程中检测方法是否合理也值得深入探讨。
有观点认为,CE的抗肿瘤作用可能是通过激活机体的免疫系统而触发的[9],CE的肿瘤抑制作用研究不宜套用常规抗肿瘤药物的筛选模式。笔者建议,在将来的活性跟踪筛选研究中,务必首先考察活性检测方法的可行性和适应性,并建立起合理的活性检测方法。
3.4 CE主要成分及活性作用机制需要明确虽然已有“CGF”/CE产品投入市场,但作为一种水溶性混合物,CE中起关键作用的主要活性成分至今没有确切定论。研究者们曾经推测核酸是CE的主要活性成分,但近期诸多关于小球藻水溶性物质生理功能的报道提示,CE中多肽[70]、多糖[52]和糖肽[63]也各具功效。此外,虽然Suárez等[35, 36, 37]报道了小球藻的3种多糖结构 (图3),但这几种物质对巨噬细胞的免疫调节作用十分微弱,没有足够证据证明这3种多糖是CE的主要活性成分。
由于CE主要活性成分未明确,CE的活性作用机制尚处于研究的初级阶段。例如,CE及其有关组分的免疫调节作用一直是研究者关注的焦点,但没有足够证据证明该调节作用是免疫激活还是免疫抑制,或是双向免疫调节作用。为了今后开发小球藻去油藻渣中CE类似高附加值产品,必须明确CE中主要功能成分的活性作用机制,为在消费者心目中树立信誉提供科学保障。此外,活性作用机制的确定,对于活性跟踪筛选也是一种具有指导性意义的反馈,有利于活性检测方法的改进和完善。
3.5 CE主要成分鉴定方法有待确立鉴于CE是一种包含了蛋白质、多糖、核酸、多肽、维生素和微量元素等多种物质的混合 物[11],其多样化的物质组成可能是CE具有多种功效的原因。因此,在合理的提取方法和活性筛选模式建立之后,应当加大力度,以生物活性为导向,研究CE中具有不同活性的多种主要功能成分,并明确其结构和理化性质,以进一步建立主成分的检测方法。主成分检测方法的建立,对于活性跟踪筛选,分离提取工艺,原料藻种的选育、培养和前处理同样具有指导意义。
3.6 CE的质量标准需规范化虽然市场上已经有许多“CGF”/CE样产品,但由于主要功能成分不明确,缺乏合理的产品标准。据科研和专利文献报道,现有评价CE质量的检测手段为样品溶液在260 nm处的光密度值 (OD)[11, 82]。众所周知,核酸分子由于含有嘌呤环和嘧啶环的共轭双键,在260 nm处具有特异性的吸收峰,其浓度与OD260呈正相关。OD260这一评价指标适用于CE研究初期,即以核酸为主要功能性成分的时期。近几年,随着研究的深入,不断有关于小球藻水溶性物质中的多 肽[70]、多糖[52]和糖肽[63]生理功能的报道,该指标逐渐显得单一而过时。若需开发多样化的CE产品,其检测标准也应该进行相应调整。因此,在明确CE的主要活性成分后,必须按照活性成分的理化性质和活性特征对产品进行规范,建立合理、统一的产品标准,从而实现CE产品的规范化管理。
4 总结与展望小球藻是一种为人们所钟爱的产品,CE的提取技术及其生物活性研究,是当前欧、美、日和我国台湾地区开发小球藻的热点所在。迄今为止,国内外关于小球藻、CE及其中某些组分,如多糖和糖蛋白的生物活性研究几乎涉及到各个领域,且正面报道居多,表明CE是一种值得开发的活性物质。但目前总体研究程度不深,全球的研究团队屈指可数,CE活性成分至今不明确。在实现CE产品规模化生产之前,需要解决藻粉原料的培养和前处理工艺、高效率的提取方法、合理可行的活性跟踪筛选技术、主成分及活性机制、主成分检测方法、以及产品质量标准等6个方面的问题。建议加大投入,针对上述6方面问题进行深入的研究,从而为CE产品的广泛应用奠定基础,同时也可为将来从提取油脂后的小球藻中制备类似CE的高附加值产品提供依据。上述问题的解决不仅可以推动小球藻产业的大发展,特别是CE的产业化,而且有望推动以小球藻为藻种的微藻能源及微藻固碳这一战略性新兴产业的发展。
| [1] | Brennan L, Owende P. Biofuels from microalgae—a review of technologies for production, processing, and extractions of biofuels and co-products. Renew Sust Energ Rev, 2010, 14(2): 557-577. |
| [2] |
Huang YM, Wang WL, Li YG, et al. Strategies for research and development and commercial production of microalgae bioenergy. Chin J Biotech, 2010, 26(7): 907-913 (in Chinese). 黄英明, 王伟良, 李元广, 等. 微藻能源技术开发和产业化的发展思路与策略. 生物工程学报, 2010, 26(7): 907-913. |
| [3] | Rioboo C, O'Connor JE, Prado R, et al. Cell proliferation alterations in Chlorella cells under stress conditions. Aquat Toxicol, 2009, 94(3): 229-237. |
| [4] | Powell RC, Nevels EM, McDowell ME. Algae feeding in humans. J Nutr, 1961, 75(1): 7-12. |
| [5] | Burlew JS. Current status of the large-scale culture of algae/Algal Culture from Laboratory to Pilot Plant. 1st ed. Washington DC.: Camegie Institute of Washington Publication, 1953: 3-23. |
| [6] | Fan J, Huang J, Li Y, et al. Sequential heterotrophy-dilution- photoinduction cultivation for efficient microalgal biomass and lipid production. Bioresource Technol, 2012, 112: 206-211. |
| [7] | 关于批准蛋白核小球藻等4种新资源食品的公告(2012年第19号) [EB/OL]. 2012-12-13.http://www.moh.gov.cn/sps/s7891/201212/5d4c82e89a9e4713aba8f782eca51e09.shtml. |
| [8] | Chlorella protothecoides strain S106 flour with 40−70% lipid (algal flour) (GRAS Notice No. GRN 000469) [EB/OL]. 2013-06-07. http://www.fda.gov/Food/IngredientsPackagingLabeling/GRAS/NoticeInventory/ucm361155.htm. |
| [9] | Merchant RE, Andre CA. A review of recent clinical trials of the nutritional supplement Chlorella pyrenoidosa in the treatment of fibromyalgia, hypertension, and ulcerative colitis. Altern Ther Health M, 2001, 7(3): 79-90. |
| [10] | Bewicke D. Chlorella: the Emerald Food. 1st ed. Berkeley, CA: Ronin Publishing, 1984: 21. |
| [11] | Hidaka S, Okamoto Y, Arita M. A hot water extract of Chlorella pyrenoidosa reduces body weight and serum lipids in ovariectomized rats. Phytother Res, 2004, 18(2): 164-168. |
| [12] |
Wei WZ. The isolation, purification and screening of the tumor prevention in vitro of glycoprotein from Chlorella pyrenoidosa [D]. Wuxi: Jiangnan University, 2008 (in Chinese). 魏文志. 小球藻糖蛋白的分离纯化与体外预防肿瘤作用筛选的研究 [D]. 无锡: 江南大学, 2008. |
| [13] | Yan L, Lim SU, Kim IH. Effect of fermented Chlorella supplementation on growth performance, nutrient digestibility, blood characteristics, fecal microbial and fecal noxious gas content in growing pigs. Asian-Aust J Anim Sci, 2012, 25(12): 1742-1747. |
| [14] |
Hao ZD, Yang LY, Guang XX, et al. Research progress in active components of Chlorella. Sci Tech Food Ind, 2010, 31(12): 4-7 (in Chinese). 郝宗娣, 刘洋洋, 续晓光, 等. 小球藻 (Chlorella) 活性成分的研究进展. 食品工业科技, 2010, 31(12): 4-7. |
| [15] |
Hu KH, Zhou SY. Extraction of active substance from Chlorella vulgaris cells and its physiological effects on Saccharomyces cerevisiae. Chin J Appl Ecol, 2005, 16(8): 1572-1576 (in Chinese). 胡开辉, 周山勇. 小球藻细胞活性物质的提取及对啤酒酵母的生理效应. 应用生态学报, 2005, 16(8): 1572-1576. |
| [16] |
Lee HT, Lai JE, Tung YC. Hypoglycemic action of Cholrella. J Formos Med Assoc, 1977, 76: 272-276 (in Chinese). 李宏图, 赖精二, 董一致. 绿藻之降血糖作用. 台湾医志, 1977, 76: 272-276. |
| [17] | Okamoto K, Iizuka Y, Murakami T, et al. Effects of Chlorella alkali extract on blood pressure in SHR. Jpn Heart J, 1978, 19(4): 622-623. |
| [18] | Hagino N, Ichimura S. Effect of Chlorella on fecal and urinary cadmium excretion in 'Itai-itai' disease. Nihon eiseigaku zasshi, 1975, 30(1): 77. |
| [19] | Ichimura S. Effect of Chlorella on skin cancer of Black Foot patients in south Formosa. Nihon Eiseigaku Zasshi, 1975, 30(1): 66. |
| [20] | Nakashima A. Growth stimulating substances in green algae 'Enteromorpha prolifera' for lactiv acid bacteria. Bull Fukuoka Wom Jun Coll, 1977, 14: 103-118. |
| [21] |
Okuda M. Extract of Chlorella cells as Tetrahymena growth factor (CGF). Physiol Ecol Jpn, 1965, 13(1): 43-48 (in Japanese). 奥田正男. テトラヒメナの成長因子としてのクロレラ藻体抽出物(CGF). 生理生態刊行会, 1965, 13(1): 43-48. |
| [22] |
Okuda M. Biological activities and chemical properties of Chlorella extract. Physiol Ecol Jpn, 1969, 15(2): 101-112 (in Japanese). 奥田正男. 明培養クロレラエキスの化学的性質と生理活性. 生理生態刊行会, 1969, 15(2): 101-112. |
| [23] | Morishita H, Sano T, Kamiya N, et al. Growth-stimulating substances for Vibrio alginolyticus contained in Chlorella extract. Nippon Suisan Gakk, 1978, 44(6): 665-671. |
| [24] | Takenishi M, Takada H. Difference between sodium chloride- and lithium chloride-hypertonicities in promotive effect of Chlorella-extract on growth of respiratory deficient mutant of yeast. J Tezukayama Jr Coll Nat Sci, 1984, 21: 1-6. |
| [25] |
Takuma K. Using Chlorella as non-milk protein source for infant. Jpn J pediatr, 1962, 15(5): 456-466 (in Japanese). 詫摩武人. クロレラを蛋白源に用いた乳児無乳栄養の試み. 小児科臨床, 1962, 15(5): 456-466. |
| [26] |
Kojima M, Ino S, Takase N, et al. Extraction of an active polysaccharide from Chlorella cells and its stimulative effect on phagocytotic activity of rat roticuloendotholial system. Nippon Nōgeikagaku Kaishi, 1972, 46(8): 373-380 (in Japanese). 小島瑞, 猪野茂, 高瀬信夫, 等. クロレラより抽出される活性多糖体と網内系機能貧食能におよぼす効果について. 日本農芸化学会誌, 1972, 46(8): 373?380. |
| [27] |
Murakami T, Iizuka Y, Matsubara Y, et al. Isolation and identification of hypotensive substances in Chlorella extract. Med J Kinki University, 1980, 5(3): 119-130 (in Japanese). 村上哲男, 飯塚義富, 松原義治. クロレラエキスに含まれる血圧降下物質の分離?同定. 近畿大学医学雑誌, 1980, 5(3): 119-130. |
| [28] | Lin Y. The supplementary effect of algae on the nutritive value of soybean milk. J Formos Med Assoc, 1969, 68(1): 15-21. |
| [29] | Ewart HS, Bloch O, Girouard GS, et al. Stimulation of cytokine production in human peripheral blood mononuclear cells by an aqueous Chlorella extract. Planta Med, 2007, 73(8): 762-768. |
| [30] | Kitada K, Machmudah S, Sasaki M, et al. Antioxidant and antibacterial activity of nutraceutical compounds from Chlorella vulgaris extracted in hydrothermal condition. Sep Sci Technol, 2009, 44(5): 1228-1239. |
| [31] | Song S, Kim I, Nam T. Effect of a hot water extract of Chlorella vulgaris on proliferation of IEC-6 cells. Int J Mol Med, 2012, 29(5): 741-746. |
| [32] | Shi Y, Sheng J, Yang F, et al. Purification and identification of polysaccharide derived from Chlorella pyrenoidosa. Food Chem, 2007, 103(1): 101-105. |
| [33] |
Han SQ. Extraction method for preparing Chlorella growth factor (CGF): CN, 1164762C. 2004-09-01 (in Chinese). 韩士群. 小球藻生长因子 (小球藻精、CGF)提取方法: 中国, 1164762C. 2004-09-01. |
| [34] |
Tang YQ, Fan Y, Fan WQ. Using high pressure method to break cell wall and the preparation of nucleotide, protein, polysaccharide, and dried powder products from Chlorella: CN, 101053577A. 2007-10-17 (in Chinese). 汤永强, 范宇, 范伟权. 小球藻压力破壁及核苷酸、蛋白质、多糖、藻干粉的制取方法: 中国, 101053577A. 2007-10-17. |
| [35] | Suárez ER, Kralovec JA, Noseda MD, et al. Isolation, characterization and structural determination of a unique type of arabinogalactan from an immunostimulatory extract of Chlorella pyrenoidosa. Carbohyd Res, 2005, 340(8): 1489-1498. |
| [36] | Suárez ER, Bugden SM, Kai FB, et al. First isolation and structural determination of cyclic β-(1→2)-glucans from an alga, Chlorella pyrenoidosa. Carbohyd Res, 2008, 343(15): 2623-2633. |
| [37] | Suárez ER, Kralovec JA, Bruce Grindley T. Isolation of phosphorylated polysaccharides from algae: the immunostimulatory principle of Chlorella pyrenoidosa. Carbohyd Res, 2010, 345(9): 1190-1204. |
| [38] | Hasegawa T, Yoshikai Y, Okuda M, et al. Accelerated restoration of the leukocyte number and augmented resistance against Eschericia coli in cyclophosphamide-treated rats orally administered with a hot water extract of Chlorella vulgaris. Int J Immunopharm, 1990, 12(8): 883-891. |
| [39] | Hasegawa T, Okuda M, Nomoto K, et al. Augmentation of the resistance against Listeria monocytogenes by oral administration of a hot water extract of Chlorella vulgaris in mice. Immunopharm Immunot, 1994, 16(2): 191-202. |
| [40] | Hasegawa T, Okuda M, Makino M, et al. Hot water extracts of Chlorella vulgaris reduce opportunistic infection with Listeria monocytogenes in C57BL/6 mice infected with LP-BM5 murine leukemia viruses. Int J Immunopharm, 1995, 17(6): 505-512. |
| [41] | Hasegawa T, Kimura Y, Hiromatsu K, et al. Effect of hot water extract of Chlorella vulgaris on cytokine expression patterns in mice with murine acquired immunodeficiency syndrome after infection with Listeria monocytogenes. Immunopharmacology, 1997, 35(3): 273-282. |
| [42] | Hasegawa T, Ito K, Ueno S, et al. Oral administration of hot water extracts of Chlorella vulgaris reduces IgE production against milk casein in mice. Int J Immunopharm, 1999, 21(5): 311-323. |
| [43] | Dantas DCM, Queiroz MLS. Effects of Chlorella vulgaris on bone marrow progenitor cells of mice infected with Listeria monocytogenes. Int J Immunopharm, 1999, 21(8): 499-508. |
| [44] | Queiroz MLS, Rodrigues APO, Bincoletto C, et al. Protective effects of Chlorella vulgaris in lead-exposed mice infected with Listeria monocytogenes. Int Immunopharmacol, 2003, 3(6): 889-900. |
| [45] | Queiroz MLS, Rocha MCD, Torello CO, et al. Chlorella vulgaris restores bone marrow cellularity and cytokine production in lead-exposed mice. Food Chem Toxicol, 2011, 49(11): 2934-2941. |
| [46] |
Han SQ, Zhang ZH, Liu HQ. Effects of Chlorella growth factor on physiological function. Chin J Biochem Pharm, 2004, 25(1): 5-7 (in Chinese). 韩士群, 张振华, 刘海琴. 小球藻生长因子对免疫功能的影响. 中国生化药物杂志, 2004, 25(1): 5-7. |
| [47] | An H, Rim H, Jeong H, et al. Hot water extracts of Chlorella vulgaris improve immune function in protein-deficient weanling mice and immune cells. Immunopharm Immunot, 2010, 32(4): 585-592. |
| [48] | Bae M, Shin HS, Chai OH, et al. Inhibitory effect of unicellular green algae (Chlorella vulgaris) water extract on allergic immune response. J Sci Food Agr, 2013, 93(12): 3133-3136. |
| [49] | Guzmán S, Gato A, Lamela M, et al. Anti-inflammatory and immunomodulatory activities of polysaccharide from Chlorella stigmatophora and Phaeodactylum tricornutum. Phytother Res, 2003, 17(6): 665-670. |
| [50] |
Shi Y. Preparation of polysaccharide from Chlorella pyrenoidosa and its immunoenhancement effect [D]. Nanjing: Nanjing Agricultural University, 2005 (in Chinese). 施瑛. 蛋白核小球藻多糖制备及其增强免疫功能的研究 [D]. 南京: 南京农业大学, 2005. |
| [51] | Kralovec JA, Power MR, Liu F, et al. An aqueous Chlorella extract inhibits IL-5 production by mast cells in vitro and reduces ovalbumin-induced eosinophil infiltration in the airway in mice in vivo. Int Immunopharmacol, 2005, 5(4): 689-698. |
| [52] | Hsu H, Jeyashoke N, Yeh C, et al. Immunostimulatory bioactivity of algal polysaccharides from Chlorella pyrenoidosa activates macrophages via Toll-like receptor 4. J Agr Food Chem, 2010, 58(2): 927-936. |
| [53] | Kralovec JA, Metera KL, Kumar JR, et al. Immunostimulatory principles from Chlorella pyrenoidosa—Part 1: Isolation and biological assessment in vitro. Phytomedicine, 2007, 14(1): 57-64. |
| [54] |
Wang L, Sun LQ, Zhou Y. Immunomodulation activities in vitro of polysaccharides from Chlorella sp.. Food Res Dev, 2013, 34(7): 30-33 (in Chinese). 王凌, 孙利芹, 周妍. 小球藻多糖体外免疫调节活性研究. 食品研究与开发, 2013, 34(7): 30-33. |
| [55] | Tanaka K, Konishi F, Himeno K, et al. Augmentation of antitumor resistance by a strain of unicellular green algae, Chlorella vulgaris. Cancer Immunol Immun, 1984, 17(2): 90-94. |
| [56] | Konishi F, Tanaka K, Himeno K, et al. Antitumor effect induced by a hot water extract of Chlorella vulgaris (CE): resistance to Meth-A tumor growth mediated by CE-induced polymorphonuclear leukocytes. Cancer Immunol Immun, 1985, 19(2): 73-78. |
| [57] | Tanaka K, Shoyama Y, Yamada A, et al. Immunopotentiating effects of a glycoprotein from Chlorella vulgaris strain CK and its characteristics. Stud Natur Prod Chem, 2001, 25: 429-458. |
| [58] | Wu L, Ho JA, Shieh M, et al. Antioxidant and antiproliferative activities of Spirulina and Chlorella water extracts. J Agr Food Chem, 2005, 53(10): 4207-4212. |
| [59] | Saad SM, Yusof YAM, Ngah WZW. Comparison between locally produced Chlorella vulgaris and Chlorella vulgaris from Japan on proliferation and apoptosis of liver cancer cell line, HepG2. Malays J Biochem Molec Biol, 2006, 13(1): 32-36. |
| [60] | Yusof YAM, Saad SM, Makpol S, et al. Hot water extract of Chlorella vulgaris induced DNA damage and apoptosis. Clinics, 2010, 65(12): 1371-1377. |
| [61] |
Wang J, Pu HL, Hong A, et al. Study on the antitumor effect and immune modulation of extract from Chlorella pyrenoidosa chick. Acta Nutrim Sin, 2004, 26(2): 136-138 (in Chinese). 汪炬, 蒲含林, 洪岸, 等. 蛋白核小球藻提取物的抑瘤作用及对免疫功能的影响. 营养学报, 2004, 26(2): 136-138. |
| [62] | Noda K, Ohno N, Tanaka K, et al. A water-soluble antitumor glycoprotein from Chlorella vulgaris. Planta Med, 1996, 62(5): 423-426. |
| [63] | Hasegawa T, Matsuguchi T, Noda K, et al. Toll-like receptor 2 is at least partly involved in the antitumor activity of glycoprotein from Chlorella vulgaris. Int Immunopharmacol, 2002, 2(4): 579-589. |
| [64] |
Tan CY, Zhao Y, Wu D, et al. Study on the culture conditions of Chlorella spp. and its inhibitory activity on α-glucosidase. Fine Spec Chem, 2011, 19(8): 30-33 (in Chinese). 谭成玉, 赵莹, 吴迪, 等. 小球藻培养条件及其抑制α-葡萄糖苷酶活性的研究. 精细与专用化学品, 2011, 19(8): 30-33. |
| [65] | Ko S, Kang N, Kim E, et al. A novel angiotensin I-converting enzyme (ACE) inhibitory peptide from a marine Chlorella ellipsoidea and its antihypertensive effect in spontaneously hypertensive rats. Process Biochem, 2012, 47(12): 2005-2011. |
| [66] | Makpol S, Yaacob N, Zainuddin A, et al. Chlorella vulgaris modulates hydrogen peroxide-induced DNA damage and telomere shortening of human fibroblasts derived from different aged individuals. Afr J Tradit Complem, 2009, 6(4): 560-572. |
| [67] | Ko S, Kim D, Jeon Y. Protective effect of a novel antioxidative peptide purified from a marine Chlorella ellipsoidea protein against free radical-induced oxidative stress. Food Chem Toxicol, 2012, 50(7): 2294-2302. |
| [68] | Hsu T, Ho J, Chao C. Purification of a UV-damaged-DNA binding activity from cell-free extracts of unicellular alga Chlorella pyrenoidosa. Plant Sci, 1998, 138(2): 137-147. |
| [69] | Shih M, Cherng J. Potential protective effect of fresh grown unicellular green algae component (resilient factor) against PMA- and UVB-induced MMP1 expression in skin fibroblasts. Eur J Dermatol, 2008, 18(3): 303-307. |
| [70] | Chen C, Liou S, Chen S, et al. Protective effects of Chlorella-derived peptide on UVB-induced production of MMP-1 and degradation of procollagen genes in human skin fibroblasts. Regul Toxicol Pharm, 2011, 60(1): 112-119. |
| [71] |
Han SQ, Chang ZZ, Zheng Q. Effect of Chlorella growth factor on the fermentation of Saccharomycete and Lactobacillus. Food Sci, 2001, 22(10): 54-56 (in Chinese). 韩士群, 常志州, 郑勤. 小球藻生长因子对啤酒和乳酸发酵的影响. 食品科学, 2001, 22(10): 54-56. |
| [72] | Kanno T, Shinpo K, Masada M, et al. Growth-promoting factor for yeast from an extract of Chlorella vulgaris CK-5. J Ferment Bioeng, 1996, 81(6): 577. |
| [73] |
Chen XQ. Study on purification and partial biological activities of the polysaccharides and proteins from two microaigae [D]. Fuzhou: Fujian Normal University, 2005 (in Chinese). 陈晓清. 二种微藻多糖和蛋白质的纯化及部分生物活性研究 [D]. 福州: 福建师范大学, 2005. |
| [74] | Tanaka K, Koga T, Konishi F, et al. Augmentation of host defense by a unicellular green alga, Chlorella vulgaris, to Escherichia coli infection. Infect Immun, 1986, 53(2): 267-271. |
| [75] | Hasegawa T, Tanaka K, Ueno K, et al. Augmentation of the resistance against Escherichia coli by oral administration of a hot water extract of Chlorella vulgaris in rats. Int J Immunopharm, 1989, 11(8): 971-976. |
| [76] |
Meng N, Huang YJ, Kim YH, et al. Hepatoprotective effect of aqueous extract of Chlorella vulgaris against acute hepatic injury in rats. Lishizhen Med Mater Med Res, 2009, 20(1): 163-164 (in Chinese). 孟楠, 黄裕景, 金容镐, 等. 小球藻提取物对大鼠急性肝损伤的保护作用. 时珍国医国药, 2009, 20(1): 163-164. |
| [77] | Li L, Li W, Kim Y, et al. Chlorella vulgaris extract ameliorates carbon tetrachloride-induced acute hepatic injury in mice. Exp Toxicol Pathol, 2013, 65(1/2): 73-80. |
| [78] | Sahebkar A, Panahi Y, Mohammad EG, et al. Investigation of the effects of Chlorella vulgaris supplementation in patients with non-alcoholic fatty liver disease: a randomized clinical trial. Clin Biochem, 2011, 44(13): S113-S114. |
| [79] | Hasegawa T, Noda K, Kumamoto S, et al. Chlorella vulgaris culture supernatant (CVS) reduces psychological stress-induced apoptosis in thymocytes of mice. Int J Immunopharm, 2000, 22(11): 877-885. |
| [80] | Kim N, Kim K, Jeong H, et al. Effects of hydrolyzed Chlorella vulgaris by malted barley on the immunomodulatory response in ICR mice and in Molt-4 cells. J Sci Food Agr, 2010, 90(9): 1551-1556. |
| [81] | An H, Choi H, Park H, et al. Oral administration of hot water extracts of Chlorella vulgaris increases physical stamina in mice. Ann Nutr Metab, 2006, 50(4): 380-386. |
| [82] | Ichinose T, Naoki Y, Mizoguchi T, et al. Composition for drinking/eating and beverage/food: US, 6627201. 2003-09-30. |
 2015, Vol. 31
2015, Vol. 31