中国科学院微生物研究所,中国微生物学会
文章信息
- 杨晨远, 于子川, 秦迪, 高媛媛. 2024
- YANG Chenyuan, YU Zichuan, QIN Di, GAO Yuanyuan.
- 抗菌肽的结构分析、抗菌机制及改造应用的研究进展
- Research progress in structures, mechanisms, and modification of antimicrobial peptides
- 微生物学报, 64(7): 2242-2259
- Acta Microbiologica Sinica, 64(7): 2242-2259
-
文章历史
- 收稿日期:2023-12-31
- 网络出版日期:2024-04-26
2. 山东第二医科大学生命科学与技术学院, 山东 潍坊 261053;
3. 山东第二医科大学药学院, 山东 潍坊 261053
2. School of Life Science and Technology, Shandong Second Medical University, Weifang 261053, Shandong, China;
3. School of Pharmacy, Shandong Second Medical University, Weifang 261053, Shandong, China
抗生素是对抗细菌感染性疾病的强效武器。随着传统抗生素疗法的普及甚至滥用,耐药菌株的种类和数量飞速增长,细菌感染的死亡率也逐年上升[1]。抗菌肽(antimicrobial peptides, AMPs)是广泛存在于生物体内的一种具有生物活性的小分子多肽,通常由12−50个氨基酸残基组成,无高度保守的序列,大多数是短的、两亲性的、高度阳离子的分子[2]。它们是先天免疫系统的重要效应器,是抵御病原体感染的第一道防线[3]。抗菌肽及其类似物(或衍生物)有着独特的抗菌机制和广谱抗菌效果[4],因此受到越来越多的关注。目前普遍认为,抗菌肽是通过破坏细菌的完整性而起到直接杀菌作用,相比于传统抗生素,抗菌肽有着丰富的微生物靶点,因此几乎不产生耐药性。某些抗菌肽还能杀灭部分病毒、真菌和癌细胞,同时对真核细胞具有细胞毒性低、热稳定性强、溶解度高和分子量低等优点[5]。因此,抗菌肽有着良好的医学应用前景。
然而,抗菌肽的临床应用因其特殊的化学属性而受到限制:应用于人体的抗菌肽会在短时间内被蛋白酶降解;高电荷肽有着潜在的细胞毒性;肽的开发制造成本相对较高等[5]。研究者通过化学修饰抗菌肽的分子结构,或利用高分子材料负载抗菌肽,以期优化功能。改良后的抗菌肽规避了部分缺点,但其抗菌活性也受到了一定影响[6]。可见,抗菌肽的普及应用仍然任重而道远。
本文将从抗菌肽的天然来源与结构特征入手,通过分析多肽分子结构及其所对应的抗菌机制,以及在现有结构基础上如何修饰改良,为进一步改造抗菌肽、开发其临床应用潜力提供启示。这或将对治疗细菌感染、抑制耐药性进展产生重要意义。
1 天然抗菌肽的来源1954年,Haberman从蜂毒中发现蜂毒肽,这是第一种真正意义上的抗菌肽[7]。据报道,截至目前,所有已研究的无脊椎动物的免疫系统中均含有抗菌肽,其中大多数抗菌肽实际上起源于真核生物[8]。同时,抗菌肽数据库(DRAMP, http://dramp.cpu-bioinfor.org/)已收录了高达6 107种常规抗菌肽(包含天然与合成抗菌肽),根据其来源可分为五大类:噬菌体抗菌肽、细菌源性抗菌肽、真菌源性抗菌肽、植物源性抗菌肽和动物源性抗菌肽(表 1)。
| Class | Peptide | Source | Reference |
| Bacteriophage AMPs | Lysins | Bacteriophages | [9] |
| VAPGHs | |||
| Depolymerases | |||
| Bacterial AMPs | Polymyxin | Paenibacillus polymyxa | [10] |
| Colicin | Escherichia coli | [10] | |
| Fungal AMPs | Alamethicin | Trichoderma viride | [11] |
| Plectasin | Pseudoplectania nigrella | [11] | |
| Plant derived AMPs | Defensins γ1-P | Triticum turgidum | [12] |
| α-hairpinins | Alternanthera sessilis | [13] | |
| Animal derived AMPs | α-defensins | Mammals | |
| β-defensins | Mammals | [14] | |
| θ-defensins | Macaca mulatta | ||
| Cathelicidins-AMPs | |||
| LL-37 | Human | ||
| Magainins | Xenopus laevis | [15] | |
| Cecropins | Insects | ||
| OH-CATH | Ophiophagus hannah | [16] | |
| BF | Bungarus fasciatus | [17] |
经过对以上信息的梳理,我们不难发现:抗菌肽在自然界中广泛存在,它们参与构成了几乎所有类型生物的非特异性免疫,而非特异性免疫又是大多数生物体的主要免疫方式。因此,抗菌肽在生物先天免疫系统中扮演着重要的角色。目前,对真核生物抗菌肽的研究最为深入。例如,与人类关系密切的cathelicidins抗菌肽,是在免疫细胞分泌颗粒中发现的阳离子抗菌肽,在被弹性蛋白酶和其他蛋白酶切割时得到激活;这种阳离子宿主防御肽可以通过直接杀灭细菌和调节宿主免疫反应来控制感染,并能抑制炎症加重以控制病情,在先天免疫系统中发挥了重要作用[18]。
以上抗菌肽均是自然选择保留下来的天然抗菌肽,来源之繁杂、分布之广泛暗示了其强大的抗菌作用与不可或缺的免疫功能。通过剖析抗菌肽的结构特征对于深入了解其抗菌机制与拓宽其改造思路有着重要意义,在抗生素滥用、耐药菌遍布全球的今天尤为重要。
2 天然抗菌肽的结构特征天然抗菌肽的长度在10−100个氨基酸残基之间,大多数少于50个氨基酸[2]。值得注意的是,肽的长度对于其抗菌效力来说至关重要。Deslouches等[19]通过比对同种类、不同长度抗菌肽的二级结构含量和最小杀菌浓度发现,形成抗菌螺旋(如α-螺旋和β-折叠)的趋势随着肽长度的减少而减少,而且螺旋含量>80%时才可视为与抗菌活性有关联。这些数据表明,由于肽链的缩短,肽形成二级结构的倾向会降低,增加肽链长度有利于抗菌螺旋的形成,而抗菌螺旋含量的增加将直接提升抗菌肽的抗菌性能。
大多数天然抗菌肽的两端都含有亲水性和疏水性残基,并且多为带有净正电荷的阳离子肽[2]。这表明,无论抗菌肽的结构差异有多大,真核生物所产生的抗菌肽在发挥抗菌作用时,都依赖于其两亲基团和正电荷的活性。此外,有研究表明,一些抗菌肽分子在水环境中没有二级结构,但当暴露于细菌细胞膜后,它们会形成特定的抗菌二级结构[20]。根据这些二级结构的特点可将抗菌肽分成多个亚类,如α-螺旋结构、β-折叠结构、混合结构、环肽和延伸结构等(图 1)。
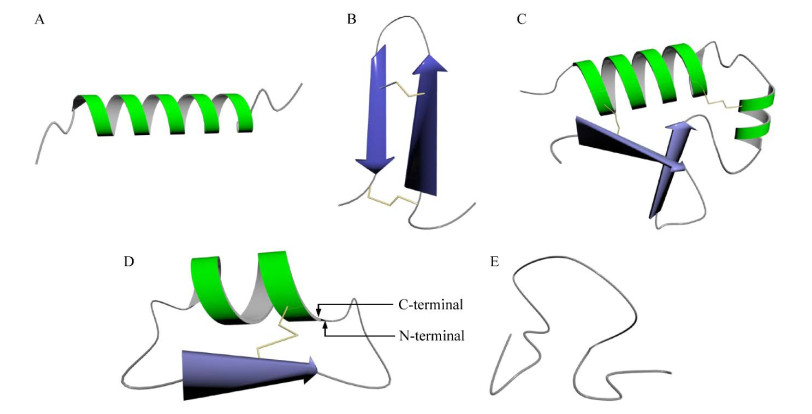
|
| 图 1 抗菌肽的二级结构 Figure 1 Secondary structures of AMPs. A: α-helix. B: β-sheet. C: αβ mixed. D: Cyclic AMPs. E: Stretched structures. |
2.1 α-螺旋
α-螺旋是天然抗菌肽中最常见的二级结构,以cecropins、pleurocidin和melittin最具有代表性。天然抗菌肽中的α-螺旋是右旋的,其稳定性和连接方式主要依赖于氢键与范德华力;相邻匝间距为0.54 nm,每个氢键的长度为0.28 nm[21]。Lei等[22]的研究表明,α-螺旋结构的形成高度依赖于肽与靶细胞膜的相互作用,此时的构象变化将亲水与疏水残基分离到N端和C端,于是α-螺旋肽在结构上具有了两亲性。带正电的两亲性α-螺旋和带负电的细菌膜磷脂分子通过静电作用结合,α-螺旋在膜中形成束,疏水端与膜相互作用,亲水端进入细菌胞内,形成跨膜孔隙,诱导细菌死亡。由此可见,α-螺旋含量增高,抗菌肽的杀菌作用也会相应增强。
2.2 β-折叠另一类抗菌肽如protegrin-1、tachyplesin、lactoferricin和θ-防御素等,含有β-折叠结构,其中至少包含有2条β链,它们之间通过二硫键连接,形成β-发夹状构象;根据2条β链是否平行以及二硫键的数量可以将β-折叠结构进行再分类;其中,反平行结构更具有稳定性,包含有2条β链的保守区域又被称作γ-核心区,是依赖二硫键稳定的紧凑结构,表现出较强的蛋白水解抗性;这种类型的抗菌肽抗菌活性通常归因于暴露在反平行β-折叠上的阳离子残基和疏水侧链[23]。这些研究表明,相比于α-螺旋,β-折叠抗菌肽在确保了抗菌活性的同时,又具备了较强的抗生物降解能力。这一发现对未来抗菌肽类药物的研发提供了新的思路:通过增加β-折叠的含量,有望延长药物作用时间,并进一步提高其生物利用度。
2.3 αβ混合结构某些抗菌肽可以同时包含多个α-螺旋和β-折叠结构,这种构象在防御素中最为常见。比如来源于抗真菌植物的抗菌肽Psd1含有βαββ折叠,可以进入真菌细胞中干扰细胞周期;人类体内的β-防御素hBD1、hBD2和hBD3含有αβββ构象[12]。尽管目前对于此类抗菌肽的研究较少,但根据其分布和构象可以推测,αβ-抗菌肽在参与非特异性免疫的同时,还兼具抗菌活性和抗降解能力。上述研究和推测为人工增加α-螺旋和β-折叠,以改良现有天然抗菌肽提供了理论支持。纵然目前尚未有研发成功的剂型,但理论层面表明,从二级结构入手的修饰方案有较强的可行性。
2.4 环肽环肽类抗菌肽有着线性的N端,而C端凭借二硫键形成环状结构。同样地,环肽的活性结构也是α-螺旋和β-折叠,环状构象则提供了紧凑的结构和折叠,对于其稳定性有着重要意义。Zohrab等[24]通过研究蛙皮细胞分泌的brevinin肽表明,这类环肽不能通过单体引起膜穿孔,但肽的多聚体可以作用于膜,并且可以通过激活溶酶体-线粒体死亡途径消灭细菌或肿瘤细胞。这些研究表明,环肽在抗菌和抗肿瘤方面有着巨大潜力。
2.5 非αβ结构非αβ抗菌肽,也被称为延伸或弹性结构抗菌肽。此类抗菌肽一般为线性结构,其活性结构由肽和膜脂质之间的氢键或范德华力形成,不依赖于氨基酸残基之间的氢键;也正因如此,肽链难以形成空间二级结构;它们中的大多数来自组织蛋白酶家族,根据氨基酸种类不同,可分为富含色氨酸、脯氨酸和甘氨酸的肽[12]。
值得注意的是,这类抗菌肽因不含αβ结构而具备独特的抗菌机制。它们能够穿膜进入胞质,与细菌生长相关的分子结合并抑制其功能,最终导致细菌死亡。Seefeldt等[25]研究了富含脯氨酸的抗菌肽Onc112,通过与核糖体出口通道的上部区域结合,有效地阻止氨酰基tRNA进入核糖体,从而阻断核糖体通道并破坏翻译启动复合物的稳定,最终抑制细菌的生长。这些研究为抗菌肽的应用提供了新的思路:延伸或弹性结构将是新型抗菌肽设计的良好基础模型,因为无论是抗菌肽还是其类似物,都具有靶向核糖体通道来抑制细菌增殖的潜力。然而,细胞毒性等问题值得注意与思考:此类抗菌肽是否会影响正常人体细胞结构的生理功能?是否具有细菌特异性?生物安全性问题不容忽视,应慎重权衡,这也是今后值得深入探究的话题。
相比于传统抗生素,抗菌肽特殊的结构与构象是其天然优势,也决定了它们独特的抗菌机制。通过了解其抗菌机制可以知道,抗菌肽具有很低的耐药性,这也是研发新型药物、替代抗生素治疗的潜力所在。
3 天然抗菌肽的抗菌机制抗菌肽在体内和体外对革兰氏阴性(G−)和革兰氏阳性菌(G+)都具有广泛的抗菌活性。Sun等[26]通过研究眼镜王蛇来源的cathelicidins抗菌肽OH-CATH30,证明其具有很强的抗菌和弱的溶血活性。前期研究测试了584个临床分离菌株,85%对OH-CATH30及其类似物敏感。与抗生素相比,L-和D-OH-CATH30对革兰氏阳性菌均有较高的抗菌活性;OH-CATH30及其类似物的综合疗效高于常规使用的9种抗生素[27]。OH-CATH以其较强的抗菌活性和较弱的溶血活性,为我们提供了有价值的药物模板,展示出抗菌肽强大的临床药用潜力。
通常情况下,抗菌肽的作用机制是直接杀死病原体,一些抗菌肽也可能通过调节宿主免疫反应间接发挥抗感染作用[28]。然而,抗菌肽的种类繁杂性以及技术的局限性限制了机制的研究,完整的作用机制及其活性机制尚不完全清楚。目前已被证实的有细胞壁靶向机制、膜靶向机制、细胞内靶向机制、双重或多重机制[3]。与传统抗生素不同的是,抗菌肽有特定的微生物靶点,这得益于其丰富的二级活性结构。建立抗菌肽的结构-功能关系(表 2),对于优化抗菌肽的抗菌性能、加速药物开发有着重要意义。
| Mechanism of action | Secondary structure | Peptide | Reference |
| Mechanism of cell wall targeting | α-β AMPs | Plectasin | [11] |
| Cyclic AMPs | Gramicidin S | [29] | |
| β-sheet AMPs | hBD3, HNP1 | [7] | |
| α-β AMPs | Eurocin | [30] | |
| α-β AMPs | Copsin | [31] | |
| Mechanism of membrane targeting | |||
| Barrel-stave model | α-helical AMPs | Alamethicin | [32] |
| β-sheet AMPs | Protegrin-1 | [33] | |
| Toroidal-pore model | α-helical AMPs | Melittin | [34] |
| α-helical AMPs | Magainin 2 | [35] | |
| Carpet model | α-helical AMPs | Dermaseptin | [36] |
| β-sheet AMPs | Thanatin | [37] | |
| Intracellular targeting mechanism of action | Stretched structures | Onc112 | [25] |
| Cyclic AMPs | Microcin J25, capistruin | [38] | |
| β-sheet AMPs | HD5ox | [39] | |
| Dual or multiple mechanisms of action | α-β AMPs | PMAP23 | [3] |
3.1 膜靶向机制
目前发现的大多抗菌肽在生理pH下净正电荷为+2–+9[40],而G+和G−表面分别含有磷壁酸和脂多糖,它们会使细菌膜表面携带负电荷;随着两亲性阳离子肽与细菌膜静电吸附并聚集,结合在膜上的抗菌肽的静电吸引力和穿透性增强,肽的疏水端插入脂质双层,进一步诱导产生膜裂解作用[3]。同时由表 2可知,自然界最常见的α-螺旋和β-折叠结构抗菌肽也集中于膜靶向机制。因此,膜靶向作用机制是抗菌肽的主要作用模式。Tornesello等[41]综述了最新研究的膜靶向模型,比如“沉筏模型” “聚合渠道模型” “肽诱导的脂质分离模型”和“肽介导的非层状相形成机制”等。本文综述了认可度最高的两种跨膜孔隙模型“桶壁模型”和“环形孔隙模型”,以及非膜孔隙模型“地毯模型”或“洗涤剂模型” (图 2)。
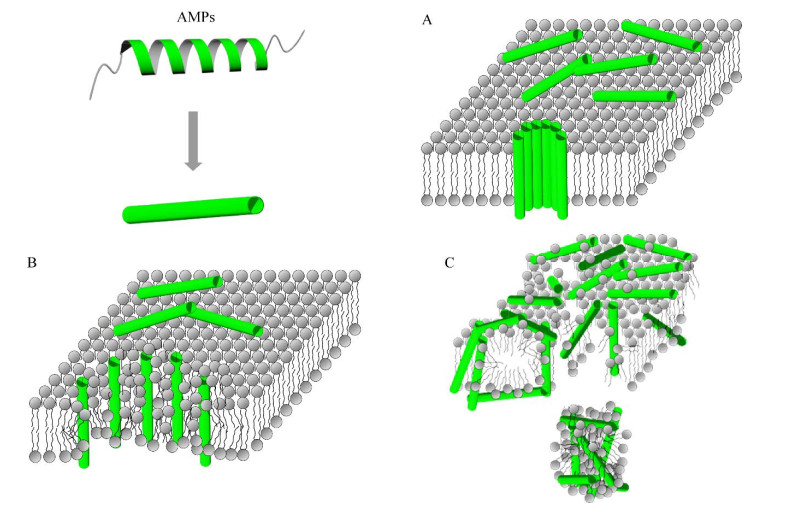
|
| 图 2 抗菌肽与细菌细胞膜的相互作用模型 Figure 2 Model of the interaction between antimicrobial peptides and bacterial cell membranes. A: Barrel-stave model. B: Toroidal-pore model. C: Carpet model. |
3.1.1 跨膜孔隙模型
跨膜孔隙模型一般包括“桶壁模型”和“环形孔隙模型”。
“桶壁模型”首先有单体肽在细胞表面的积累,随后构象变化和聚集,在细菌膜内形成桶形多聚体[41]。聚集作用使抗菌肽进入膜的疏水中心,并防止肽的亲水部分暴露于膜内的疏水部分。然后,抗菌肽的疏水链与膜的酰基链接触,与双层的脂质核心对齐,并诱导细胞膜的弱化。而肽的亲水部分形成水性孔,随着聚集肽数量的增加,水性孔变宽[42],形成桶壁形状,从而诱导细菌细胞膜的破裂。代表性的抗菌肽有alamethicin、pardaxin和protegrin-1[3]。
“环形孔隙模型”是一个“两阶段”模型。这个模型中的抗菌肽在低浓度状态下保持无活性或低活性,而在高浓度时转变为高活性状态,并且由平行于磷脂双分子层的状态变为垂直状态。垂直插入脂质双分子层的肽链诱导膜磷脂分子向内弯曲形成孔隙,这样给细胞膜带来了不可逆的破坏:一方面影响了细菌细胞膜的稳定性,另一方面又允许抗菌肽进入细菌胞内,以影响其正常生理功能,如DNA复制和蛋白质合成,从而诱导细菌死亡[41]。代表抗菌肽有magainin 2、melittin等[3, 41]。
3.1.2 非膜孔隙模型“地毯模型”被认为是大多数抗菌肽的活性机制[43]。这种模型描述了细菌膜外层被抗菌肽“地毯式”覆盖的情形,即α-螺旋的阳离子抗菌肽与膜外层带负电的磷脂相互作用。起初,低浓度抗菌肽保持与细胞表面平行,而不插入脂质双层,但当肽浓度上升到一定程度时,它们会自行旋转,使磷脂重新定向和膜流动性增加,破坏细胞膜并形成胶束,诱导了细菌死亡[44]。细胞膜向内流动破裂的方式类似于洗涤剂,因此这种模型有时也被称为“洗涤剂模型”。这种模型的代表抗菌肽有dermaseptin、thanatin、cecropin P1、LL-37等[42]。
3.2 细胞壁靶向机制然而,细菌膜破坏模型并不能完全解释抗菌肽介导的完整抗菌机制。具体来说,该机制很难解释抗菌肽如何迅速穿透G+的多层肽聚糖。肽聚糖是G+细胞壁的主要成分,其关键成分之一是脂质Ⅱ,它对于细胞壁亚基在细菌质膜上的运输至关重要,影响着细菌的完整性和存活度[45]。Schneider等[11]通过体外遗传和生化实验发现,plectasin不会对膜完整性造成任何破坏,而是以脂质Ⅱ为细胞靶点,直接与脂质Ⅱ结合来破坏细胞壁的合成,以此提出了细胞壁靶向机制。除了plectasin外,研究人员还发现了其他靶向脂质Ⅱ的抗菌肽,如hBD3和HNP1,长牡蛎中的Cg-Defh1-2,真菌中的copsin和eurocin,以及蛆中的lucifensin[46]。
3.3 细胞内靶向机制近年来许多研究表明,一些抗菌肽可以直接穿透细菌膜,进入细菌内部干扰基本的生命活动,包括DNA复制、转录、翻译、蛋白质合成、折叠和细胞分裂等[47]。抗菌肽主要通过两种形式入膜:不依赖能量的质膜直接渗透(有形成瞬时孔隙、通过膜不稳定性直接易位两种途径)和能量依赖的内吞作用[3]。抗菌肽进入并积累在细胞膜后,可靶向细胞内大分子和生物过程发挥进一步的活性。其具有特异且多样的胞内靶点,包括核酸靶向、蛋白质靶向、蛋白酶靶向等。细胞内靶向可有效阻止细菌耐药性的进展,并有望携带其他药物实现靶向治疗[48]。随着分子合成与材料递送技术的发展,大量经过优化的抗菌肽有望成为新一代临床靶向药物。
4 抗菌肽的改造与递送策略值得注意的是,在抗菌肽生物实验的过程中,不可抗地出现了部分细菌的耐药性:它们根据环境刺激进行膜的修饰,可以降低细菌膜和抗菌肽之间的亲和力[49],使抗菌肽在发挥作用之前便被降解。这意味着,抗菌肽需要加以优化来改善应用困境。因此,非膜靶向作用机制或许能成为抗菌肽耐药的突破口:比如在分子结构层面增加环肽或延伸性结构的含量,从而增加抗菌肽的作用靶点以避免单一膜靶向作用。这种人工抗菌肽改造方式是从分子层面入手,通过化学修饰改良其结构与功能。此外,Liu等[50]构建了一种可形变的脂肽纳米药物递送系统,通过长效滞留效应,增强了对细菌细胞膜的破坏,促进抗生素的渗透,增强治疗效果。这为高分子材料负载抗菌肽的药物递送系统提供了良好的理论模型和思路。不论何种改造方式,主要目标都应是选择性地释放肽分子,以此提高药物治愈率并减弱毒副作用。
4.1 人工抗菌肽纵使天然抗菌肽的前景广阔,但其研发与应用仍受到来源、不稳定性、毒性和生物利用度的限制。针对这一问题,许多研究者致力于开发同样由正电性和疏水基团组成的抗菌肽类似物。设计、修饰、合成人工抗菌肽将会是未来的研究热点。随着近年来蛋白修饰酶的研究进展,人工抗菌肽展现出广阔的应用前景。Gao等[6]对抗菌肽的修饰策略进行了详细的综述,其中包括有脂肪族修饰、与抗生素偶联、金属修饰、聚乙二醇化和糖基化。
每一种人工改性方式都有其优劣:如脂肪酸修饰能够延长抗菌肽的半衰期、降低生物降解度,但某些情况下却会削弱其抗菌活性[6]。聚乙二醇化能改变多肽的构象,降低疏水性和蛋白水解性,从而增加多肽的稳定性[51]。Shen等[52]在小鼠伤口感染模型中证实,经过癸酸修饰PMAP23RI的C末端构建的抗菌肽(PMAP- 23RI-Dee)在控制伤口感染方面的显著效果。其中,蛋白水解活性是备受关注的问题,简单的化学修饰和D-氨基酸的利用是不足且昂贵的。作为替代方案,针对抗胰蛋白酶的天然氨基酸排列和抗凝乳蛋白酶水解肽结构的合成肽的开发,已被证实能够显著保持抗菌肽的体内抗菌效果[53]。
以上研究表明,人工改造抗菌肽可以从根本上解决抗菌肽序列、结构等层面存在的天然缺陷。然而,分子结构的改造开发困难、造价高昂,至今并未有普及性成果,但也为改良抗菌肽、拓宽抗菌肽的临床应用途径提供了宝贵经验。因此,探索稳定和高效的材料配方以保持抗菌肽的稳定性、抗菌效力和生物安全性作为一种全新思路,在抗菌肽处理临床感染试验的设计中必不可少。
4.2 递送策略抗菌肽在感染治疗的应用中面临着两大挑战:其一,抗菌肽的天然缺陷,如半衰期短、对环境因素敏感等,pH、蛋白质分解、水解、氧化和光解的变化,都可能影响其结构与抗菌效果;其二,抗菌肽的无序给药因其较低的靶向性,常常导致局部甚至全身的细胞毒性和高溶血性,同时也降低了其作用效率。因此,抗菌肽的递送策略具有重要的研究价值,以期实现抗菌肽的靶向治疗,同时降低给药剂量和给药频率,最大限度地减少副作用并发挥抗菌作用。
4.2.1 递送途径局部给药是目前抗菌肽应用最可行的方法,在作用部位提供较高的肽浓度,可系统地减少不良影响。例如,抗菌肽peceleganan (PL-5)以喷雾剂形式用于治疗局部皮肤和伤口的细菌感染,特别是由顽固的耐药细菌引起的细菌感染。PL-5喷雾剂经临床证实是一种安全有效的皮肤伤口感染治疗方法,也是第一种专门用于皮肤伤口感染的外用抗菌肽喷雾剂[54]。在局部给药的基础上,将抗菌肽与生物相容的载体配制成药剂,可以潜在地增强肽的蛋白分解稳定性,减缓细菌耐药,同时提供对肽的保护,防止伤口感染期间pH变化导致抗菌肽失活。目前,研究者探索了各种药物递送系统(表 3),涵盖了无机载体(包括金、银和二氧化硅固体纳米颗粒)、有机载体(包括胶束、脂质体和水凝胶)以及特异性靶向递送。
| Drug delivery system | Peptide | Application | Reference |
| Porous material | |||
| Mesoporous silica | Bacillocin A | Staphylococcus aureus | [55] |
| Mesoporous titanium dioxide | Daptomycin | S. aureus | [56] |
| Surface attachment | |||
| Polymeric micelle | KYE28 | E. coli | [57] |
| Nanofibre | ε-PL | S. aureus | [58] |
| Liposome | DP7-C | Methicillin-resistant Staphylococcus aureus (MRSA) | [59] |
| Lipid nanoparticles | Polymyxin B | Pseudomonas aeruginosa | [60] |
| Lipid crystallization | LL-37 | E. coli | [61] |
| Self-assembly | |||
| Self-assembly of peptides | WMR PAs | P. aeruginosa | [62] |
| Microgel | PSI | E. coli and S. aureus | [63] |
| Covalent conjugate | |||
| Inorganic nanoparticles | Odorranain-A-OA1 | E. coli | [64] |
| Chitosan nanoparticles | Dhvar-5 | S. aureus | [65] |
| Synthetic polymer | OM19r-8 | E. coli | [66] |
| AMP-antibiotic conjugates | Melittin | MRSA | [67] |
| Photosensitizing drug | APPS | E. coli | [68] |
| Targeted delivery | |||
| AMPs to target tumor cells | [D]-H6L9 | C26 tumor | [69] |
| Cry3Aa protein crystal | Dermaseptin S1 | Leishmania spp. | [70] |
目前,设计新型抗菌肽递送系统的其他流行方法还包括支架,即三维多孔固体生物材料,作为容纳生物活性化合物的基质。Håkansson等[71]将抗菌肽(如DPK-060)支架形成有序的纳米晶体复合体,有助于细胞因子的生成,从而产生强大的免疫调节作用。近年来,静电纺丝技术已成为用于开发嵌入抗菌肽的纳米纤维的一种备受瞩目的方法,该技术能够将抗菌肽通过静电纺丝形成纳米纤维膜,其作为伤口敷料既可以阻隔外来细菌的入侵,又可以清除伤口内感染的细菌,如OH-CATH30已被证明可以通过静电纺丝增强疗效并实现肽的控释[72]。这两项研究都使用最新的体内小鼠模型比较了抗菌肽载体的效果,其提高了抗菌和伤口愈合能力,比对照组具有更高的安全性。
在设计药物递送系统时,主要目标是选择性地释放抗菌肽分子,使它们能够在不影响健康细胞的情况下迅速积聚在靶点。与单一抗菌肽相比,生物材料负载的肽可以实现缓释、提供有效的局部浓度、减少脱靶效应和毒性、提高抗菌肽的稳定性和活性,并实现局部微环境的调节[73]。因此,生物材料递送与响应性药物释放可进一步提高抗菌肽药物的靶向性和生物利用度。
4.2.2 递送后响应性释放值得注意的是,暴露在细菌感染下的炎症反应将改变感染部位的微环境,如pH值、活性氧(reactive oxygen species, ROS)水平、谷胱甘肽(glutathione, GSH)氧化还原比和特定酶的产生。这些微环境参数的变化为衡量感染严重程度和制造响应性载体提供了新的参考,是刺激递送系统实现抗菌肽药物释放的“触发器”。本文将简述抗菌治疗中使用的一些响应性载体及其构建方案。
pH响应性载体对于靶向部位的低pH水平有一定的敏感性。Pranantyo等[74]研究发现,半胱氨酸封端的抗菌肽与金纳米簇组装,并进一步用阴离子柠檬酰基修饰表面,得到带负电荷的表面。该络合物具有较高的稳定性,在生理条件下具有较低的溶血和细胞毒性。在细菌感染部位的酸性pH环境下,柠檬酰胺可以自动切割,实现电荷从负电荷到正电荷的反转,从而提供有效的细菌结合和杀菌效果,展示了一种“智能”的pH响应配方设计。与之类似的是,Wang等[75]制备了一种核壳结构纳米凝胶作为药物载体,该纳米载体具有酸性感染微环境响应性,可以实现控制性释放抗菌肽和益生元菊糖,用于高选择性杀菌和动态促进有益细菌增殖。这种新的给药方法不同于传统的药物修饰和构象改造,而是专注于保持抗菌肽生理活性的同时,最大限度地规避其天然不稳定性和细胞毒性。
革兰氏阴性细菌的脂多糖是炎症诱导的氧化应激的主要因素,清除ROS和下调相关途径可以减轻炎症影响;ROS触发的药物递送系统具有类似于pH响应系统的设计原理,利用化学键变化、改变的表面电位或改变的疏水特性来实现药物的释放或持续释放[76]。Cheng等[77]制备出了GelMA-DOPA水凝胶并与抗菌肽结合,使水凝胶伤口敷料具有抗菌和清除ROS的能力。Zhao等[78]利用聚乙烯醇(polyvinyl alcohol, PVA)交联一种具有ROS响应性的连接剂,开发了一种清除ROS的水凝胶,其可通过降低ROS水平,上调创面周围M2表型巨噬细胞,促进创面闭合。
GSH可以与多种物质发生反应。例如二硫键对于GSH极其敏感,这主要是通过巯基官能团诱导的二硫键裂解反应来实现的。因此GSH能够触发相应的自组装纳米颗粒分解,促进药物释放[79]。Pal等[80]利用这一原理设计了两种新的左氧氟沙星衍生物,它们与GSH特异性反应产生的药物抑菌率超过99%,并且毒性低于原药左氧氟沙星。另外,Hu等[81]利用GSH敏感的α-环糊精(α-cyclodextrin, α-CD)共轭了一氧化氮(NO),当药物体系接触表达GSH的细菌生物膜时,表现为GSH触发NO快速释放,起到杀菌作用的同时辅助了后续NO与ROS的反应,有利于提高生物膜的穿透效率。由此可见,GSH响应策略实现了药物联合和多级响应,具有可观的临床应用性。
抗菌肽的酶响应性释放受特定微生物种类的酶活性影响,比pH响应释放更精确。Zhang等[82]设计了脂肪酶敏感的聚合物纳米颗粒,用于腹膜炎模型的抗炎作用。Lu等[83]合成了一个由3个组分组成的多结构域抗菌肽,然后将抗菌肽吸附在金纳米颗粒上,制备出一种酶响应性纳米复合材料,该纳米复合材料可以被细菌细胞表达的明胶酶激活,以启动纳米颗粒的原位聚集。Wang等[84]使用透明质酸表面修饰的银纳米颗粒有效地输送庆大霉素,靶向杀灭金黄色葡萄球菌。
然而,这些包含pH值、ROS、GSH和酶反应的设计有一定局限性:以pH响应为例,最主要的挑战是电荷反转策略[79],这将直接影响该药物体系的疗效。此外,药物递送策略还受到纳米材料的选择、有限的体外和动物模型以及缺乏有效性和毒理性的量化指标等限制,难以完全解决当前的挑战。因此,从病原体感染机制和多种疾病的靶向治疗策略中获得见解,可能会揭示现有细菌治疗的优化方向。
5 抗菌肽的临床应用抗菌肽被认为是目前替代抗生素的新希望之一。然而,多肽药物临床应用的发展十分缓慢。这是由多重因素带来的限制,例如抗菌肽的天然属性(昂贵、稳定性差、膜渗透性差、体内清除快)、缺乏对其作用机制的充分了解和缺乏先进的计算工具等[85]。尽管抗菌肽的临床应用遇到了许多挑战,但仍有少数抗菌药物成功获批用于抗菌治疗,并且有许多新的临床研究被报道。本文将目前的临床应用分为单一肽治疗与联合治疗并分别进行综述。
5.1 单一肽治疗目前较为先进的一种抗菌肽药物是pexiganan,它是一种从非洲爪蟾分离出的magainin肽的类似物,目前由Dipexium Pharmaceuticals Inc进行Ⅲ期临床试验。他们的目标是确定局部应用含有0.8% pexiganan的乳膏对于糖尿病足相关伤口的临床优势和安全性,并与治疗轻度感染糖尿病足的安慰剂乳膏进行比较[86]。Mascio等[87]对surotomycin (CB-183, 315)进行了Ⅲ期临床试验,目的是比较其与口服万古霉素在治疗艰难梭菌相关性腹泻(clostridium difficile-associated diarrhea, CDAD)中的有效性,并且在Ⅱ期临床试验中口服surotomycin表现出良好的患者耐受性。除此之外,还有LL-37、hCAP18、DPK 060、omiganan、Nal-P-113等抗菌肽已进入不同阶段的临床试验[88]。
然而已有研究表明,细菌对抗菌肽的耐药性已从实验室和自然界进化出来,并且对单一肽抗性的进化趋势尤为明显[89]。因此,突破单一药物治疗并寻求抑制耐药进化的方案刻不容缓。
5.2 联合治疗抗生素的联合治疗过去已有诸多先例,例如结核病的治疗需要长期使用抗生素“鸡尾酒”疗法[90]。这也为抗菌肽的临床应用拓宽了思路。与大多数抗生素相比,抗菌肽有着许多不同的作用靶点。因此,抗菌肽之间或抗菌肽与常规抗生素的协同组合具有很大的治疗潜力。
抗菌肽之间的协同作用是一种自然现象,具有很强的普遍性和应用价值。Shtreimer Kandiyote等[91]证明了PGLa和magainin-2联合应用对于铜绿假单胞菌的生物膜生长有很强的抑制作用,这对于延长医疗器械的使用寿命有着重要意义。Lüders等[92]协同了真核生物抗菌肽pleurocidin和原核生物抗菌肽pediocin PA-1、sakacin P、curvacin A后发现,联合用药对大肠杆菌的抑制能力比单独使用pleurocidin提高了近4倍。由此可见,联合用药通过利用抗菌肽之间的高度协同性与多样化的作用机制,显著提高了抗菌肽的活性。
抗菌肽与抗生素联合用药已有明显的抗菌效应。例如,抗菌肽DP7与阿奇霉素或万古霉素的结合已被证明可以根除一些耐药的金黄色葡萄球菌、铜绿假单胞菌和大肠杆菌[93]。与之类似的有LL-37衍生物KR-12-a5及其类似物与氯霉素、环丙沙星和苯唑西林的协同作用对多重耐药铜绿假单胞菌有很高的疗效[94]。除此之外,Dai等[95]为降低单一使用多黏菌素引起的肾毒性和神经毒性,创新地构建了多黏菌素-姜黄素联合体系,这是抗菌肽与非主流类抗菌药物联合应用的大胆尝试。协同抑制细菌生长的同时,通过抑制氧化应激等多种途径减弱了多黏菌素的副作用。
由此可见,抗菌肽与美国食品药品监督管理局(Food and Drug Administration, FDA)批准的药物、天然产物联合治疗是克服各种不良反应和细菌耐药性的新兴策略。尽管存在很多挑战,但目前的研究结果依然乐观,抗菌肽的联合用药是一个颇具前景的临床新方向。这将加速抗菌肽相关药物的研发,为今后面对感染性疾病创造新的治疗选择。
6 展望截至目前,抗生素在临床感染性疾病的治疗中仍有着不可或缺的作用,但超级细菌、抗生素耐药性等问题日益严重,正逐渐对抗生素的临床价值构成挑战。本文重点讲解的抗菌肽已被认为是一种潜在的替代抗生素的候选药物:与传统抗生素相比,抗菌肽在与细菌相互作用时形成的特殊结构与其独特且多样化的作用机制,表现出不俗的抗细菌耐药性与临床药用潜力。
提高抗菌活性是实现抗菌肽临床应用的关键所在。就基于抗菌肽二级结构开发高抗菌活性药物的可能性而言,α-螺旋、β-折叠等结构具有重要的功能特征,后期研发可以通过增加α或β构象片段来完善不同抗菌肽的生物学功能,弥补它们在临床应用上的缺陷,如低抗菌活性、易降解等,为其投入临床使用带来新的希望。
然而,抗菌肽耐药性问题已有先例,其细胞毒性也不容忽视。因此,精准的靶向治疗成为了新的突破口,目前的思路有两种:一方面通过化学修饰改变抗菌肽的本质结构,从而改变其作用靶点、获得抗降解能力等,但研究难度极大,并且抗菌活性也随之受到影响;另一方面采用高分子细菌响应性材料递送的方式,可以协助实现抗菌肽的靶向、渗透、缓释和抗降解等效能,但药物释放率以及材料对于人体的毒副作用等问题,也值得再三权衡。正因如此,未来的研究要努力实现新型靶向思路,这将极大地促进抗菌肽应用的进步。
综上所述,优化抗菌肽应用的途径有两条:增强抗菌活性与抗菌肽的靶向治疗。然而,两者此消彼长,难以实现同时提升。此外,抗菌肽制剂研制成本高昂、运输条件苛刻。诸如此类的问题限制了抗菌肽剂型的临床应用,但抗菌肽与其他抗菌药物的联合治疗又为其临床应用创造了新的希望。寻找新型联合方案、提高抗菌肽抗菌活性与作用时间、减弱细胞毒性,将是下一阶段思考与研究的重点所在。
由此可见,抗菌肽的普及应用任重而道远。充分了解抗菌肽的作用机制、体内过程和降解机制,对于改良抗菌肽类药物有着事半功倍的效果,这便需要多学科交叉合作研究。实现抗菌肽类药物的抗菌活性、分子稳定性与细胞毒性的相互协调,开发低成本、低毒性、高渗透性、高细菌响应性的靶向抗菌分子和抗菌材料等,仍需更加深入地研究与探索。
| [1] | LEVY SB, MARSHALL B. Antibacterial resistance worldwide: causes, challenges and responses[J]. Nature Medicine, 2004, 10: S122-S129 DOI:10.1038/nm1145. |
| [2] | SAVINI F, LOFFREDO MR, TROIANO C, BOBONE S, MALANOVIC N, EICHMANN TO, CAPRIO L, CANALE VC, PARK Y, MANGONI ML, STELLA L. Binding of an antimicrobial peptide to bacterial cells: interaction with different species, strains and cellular components[J]. Biochimica et Biophysica Acta Biomembranes, 2020, 1862(8): 183291 DOI:10.1016/j.bbamem.2020.183291. |
| [3] | LUO Y, SONG YZ. Mechanism of antimicrobial peptides: antimicrobial, anti-inflammatory and antibiofilm activities[J]. International Journal of Molecular Sciences, 2021, 22(21): 11401 DOI:10.3390/ijms222111401. |
| [4] | ZHAO F, LAN XQ, DU Y, CHEN PY, ZHAO J, ZHAO F, LEE WH, ZHANG Y. King cobra peptide OH-CATH30 as a potential candidate drug through clinic drug-resistant isolates[J]. Zoological Research, 2018, 39(2): 87-96 DOI:10.24272/j.issn.2095-8137.2018.025. |
| [5] | JENSSEN H, HAMILL P, HANCOCK REW. Peptide antimicrobial agents[J]. Clinical Microbiology Reviews, 2006, 19(3): 491-511 DOI:10.1128/CMR.00056-05. |
| [6] | GAO YD, FANG HT, FANG L, LIU DW, LIU JS, SU MH, FANG Z, REN WZ, JIAO HP. The modification and design of antimicrobial peptide[J]. Current Pharmaceutical Design, 2018, 24(8): 904-910 DOI:10.2174/1381612824666180213130318. |
| [7] | GAO XH, DING JQ, LIAO CB, XU JL, LIU XX, LU WY. Defensins: the natural peptide antibiotic[J]. Advanced Drug Delivery Reviews, 2021, 179: 114008 DOI:10.1016/j.addr.2021.114008. |
| [8] | HANCOCK REW, BROWN KL, MOOKHERJEE N. Host defence peptides from invertebrates: emerging antimicrobial strategies[J]. Immunobiology, 2006, 211(4): 315-322 DOI:10.1016/j.imbio.2005.10.017. |
| [9] | RODRÍGUEZ-RUBIO L, MARTÍNEZ B, DONOVAN DM, RODRÍGUEZ A, GARCÍA P. Bacteriophage virion-associated peptidoglycan hydrolases: potential new enzybiotics[J]. Critical Reviews in Microbiology, 2013, 39(4): 427-434 DOI:10.3109/1040841X.2012.723675. |
| [10] | FATHIZADEH H, SAFFARI M, ESMAEILI D, MONIRI R, SALIMIAN M. Evaluation of antibacterial activity of enterocin A-colicin E1 fusion peptide[J]. Iranian Journal of Basic Medical Sciences, 2020, 23(11): 1471-1479. |
| [11] | SCHNEIDER T, KRUSE T, WIMMER R, WIEDEMANN I, SASS V, PAG U, JANSEN A, NIELSEN AK, MYGIND PH, RAVENTÓS DS, NEVE S, RAVN B, BONVIN AMJJ, de MARIA L, ANDERSEN AS, GAMMELGAARD LK, SAHL HG, KRISTENSEN HH. Plectasin, a fungal defensin, targets the bacterial cell wall precursor lipid Ⅱ[J]. Science, 2010, 328(5982): 1168-1172 DOI:10.1126/science.1185723. |
| [12] | BIN HAFEEZ A, JIANG XK, BERGEN PJ, ZHU Y. Antimicrobial peptides: an update on classifications and databases[J]. International Journal of Molecular Sciences, 2021, 22(21): 11691 DOI:10.3390/ijms222111691. |
| [13] | TAM JP, WANG SJ, WONG KH, TAN WL. Antimicrobial peptides from plants[J]. Pharmaceuticals, 2015, 8(4): 711-757 DOI:10.3390/ph8040711. |
| [14] | DINI I, de BIASI MG, MANCUSI A. An overview of the potentialities of antimicrobial peptides derived from natural sources[J]. Antibiotics, 2022, 11(11): 1483 DOI:10.3390/antibiotics11111483. |
| [15] | van HARTEN RM, van WOUDENBERGH E, van DIJK A, HAAGSMAN HP. Cathelicidins: immunomodulatory antimicrobials[J]. Vaccines, 2018, 6(3): 63 DOI:10.3390/vaccines6030063. |
| [16] | ZHANG Y, ZHAO H, YU GY, LIU XD, SHEN JH, LEE WH, ZHANG Y. Structure-function relationship of king cobra cathelicidin[J]. Peptides, 2010, 31(8): 1488-1493 DOI:10.1016/j.peptides.2010.05.005. |
| [17] | WANG YP, HONG J, LIU XH, YANG HL, LIU R, WU J, WANG AL, LIN DH, LAI R. Snake cathelicidin from Bungarus fasciatus is a potent peptide antibiotics[J]. PLoS One, 2008, 3(9): e3217 DOI:10.1371/journal.pone.0003217. |
| [18] | SHINNAR AE, BUTLER KL, PARK HJ. Cathelicidin family of antimicrobial peptides: proteolytic processing and protease resistance[J]. Bioorganic Chemistry, 2003, 31(6): 425-436 DOI:10.1016/S0045-2068(03)00080-4. |
| [19] | DESLOUCHES B, PHADKE SM, LAZAREVIC V, CASCIO M, ISLAM K, MONTELARO RC, MIETZNER TA. De novo generation of cationic antimicrobial peptides: influence of length and tryptophan substitution on antimicrobial activity[J]. Antimicrobial Agents and Chemotherapy, 2005, 49(1): 316-322 DOI:10.1128/AAC.49.1.316-322.2005. |
| [20] | FRY DE. Antimicrobial peptides[J]. Surgical Infections, 2018, 19(8): 804-811 DOI:10.1089/sur.2018.194. |
| [21] | LEIGH T, FERNANDEZ-TRILLO P. Helical polymers for biological and medical applications[J]. Nature Reviews Chemistry, 2020, 4: 291-310 DOI:10.1038/s41570-020-0180-5. |
| [22] | LEI J, SUN LC, HUANG SY, ZHU CH, LI P, HE J, MACKEY V, COY DH, HE QY. The antimicrobial peptides and their potential clinical applications[J]. American Journal of Translational Research, 2019, 11(7): 3919-3931. |
| [23] | PANTELEEV PV, BOLOSOV IA, BALANDIN SV, OVCHINNIKOVA TV. Structure and biological functions of β-hairpin antimicrobial peptides[J]. Acta Naturae, 2015, 7(1): 37-47 DOI:10.32607/20758251-2015-7-1-37-47. |
| [24] | ZOHRAB F, ASKARIAN S, JALILI A, KAZEMI OSKUEE R. Biological properties, current applications and potential therapeautic applications of brevinin peptide superfamily[J]. International Journal of Peptide Research and Therapeutics, 2019, 25(1): 39-48 DOI:10.1007/s10989-018-9723-8. |
| [25] | SEEFELDT AC, NGUYEN F, ANTUNES S, PÉRÉBASKINE N, GRAF M, ARENZ S, INAMPUDI KK, DOUAT C, GUICHARD G, WILSON DN, INNIS CA. The proline-rich antimicrobial peptide Onc112 inhibits translation by blocking and destabilizing the initiation complex[J]. Nature Structural & Molecular Biology, 2015, 22: 470-475. |
| [26] | SUN TY, ZHAN B, ZHANG WF, QIN D, XIA GX, ZHANG HJ, PENG MY, LI SG, ZHANG Y, GAO YY, LEE WH. Carboxymethyl chitosan nanoparticles loaded with bioactive peptide OH-CATH30 benefit nonscar wound healing[J]. International Journal of Nanomedicine, 2018, 13: 5771-5786 DOI:10.2147/IJN.S156206. |
| [27] | LI SG, LEE WH, ZHANG Y. Efficacy of OH-CATH30 and its analogs against drug-resistant bacteria in vitro and in mouse models[J]. Antimicrobial Agents and Chemotherapy, 2012, 56(6): 3309-3317 DOI:10.1128/AAC.06304-11. |
| [28] | HANCOCK REW, NIJNIK A, PHILPOTT DJ. Modulating immunity as a therapy for bacterial infections[J]. Nature Reviews Microbiology, 2012, 10: 243-254 DOI:10.1038/nrmicro2745. |
| [29] | WENZEL M, CHIRIAC AI, OTTO A, ZWEYTICK D, MAY C, SCHUMACHER C, GUST R, ALBADA HB, PENKOVA M, KRÄMER U, ERDMANN R, METZLER-NOLTE N, STRAUS SK, BREMER E, BECHER D, BRÖTZ-OESTERHELT H, SAHL HG, BANDOW JE. Small cationic antimicrobial peptides delocalize peripheral membrane proteins[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(14): E1409-E1418. |
| [30] | OEEMIG JS, LYNGGAARD C, KNUDSEN DH, HANSEN FT, NØRGAARD KD, SCHNEIDER T, VAD BS, SANDVANG DH, NIELSEN LA, NEVE S, KRISTENSEN HH, SAHL HG, OTZEN DE, WIMMER R. Eurocin, a new fungal defensin: structure, lipid binding, and its mode of action[J]. The Journal of Biological Chemistry, 2012, 287(50): 42361-42372 DOI:10.1074/jbc.M112.382028. |
| [31] | ESSIG A, HOFMANN D, MÜNCH D, GAYATHRI S, KÜNZLER M, KALLIO PT, SAHL HG, WIDER G, SCHNEIDER T, AEBI M. Copsin, a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis[J]. The Journal of Biological Chemistry, 2014, 289(50): 34953-34964 DOI:10.1074/jbc.M114.599878. |
| [32] | MATHEW MK, BALARAM P. Alamethicin and related membrane channel forming polypeptides[J]. Molecular and Cellular Biochemistry, 1983, 50(1): 47-64. |
| [33] | BOLINTINEANU DS, VIVCHARUK V, KAZNESSIS YN. Multiscale models of the antimicrobial peptide protegrin-1 on Gram-negative bacteria membranes[J]. International Journal of Molecular Sciences, 2012, 13(9): 11000-11011 DOI:10.3390/ijms130911000. |
| [34] | MEMARIANI H, MEMARIANI M, MORAVVEJ H, SHAHIDI-DADRAS M. Melittin: a venom-derived peptide with promising anti-viral properties[J]. European Journal of Clinical Microbiology & Infectious Diseases, 2020, 39(1): 5-17. |
| [35] | SAIDUMOHAMED BE, BABURAJ AP, JOHNY TK, SHEELA UB, SREERANGANATHAN M, BHAT SG. A magainin-2 like bacteriocin BpSl14 with anticancer action from fish gut Bacillus safensis SDG14[J]. Analytical Biochemistry, 2021, 627: 114261 DOI:10.1016/j.ab.2021.114261. |
| [36] | SHAI Y. Mechanism of the binding, insertion and destabilization of phospholipid bilayer membranes by alpha-helical antimicrobial and cell non-selective membrane-lytic peptides[J]. Biochimica et Biophysica Acta, 1999, 1462(1/2): 55-70. |
| [37] | SINHA S, ZHENG LZ, MU YG, NG WJ, BHATTACHARJYA S. Structure and interactions of a host defense antimicrobial peptide thanatin in lipopolysaccharide micelles reveal mechanism of bacterial cell agglutination[J]. Scientific Reports, 2017, 7(1): 17795 DOI:10.1038/s41598-017-18102-6. |
| [38] | BRAFFMAN NR, PISCOTTA FJ, HAUVER J, CAMPBELL EA, LINK AJ, DARST SA. Structural mechanism of transcription inhibition by lasso peptides microcin J25 and capistruin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(4): 1273-1278. |
| [39] | CHILEVERU HR, LIM SA, CHAIRATANA P, WOMMACK AJ, CHIANG IL, NOLAN EM. Visualizing attack of Escherichia coli by the antimicrobial peptide human defensin 5[J]. Biochemistry, 2015, 54(9): 1767-1777 DOI:10.1021/bi501483q. |
| [40] | MOOKHERJEE N, ANDERSON MA, HAAGSMAN HP, DAVIDSON DJ. Antimicrobial host defence peptides: functions and clinical potential[J]. Nature Reviews Drug Discovery, 2020, 19: 311-332 DOI:10.1038/s41573-019-0058-8. |
| [41] | TORNESELLO AL, BORRELLI A, BUONAGURO L, BUONAGURO FM, TORNESELLO ML. Antimicrobial peptides as anticancer agents: functional properties and biological activities[J]. Molecules, 2020, 25(12): 2850 DOI:10.3390/molecules25122850. |
| [42] | PIOTROWSKA U, SOBCZAK M, OLEDZKA E. Current state of a dual behaviour of antimicrobial peptides-therapeutic agents and promising delivery vectors[J]. Chemical Biology & Drug Design, 2017, 90(6): 1079-1093. |
| [43] | GANZ T. Defensins: antimicrobial peptides of innate immunity[J]. Nature Reviews Immunology, 2003, 3: 710-720 DOI:10.1038/nri1180. |
| [44] | BORRELLI A, TORNESELLO AL, TORNESELLO ML, BUONAGURO FM. Cell penetrating peptides as molecular carriers for anti-cancer agents[J]. Molecules, 2018, 23(2): 295 DOI:10.3390/molecules23020295. |
| [45] | CLARKE AJ. Peptidoglycan: another brick in the wall[J]. Nature Chemical Biology, 2017, 13(7): 695-696 DOI:10.1038/nchembio.2419. |
| [46] | FU J, ZONG X, JIN ML, MIN JX, WANG FD, WANG YZ. Mechanisms and regulation of defensins in host defense[J]. Signal Transduction and Targeted Therapy, 2023, 8: 300 DOI:10.1038/s41392-023-01553-x. |
| [47] | CHEN N, JIANG C. Antimicrobial peptides: structure, mechanism, and modification[J]. European Journal of Medicinal Chemistry, 2023, 255: 115377 DOI:10.1016/j.ejmech.2023.115377. |
| [48] | LE CF, FANG CM, SEKARAN SD. Intracellular targeting mechanisms by antimicrobial peptides[J]. Antimicrobial Agents and Chemotherapy, 2017, 61(4): e02340-16. |
| [49] | MARIA-NETO S, de ALMEIDA KC, MACEDO MLR, FRANCO OL. Understanding bacterial resistance to antimicrobial peptides: from the surface to deep inside[J]. Biochimica et Biophysica Acta, 2015, 1848(11 Pt B): 3078-3088. |
| [50] | LIU J, ZHANG X, ZOU PF, YAO JH, LIU LL, CAI Y, SUN TY, GAO YY, LI LL. Peptide-based nano-antibiotic transformers with antibiotic adjuvant effect for multidrug resistant bacterial pneumonia therapy[J]. Nano Today, 2022, 44: 101505 DOI:10.1016/j.nantod.2022.101505. |
| [51] | MANTEGHI R, PALLAGI E, OLAJOS G, CSÓKA I. Pegylation and formulation strategy of anti-microbial peptide (AMP) according to the quality by design approach[J]. European Journal of Pharmaceutical Sciences: Official Journal of the European Federation for Pharmaceutical Sciences, 2020, 144: 105197 DOI:10.1016/j.ejps.2019.105197. |
| [52] | SHEN TF, CHEN LL, LIU YQ, SHI SB, LIU ZX, CAI KR, LIAO CS, WANG C. Decanoic acid modification enhances the antibacterial activity of PMAP-23RI-Dec[J]. European Journal of Pharmaceutical Sciences: Official Journal of the European Federation for Pharmaceutical Sciences, 2021, 157: 105609 DOI:10.1016/j.ejps.2020.105609. |
| [53] | WANG JJ, SONG J, YANG ZY, HE SQ, YANG Y, FENG XJ, DOU XJ, SHAN AS. Antimicrobial peptides with high proteolytic resistance for combating Gram-negative bacteria[J]. Journal of Medicinal Chemistry, 2019, 62(5): 2286-2304 DOI:10.1021/acs.jmedchem.8b01348. |
| [54] | WEI YT, WU J, CHEN YX, FAN KW, YU XM, LI XJ, ZHAO YH, LI Y, LV GZ, SONG GD, RONG XZ, LIN C, WANG HT, CHEN XD, ZHANG PH, HAN CM, ZU HX, LIU WJ, ZHANG Y, LIU C, et al. Efficacy and safety of PL-5 (peceleganan) spray for wound infections: a phase IIb randomized clinical trial[J]. Annals of Surgery, 2023, 277(1): 43-49 DOI:10.1097/SLA.0000000000005508. |
| [55] | DURACK E, MALLEN S, O'CONNOR PM, REA MC, ROSS RP, HILL C, HUDSON S. Protecting bactofencin A to enable its antimicrobial activity using mesoporous matrices[J]. International Journal of Pharmaceutics, 2019, 558: 9-17 DOI:10.1016/j.ijpharm.2018.12.035. |
| [56] | ATEFYEKTA S, ERCAN B, KARLSSON J, TAYLOR E, CHUNG S, WEBSTER TJ, ANDERSSON M. Antimicrobial performance of mesoporous titania thin films: role of pore size, hydrophobicity, and antibiotic release[J]. International Journal of Nanomedicine, 2016, 11: 977-990. |
| [57] | RIGO S, HÜRLIMANN D, MAROT L, MALMSTEN M, MEIER W, PALIVAN CG. Decorating nanostructured surfaces with antimicrobial peptides to efficiently fight bacteria[J]. ACS Applied Bio Materials, 2020, 3(3): 1533-1543 DOI:10.1021/acsabm.9b01154. |
| [58] | AMARIEI G, KOKOL V, VIVOD V, BOLTES K, LETÓN P, ROSAL R. Biocompatible antimicrobial electrospun nanofibers functionalized with ε-poly-L-lysine[J]. International Journal of Pharmaceutics, 2018, 553(1/2): 141-148. |
| [59] | LIU XW, LI Z, WANG XD, CHEN YJ, WU FB, MEN K, XU T, LUO Y, YANG L. Novel antimicrobial peptide-modified azithromycin-loaded liposomes against methicillin-resistant Staphylococcus aureus[J]. International Journal of Nanomedicine, 2016, 11: 6781-6794 DOI:10.2147/IJN.S107107. |
| [60] | ROCHA ED, FERREIRA MRS, dos SANTOS NETO E, BARBOSA EJ, LÖBENBERG R, LOURENÇO FR, BOU-CHACRA N. Enhanced in vitro antimicrobial activity of polymyxin B-coated nanostructured lipid carrier containing dexamethasone acetate[J]. Journal of Pharmaceutical Innovation, 2021, 16(1): 125-135 DOI:10.1007/s12247-020-09427-3. |
| [61] | BOGE L, BROWNING KL, NORDSTRÖM R, CAMPANA M, DAMGAARD LSE, SETH CAOUS J, HELLSING M, RINGSTAD L, ANDERSSON M. Peptide-loaded cubosomes functioning as an antimicrobial unit against Escherichia coli[J]. ACS Applied Materials & Interfaces, 2019, 11(24): 21314-21322. |
| [62] | LOMBARDI L, SHI YJ, FALANGA A, GALDIERO E, de ALTERIIS E, FRANCI G, CHOURPA I, AZEVEDO HS, GALDIERO S. Enhancing the potency of antimicrobial peptides through molecular engineering and self-assembly[J]. Biomacromolecules, 2019, 20(3): 1362-1374 DOI:10.1021/acs.biomac.8b01740. |
| [63] | HUANG L, ZHU ZY, WU DW, GAN WD, ZHU SS, LI WQ, TIAN JH, LI LH, ZHOU CR, LU L. Antibacterial poly (ethylene glycol) diacrylate/chitosan hydrogels enhance mechanical adhesiveness and promote skin regeneration[J]. Carbohydrate Polymers, 2019, 225: 115110 DOI:10.1016/j.carbpol.2019.115110. |
| [64] | PAL I, BRAHMKHATRI VP, BERA S, BHATTACHARYYA D, QUIRISHI Y, BHUNIA A, ATREYA HS. Enhanced stability and activity of an antimicrobial peptide in conjugation with silver nanoparticle[J]. Journal of Colloid and Interface Science, 2016, 483: 385-393 DOI:10.1016/j.jcis.2016.08.043. |
| [65] | PETRIN THC, FADEL V, MARTINS DB, DIAS SA, CRUZ A, SERGIO LM, ARCISIO-MIRANDA M, CASTANHO MARB, DOS SANTOS CABRERA MP. Synthesis and characterization of peptide-chitosan conjugates (PepChis) with lipid bilayer affinity and antibacterial activity[J]. Biomacromolecules, 2019, 20(7): 2743-2753 DOI:10.1021/acs.biomac.9b00501. |
| [66] | CUI Q, XU QJ, LIU L, GUAN LL, JIANG XY, INAM M, KONG LC, MA HX. Preparation, characterization and pharmacokinetic study of N-terminal PEGylated D-form antimicrobial peptide OM19r-8[J]. Journal of Pharmaceutical Sciences, 2021, 110(3): 1111-1119 DOI:10.1016/j.xphs.2020.10.048. |
| [67] | JELINKOVA P, SPLICHAL Z, JIMENEZ AMJ, HADDAD Y, MAZUMDAR A, SUR VP, MILOSAVLJEVIC V, KOPEL P, BUCHTELOVA H, GURAN R, ZITKA O, RICHTERA L, HEGEROVA D, HEGER Z, MOULICK A, ADAM V. Novel vancomycin-peptide conjugate as potent antibacterial agent against vancomycin-resistant Staphylococcus aureus[J]. Infection and Drug Resistance, 2018, 11: 1807-1817 DOI:10.2147/IDR.S160975. |
| [68] | LEI XL, QIU L, LAN M, DU XC, ZHOU SW, CUI PF, ZHENG RH, JIANG PJ, WANG JH, XIA J. Antibacterial photodynamic peptides for staphylococcal skin infection[J]. Biomaterials Science, 2020, 8(23): 6695-6702 DOI:10.1039/D0BM01467B. |
| [69] | ZHANG QY, TANG J, RAN R, LIU YY, ZHANG ZR, GAO HL, HE Q. Development of an anti-microbial peptide-mediated liposomal delivery system: a novel approach towards pH-responsive anti-microbial peptides[J]. Drug Delivery, 2016, 23(4): 1163-1170 DOI:10.3109/10717544.2014.1003665. |
| [70] | YANG ZF, ZHENG JL, CHAN CF, WONG ILK, HEATER BS, CHOW LMC, LEE MMM, CHAN MK. Targeted delivery of antimicrobial peptide by Cry protein crystal to treat intramacrophage infection[J]. Biomaterials, 2019, 217: 119286 DOI:10.1016/j.biomaterials.2019.119286. |
| [71] | HÅKANSSON J, CAVANAGH JP, STENSEN W, MORTENSEN B, SVENDSEN JS, SVENSON J. In vitro and in vivo antibacterial properties of peptide AMC-109 impregnated wound dressings and gels[J]. The Journal of Antibiotics, 2021, 74: 337-345 DOI:10.1038/s41429-021-00406-5. |
| [72] | ZOU PF, LEE WH, GAO ZQ, QIN D, WANG YX, LIU J, SUN TY, GAO YY. Wound dressing from polyvinyl alcohol/chitosan electrospun fiber membrane loaded with OH-CATH30 nanoparticles[J]. Carbohydrate Polymers, 2020, 232: 115786 DOI:10.1016/j.carbpol.2019.115786. |
| [73] | LI GY, LAI ZH, SHAN AS. Advances of antimicrobial peptide-based biomaterials for the treatment of bacterial infections[J]. Advanced Science, 2023, 10(11): e2206602 DOI:10.1002/advs.202206602. |
| [74] | PRANANTYO D, LIU P, ZHONG WB, KANG ET, CHAN-PARK MB. Antimicrobial peptide-reduced gold nanoclusters with charge-reversal moieties for bacterial targeting and imaging[J]. Biomacromolecules, 2019, 20(8): 2922-2933 DOI:10.1021/acs.biomac.9b00392. |
| [75] | WANG XX, WANG YT, TANG MT, WANG XY, XUE W, ZHANG X, WANG YX, LEE WH, WANG YS, SUN TY, GAO YY, LI LL. Controlled cascade-release and high selective sterilization by core-shell nanogels for microenvironment regulation of aerobic vaginitis[J]. Advanced Healthcare Materials, 2023, 12(15): e2202432 DOI:10.1002/adhm.202202432. |
| [76] | LI C, WANG YF, ZHANG S, ZHANG JJ, WANG F, SUN YH, HUANG LR, BIAN W. pH and ROS sequentially responsive podophyllotoxin prodrug micelles with surface charge-switchable and self-amplification drug release for combating multidrug resistance cancer[J]. Drug Delivery, 2021, 28(1): 680-691 DOI:10.1080/10717544.2021.1905750. |
| [77] | CHENG H, SHI Z, YUE K, HUANG XS, XU YC, GAO CH, YAO ZQ, ZHANG YS, WANG J. Sprayable hydrogel dressing accelerates wound healing with combined reactive oxygen species-scavenging and antibacterial abilities[J]. Acta Biomaterialia, 2021, 124: 219-232 DOI:10.1016/j.actbio.2021.02.002. |
| [78] | ZHAO H, HUANG J, LI Y, LV XJ, ZHOU HT, WANG HR, XU YY, WANG C, WANG J, LIU Z. ROS-scavenging hydrogel to promote healing of bacteria infected diabetic wounds[J]. Biomaterials, 2020, 258: 120286 DOI:10.1016/j.biomaterials.2020.120286. |
| [79] | YAO L, LIU QY, LEI ZX, SUN TL. Development and challenges of antimicrobial peptide delivery strategies in bacterial therapy: a review[J]. International Journal of Biological Macromolecules, 2023, 253(Pt 3): 126819. |
| [80] | PAL S, RAMU V, TAYE N, MOGARE DG, YEWARE AM, SARKAR D, REDDY DS, CHATTOPADHYAY S, DAS A. GSH induced controlled release of levofloxacin from a purpose-built prodrug: luminescence response for probing the drug release in Escherichia coli and Staphylococcus aureus[J]. Bioconjugate Chemistry, 2016, 27(9): 2062-2070 DOI:10.1021/acs.bioconjchem.6b00324. |
| [81] | HU DF, DENG YY, JIA F, JIN Q, JI J. Surface charge switchable supramolecular nanocarriers for nitric oxide synergistic photodynamic eradication of biofilms[J]. ACS Nano, 2020, 14(1): 347-359 DOI:10.1021/acsnano.9b05493. |
| [82] | ZHANG CY, GAO J, WANG ZJ. Bioresponsive nanoparticles targeted to infectious microenvironments for sepsis management[J]. Advanced Materials, 2018, 30(43): e1803618 DOI:10.1002/adma.201803618. |
| [83] | LU SZ, GUO XY, ZOU MS, ZHENG ZQ, LI YC, LI XD, LI LL, WANG H. Bacteria-instructed in situ aggregation of AuNPs with enhanced photoacoustic signal for bacterial infection bioimaging[J]. Advanced Healthcare Materials, 2020, 9(1): e1901229 DOI:10.1002/adhm.201901229. |
| [84] | WANG X, WU J, LI PL, WANG LN, ZHOU J, ZHANG GK, LI X, HU BC, XING XD. Microenvironment-responsive magnetic nanocomposites based on silver nanoparticles/gentamicin for enhanced biofilm disruption by magnetic field[J]. ACS Applied Materials & Interfaces, 2018, 10(41): 34905-34915. |
| [85] | LUO XF, CHEN HF, SONG YN, QIN ZD, XU LJ, HE NY, TAN YM, DESSIE W. Advancements, challenges and future perspectives on peptide-based drugs: focus on antimicrobial peptides[J]. European Journal of Pharmaceutical Sciences: Official Journal of the European Federation for Pharmaceutical Sciences, 2023, 181: 106363 DOI:10.1016/j.ejps.2022.106363. |
| [86] | GREBER KE, DAWGUL M. Antimicrobial peptides under clinical trials[J]. Current Topics in Medicinal Chemistry, 2017, 17(5): 620-628. |
| [87] | MASCIO CTM, MORTIN LI, HOWLAND KT, van PRAAGH ADG, ZHANG SX, ARYA A, CHUONG CL, KANG CF, LI TC, SILVERMAN JA. In vitro and in vivo characterization of CB-183, 315, a novel lipopeptide antibiotic for treatment of Clostridium difficile[J]. Antimicrobial Agents and Chemotherapy, 2012, 56(10): 5023-5030 DOI:10.1128/AAC.00057-12. |
| [88] | ZHANG CY, YANG M. Antimicrobial peptides: from design to clinical application[J]. Antibiotics, 2022, 11(3): 349 DOI:10.3390/antibiotics11030349. |
| [89] | MARON B, ROLFF J, FRIEDMAN J, HAYOUKA Z. Antimicrobial peptide combination can hinder resistance evolution[J]. Microbiology Spectrum, 2022, 10(4): e0097322 DOI:10.1128/spectrum.00973-22. |
| [90] | PANT A, DAS B, ARIMBASSERI GA. Host microbiome in tuberculosis: disease, treatment, and immunity perspectives[J]. Front Microbiol, 2023, 14: 1236348 DOI:10.3389/fmicb.2023.1236348. |
| [91] | SHTREIMER KANDIYOTE N, MOHANRAJ G, MAO CW, KASHER R, ARNUSCH CJ. Synergy on surfaces: anti-biofouling interfaces using surface-attached antimicrobial peptides PGLa and magainin-2[J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2018, 34(37): 11147-11155 DOI:10.1021/acs.langmuir.8b01617. |
| [92] | LÜDERS T, BIRKEMO GA, FIMLAND G, NISSEN-MEYER J, NES IF. Strong synergy between a eukaryotic antimicrobial peptide and bacteriocins from lactic acid bacteria[J]. Applied and Environmental Microbiology, 2003, 69(3): 1797-1799 DOI:10.1128/AEM.69.3.1797-1799.2003. |
| [93] | WU XZ, LI Z, LI XL, TIAN YM, FAN YZ, YU CH, ZHOU BL, LIU Y, XIANG R, YANG L. Synergistic effects of antimicrobial peptide DP7 combined with antibiotics against multidrug-resistant bacteria[J]. Drug Design, Development and Therapy, 2017, 11: 939-946 DOI:10.2147/DDDT.S107195. |
| [94] | KIM EY, RAJASEKARAN G, SHIN SY. LL-37-derived short antimicrobial peptide KR-12-a5 and its D-amino acid substituted analogs with cell selectivity, anti-biofilm activity, synergistic effect with conventional antibiotics, and anti-inflammatory activity[J]. European Journal of Medicinal Chemistry, 2017, 136: 428-441 DOI:10.1016/j.ejmech.2017.05.028. |
| [95] | DAI CS, WANG Y, SHARMA G, SHEN JZ, VELKOV T, XIAO XL. Polymyxins-curcumin combination antimicrobial therapy: safety implications and efficacy for infection treatment[J]. Antioxidants, 2020, 9(6): 506 DOI:10.3390/antiox9060506. |
 2024, Vol. 64
2024, Vol. 64