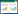中国科学院微生物研究所,中国微生物学会
文章信息
- 王家丽, 蒲秀瑛, 杨帆, 邵文华, 黄梦瑶, 曹伟军, 郑海学, 张伟. 2024
- WANG Jiali, PU Xiuying, YANG Fan, SHAO Wenhua, HUANG Mengyao, CAO Weijun, ZHENG Haixue, ZHANG Wei.
- 敲除LTA4H基因的PK-15细胞系构建及其对口蹄疫病毒复制的影响
- Construction of PK-15 cell line with LTA4H gene knockout and its impact on the replication of foot-and-mouth disease virus
- 微生物学报, 64(3): 733-744
- Acta Microbiologica Sinica, 64(3): 733-744
-
文章历史
- 收稿日期:2023-07-29
- 网络出版日期:2023-12-25
2. 中国农业科学院兰州兽医研究所/兰州大学动物医学与生物安全学院 动物疫病防控全国重点实验室, 甘肃 兰州 730000;
3. 甘肃省病原生物学基础学科研究中心, 甘肃 兰州 730046
2. State Key Laboratory of Animal Disease Prevention and Control, Lanzhou Veterinary Institute, Chinese Academy of Agricultural Sciences/College of Animal Medicine and Biosafety, Lanzhou University, Lanzhou 730000, Gansu, China;
3. Gansu Provincial Research Center of Pathogen Biology, Lanzhou 730046, Gansu, China
白三烯A4水解酶(leukotriene A4 hydrolase, LTA4H)属于肽酶M1家族蛋白,是一种双功能含锌酶,也是重要的抗炎靶点[1],具有环氧化物水解酶和氨基肽酶的活性。作为环氧化物水解酶,LTA4H催化环氧化物白三烯A4 (leukotriene A4, LTA4)水解转化为促炎物质白三烯B4 (leukotriene B4, LTB4),LTA4H主要起化学引诱剂和炎症细胞激活剂的作用,以响应各种刺激反应[2-3]。作为一种氨基肽酶,LTA4H可以处理与炎症和宿主防御相关的肽。此外,LTA4H和5-脂氧合酶(5-lipoxygenase, 5-LOX)作为花生四烯酸(arachidonic acid, AA)代谢途径中5-LOX分支的主要靶点,发挥其经典的生物学功能,包括趋化性、内皮细胞黏附和白细胞活化[4-5],其在炎症的治疗中起着重要作用,是癌症化学预防和化疗的新靶点[6]。
近几年来,对LTA4H基因多态性的研究多集中在癌症及呼吸系统疾病等方面[7],最近的研究表明,LTA4H促进了肿瘤的增殖、迁移和转移[8-9],在几种人类癌症中过表达[10]。在食管腺癌的慢性炎症相关动物模型中,与正常组织相比,LTA4H在肿瘤中过表达[11-12]。Mansoura大学的研究人员报道了一种新的烷型二萜通过抑制LTA4H活性抑制人HCT-116结直肠癌[13]。LTA4H也参与结核病(tuberculosis, TB)中的反常反应(paradoxical reaction, PR),当PR涉及中枢神经系统(central nervous system, CNS)等关键结构时,进行免疫调节治疗[14]。在病毒研究方面,LTA4H水解酶在杆状病毒载体感染昆虫细胞中高水平表达[15]。此外,LTA4H抑制剂MTX通过高亲和力靶向LTA4H抑制促炎介质LTB4的产生,有效抑制宿主的促炎功能和抗病毒免疫,从而促进病毒感染[16]。然而,LTA4H在口蹄疫中的作用尚不清楚,前期本团队通过质谱筛选发现口蹄疫病毒3B蛋白可能与LTA4H相互作用(质谱分析图数据已提交国家微生物科学数据中心,编号:NMDCX0000244),但具体调控机制不清楚。为此本团队在PK-15细胞上构建LTA4H缺失细胞系,研究LTA4H蛋白是否能够调控病毒的复制,为后续LTA4H功能研究及抗病毒机制研究提供理论依据。
口蹄疫(foot-and-mouth disease, FMD)是一种由口蹄疫病毒(foot-and-mouth disease virus, FMDV)感染偶蹄类动物的传染病,目前发现猪、牛、羊等多种易感动物。由于口蹄疫的巨大危害性,被世界动物卫生组织(World Organization for Animal Health, WAHO)列为一种最具传染性的疫病。FMDV属于小RNA病毒科、口蹄疫病毒属[17-18],无囊膜,包含一个约8 500 bp的单股正链RNA基因组[19]。FMDV的基因组本身只编码12种蛋白质,然而这些蛋白不足以完成自身的生命周期,因此必须借助宿主细胞。宿主细胞蛋白种类繁多,功能多样,其中一些蛋白质功能的发挥有利于病毒生长,另一些蛋白质功能的发挥威胁病毒生存。宿主细胞被病毒感染,感染过程一方面采用了能够表达蛋白质或复制其基因组和子代的机制组装病毒粒子,另一方面病毒需要以某种方式避免被宿主清除,包括逃避免疫监视、抑制免疫相关基因表达、诱导凋亡等。
本研究发现宿主蛋白LTA4H在调控FMDV复制中有重要作用,采用CRISPR/Cas9基因编辑技术,在PK-15细胞上成功构建了LTA4H缺失细胞系,通过RT-qPCR、Western blotting和病毒滴度测定试验,评价LTA4H对FMDV感染的PK-15细胞的作用,为进一步阐明LTA4H促进FMDV复制及调控FMDV复制机制提供理论依据。
1 材料与方法 1.1 载体、细胞及病毒CRISPR/Cas9载体质粒pX459-puro-MCS、PK-15细胞、BHK-21细胞、FMDV (O/BY/CHA/2010)来源于中国农业科学院兰州兽医研究所口蹄疫与新发病流行病学团队与国家口蹄疫参考实验室。
1.2 试剂及抗体DMEM细胞培养基及0.25% EDTA胰酶购自Gibco公司;大肠杆菌DH5α感受态细胞、T4 DNA连接酶购自宝生物工程(大连)有限公司;胎牛血清(fetal bovine serum, FBS)购自Biological Industries (BI)公司;蛋白预染Marker、TRIzol试剂等均购自Invitrogen公司;Western blotting抗体稀释液购自上海碧云天生物技术有限公司;10×LA Taq酶购自康为世纪生物科技股份有限公司;Prime ScriptTM TMRT Reagent Kit with gDNA Eraser反转录试剂盒、RT-qPCR试剂盒TB GreenTM Premix Ex TaqTM Ⅱ购自南京诺唯赞生物科技股份有限公司;胶回收试剂盒、质粒提取试剂盒购自OMEGA公司;jet PRIME Transfection Reagent购自Polyplus Transfection公司;蛋白检测显色试剂盒(PierceTM ECL Western Blotting Substrate)购自ThermoFisher Scientific公司;限制性核酸内切酶Bbs Ⅰ购自NEB公司;LTA4H抗体购自Proteintech公司;β-actin抗体购自Santa Cruz公司;VP1单抗由兰州兽医研究所流行病学团队保存;辣根过氧化物酶(horseradish peroxidase, HRP)标记的山羊抗兔IgG抗体、HRP标记的山羊抗鼠IgG抗体购自Sigma-Aldrich公司。
1.3 sgRNA引物的设计及合成利用NCBI数据库查询LTA4H基因序列(Transcript: ENSSSCT00000000975.4),根据CRISPR/Cas9设计原则[20-21],并基于张峰实验室网站(http://crispr.mit.edu/)推荐,在LTA4H基因的外显子区域设计2条sgRNA序列,结果如表 1所示。
| Primer names | Primer sequences (5′→3′) |
| LTA4H-sgRNA1-F | GCAGCGTCGACTTTACTCGC |
| LTA4H-sgRNA1-R | GCGAGTAAAGTCGACGCTGC |
| LTA4H-sgRNA2-F | TTACTCGCCGGGTACTGACC |
| LTA4H-sgRNA2-R | GGTCAGTACCCGGCGAGTAA |
1.4 重组质粒pX459-sgRNA的构建
将上述sgRNA上下游引物稀释至100 μmol/L,配制共10 μL反应体系:上游引物(10 μmol/L) 4.5 μL,下游引物(10 μmol/L) 4.5 μL,10×LATaq酶1 μL,轻轻混匀。退火程序:95 ℃ 10 min;退火完成后室温静置,形成双链DNA。利用Bbs Ⅰ内切酶酶切pX459-puro-MCS载体,经1%琼脂糖凝胶电泳后,胶回收酶切片段。将胶回收获取的线性化酶切产物与sgRNA序列在T4连接酶作用下进行连接,然后转化到DH5α感受态细胞,涂布于氨苄青霉素抗性的LB平板上,37 ℃倒置培养过夜,选择单克隆培养物,用菌液PCR对阳性克隆进行鉴定筛选,提取质粒送西安擎科生物科技有限公司测序。
1.5 细胞的转染与筛选复苏PK-15细胞于T25细胞培养瓶中,放置37 ℃、5% CO2温箱中培养,传代细胞1–2次,待细胞状态稳定后,按每孔2×105个细胞的密度接种至6孔板中,细胞生长密度至70%−80%后,根据Poly plus的标准转染程序,将2 μg的CRISPR重组质粒转染进PK-15细胞,生长1 d后消化细胞,按照1:3比例传代到6孔板中,同时每孔细胞中加入终浓度3 μg/mL的嘌呤霉素加压筛选3 d,剔除大量sgRNA阴性细胞,更换正常培养基使阳性细胞正常生长1 d后,使用有限稀释法进行亚克隆,将细胞稀释至10个/mL细胞,接种于96孔板中,每孔100 μL,即每孔中有1个细胞,筛选7 d。标记状态良好的单克隆细胞孔,加胰酶消化后混匀,传代至48孔板继续培养,待细胞长满,选取细胞状态良好的孔传代至24孔板并进行测序鉴定。
1.6 基因测序鉴定取待鉴定单克隆细胞株,使用细胞微量DNA提取试剂盒提取DNA,用LTA4H鉴定引物扩增含有sgRNA靶向位点的片段后,使用1%琼脂糖凝胶对质粒大小进行鉴定,胶回收后扩增产物,进行测序。对扩增产物的测序结果进行序列分析比对。将测序结果中显示为套峰或基因突变的样品进行进一步分析,将扩增片段连接到T载体上进行连接转化,随机选取8株单克隆细菌进行重测序和鉴定。
1.7 细胞活力检测将野生型(wild type, WT) PK-15细胞和LTA4H基因敲除PK-15细胞系消化后计数,调整细胞密度为1×105–2×105个/mL,每孔100 μL接种至96孔板,在细胞培养箱培养12 h后;加入CCK-8溶液,10 μL/孔,注意不要向孔中引入气泡。置于细胞培养箱继续培养2−4 h,测定细胞个数,分析活力。
1.8 细胞生长速率测定将WT型PK-15、LTA4H-KO-1和LTA4H-KO-2细胞调整密度为1×105–2×105个/mL,每孔100 μL接种至96孔中,分别于0、2、4、6、8、10、12 h测定细胞个数,制作细胞的生长曲线。
1.9 RT-qPCR检测将WT型PK-15、LTA4H-KO-1和LTA4H-KO-2细胞分别铺于6孔板中,待细胞长满后感染FMDV,于0、6、12、24 h分别收取细胞,用Trizol裂解法提取细胞总RNA,测定浓度后,利用Prime ScriptTM TMRT Reagent Kit with gDNA Eraser反转录试剂盒进行反转录获得cDNA。配制总反应体系:TB GreenTM Premix Ex TaqTM Ⅱ 10 μL,FMDV相对定量上游引物FMDV-F (5′-CACTGGTGACAGGCTAAGG-3′)和下游引物FMDV-R (5′-CCCTTCTCAGATTCCG AGT-3′)各0.4 μL,ddH2O 8.2 μL,cDNA 1 μL,共20 μL。RT-qPCR反应程序:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s (收集荧光),共40个循环。GAPDH作为内参基因,对FMDV mRNA的相对表达水平进行定量,所有试验设置3个重复,用2−∆∆Ct方法分析数据。
1.10 Western blotting分析病毒蛋白的表达为了研究敲除LTA4H基因之后对FMDV蛋白水平的影响,将LTA4H基因敲除PK-15细胞系(LTA4H-KO-1和LTA4H-KO-2)和野生型PK-15细胞(WT)分别铺6孔板,待细胞长满后感染FMDV,分别于0、6、12、24 h收取细胞样品。加入上样缓冲液混匀,金属浴100 ℃煮沸15 min,室温静置冷却。利用定量结果确定上样体积,上样量一般为20−40 μL。蛋白样品经SDS-PAGE电泳后,冰水浴中100 V恒压转NC膜1.5 h。5%脱脂奶粉封闭1−2 h。β-actin抗体(Santa Cruz) 1:1 000倍比稀释;LTA4H的抗体(Cat No.11315-1-AP) 1:1 000倍比稀释;VP1单克隆抗体(由本实验室制备保存) 1:1 000倍比稀释。一抗4 ℃孵育过夜。辣根过氧化物酶(HRP)标记的相应二抗1:5 000倍比稀释,二抗室温孵育1 h。蛋白检测用Thermo Fisher Scientific公司的显色试剂盒1:1配制,图片经Image Lab 4.1软件(Bio-Rad)扫描成像。
1.11 病毒滴度在LTA4H基因敲除PK-15细胞系LTA4H-KO-1、LTA4H-KO-2和野生型PK-15细胞(WT)中分别比较了病毒滴度的差异,将FMDV分别感染LTA4H-KO-1、LTA4H-KO-2和WT细胞,不同时间点收取样品。反复冻融3次后,用无血清的DMEM将获得细胞样品进行10−3–10−7倍梯度稀释,将各梯度稀释毒液分别接种于单层BHK-21细胞的96孔细胞培养板中,每个稀释度做8个重复孔,每个孔100 μL。置于37 ℃、5% CO2恒温培养箱中培养,每隔12 h观察并记录细胞病变效应(cytopathy effect, CPE)情况,观察3 d。根据Reed-Muench法计算扩增病毒的TCID50。
1.12 一步生长曲线分别将LTA4H基因敲除PK-15细胞系LTA4H-KO和野生型PK-15细胞(WT)铺于6孔板中,细胞生长密度至70%−80%后,感染FMDV,于0、4、8、12 h分别收取样品,反复冻融3次后,做病毒滴度试验,每个稀释度做8个重复孔。置于37 ℃、5% CO2恒温培养箱中培养并观察3 d,每隔12 h观察并记录细胞病变效应(CPE)情况,根据Reed-Muench法计算扩增病毒的TCID50。
1.13 统计学分析实验数据使用Graph pad Prism 8. 01软件,通过统计学方法进行数据分析并作图。同一时间点重复3次试验,使用t-test检验法进行显著性差异分析。*:P<0.05;**:P<0.01;***:P<0.001。
2 结果与分析 2.1 pX459-LTA4H-sgRNA的鉴定根据CRISPR/Cas9设计原则,利用CRISPR网站在LTA4H基因的第1个外显子区域的327 bp位置和339 bp位置分别设计了2条sgRNA序列(图 1)。单链的sgRNA退火过程中形成双链片段,分别构建至载体pX459-puro-MCS中,提取质粒送测序。基因测序结果显示具有靶向LTA4H基因同一外显子的sgRNA重组质粒构建成功,重组质粒分别命名为pX459-LTA4H-gRNA-1和pX459-LTA4H-gRNA-2。
|
| 图 1 猪LTA4H敲除重组质粒的构建 Figure 1 Construction of the porcine LTA4H knockout recombinant plasmid. PAM sequences are underlined and highlighted in green; sgRNA targeting sites are underlined and highlighted in red; Red vertical bar arrows indicate gRNA targeting sites. |
2.2 敲除LTA4H基因的PK-15细胞系的构建与鉴定
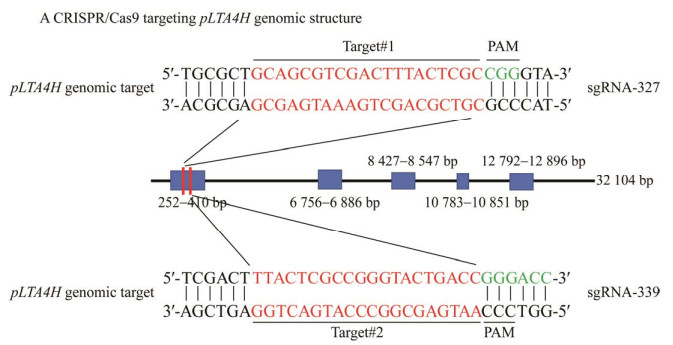
将重组质粒pX459-LTA4H-gRNA-1和pX459-LTA4H-gRNA-2分别转染PK-15细胞,转染24 h后加入嘌呤霉素筛选,一周后单个细胞克隆形成后转移至48孔板,于37 ℃、5% CO2培养箱中,添加DMEM培养基中[10%胎牛血清和1%抗生素(penicilin-streptomycin)]扩大培养。收集不同细胞克隆分别在DNA水平和蛋白水平进行鉴定;扩增产物进行基因测序,结果如图 2A和2B所示,在LTA4H基因第1个外显子的327 bp预定切割位置处[距离PAM基序(CGG)第4个和5个碱基之间]有1个碱基的插入,在LTA4H基因第1个外显子的339 bp预定切割位置处[距离PAM基序(GGG)第3个和4个碱基之间]有1个碱基的缺失。
|
| 图 2 LTA4H基因敲除细胞系的构建与鉴定 Figure 2 Construction and identification of LTA4H knockout cell lines. A:LTA4H-KO-1细胞系基因缺失突变型分析图. B:LTA4H-KO-2细胞系基因缺失突变型分析图. C:Western blotting筛选LTA4H敲除图. D:Western blotting检测敲除细胞系中LTA4H基因的蛋白水平 A: Analysis of gene deletion mutant types in LTA4H-KO-1 cell lines. B: Analysis of gene deletion mutant types in LTA4H-KO-2 cell lines. C: LTA4H knockdown map screened by Western blotting. D: Protein levels of the LTA4H gene in the knockdown cell lines were determined by Western blotting. |
蛋白水平鉴定,收集不同细胞克隆进行制样,利用Western blotting检测LTA4H的蛋白水平表达,初步筛选出3株疑似敲除细胞如图 2C所示,转染重组质粒pX459-LTA4H-gRNA-1筛选到的细胞分别命名为:PK-15-LTA4H-1-5、PK-15-LTA4H-1-23;转染重组质粒pX459-LTA4H-gRNA-2筛选到的细胞命名为:PK-15-LTA4H-2-5。将上述细胞进行传代培养,待细胞状态稳定,再次进行蛋白水平检测,结果如图 2D所示,最终选定2株细胞:PK-15-LTA4H-1-23、PK-15-LTA4H-2-5为敲除细胞,重新命名为:LTA4H-KO-1、LTA4H-KO-2,且细胞系中均检测不到LTA4H的蛋白表达。Western blotting检测时使用LTA4H的抗体,上述结果表明,LTA4H基因敲除PK-15细胞系构建成功。
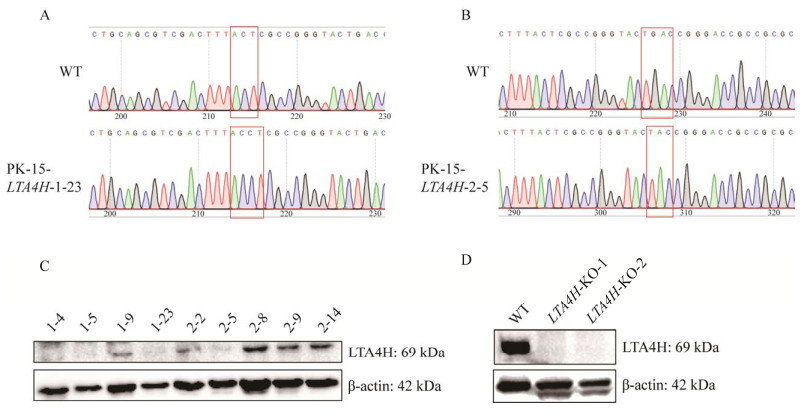
2.3 细胞活力检测将WT型PK-15细胞、LTA4H-KO-1和LTA4H-KO-2细胞接种至96孔板,培养12 h后,加CCK-8溶液10 μL/孔,放温箱继续培养1−4 h,用酶标仪测定每孔的OD450,分析数据。结果显示,LTA4H基因敲除PK-15细胞与野生型PK-15细胞的细胞活力相似(图 3A)。重新消化LTA4H-KO细胞和WT细胞,铺96孔板,培养一定时间后,加CCK-8溶液,分别于0、2、4、6、8、10、12 h用酶标仪测定每孔的OD450。结果显示LTA4H-KO细胞和WT细胞的生长速率相同,表明LTA4H基因的敲除并不影响宿主细胞的正常生长(图 3B)。
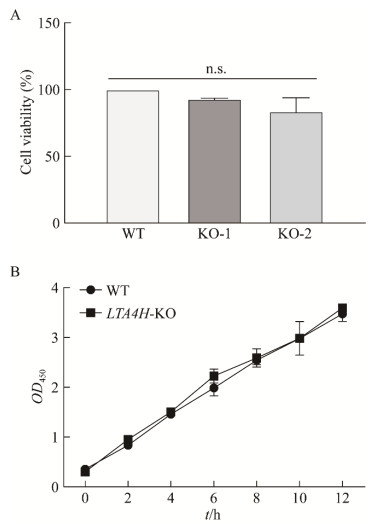
|
| 图 3 LTA4H基因功能缺失细胞系LTA4H-KOs细胞活力检测 Figure 3 Cell viability assay of LTA4H-deficient cell line LTA4H-KOs. A:LTA4H-KOs细胞系细胞活力检测. B:LTA4H-KOs细胞系细胞生长速率图 A: Cell viability assay of LTA4H-KOs cell line. B. Plot of cell growth rate of the LTA4H-KOs cell line. The "n.s." in the plot represent there was no significant difference with the WT (P>0.05). |
2.4 敲除LTA4H基因对FMDV复制的影响
将LTA4H基因敲除PK-15细胞系细胞LTA4H-KO-1、LTA4H-KO-2与野生型PK-15细胞(WT)感染FMDV,于不同时间点收样,提取RNA反转录,做RT-qPCR试验。以GAPDH作为内参基因,对FMDV的相对表达水平进行定量。结果如图 4所示,敲除LTA4H之后会显著抑制FMDV复制。
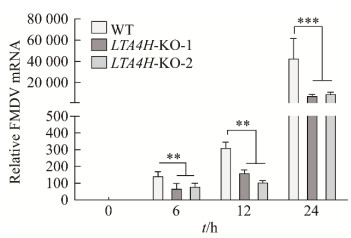
|
| 图 4 相对定量检测FMDV在WT和LTA4H-KOs细胞中的复制 Figure 4 Relative quantification of FMDV replication in WT and LTA4H-KOs cells. The "**" in the plot represent significant difference compared with the WT (P<0.01); The "***" in the plot represent a very significant difference from the WT (P<0.001). |
2.5 敲除LTA4H基因对蛋白表达的影响
在LTA4H-KO细胞和WT细胞分别感染FMDV后,分别于0、6、12、24 h收取样品,进行Western blotting分析,并对结果进行灰度扫描,结果如图 5所示,在细胞感染FMDV后收取的样品中,与WT细胞相比表达在6、12和24 h分别下降87%、83%和58%。在病毒感染24 h后,细胞病变严重,脱落,收集到的细胞量较少,导致内参蛋白表达量明显下降。
|
| 图 5 Western blotting检测FMDV在WT和LTA4H-KO细胞中的蛋白水平 Figure 5 FMDV protein levels in WT and LTA4H-KO cells measured by Western blotting. |
2.6 敲除LTA4H基因对病毒滴度的影响
将FMDV分别感染LTA4H-KO和WT细胞,不同时间点收取病毒液,反复冻融3次并离心后,测定TCID50。结果如图 6所示,在感染FMDV接毒后收取的样品中,与WT细胞相比,LTA4H基因敲除引起病毒滴度降低。在12 h时,病毒滴度降低约14.7%;24 h时,病毒滴度降低约21.1%。说明LTA4H基因功能缺失单克隆细胞系能够显著抑制FMDV的复制。
|
| 图 6 LTA4H-KO细胞中口蹄疫病毒的病毒滴度检测 Figure 6 Viral titer determination of foot-and-mouth disease virus in LTA4H-KO cells. The "**" in the plot represent significant difference compared with the WT (P<0.01). |
2.7 FMDV在敲除LTA4H细胞上的一步生长曲线
将LTA4H-KO细胞和野生型PK-15细胞(WT)感染FMDV,在0、4、8、12 h分别收取细胞上清,测定病毒滴度。结果如图 7所示,LTA4H-KO细胞的病毒滴度显著低于野生型细胞。
|
| 图 7 FMDV在LTA4H-KO细胞上的一步生长曲线图 Figure 7 One-step growth profile of FMDV on LTA4H-KO cells. The "*" in the plot represent significant difference compared with the control (P<0.05); the "***" in the plot represent a very significant difference from the WT (P<0.001). |
3 讨论与结论
本研究采用基因编辑技术(CRISPR/Cas9)成功构建了LTA4H基因敲除的PK-15细胞系。构建重组质粒pX459-LTA4H-gRNA-1和pX459-LTA4H-gRNA-2,转染PK-15细胞后,使用嘌呤霉素加压筛选,剔除了大量pX459-LTA4H-gRNA-1和pX459-LTA4H-gRNA-2阴性细胞,用有限稀释法获得单克隆细胞系,在候选细胞系中提高了靶基因的敲除效率。通过测序和蛋白表达水平鉴定,成功获得了LTA4H基因敲除细胞系。对野生型细胞和敲除细胞进行细胞活力检测,结果表明,敲除细胞系细胞生长状态和生长速率与野生型细胞相比无显著差异,以保证后续相关试验的有效性,为进一步研究LTA4H基因敲除细胞系的病毒感染及蛋白水平检测奠定了一定的基础。本试验中利用LTA4H敲除细胞系,在感染FMDV后,与野生型PK-15细胞相比,mRNA转录水平、蛋白表达水平及病毒滴度在不同时间点均显著降低,表明LTA4H对FMDV的复制具有重要的调控作用。
CRISPR/Cas9系统对基因的定向识别和剪切是由sgRNA和Cas9实现的,sgRNA决定了Cas9的靶向性,也决定了Cas9的切割活性[22]。CRISPR/Cas9技术具有操作方便、成本低、靶向效率高等优点,广泛应用于基因功能研究、疾病治疗和制药行业[23]。同时,利用CRISPR/Cas9基因编辑技术可以实现基因敲入、敲除、沉默等多种形式的靶基因的高效编辑[24-26],克服了以往基因编辑技术遇到的障碍与瓶颈。目前,詹群美[27]已通过CRISPR-Cas9技术制备了肌肉生成抑制素(myostatin, MSTN)基因编辑巴马香猪,显著提高了巴马香猪的生长速率和瘦肉百分率。在疫病防治方面,使用CRISPR/Cas9基因编辑技术可以有效预防和治疗HYAL2基因功能丧失后的羊肺腺癌综合征[28]。有团队通过CRISPR-Cas9制备出了同时抗猪繁殖与呼吸综合征、猪传染性胃肠炎病毒、猪德尔塔冠状病毒等3种重大疫病的基因猪。Sato等[29]利用CRISPR/Cas9系统成功敲除了猪的GGTA1基因,消除了猪和人的异种器官移植免疫排斥问题。冉乾东等[30]也通过CRISPR-Cas9技术成功构建了KLHL34基因敲除的PK-15细胞系,显著促进FMDV的复制,以提高病毒滴度和抗原产量。可见,随着基因编辑技术的发展和对新的疾病有效靶点的不断认识,人们通过编辑有效的致病基因或突变来治疗疾病在临床上已成为可能。本研究基于CRISPR/Cas9技术成功构建获得LTA4H基因敲除PK-15细胞,为今后深入研究LTA4H基因在猪源疾病感染中的作用机理提供了技术支撑。
RNA结合代谢酶LTA4H是癌症化学预防和化疗的新靶[2]。LTA4H基因在有丝分裂细胞周期、DNA修复、RNA剪接相关通路和RNA代谢通路中显著富集,这说明LTA4H具有肿瘤相关的可变剪接调控功能[9]。最近的研究表明,LTA4H在喉鳞状细胞癌(squamous cell carcinoma of the larynx, LSCC)中的表达增加促进了肿瘤的增殖、迁移和转移[31]。Wan等开发了一种酶激活的荧光探针,通过将LTA4H的特定识别单元与红色荧光团结合,用于癌症诊断中LTA4H的活性检测[32]。LTA4H是一种双功能锌金属酶,它通过环氧化物水解酶活性处理LTA4,也能够通过其氨基肽酶活性一次从N端肽底物中剪裁一个氨基酸,来确定LTA4H的氨基肽酶特异性,发现LTA4H识别的最佳蛋白质生成氨基酸是精氨酸,可以用于设计这种酶的有效抑制剂[33]。然而,LYS006作为LTA4H的一种抑制剂,不仅可以减少促炎LTB4,还可以诱导脂质介质类型从促炎到促溶解的转换,从而有助于慢性炎症的解决[34]。目前关于LTA4H基因与病毒关系的研究并不多,且相关基因调控的具体分子生物学机制还不清楚,需要进一步研究。本研究成功构建了LTA4H基因敲除细胞系,表明敲除细胞相比未敲除LTA4H的细胞,可以抑制病毒复制及病毒毒力增强。因此,RNA结合代谢酶LTA4H可以促进FMDV复制。根据试验结果猜测宿主蛋白LTA4H与病毒蛋白3B相互作用,并且通过稳定3B蛋白来促进FMDV复制。因此,利用LTA4H蛋白抑制剂研发小分子药物,为未来预防或抑制FMDV感染提供一种可行策略。
综上所述,本研究利用CRISPR/Cas9基因编辑技术实现了LTA4H基因的高效编辑,为其他基因敲除细胞系的建立提供了参考。LTA4H基因敲除细胞系的建立能为LTA4H调控FMDV复制的研究奠定基础,也能够为进一步开展LTA4H调控其他病毒复制的机制研究提供思路,也能够为预防或治疗FMDV提供一个新的药物靶标。
| [1] | QIN R, WANG H, YAN A. Classification and QSAR models of leukotriene A4 hydrolase (LTA4H) inhibitors by machine learning methods[J]. SAR and QSAR in Environmental Research, 2021, 32(5): 411-431 DOI:10.1080/1062936X.2021.1910862. |
| [2] | VO TTL, JANG WJ, JEONG CH. Leukotriene A4 hydrolase: an emerging target of natural products for cancer chemoprevention and chemotherapy[J]. Annals of the New York Academy of Sciences, 2018, 1431(1): 3-13 DOI:10.1111/nyas.13929. |
| [3] | HE R, CHEN Y, CAI Q. The role of the LTB4-BLT1 axis in health and disease[J]. Pharmacological Research, 2020, 158: 104857 DOI:10.1016/j.phrs.2020.104857. |
| [4] | HAEGGSTRÖM JZ. Leukotriene biosynthetic enzymes as therapeutic targets[J]. Journal of Clinical Investigation, 2018, 128(7): 2680-2690 DOI:10.1172/JCI97945. |
| [5] | OH DY, OLEFSKY JM. G protein-coupled receptors as targets for anti-diabetic therapeutics[J]. Nature Reviews Drug Discovery, 2016, 15(3): 161-172 DOI:10.1038/nrd.2015.4. |
| [6] |
YAN HB. Systematic mining and functional analysis of four tapeworm proteases and their inhibitors[D]. Beijing: Doctoral Dissertation of Chinese Academy of Agricultural Sciences, 2013 (in Chinese). 闫鸿斌. 四种绦虫蛋白酶及其抑制剂的系统挖掘与功能分析[D]. 北京: 中国农业科学院博士学位论文, 2013. |
| [7] |
汪文斐, 朱宇珍, 崔淑俊, 段艳辉, 张福萍, 张洁云, 陈心春, 黄功华, 张明霞. LTA4H基因单核苷酸多态性与肺结核易感性的相关性研究[J]. 新发传染病电子杂志, 2017, 2(4): 202-204.
WANG WF, ZHU YZ, CUI SJ, DUAN YH, ZHANG FP, ZHANG JY, CHEN XC, HUANG GH, ZHANG MX. Association between LTA4H gene polymorphism and susceptibility to tuberculosis[J]. Electronic Journal of Emerging Infectious Diseases, 2017, 2(4): 202-204 (in Chinese). |
| [8] |
袁荣荣, 张宏, 陈静, 周畅, 姚倩倩, 张晨. LTA4H基因多态性及吸烟对动脉粥样硬化型脑梗死发生影响[J]. 青岛大学医学院学报, 2014, 50(6): 512-515.
YUAN RR, ZHANG H, CHEN J, ZHOU C, YAO QQ, ZHANG C. Influence of LTA4H gene polymorphism and smoking on atherosclerotic cerebral infarction[J]. Journal of Qingdao University (Medical Sciences), 2014, 50(6): 512-515 (in Chinese). |
| [9] | REN TJ, WANG S, ZHANG B, ZHOU W, WANG CS, ZHAO XR, FENG J. LTA4H extensively associates with mRNAs and lncRNAs indicative of its novel regulatory targets[J]. PeerJ, 2023, 11: e14875 DOI:10.7717/peerj.14875. |
| [10] | OI N, YAMAMOTO H, LANGFALD A, BAI RH, LEE MH, BODE AM, DONG ZG. LTA4H regulates cell cycle and skin carcinogenesis[J]. Carcinogenesis, 2017, 38(7): 728-737 DOI:10.1093/carcin/bgx049. |
| [11] |
张瑛, 郝飞. 白三烯B4及其受体与肿瘤的关系[J]. 实用皮肤病学杂志, 2009, 2(1): 28-30.
ZHANG Y, HAO F. Relationship between leukotriene B4 and its receptor and tumor[J]. Journal of Practical Dermatology, 2009, 2(1): 28-30 (in Chinese). |
| [12] |
YANG JH. Association between leukotriene A4 hydrolase gene polymorphism and susceptibility to tuberculosis in Chinese[D]. Shanghai: Master's Thesis of Fudan University, 2012 (in Chinese). 杨景卉. 白三烯A4水解酶基因多态性与中国人结核易感性的相关性研究[D]. 上海: 复旦大学硕士学位论文, 2012. |
| [13] | EL-NAGGAR MH, MIRA A, ABDEL BAR FM, SHIMIZU K, AMER MM, BADRIA FA. Synthesis, docking, cytotoxicity, and LTA4H inhibitory activity of new gingerol derivatives as potential colorectal cancer therapy[J]. Bioorganic & Medicinal Chemistry, 2017, 25(3): 1277-1285. |
| [14] | KUMAR SS, SOLOMON R, GAUTAM P, INBARAJ LR, SIVADASAN A, MICHAEL JS, KARTHIK R, VARGHESE GM, CHRISTUDASS CS, SAMUEL P, MANESH A. Leukotriene A4 hydrolase (LTA4H rs17525495) gene polymorphisms and paradoxical reactions in extrapulmonary tuberculosis[J]. Scientific Reports, 2023, 13: 3746 DOI:10.1038/s41598-023-30923-2. |
| [15] | GIERSE JK, LUCKOW VA, ASKONAS LJ, DUFFIN KL, AYKENT S, BILD GS, RODI CP, SULLIVAN PM, BOURNER MJ, KIMACK NM, KRIVI GG. High-level expression and purification of human leukotriene A4 hydrolase from insect cells infected with a baculovirus vector[J]. Protein Expression and Purification, 1993, 4(5): 358-366 DOI:10.1006/prep.1993.1047. |
| [16] | FANG MQ, TANG XP, ZHANG J, LIAO ZY, WANG G, CHENG RM, ZHANG ZY, ZHAO HW, WANG J, TAN ZX, KAMAU PM, LU QM, LIU Q, DENG GH, LAI R. An inhibitor of leukotriene-A4 hydrolase from bat salivary glands facilitates virus infection[J]. Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(10): e2110647119. |
| [17] |
梁剑平, 陈积红, 尚若峰, 崔颖, 王学红, 华兰英, 罗永江. 光与氧对金丝桃蛋白复合物抗口蹄疫病毒的活性的影响[J]. 中国动物保健, 2005, 7(11): 29-30.
LIANG JP, CHEN JH, SHANG RF, CUI Y, WANG XH, HUA LY, LUO YJ. Influence of light and oxygen on the activity of hypericum protein complex against FMD virus[J]. China Animal Health, 2005, 7(11): 29-30 (in Chinese). |
| [18] | LI KL, WANG CC, YANG F, CAO WJ, ZHU ZX, ZHENG HX. Virus-host interactions in foot-and-mouth disease virus infection[J]. Frontiers in Immunology, 2021, 12: 571509 DOI:10.3389/fimmu.2021.571509. |
| [19] | LI SF, GONG MJ, SUN YF, SHAO JJ, ZHANG YG, CHANG HY. Antiviral activity of brequinar against foot-and-mouth disease virus infection in vitro and in vivo[J]. Biomedicine & Pharmacotherapy, 2019, 116: 108982. |
| [20] | JENSEN MK. Design principles for nuclease-deficient CRISPR-based transcriptional regulators[J]. FEMS Yeast Research, 2018, 18(4): foy039. |
| [21] | ZHANG W, WANG Q, YANG F, ZHU ZX, DUAN YY, YANG Y, CAO WJ, ZHANG KS, MA JW, LIU XT, ZHENG HX. JMJD6 negatively regulates cytosolic RNA induced antiviral signaling by recruiting RNF5 to promote activated IRF3 K48 ubiquitination[J]. PLoS Pathogens, 2021, 17(3): e1009366 DOI:10.1371/journal.ppat.1009366. |
| [22] |
LIU K. Establishment of transcription activation system mediated by CRISPR/Cas9 and its experimental study in vitro[D]. Xi'an: Master's Thesis of Shaanxi Normal University, 2016 (in Chinese). 刘宽. CRISPR/Cas9介导的转录激活系统的建立及其体外实验研究[D]. 西安: 陕西师范大学硕士学位论文, 2016. |
| [23] |
詹长生, 夏小雨. 基于CRISPR-Cas9技术的基因治疗研究进展[J]. 生物工程学报, 2016, 32(7): 861-869.
ZHAN CS, XIA XY. Research progress of CRISPR-Cas9 system for gene therapy[J]. Chinese Journal of Biotechnology, 2016, 32(7): 861-869 (in Chinese). |
| [24] | LIU SC, FENG YL, SUN XN, CHEN RD, LIU Q, XIAO JJ, ZHANG JN, HUANG ZC, XIANG JF, CHEN GQ, YANG Y, LOU C, LI HD, CAI Z, XU SM, LIN H, XIE AY. Target residence of Cas9-sgRNA influences DNA double-strand break repair pathway choices in CRISPR/Cas9 genome editing[J]. Genome Biology, 2022, 23(1): 165 DOI:10.1186/s13059-022-02736-5. |
| [25] | XU H, XIAO TF, CHEN CH, LI W, MEYER CA, WU Q, WU D, CONG L, ZHANG F, LIU JS, BROWN M, LIU XS. Sequence determinants of improved CRISPR sgRNA design[J]. Genome Research, 2015, 25(8): 1147-1157 DOI:10.1101/gr.191452.115. |
| [26] | JINEK M, CHYLINSKI K, FONFARA I, HAUER M, DOUDNA JA, CHARPENTIER E. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity[J]. Science, 2012, 337(6096): 816-821 DOI:10.1126/science.1225829. |
| [27] |
ZHAN QM. Production of MSTN gene knockout Bama minipigs by CRISPR/Cas9 gene editing technology[D]. Foshan: Master' Thesis of Foshan Institute of Science and Technology, 2020 (in Chinese). 詹群美. 利用CRISPR/Cas9基因编辑技术生产MSTN基因敲除巴马香猪[D]. 佛山: 佛山科学技术学院硕士学位论文, 2020. |
| [28] | WHITELAW B. Abstracts from the UC Davis transgenic animal research conference Ⅸ[J]. Transgenic Research, 2014, 23(1): 187-210 DOI:10.1007/s11248-013-9761-0. |
| [29] | SATO M, MIYOSHI K, NAGAO Y, NISHI Y, OHTSUKA M, NAKAMURA S, SAKURAI T, WATANABE S. The combinational use of CRISPR/Cas9-based gene editing and targeted toxin technology enables efficient biallelic knockout of the α-1,3-galactosyltransferase gene in porcine embryonic fibroblasts[J]. Xenotransplantation, 2014, 21(3): 291-300 DOI:10.1111/xen.12089. |
| [30] |
冉乾东, 杨帆, 张伟, 曹伟军, 郑海学, 蔺国珍. CRISPR/Cas9介导的KLHL34基因敲除细胞系的建立及其应用[J]. 中国兽医科学, 2023, 53(7): 851-857.
RAN QD, YANG F, ZHANG W, CAO WJ, ZHENG HX, LIN GZ. Establishment and application of KLHL34 gene knockout cell line mediated by CRISPR/Cas9[J]. Chinese Veterinary Science, 2023, 53(7): 851-857 (in Chinese). |
| [31] | WU YG, LI XY, PANG TZ, LI WM, PAN XL. MiR-370 targeted FoxM1 functions as a tumor suppressor in laryngeal squamous cell carcinoma (LSCC)[J]. Biomedicine & Pharmacotherapy, 2014, 68(2): 149-154. |
| [32] | WAN XX, WANG H, SHI B, GUO Y, LIU SY, WANG X. An enzyme activated fluorescent probe for LTA4H activity sensing and its application in cancer screening[J]. Talanta, 2023, 253: 123887 DOI:10.1016/j.talanta.2022.123887. |
| [33] | BYZIA A, HAEGGSTRÖM JZ, SALVESEN GS, DRAG M. A remarkable activity of human leukotriene A4 hydrolase (LTA4H) toward unnatural amino acids[J]. Amino Acids, 2014, 46(5): 1313-1320 DOI:10.1007/s00726-014-1694-2. |
| [34] | MARKERT C, THOMA G, SRINIVAS H, BOLLBUCK B, LÜÖND RM, MILTZ W, WÄLCHLI R, WOLF R, HINRICHS J, BERGSDORF C, AZZAOUI K, PENNO CA, KLEIN K, WACK N, JÄGER P, HASLER F, BEERLI C, LOETSCHER P, DAWSON J, WIECZOREK G, et al. Discovery of LYS006, a potent and highly selective inhibitor of leukotriene A4 hydrolase[J]. Journal of Medicinal Chemistry, 2021, 64(4): 1889-1903 DOI:10.1021/acs.jmedchem.0c01955. |
 2024, Vol. 64
2024, Vol. 64