中国科学院微生物研究所,中国微生物学会
文章信息
- 马莹, 姜岸, 石孝均, 李振轮, 陈新平. 2024
- MA Ying, JIANG An, SHI Xiaojun, LI Zhenlun, CHEN Xinping.
- 微生物胞外多糖的合成及其在重金属修复中的作用机制与应用
- Synthesis of microbial exopolysaccharides and their mechanisms and applications in heavy metal remediation
- 微生物学报, 64(3): 701-719
- Acta Microbiologica Sinica, 64(3): 701-719
-
文章历史
- 收稿日期:2023-09-30
- 网络出版日期:2023-12-20
全球经济的迅速发展不仅带来了社会进步和人民福祉的提升,还伴随着农业实践、城市化和工业化进程中大规模环境污染的问题[1]。化肥和农药的不合理使用、大量汽车轮胎制造及尾气排放、矿物的过度开采和冶炼、污水灌溉和城市废弃物积累等行为都会导致大量重金属如镉、铅、锌和汞等进入土壤、水域和大气,从而引发严重的环境污染[2-3]。重金属由于其生物不可降解性,在环境中长期存在,并通过吸入、食物污染或皮肤接触进入人体,造成严重且不可逆转的健康危害[4-5]。重金属污染问题不仅是我国面临的严峻环境问题之一,也是世界环保界公认的难以解决的环境治理难题[6]。
目前,重金属修复主要集中在传统的物化方法,例如化学沉淀、离子交换、淋洗和反渗透等,尽管这些方法在实践中被证明是有效的,但其存在高成本、能耗大、低修复效率,以及产生有毒污染物和副产品等问题[4, 7-8]。因此,迫切需要一种经济、高效、安全的修复方法。随着微生物技术的不断发展和进步,重金属污染修复迎来了新的机遇。微生物修复技术利用细菌、真菌和少数藻类等生物进行修复,具有修复效果好、对环境污染小且无二次污染等优势,能够高效吸收和降低环境中重金属的毒性和离子浓度[9-10]。微生物修复技术主要是指微生物通过主动或被动地与重金属离子相互作用,将其转化为毒性较小或生物可利用性较低的形式,或将其固定以防止其进入生物系统[11-12]。胞外聚合物是附着在微生物表面的关键组分,在重金属污染修复过程中起着重要作用。其中,胞外多糖(exopolysaccharides, EPS)是胞外聚合物的重要组成部分,充当保护屏障的角色,限制了重金属离子的进入,从而使微生物能够在极端环境(如低温、高温、高盐)或受到有毒化合物胁迫的条件下生存[13]。此外,EPS的结构含有多种阴离子官能团(如羧基、羟基、硫酸盐等),能够与重金属离子结合[14]。研究发现微生物分泌的EPS比该微生物具有更高的重金属去除能力,这明显表明EPS在重金属去除中具有重要作用[15]。因此,EPS已被推荐作为有潜力的重金属污染物吸附剂。然而,目前缺乏关于微生物EPS合成过程、与重金属互作机制及其在重金属胁迫环境中应用现状的系统综述。
鉴于微生物EPS在应对重金属胁迫环境中修复的重要性,本文全面介绍了EPS的分类和结构、合成机制及其在重金属修复中的作用机制。此外,还汇总了利用产EPS的微生物进行重金属污染修复的最新研究进展,可为微生物EPS进一步应用于环境重金属污染修复提供支持和科学依据。
1 微生物胞外多糖概述EPS是微生物的次级代谢产物,是微生物在生长代谢过程中分泌到细胞外的高分子化合物[16]。EPS由多种单糖通过糖苷键连接而成,主要由有机大分子(多糖)组成,同时含有少量的蛋白质、脂质和糖醛酸等成分[17]。EPS由于其中的糖醛酸、丙酮酸、磷酸盐和硫酸盐等组分展现一定的酸性特质,在与金属结合过程中起着重要作用,能够保护微生物在重金属胁迫的环境下生存[18-19]。EPS具有低毒性、可生物降解性和可持续利用等特性[20],作为微生物的保护屏障,不仅帮助微生物对抗外界环境的挑战,抵御脱水或有毒物质的侵害,同时还能为微生物的生长和繁殖提供碳源和营养物质[21]。EPS存在两种形态,一种是与微生物细胞壁紧密附着的荚膜多糖,另一种是游离在细胞壁外部的无定形黏液多糖[22]。并非所有微生物都具备在各种环境条件下产生EPS的能力,大多数微生物只在恶劣的环境条件下,如重金属胁迫或营养不均衡的压力下才会分泌EPS,其中已经广泛报道的能够产生EPS的微生物主要包括细菌、真菌和水生藻类[23]。
EPS可根据单糖组成分为同多糖(homopolysaccharide)和杂多糖(heteropolysaccharide)两类。同多糖由一种单糖构成,其中包括葡聚糖(glucans)和果聚糖(fructans)为主要代表[24]。同多糖可根据其糖苷键类型和单体单元的构成进一步分为4种亚类,分别为β-D-葡聚糖、α-D-葡聚糖、半乳聚糖和果聚糖。β-D-葡聚糖包括凝胶多糖(curdlan)、纤维素(cellulose)、索拉胶(salecan);而α-D-葡聚糖的代表是右旋糖酐(dextran);果聚糖的代表包括β-2,6-果聚糖(levan)、菊粉(inulin)和低聚果糖(fructooligosaccharide)[24-25]。杂多糖则由两种或更多种不同的单糖或单糖衍生物构成。其组成单元包括D-葡萄糖、D-半乳糖、L-鼠李糖、N-乙酰半乳糖胺、N-乙酰氨基葡萄糖或葡萄糖醛酸,而某些细菌的EPS可能还含有非碳水化合物取代基,例如结冷胶中的乙酰基和甘油酰基,黄原胶中的丙酮酸基团[24, 26]。杂多糖的主链上的单体单元之间的键包括刚性的1, 4-β-或1,3-β-键以及灵活的1,2-α-或1,6-α-键;常见的杂多糖包括结冷胶、琥珀酰聚糖、藻酸盐和黄原胶等[26]。
2 微生物胞外多糖的合成 2.1 EPS的生物合成机制EPS的生物合成过程不仅决定了其化学组成,而且还是了解EPS与金属离子互作机理的关键环节[22]。EPS的合成是一个复杂的过程,细菌、真菌和水生藻类均能合成EPS,但本文的重点是讨论细菌EPS的合成机制。除了少量由革兰氏阳性菌产生的同多糖(如果聚糖、葡聚糖、右旋糖苷等)在胞外合成,大多数EPS (同多糖或杂多糖)的合成过程发生在胞内。这个过程涉及多种酶和不同的调节分子的参与[27]。
2.1.1 胞内合成胞内合成是通过胞内组装糖核苷酸前体,将单糖转移到脂类载体上形成重复单元,随后进行多糖的延伸、聚合和胞外输出,最终形成EPS[27-28]。该过程始于底物中的各种糖(如葡萄糖、果糖等),通过细胞主动或被动摄取,然后经过周质氧化或细胞内磷酸化的代谢途径进行分解;图 1A以葡萄糖为例展示了用于EPS合成的糖核苷酸前体的组装过程:葡萄糖-6-磷酸经过葡萄糖磷酸变位酶的催化转化为糖-1磷酸,成为二磷酸核苷/一磷酸核苷(nucleoside diphosphate/nucleoside monophosphate, NDP/NMP)糖合成的核心糖基供体,最终合成尿苷二磷酸-乙酰基葡糖胺(uridine diphosphate-acetylglucosamine, UDP-GlcNAc)、尿苷二磷酸-乙酰基半乳糖胺(UDP-acetylgalactosamine, UDP-GalNAc)等前体分子,用于EPS的合成[29-30]。值得一提的是,当葡萄糖被磷酸化为葡萄糖-6-磷酸后,存在两条代谢途径。一条是转化为富含能量的核苷二磷酸糖(NDP-sugar),这些糖作为核苷酸的前体,可以通过差向异构化、氧化、脱羧和还原反应进行相互转化;另外一条途径是葡萄糖-6-磷酸通过磷酸葡萄糖异构酶的作用转化为果糖-6-磷酸(图 1B)[31-32]。果糖-6-磷酸在一方面进一步生成GDP-果糖和UDP-N-乙酰半乳糖胺,另一方面进入糖酵解途径进行分解代谢产生丙酮酸。在需氧条件下,转化为乙酰辅酶A并进入三羧酸循环(tricarboxylic acid cycle, TCA cycle),产生ATP,为EPS合成提供能量,并且用作生物合成的初级代谢产物,例如核糖核苷酸和氨基酸前体[33-34]。
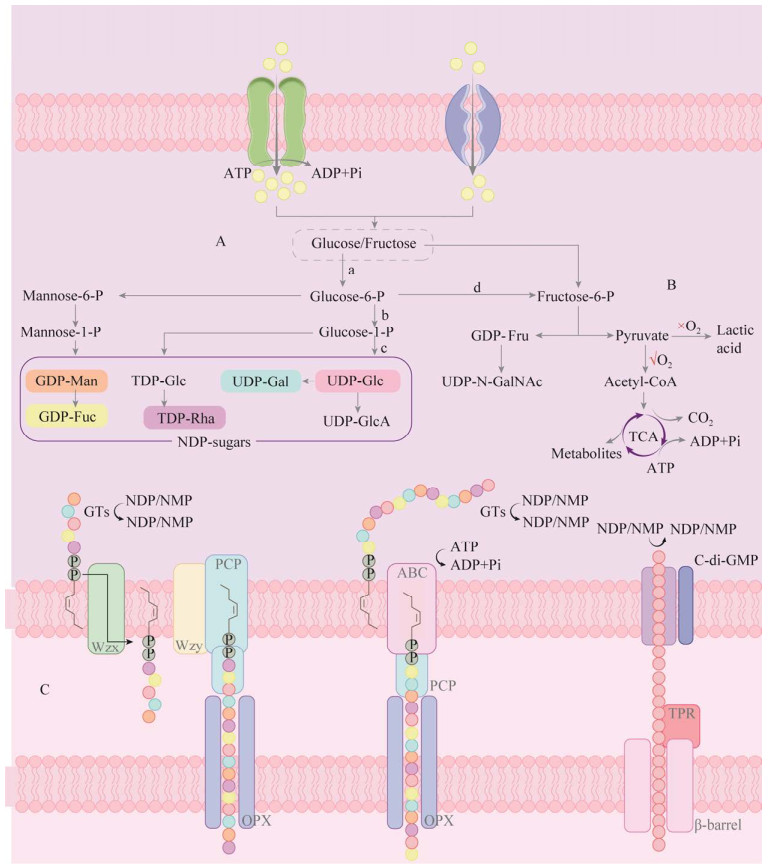
|
| 图 1 细菌胞外多糖胞内合成途径 Figure 1 Intracellular synthesis pathway of bacterial exopolysaccharides. A: The assembly process of glucose nucleotide precursors. B: Catabolic process after conversion of glucose-6-phosphate to fructose-6-phosphate. C: EPS synthesis and export pathway of Gram-negative bacteria. a: Hexokinase; b: Phosphoglucomutase; c: UDP-glucose pyrophosphorylase; d: Glucose phosphate isomerase; Man: Mannose; Fuc: Fucose; Glc: Glucose; Gal: Galactose; Rha: Rhamnose; GlcA: Glucuronic acid; Fru: Fructose; TCA: Tricarboxylic acid cycle; P: Undecaprenyl phosphate (C55-P); Wzx: Flippase; Wzy: Polymerase; PCP: Polysaccharide copolymerase; OPX: Outer membrane polysaccharide export protein; ABC: ABC transporter; C-di-GMP: Cyclic diguanylate; TPR: Tetratricopeptide repeat. |
此后,在“糖基转移酶”的作用下,将活化后的NDP-sugar的部分糖分子转移到位于细胞质膜的类异戊二烯脂类载体上,即十一异戊烯基磷酸(undecadecanyl phosphate, C55-P),脂质载体的末端醇基团通过焦磷酸桥连接至单糖单元,以实现单体的聚合,从而形成多糖[35]。经过不同的酶活性如酰化、乙酰化、硫酸化和甲基化进行修饰后的多糖进入合成过程中的最重要的一步,即多糖的延伸、聚合和胞外输出[33, 35]。据报道,革兰氏阴性菌的EPS合成和输出途径主要遵循以下3种机制:(1) Wzx-Wzy依赖性途径(图 1C左),它涉及单个的重复单元(NDP-糖)与内膜上的十一异戊烯醇二磷酸(und-PP)受体相连接,通过几种糖基转移酶(glycosyltransferases, GT)组装,并借助Wzx蛋白(又称Wzx翻转酶)在细胞质膜上进行跨细胞质膜转运[36]。随后,借助Wzy蛋白(又称Wzy聚合酶)在周质空间中聚合,形成高分子量多糖,然后将其运输到细胞表面;这一聚合过程还受多糖共聚合酶(polysaccharide copolymerase, PCP)和外膜多糖出口蛋白(outer membrane polysaccharide export protein, OPX) (以前称其为OMA蛋白)的调控[37-38];(2) ABC转运蛋白依赖途径(图 1C中),该途径主要参与荚膜多糖的生物合成,与Wzx-Wzy依赖性途径不同的是,通过ABC转运蛋白途径合成的多糖在还原末端携带由磷脂酰甘油和聚-2-酮-3-脱氧辛酮糖酸(poly-2-keto-3-deoxyoctanuconic acid, Kdo糖脂)连接组成的保守糖脂[36, 39];(3) 合成酶依赖途径(图 1C右),该途径通常用于只需要一种类型的糖前体进行同多糖的聚合和转运,例如纤维素、藻酸盐等,与前两条途径不同,合成酶依赖途径不需受体的调节,而是根据所合成的多糖的需要来确定脂质受体的需求[40]。研究表明,在该途径中,一些聚合过程受到内膜受体的调节,例如,在铜绿假单胞菌的藻酸盐合成中,内膜受体与细菌第二信使bis-(3′-5′)-环二聚鸟苷酸(cyclic dimer guanylate, c-di-GMP)结合,从而促进多糖的聚合;当聚合物到达周质时,含有三肽重复序列的支架蛋白(TPR蛋白)会保护其免于降解[36, 40]。
2.1.2 胞外合成相比胞内合成模式而言,胞外合成体系较为简单,糖基供体的糖基基团在糖基转移酶的作用下转移到糖基受体上,从而聚合生成EPS;该合成过程不依赖于脂质载体,而特定底物如蔗糖也不进入细胞内[41-43]。以β-2, 6-果聚糖(levan)为例,利用蔗糖作为底物,在果聚糖蔗糖转移酶的作用下合成。其合成反应见反应式(1)[41]。

|
公式(1) |
在受到重金属胁迫的环境下,微生物经受强烈的刺激,产生EPS作为一种防御机制,显著提高了细胞在含金属溶液中的生存能力[44]。研究表明,在特定的浓度范围内,随着重金属浓度的增加,微生物会被诱导产生更多的EPS。Ding等[45]的研究发现,当Zn2+浓度从0 mg/L增加到8 mg/L时,死谷芽孢杆菌(Bacillus vallismortis)多糖的产量从37.55 mg/g-VSS增加到86.16 mg/g-VSS,这可能是由于Zn诱导糖原合酶活性的增加,从而形成糖苷键,促进了单糖聚合成多糖。类似的结论也在Zeng等[46]的研究中得出,芽孢杆菌(Bacillus sp.) S3在Cd2+、Cr6+和Cu2+胁迫下,EPS产量显著增加,EPS含量会随着重金属离子浓度增加而增加;然而,在过高浓度下,这些有毒重金属会降低Bacillus sp. S3的代谢活性,从而减少EPS的产生。这是因为超过一定浓度的重金属会对细胞在生理和分子水平上产生毒性影响,导致酶失活并阻碍EPS的合成。值得注意的是,当微生物受到重金属诱导或刺激时,它们不仅会促进合成并释放胞外多糖,甚至会改变多糖的组成。这一现象已在多个微生物菌株中得到验证。例如,当铜绿假单胞菌(Pseudomonas aeruginosa)和粪产碱菌(Alcaligenes faecalis)面对3种不同的Cd2+化合物胁迫时,它们分泌的EPS含量呈现出一种先升高后降低的趋势;Cd2+的存在导致铜绿假单胞菌(Pseudomonas aeruginosa) EPS中的氨基酸发生变化,其中谷氨酸(glutamate, GLU)、脯氨酸(proline, PRO)、赖氨酸(lysine, LYS)和苯丙氨酸(phenylalanine, PHE)的比例增加,这一变化有助于EPS与重金属结合;同样,铜绿假单胞菌(Pseudomonas aeruginosa) EPS中的丙氨酸(alanine, ALA)比例也有所增加,这被认为有助于形成铵盐与重金属离子结合,从而减轻重金属的毒性作用[13]。
eps基因簇包括一系列编码不同底物特异性糖基转移酶的基因,如epsB、epsA和epsP等,它们在合成多糖的重复单元过程中扮演关键角色[47]。在研究重金属离子对偶发贪铜菌(Cupriavidus pauculus) 1490 EPS合成的影响时,Zeng等[48]不仅发现EPS含量随着Cd2+浓度的增加和孵育时间的延长呈现出先增加后下降的趋势,而且通过实时PCR分析,他们还观察到基因epsB、epsP和Wzz的表达分别上调了约3.31、4.19和2.93倍。结果表明这些关键EPS合成基因在重金属胁迫下发挥着重要的作用。此外,还有研究发现重金属离子的刺激会影响EPS合成过程中编码ExoD蛋白和ABC转运蛋白KpsM的基因表达[49]。
在此,概述了EPS的生物合成过程以及重金属胁迫对微生物EPS合成的影响。尽管不同细菌分泌的EPS在结构和组分上有所不同,但它们的生物合成过程大致相似。近年来,细菌EPS合成的生物学和遗传学机制取得了广泛的研究进展。随着研究的不断深入,与EPS生物合成相关的调控基因(gumA、algG等)受到了更多的关注,专家学者们也阐明了一些基因的功能。然而,目前研究主要集中在细菌EPS的生物合成过程上,对于真菌及藻类所分泌的EPS的生物合成过程及其调控相关基因的研究相对较少,关于重金属对EPS合成的影响以及合成过程中相关基因的调控机制信息仍然有限。未来需要进一步探索真菌、藻类EPS的合成过程,以及包括细菌在内的微生物EPS生物合成调控基因的功能。这将有助于更全面地了解微生物EPS,为应对重金属污染等环境问题提供更多的解决方案。
3 微生物EPS在重金属污染修复中的生物化学机制EPS的生成是微生物在重金属胁迫下生存和生长的一种保护策略,与动植物多糖相比,EPS不会受到农作物损失、海洋污染或气候变化等引起的不稳定性的影响[22]。EPS分子与重金属离子具有高度亲和力,因此,微生物EPS与重金属离子的结合被认为是微生物修复过程中重金属解毒机制的重要体现。这主要包括生物吸附(如络合、离子交换、生物沉淀等)和生物转化(如氧化还原、纳米颗粒形成和生物矿化)等过程[50-52]。
3.1 生物吸附EPS因其结构中含有许多带有负电荷的官能团,如羧基、羟基、磷酸根基团、硫酸根基团和氨基等,被广泛认为是有效的重金属污染物生物吸附剂[13]。这些官能团能够与带正电荷的重金属离子在细胞表面发生离子交换、络合、沉淀等反应(图 2),从而增强对重金属离子的吸附和固持[53]。值得注意的是,在相同条件下,EPS对不同的重金属表现出不同的亲和力,其作用机制也会因重金属类型和环境条件的不同而有所变化[54-55]。此外,在相同情况下,多种作用机制可能同时发生[54]。

|
| 图 2 微生物胞外多糖与重金属互作机制 Figure 2 Interaction mechanism between microbial exopolysaccharides and heavy metals. Mn+: Heavy metal ion. |
3.1.1 络合反应
络合反应是生物吸附中常见的机制之一。EPS中的羟基、氨基、酯基和羧基等功能基团可以与重金属离子形成配位键,其中的N、O、P和S等原子可作为配位原子,与各种金属离子形成稳定的络合化合物[56-57]。例如,EPS结构中的羟基、醚键和酯基等官能团在吸附过程中与Cd2+、Zn2+发生了络合配位反应[57]。这些官能团中的O原子在吸附过程中与重金属离子螯合,导致含氧官能团的电子云密度降低,从而改变其振动频率和振动强度[58]。然而,在官能团与重金属离子螯合过程中也存在选择性。通过傅里叶红外扫描结合主成分分析研究假单胞菌与重金属互作发现,EPS组分中与氨基螯合的重金属离子是Cu2+、Zn2+,而与羧基螯合的重金属离子是Cd2+,这表明EPS在螯合过程中具有特异性[59]。
3.1.2 离子交换机制离子交换机制也是EPS吸附过程中常见的机制之一。EPS的结构中富含带有负电荷的官能团,这些官能团与带正电荷的重金属离子之间存在较强的静电结合亲和力,因此,多糖表面存在的H+或Na+、K+、Mg2+等轻金属离子会以离子交换的方式被具有更强亲和力的重金属离子(如Pb2+、Mn2+、Cd2+等)所替代[60-62]。不同的重金属对EPS的吸附表现出不同程度的特异性和亲和力,例如镉可能比铜和锌对EPS具有更强的亲和力[61]。离子交换作用可以与络合反应同时发生,其发生与pH值密切相关;随着pH值升高,EPS中官能团的连续解离和去质子化会引起负电荷增加,进而与重金属离子发生络合的离子交换反应,从而增强了与重金属离子的静电亲和力[63-64]。也有研究表明,在吸附过程中,离子交换反应可能起主导作用[65]。
3.1.3 生物沉淀除上述作用机制,EPS还能通过与可溶性重金属离子反应,形成不可溶化合物,这一机制也被称为生物沉淀。这个过程与pH值密切相关。在酸性条件下,铅和镉以二价金属离子形式存在,而在碱性条件下,它们会与羟基结合生成羟基化合物沉淀;生物沉淀也可以同时与其他两种机制共同发生[16]。由于官能团和金属离子的多样性以及环境条件的复杂性,EPS与重金属的吸附机制也复杂多样,因而难以对其进行明确定义和分类[66]。
3.2 生物转化微生物EPS通过氧化还原等化学反应改变重金属离子形态和价态,从而减弱其毒性。与生物沉淀不同,生物转化作用中重金属离子价态会发生变化,主要包括氧化还原反应、纳米颗粒的形成以及生物矿化(图 2)[66]。通常氧化还原反应是生物转化过程中的首要步骤,为纳米颗粒和生物矿化的形成奠定基础[57]。
3.2.1 氧化还原反应某些重金属元素,如Cr、Mo、Se、U和Au等,在氧化状态下以高度可溶和移动的离子形式存在,而在还原条件下,它们可被还原成难溶性或不溶性的物质[66-67]。EPS中含有具有还原性的官能团,如羟基、酚基、醛基等,以及羰基和醇类化合物所形成的金属还原自由基;这些官能团能催化氧化状态下的金属离子,使其生成不溶性的化合物,从而降低其溶解度和生物可利用度,进而降低重金属离子的毒性[68-70]。pH值在氧化还原机制中扮演重要角色,当pH值升高时,EPS中羧基、磷酰基、酚基和羟基等官能团会增加,从而加速还原反应速率[69]。
3.2.2 形成纳米颗粒最近的研究表明,EPS与金属离子发生化学反应后,能将其进一步转化为不同形态的金属纳米颗粒,并通过改变细胞表面性质、将金属离子结合在细胞表面上、降低金属物质在水溶液中的迁移,以及将金属生物转化为毒性较小的元素来减弱金属对细胞的毒性[71]。微生物胞外聚合物可将Au3+还原为零价的金纳米颗粒(Au nanoparticles, AuNPs);当胞外聚合物中的EPS组分被去除时,Au3+的还原明显受到抑制。这说明EPS在Au3+转化AuNPs过程中起主要作用,并抑制了其向细胞内渗透,从而降低其金属毒性[72]。EPS还能将Ag+还原为零价银纳米颗粒(Ag nanoparticles, AgNPs),并作为可渗透屏障来减弱Ag+的毒性[73]。
3.2.3 生物矿化生物矿化分为生物诱导矿化(bacteria-induced mineralization, BIM)和生物控制矿化两种类型,而EPS参与的是前者。在BIM过程中,EPS中带有电荷的官能团作为吸附位点与重金属离子互作,进而诱导生成不同矿物质(如碳酸盐、硅酸盐、硫酸盐等)[74-75]。例如,从微生物诱导的碳酸盐中提取的EPS可通过生物矿化过程形成碳酸钙沉淀;而EPS中的羧基、酰胺基和磷酸基等官能团对Cu2+具有高度的生物吸附能力,可通过生物矿化过程诱导含铜磷酸盐矿物的形成;此外,该EPS还能将DTPA-Cu固定在污染土壤中,形成稳定矿物形式[Cu5(PO4)2(OH)4][76-77]。
由此可见,微生物EPS不仅能够作为生物吸附剂对重金属离子进行生物吸附,同时可改变重金属离子的价态,从而降低其毒性或生物可利用度。尽管近年来微生物EPS与重金属之间的互作机制引起了国内外学者的广泛研究兴趣,但仍存在一些问题:(1) EPS生物吸附是一个复杂的过程,其去重金属离子作用过程中会受到许多物理化学因素的影响。当前的研究中鲜有关注影响EPS生物吸附的理化参数及其最大或最小临界值,未来的研究需进一步探索这些影响因素;(2) 目前微生物EPS对重金属作用的生物沉淀和生物矿化机制还不太清楚,还需要进一步解释EPS在生物转化中的作用机制;(3) 不同微生物来源和EPS类型与重金属离子互作机制存在显著差异,同时,单一重金属与复合重金属对EPS作用也有所相同。未来的研究需要综合考虑EPS与金属离子的互作机制,考虑存在不同重金属及形态的实际条件,深入探究EPS对重金属的特异性和选择性。鉴于此,作者的课题组最近正在利用分子生物学和光学技术等方法,分析不同重金属胁迫下对EPS组成及构象的影响,以便更深入地研究不同微生物EPS对单一及复合重金属的作用机制。
4 产EPS的微生物在重金属污染修复中的应用在涉及活性微生物的生物修复过程中,通常会出现潜在的致病性问题。然而,EPS不仅是一种容易被生物降解利用的物质,还是一种无生命的生物修复剂,因此不会引起致病性问题。此外,微生物产生的EPS具有出色的环境适应能力,能够保护微生物在极端生态环境中存活,如极寒、高盐、温泉等环境[78]。更重要的是,微生物分泌的EPS形成保护层,通过覆盖污染物和病原体的影响来保护细胞免受有毒重金属和病原体的侵害[15]。微生物EPS在重金属污染的生物修复领域的应用引起了广泛关注,并已有许多研究报道了EPS成功从土壤和水体中有效去除有毒金属的案例(表 1),从而将污染危害降到了最低水平。
| Exopolysaccharide producing strain | Polluting medium | Types of heavy metals for bioremediation | Reference |
| Enterococci sp. MC1 | Fertilizer polluted water | Cd2+, Pb2+ | [81] |
| Bacillus acidiproducens SM2 | Fertilizer polluted water | Cr2+ | [81] |
| Nostoc sphaeroides | Industrial polluted water | Cd2+, Pb2+, Ni2+, Mn2+, Cr2+, Cu2+ | [84] |
| Cyanothece sp. | Industrial polluted water | Cu2+, Cd2+, Pb2+ | [85] |
| Rhodococcus rhodochrous | Waste water | Cd2+, Pb2+, Ni2+, Co2+, Cr2+ | [95] |
| Rhodococcus opacus | Waste water | Cd2+, Pb2+, Ni2+, Co2+, Cr2+ | [95] |
| Aspergillus terreus AML02 | River pollution | Cd2+, Cr3+, Pb2+, Ni2+, Cu2+, Zn2+ | [96] |
| Paecilomyces fumosovoseus 4099 | River pollution | Cd2+, Cr3+, Pb2+, Ni2+, Cu2+, Zn2+ | [96] |
| Beauveria bassiana 4580 | River pollution | Cd2+, Cr3+, Pb2+, Ni2+, Cu2+, Zn2+ | [96] |
| Klebsiella sp. H-207 | Waste water | Cr6+ | [97] |
| Anthrospira platensis | Tannery industrial effluents | Cr6+ | [98] |
| Pseudoalteromonas agarivorans | Farmland soil | Pb2+ | [88] |
| Halomonas sp. | Farmland soil | As3+ | [89] |
| Bacillus gibsoni | Farmland soil | Cd2+, Cr3+, Ni2+, Cu2+ | [91] |
| Bacillus xiamenensis | Farmland soil | Cd2+, Cr3+, Ni2+, Cu2+ | [91] |
| Cellulosimicrobium funkei | Industrial polluted soil | Cr6+ | [92] |
| Halophilic bacterium | Waste contaminated soil | Cd2+, Pb2+ | [93] |
| Azotobacter sp. bd39 | Mine contaminated soil | Hg2+ | [99] |
| Bacillus cereus BDBC01 | Soil around the car workshop | Cr6+, Ni2+, Cd2+ | [100] |
| Bacillus cereus NC7401 | Soil around the car workshop | Cr6+, Ni2+, Cd2+ | [100] |
| Pseudomonas stutzeri AS22 | Farmland soil | Cu2+, Co2+, Pb2+, Cd2+, Fe2+ | [101] |
4.1 产EPS微生物应用于重金属污染废水修复
EPS具有较大的比表面积、丰富的官能团和强的负电性,使其具备对重金属和有机污染物强大的吸附能力,因此被认为是一种具有巨大发展潜力的新型污水处理剂[52]。在重金属镉的修复过程中,革兰氏阴性菌和革兰氏阳性菌分泌的EPS通过将金属阳离子被动结合到EPS中的酸性基团的负电荷上,在合成废水中去除镉的修复过程中起到重要作用[79]。Concórdio-Reis等[80]报道了肠杆菌(Enterobacter sp.) A47分泌的含岩藻糖的EPS在管理Pb2+污染水体方面具有良好的潜力,可作为可生物降解且安全的生物吸附剂的有前景选择。混浊红球菌(Rhodococcus opacus)和紫红红球菌(Rhodococcus rhodochrous)在pH值为2.0−7.5的水中表现出对Cd、Pb、Ni、Co和Cr的强大吸附能力,其中羟基、乙酰氨基或氨基与金属离子之间的互作是主要的吸附机制[24]。肠球菌(Enterococci sp.) MC1对镉和铅的去除率分别为46%和43%,而产酸芽孢杆菌(Bacillus acidiproducens) SM2对铬的去除率为43%[81]。除细菌外,蓝藻EPS也被认为是一种有潜力的螯合剂,由于其细胞外表面富含负电荷,可用于去除水中带正电荷的重金属离子。对于废水中重金属铜、钴、铅和锰,其去除率分别为12.5%−81.8%、11.8%−33.7%、26.4%−100%和32.7%−100%[82-83]。球状念珠藻(Nostoc sphaeroides)也能够有效去除人工合成废水中的Pb、Cd、Cu、Mn、Cr和Ni[84]。越南富寿省的稻田中分离出一种产量较高的EPS的单细胞蓝藻,其结构分析表明含有尿酸,被称为硫酸化鼠李糖胶聚糖,它表现出强大的吸附或消除镉、铜、铅等重金属的能力,可作为环保经济的生物吸附剂去除废水中的重金属离子[85]。
4.2 产EPS微生物应用于重金属污染土壤修复微生物EPS具有强大的吸附土壤系统中不同重金属的潜力,已有研究证明,产EPS的细菌能有效降低土壤重金属的生物利用度,减少污染物的迁移,从而缓解环境压力[86]。此外,从植物根际促生菌(plant growth promoting rhizobacteria, PGPR)产生的EPS可通过直接或间接机制促进植物的生长。EPS有助于形成生物膜,保护细胞免受外部环境的侵害[20]。EPS可以通过阴离子官能团(如磷酸、羟基、琥珀酰基和糖醛酸)去除根际土壤中的重金属[87]。研究表明,产EPS的假交替单胞菌(Pseudoalteromonas sp.)菌株显著降低了Pb污染根际土壤中Pb的含量,以及小白菜可食用组织和根部的Pb含量,有效地提高了小白菜的生物量[88]。在As胁迫下,盐单胞菌(Halomonas sp.)产生EPS,能够将有毒的As3+氧化为较低毒性的As6+,从而对土壤中的As进行解毒或生物修复,并促进As胁迫下水稻的生长[89]。通过模拟Cu2+胁迫试验发现,Cu2+胁迫显著抑制了水稻的生长,而添加EPS溶液后,Cu2+胁迫下的水稻的根长、茎长及鲜重均显著增高。此外,脯氨酸含量较对照组明显降低,这表明EPS溶液可能有助于减轻重金属Cu2+的胁迫,从而降低了脯氨酸含量[90]。两株产生EPS的Bacillus gibsoni和厦门芽孢杆菌(Bacillus xiamenensis),通过减轻Cd、Ni、Cr和Cu重金属胁迫,提高了亚麻的养分利用率,促进其生长发育[91]。芬式纤维微菌(Cellulosimicrobium funkei)能够缓解Cr6+的毒性效应,提高菜豆的种子发芽率、总生物量以及叶绿素a、叶绿素b等生理指标,稳定和调节了菜豆的抗氧化系统,减少菜豆组织中Cr的积累,从而提高农作物产量[92]。产EPS海洋细菌噬琼胶假交替单胞菌(Pseudoalteromonas agarivorans)能够降低土壤中可溶性镉的含量,减少Cd2+向生菜可食用组织中的迁移,并降低了Cd2+生物利用度[93]。Upadhyay等[94]的研究发现,荧光假单胞菌(Pseudomonas fluorescens) Psd产生的EPS主要成分是藻酸盐,这有助于土壤中Zn2+的生物修复。当缺少编码藻酸盐聚合酶亚单位的alg8基因时,EPS的产量显著减少,导致对Zn2+的吸附能力明显降低。此外,固氮菌产生的藻酸盐也被证实有助于修复有毒金属,它通过创建适宜金属离子的微环境来维持土壤生态平衡,从而促进了植物的生长[20]。迄今为止,已知多种细菌的EPS参与不同重金属污染土壤的生物修复,如芽孢杆菌属(Bacillus sp.)、芬式纤维微菌(Cellulosimicrobium funkei)、假单胞菌属(Pseudomonas sp.)、固氮菌属(Azotobacter sp.)等(表 1)。
4.3 产EPS微生物修复相比于植物修复的优势与劣势利用植物去除、稳定或降低重金属毒性是一种经济有效的方法,受到众多学者的强烈关注。一些超富集植物,如天蓝遏蓝菜(Thlaspi caerulescens)、拟南芥(Arabidopsis halleri)、商陆(Phytolacca acinosa)和伴矿景天(Sedum plumbizincicola),表现出对某些重金属特别强的吸收能力,且自身不受重金属毒害[12]。然而,大多数超富集植物生长缓慢、生物量小、对金属有选择性,并且从根部到地上部的重金属转移率低等缺陷,导致实际修复效率低且修复时间长[102]。近年来,一些学者提出使用生长迅速、生物量较大的非超富集植物来解决重金属污染问题,如甜高粱(Sorghum bicolor)、向日葵(Helianthus annuus)和烟草(Nicotiana tabacum)等。尽管这些植物相对于超富集植物在生物量、生长周期和经济效益方面具有优势,但它们对重金属的吸收能力较低,因此导致修复效率低,实际中很少出现大规模应用的案例。此外,植物修复过程中产生大量携带重金属的植物材料,如果处理不当,可能再次释放到环境中,引起二次污染[103]。相比之下,微生物EPS的生物修复更加灵活和迅速。除了具备安全、经济高效、不产生有毒副产品的优势外,生物质EPS中的活细胞和死细胞都可以用于重金属吸附;值得注意的是,死生物质EPS可以通过解吸吸附的离子进行进一步的吸附循环,实现重金属的回收,且回收的重金属离子可以再次被利用[19]。微生物EPS在农业土壤中除了去除污染物外还发挥着额外的作用,EPS通过氢键、阴离子吸附力和范德华力附着到土壤表面,减少了土壤湿润和膨胀,增加了根际微生物的活性,提高土壤有机质含量,稳定了土壤团聚体的通气性和渗透性,并改善重金属胁迫下农作物的生长发育[104-105]。因此,微生物EPS是去除土壤和废水中重金属杂质的优选材料。
综上,产EPS的菌株有助于其在重金属胁迫下形成生物膜,从而增强水、土环境中的重金属吸附和稳定。因此,微生物EPS,尤其是细菌EPS,作为新兴的生物修复剂,已经成为重金属污染生物修复研究的热点领域[15, 106]。然而,与细菌EPS相比,真菌EPS优势更为突出,即使对于敏感的真菌菌株而言,它们也能在高浓度重金属环境下存活,可以更好、更有效地进行生物修复。因此,在未来应用中,应更多地考虑利用真菌EPS来解决水、土环境中重金属污染问题。此外,目前的应用主要局限于生理生化指标的测定和分析,对分子生物学指标的影响尚不清楚。未来的研究可借助分子生物学技术、代谢组学分析和宏基因组学分析,更深入地了解微生物EPS在重金属污染修复中的应用。值得强调的是,植物修复方法存在一定的局限性,但微生物和植物在重金属修复领域具有相互促进的潜力。微生物EPS不仅有助于去除重金属污染,还可以改善重金属胁迫下植物的生长和发育。然而,目前关于利用微生物EPS促进富集/超富集植物修复的研究相对较少。鉴于此,本课题组目前正进行与微生物EPS对油料作物的生长以及铅镉积累相关的研究,以深入探究植物与微生物EPS之间的协同修复和治理重金属污染土壤的作用机制。
5 结论与展望本文概述了微生物EPS及其分类,阐述了微生物EPS从组装糖核苷酸前体到延伸、聚合和胞外输出的生物合成过程,讨论了微生物EPS与重金属之间的互作机制,如络合反应、生物沉淀、氧化还原反应等,并突出了微生物EPS在重金属污染水体及土壤修复方面的应用。这些研究结果表明,利用微生物EPS进行重金属污染修复不仅能够解决传统物化方法无法解决的问题,更是一种经济、可持续且环境友好的修复策略。未来几年,可以预期微生物EPS的开发和应用将继续成为科研人员的热门研究领域。然而,随着技术不断革新和研究的深入,微生物EPS仍面临着诸多挑战和待解决的科学问题。
(1) 深入探究EPS的合成及与重金属的互作机制。虽然目前的研究主要集中在细菌领域,但未来应该扩大研究范围,涵盖真菌和藻类等其他微生物。通过运用多组学知识,重点关注不同微生物的生物EPS合成过程、功能基因调控机制以及在重金属胁迫下的作用机制。
(2) 寻找EPS用量与土壤肥力之间的平衡点。考虑到EPS对重金属的吸附是非特异性的,不仅可以吸附有害的重金属,还可能吸附植物所需的金属离子,如Zn、Cu、Mn等。过度使用EPS可能导致农作物养分含量的下降。因此,需要不断进行技术革新,深入研究聚合物与重金属的互作机制,以合理应用EPS,在维持农作物所需的营养元素含量的基础上,提高对重金属的修复效果。
(3) 目前的研究主要集中在实验室模拟研究上,因为实验室中的操作条件可以轻松控制。然而,在田间试验中,面临许多不利的环境条件,例如温度、pH值、离子强度、有机和无机配体以及其他理化参数的调节和控制通常较为困难。因此,下一步的研究重点应该是将实验室研究的结果应用到真实环境中。这将需要解决实验室与实际应用之间的差距,并考虑实际环境中的复杂性和变异性。此外,值得探索的研究方向包括如何有效回收和无害处理吸附后的EPS以及如何高效开发利用回收得到的金属离子。这些方面都是未来研究的重要方向,对于进一步应用和发展EPS在重金属污染治理和资源回收方面具有重要意义。
综上所述,对微生物EPS的结构、合成机制以及与重金属的互作机制的研究不仅具有理论价值,而且具有重要的应用价值。微生物EPS为重金属污染的生物修复提供了广阔的思路和希望。
| [1] | QIN GW, NIU ZD, YU JD, LI ZH, MA JY, XIANG P. Soil heavy metal pollution and food safety in China: effects, sources and removing technology[J]. Chemosphere, 2021, 267: 129205 DOI:10.1016/j.chemosphere.2020.129205. |
| [2] | YANG QQ, LI ZY, LU XN, DUAN QN, HUANG L, BI J. A review of soil heavy metal pollution from industrial and agricultural regions in China: pollution and risk assessment[J]. Science of the Total Environment, 2018, 642: 690-700 DOI:10.1016/j.scitotenv.2018.06.068. |
| [3] | CHERAGHI-ALIAKBARI S, BEHESHTI-ALAGHA A, RANJBAR F, NOSRATTI I. Comparison of Myagrum perfoliatum and Sophora alopecuroides in phytoremediation of Cd- and Pb-contaminated soils: a chemical and biological investigation[J]. Chemosphere, 2020, 259: 127450 DOI:10.1016/j.chemosphere.2020.127450. |
| [4] | NARAYANAN M, MA Y. Metal tolerance mechanisms in plants and microbe-mediated bioremediation[J]. Environmental Research, 2023, 222: 115413 DOI:10.1016/j.envres.2023.115413. |
| [5] | NAGAJYOTI PC, LEE KD, SREEKANTH TVM. Heavy metals, occurrence and toxicity for plants: a review[J]. Environmental Chemistry Letters, 2010, 8(3): 199-216 DOI:10.1007/s10311-010-0297-8. |
| [6] | LI ZY, MA ZW, van der KUIJP TJ, YUAN Z, HUANG L. A review of soil heavy metal pollution from mines in China: pollution and health risk assessment[J]. Science of the Total Environment, 2014, 468/469: 843-853 DOI:10.1016/j.scitotenv.2013.08.090. |
| [7] | TANG X, NI YQ. Review of remediation technologies for cadmium in soil[J]. E3S Web of Conferences, 2021, 233: 01037 DOI:10.1051/e3sconf/202123301037. |
| [8] |
马莹, 王玥, 石孝均, 陈新平, 李振轮. 植物促生菌在重金属生物修复中的作用机制及应用[J]. 环境科学, 2022, 43(9): 4911-4922.
MA Y, WANG Y, SHI XJ, CHEN XP, LI ZL. Mechanism and application of plant growth-promoting bacteria in heavy metal bioremediation[J]. Environmental Science, 2022, 43(9): 4911-4922 (in Chinese). |
| [9] | LI XM, PENG WH, JIA YY, LU L, FAN WH. Bioremediation of lead contaminated soil with Rhodobacter sphaeroides[J]. Chemosphere, 2016, 156: 228-235 DOI:10.1016/j.chemosphere.2016.04.098. |
| [10] | WANG Y, NARAYANAN M, SHI XJ, CHEN XP, LI ZL, NATARAJAN D, MA Y. Plant growth-promoting bacteria in metal-contaminated soil: current perspectives on remediation mechanisms[J]. Frontiers in Microbiology, 2022, 13: 966226 DOI:10.3389/fmicb.2022.966226. |
| [11] | YIN K, WANG QN, LV M, CHEN LX. Microorganism remediation strategies towards heavy metals[J]. Chemical Engineering Journal, 2019, 360: 1553-1563 DOI:10.1016/j.cej.2018.10.226. |
| [12] | MA Y, RAJKUMAR M, ZHANG C, FREITAS H. Beneficial role of bacterial endophytes in heavy metal phytoremediation[J]. Journal of Environmental Management, 2016, 174: 14-25 DOI:10.1016/j.jenvman.2016.02.047. |
| [13] | LIAN ZY, YANG ZY, SONG WF, SUN MG, GAN Y, BAI XY. Effects of different exogenous cadmium compounds on the chemical composition and adsorption properties of two Gram-negative bacterial EPS[J]. Science of the Total Environment, 2022, 806: 150511 DOI:10.1016/j.scitotenv.2021.150511. |
| [14] | MOHITE BV, KOLI SH, PATIL SV. Heavy metal stress and its consequences on exopolysaccharide (EPS)-producing Pantoea agglomerans[J]. Applied Biochemistry and Biotechnology, 2018, 186(1): 199-216 DOI:10.1007/s12010-018-2727-1. |
| [15] | MADDELA NR, SCALVENZI L, RADICE M. Novel insights of microbial exopolysaccharides as bio-adsorbents for the removal of heavy metals from soil and wastewater[M]//NADDA AK, SAJNA KV, SHARMA S. Microbial Exopolysaccharides as Novel and Significant Biomaterials. Switzerland: Springer Nature, 2021: 265-283. |
| [16] | COMTE S, GUIBAUD G, BAUDU M. Biosorption properties of extracellular polymeric substances (EPS) towards Cd, Cu and Pb for different pH values[J]. Journal of Hazardous Materials, 2008, 151(1): 185-193 DOI:10.1016/j.jhazmat.2007.05.070. |
| [17] | MORE TT, YADAV J, YAN S, TYAGI RD, SURAMPALLI RY. Extracellular polymeric substances of bacteria and their potential environmental applications[J]. Journal of Environmental Management, 2014, 144: 1-25. |
| [18] | LAU TC, WU XA, CHUA H, QIAN PY, WONG PK. Effect of exopolysaccharides on the adsorption of metal ions by Pseudomonas sp. CU-1[J]. Water Science and Technology, 2005, 52(7): 63-68 DOI:10.2166/wst.2005.0182. |
| [19] | GUPTA P, DIWAN B. Bacterial exopolysaccharide mediated heavy metal removal: a review on biosynthesis, mechanism and remediation strategies[J]. Biotechnology Reports, 2017, 13: 58-71 DOI:10.1016/j.btre.2016.12.006. |
| [20] | LAL S, RATNA S, BEN SAID O, KUMAR R. Biosurfactant and exopolysaccharide-assisted rhizobacterial technique for the remediation of heavy metal contaminated soil: an advancement in metal phytoremediation technology[J]. Environmental Technology & Innovation, 2018, 10: 243-263. |
| [21] | AMAO JA, OMOJASOLA PF, BAROOAH M. Isolation and characterization of some exopolysaccharide producing bacteria from Cassava peel heaps[J]. Scientific African, 2019, 4: e00093 DOI:10.1016/j.sciaf.2019.e00093. |
| [22] | MOHITE BV, KOLI SH, NARKHEDE CP, PATIL SN, PATIL SV. Prospective of microbial exopolysaccharide for heavy metal exclusion[J]. Applied Biochemistry and Biotechnology, 2017, 183(2): 582-600 DOI:10.1007/s12010-017-2591-4. |
| [23] | RUAS-MADIEDO P, HUGENHOLTZ J, ZOON P. An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J]. International Dairy Journal, 2002, 12(2-3): 163-171 DOI:10.1016/S0958-6946(01)00160-1. |
| [24] | NWODO UU, GREEN E, OKOH AI. Bacterial exopolysaccharides: functionality and prospects[J]. International Journal of Molecular Sciences, 2012, 13(11): 14002-14015. |
| [25] | MONSAN P, BOZONNET S, ALBENNE C, JOUCLA G, WILLEMOT RM, REMAUD-SIMÉON M. Homopolysaccharides from lactic acid bacteria[J]. International Dairy Journal, 2001, 11(9): 675-685 DOI:10.1016/S0958-6946(01)00113-3. |
| [26] | de VUYST L, de VIN F, VANINGELGEM F, DEGEEST B. Recent developments in the biosynthesis and applications of heteropolysaccharides from lactic acid bacteria[J]. International Dairy Journal, 2001, 11(9): 687-707 DOI:10.1016/S0958-6946(01)00114-5. |
| [27] |
LI O. Structure characterization and identification of biosynthetic pathway of the exopolysaccharide from Paenibacillus elgii B69[D]. Hangzhou: Doctoral Dissertation of Zhejiang University, 2014 (in Chinese). 李欧. Paenibacillus elgii B69胞外多糖结构鉴定及生物合成途径研究[D]. 杭州: 浙江大学博士学位论文, 2014. |
| [28] | ZAYED A, MANSOUR MK, SEDEEK MS, HABIB MH, ULBER R, FARAG MA. Rediscovering bacterial exopolysaccharides of terrestrial and marine origins: novel insights on their distribution, biosynthesis, biotechnological production, and future perspectives[J]. Critical Reviews in Biotechnology, 2022, 42(4): 597-617. |
| [29] | CUTHBERTSON L, MAINPRIZE IL, NAISMITH JH, WHITFIELD C. Pivotal roles of the outer membrane polysaccharide export and polysaccharide copolymerase protein families in export of extracellular polysaccharides in Gram-negative bacteria[J]. Microbiology and Molecular Biology Reviews, 2009, 73(1): 155-177 DOI:10.1128/MMBR.00024-08. |
| [30] | ULLRICH M. Bacterial Polysaccharides: Current Innovations and Future Trends[J]. England: Caister Academic Press, 2009: 279-310. |
| [31] | ATES O. Systems biology of microbial exopolysaccharides production[J]. Frontiers in Bioengineering and Biotechnology, 2015, 3: 200. |
| [32] | WELMAN AD, MADDOX IS. Exopolysaccharides from lactic acid bacteria: perspectives and challenges[J]. Trends in Biotechnology, 2003, 21(6): 269-274 DOI:10.1016/S0167-7799(03)00107-0. |
| [33] | FREITAS F, ALVES VD, REIS MAM. Advances in bacterial exopolysaccharides: from production to biotechnological applications[J]. Trends in Biotechnology, 2011, 29(8): 388-398 DOI:10.1016/j.tibtech.2011.03.008. |
| [34] |
曾化伟, 郑惠华, 陈惠, 廖祥儒, 蔡宇杰. 微生物多糖的生物合成及代谢工程研究进展[J]. 陕西理工学院学报(自然科学版), 2015, 31(4): 49-58.
DOI:10.3969/j.issn.1673-2944.2015.04.011 ZENG HW, ZHENG HH, CHEN H, LIAO XR, CAI YJ. Progress in research on biosynthesis and metabolic engineering of microbial polysaccharides[J]. Journal of Shaanxi University of Technology (Natural Science Edition), 2015, 31(4): 49-58 (in Chinese). |
| [35] | WHITFIELD GB, MARMONT LS, HOWELL PL. Enzymatic modifications of exopolysaccharides enhance bacterial persistence[J]. Frontiers in Microbiology, 2015, 6: 471. |
| [36] | SCHMID J, SIEBER V, REHM B. Bacterial exopolysaccharides: biosynthesis pathways and engineering strategies[J]. Frontiers in Microbiology, 2015, 6: 496. |
| [37] | WANG J, SALEM DR, SANI RK. Extremophilic exopolysaccharides: a review and new perspectives on engineering strategies and applications[J]. Carbohydrate Polymers, 2019, 205: 8-26 DOI:10.1016/j.carbpol.2018.10.011. |
| [38] | ISLAM ST, LAM JS. Synthesis of bacterial polysaccharides via the Wzx/Wzy-dependent pathway[J]. Canadian Journal of Microbiology, 2014, 60(11): 697-716 DOI:10.1139/cjm-2014-0595. |
| [39] | WILLIS LM, STUPAK J, RICHARDS MR, LOWARY TL, LI JJ, WHITFIELD C. Conserved glycolipid termini in capsular polysaccharides synthesized by ATP-binding cassette transporter-dependent pathways in Gram-negative pathogens[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(19): 7868-7873. |
| [40] | WHITNEY JC, HOWELL PL. Synthase-dependent exopolysaccharide secretion in Gram-negative bacteria[J]. Trends in Microbiology, 2013, 21(2): 63-72 DOI:10.1016/j.tim.2012.10.001. |
| [41] | SURESH KUMAR A, MODY K, JHA B. Bacterial exopolysaccharides-a perception[J]. Journal of Basic Microbiology, 2007, 47(2): 103-117 DOI:10.1002/jobm.200610203. |
| [42] | BADEL S, BERNARDI T, MICHAUD P. New perspectives for Lactobacilli exopolysaccharides[J]. Biotechnology Advances, 2011, 29(1): 54-66 DOI:10.1016/j.biotechadv.2010.08.011. |
| [43] | SUTHERLAND IW. Microbial polysaccharides from Gram-negative bacteria[J]. International Dairy Journal, 2001, 11(9): 663-674 DOI:10.1016/S0958-6946(01)00112-1. |
| [44] | GONZÁLEZ AG, SHIROKOVA LS, POKROVSKY OS, EMNOVA EE, MARTÍNEZ RE, SANTANA-CASIANO JM, GONZÁLEZ-DÁVILA M, POKROVSKI GS. Adsorption of copper on Pseudomonas aureofaciens: protective role of surface exopolysaccharides[J]. Journal of Colloid and Interface Science, 2010, 350(1): 305-314 DOI:10.1016/j.jcis.2010.06.020. |
| [45] | DING PF, SONG WF, YANG ZH, JIAN JY. Influence of Zn(Ⅱ) stress-induction on component variation and sorption performance of extracellular polymeric substances (EPS) from Bacillus vallismortis[J]. Bioprocess and Biosystems Engineering, 2018, 41(6): 781-791 DOI:10.1007/s00449-018-1911-6. |
| [46] | ZENG WM, LI F, WU CH, YU RL, WU XL, SHEN L, LIU YD, QIU GH, LI JK. Role of extracellular polymeric substance (EPS) in toxicity response of soil bacteria Bacillus sp. S3 to multiple heavy metals[J]. Bioprocess and Biosystems Engineering, 2020, 43(1): 153-167 DOI:10.1007/s00449-019-02213-7. |
| [47] | LIU PZ, CHEN Z, YANG LJ, LI QB, HE N. Increasing the bioflocculant production and identifying the effect of overexpressing epsB on the synthesis of polysaccharide and γ-PGA in Bacillus licheniformis[J]. Microbial Cell Factories, 2017, 16(1): 163 DOI:10.1186/s12934-017-0775-9. |
| [48] | ZENG WM, ZHANG SS, XIA MC, WU XL, QIU GZ, SHEN L. Insights into the production of extracellular polymeric substances of Cupriavidus pauculus 1490 under the stimulation of heavy metal ions[J]. RSC Advances, 2020, 10(34): 20385-20394 DOI:10.1039/C9RA10560C. |
| [49] | SHEN L, LI ZF, WANG JJ, LIU AJ, LI ZH, YU RL, WU XL, LIU YD, LI JK, ZENG WM. Characterization of extracellular polysaccharide/protein contents during the adsorption of Cd(Ⅱ) by Synechocystis sp. PCC6803[J]. Environmental Science and Pollution Research, 2018, 25(21): 20713-20722 DOI:10.1007/s11356-018-2163-3. |
| [50] | SU C, JIANG LQ, ZHANG WJ. A review on heavy metal contamination in the soil worldwide: situation, impact and remediation techniques[J]. Environmental Skeptics and Critics, 2014, 3(2): 24-38. |
| [51] | ARJOON A, OLANIRAN AO, PILLAY B. Co-contamination of water with chlorinated hydrocarbons and heavy metals: challenges and current bioremediation strategies[J]. International Journal of Environmental Science and Technology, 2013, 10(2): 395-412 DOI:10.1007/s13762-012-0122-y. |
| [52] | RAJ KK, SARDAR UR, BHARGAVI E, DEVI I, BHUNIA B, TIWARI ON. Advances in exopolysaccharides based bioremediation of heavy metals in soil and water: a critical review[J]. Carbohydrate Polymers, 2018, 199: 353-364 DOI:10.1016/j.carbpol.2018.07.037. |
| [53] | WEI LL, LI Y, NOGUERA DR, ZHAO NB, SONG Y, DING J, ZHAO QL, CUI FY. Adsorption of Cu2+ and Zn2+ by extracellular polymeric substances (EPS) in different sludges: effect of EPS fractional polarity on binding mechanism[J]. Journal of Hazardous Materials, 2017, 321: 473-483 DOI:10.1016/j.jhazmat.2016.05.016. |
| [54] | LI N, WEI D, WANG ST, HU LH, XU WY, DU B, WEI Q. Comparative study of the role of extracellular polymeric substances in biosorption of Ni(Ⅱ) onto aerobic/anaerobic granular sludge[J]. Journal of Colloid and Interface Science, 2017, 490: 754-761 DOI:10.1016/j.jcis.2016.12.006. |
| [55] | NARAYANAN M, MA Y. Mitigation of heavy metal stress in the soil through optimized interaction between plants and microbes[J]. Journal of Environmental Management, 2023, 345: 118732 DOI:10.1016/j.jenvman.2023.118732. |
| [56] | YE SH, ZHANG MP, YANG H, WANG H, XIAO S, LIU Y, WANG JH. Biosorption of Cu2+, Pb2+ and Cr6+ by a novel exopolysaccharide from Arthrobacter ps-5[J]. Carbohydrate Polymers, 2014, 101: 50-56 DOI:10.1016/j.carbpol.2013.09.021. |
| [57] | NAVEED S, LI CH, LU XD, CHEN SS, YIN B, ZHANG CH, GE Y. Microalgal extracellular polymeric substances and their interactions with metal(loid)s: a review[J]. Critical Reviews in Environmental Science and Technology, 2019, 49(19): 1769-1802 DOI:10.1080/10643389.2019.1583052. |
| [58] |
CAO FS. The study of exopolysaccharide from Anoxybacillus kamchatkensis L1 in random hot spring[D]. Hangzhou: Master's Thesis of Zhejiang Gongshang University, 2013 (in Chinese). 曹斐姝. 氨温泉中Anoxybacillus kamchatkensis L1菌产胞外多糖的研究[D]. 杭州: 浙江工商大学硕士学位论文, 2013. |
| [59] | FERREIRA ML, GERBINO E, CAVALLERO GJ, CASABUONO AC, COUTO AS, GOMEZ-ZAVAGLIA A, RAMIREZ SAM, VULLO DL. Infrared spectroscopy with multivariate analysis to interrogate the interaction of whole cells and secreted soluble exopolimeric substances of Pseudomonas veronii 2E with Cd(Ⅱ), Cu(Ⅱ) and Zn(Ⅱ)[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2020, 228: 117820 DOI:10.1016/j.saa.2019.117820. |
| [60] | MOTA R, ROSSI F, ANDRENELLI L, PEREIRA SB, PHILIPPIS R, TAMAGNINI P. Released polysaccharides (RPS) from Cyanothece sp. CCY 0110 as biosorbent for heavy metals bioremediation: interactions between metals and RPS binding sites[J]. Applied Microbiology and Biotechnology, 2016, 100(17): 7765-7775 DOI:10.1007/s00253-016-7602-9. |
| [61] | SULAYMON AH, MOHAMMED AA, AL-MUSAWI TJ. Competitive biosorption of lead, cadmium, copper, and arsenic ions using algae[J]. Environmental Science and Pollution Research, 2013, 20(5): 3011-3023 DOI:10.1007/s11356-012-1208-2. |
| [62] | DMYTRYK A, SAEID A, CHOJNACKA K. Biosorption of microelements by Spirulina: towards technology of mineral feed supplements[J]. The Scientific World Journal, 2014, 2014: 356328. |
| [63] | PARDO R, HERGUEDAS M, BARRADO E, VEGA M. Biosorption of cadmium, copper, lead and zinc by inactive biomass of Pseudomonas putida[J]. Analytical and Bioanalytical Chemistry, 2003, 376(1): 26-32 DOI:10.1007/s00216-003-1843-z. |
| [64] | ZHOU Y, XIA SQ, ZHANG J, NGUYEN BT, ZHANG ZQ. Insight into the influences of pH value on Pb(Ⅱ) removal by the biopolymer extracted from activated sludge[J]. Chemical Engineering Journal, 2017, 308: 1098-1104 DOI:10.1016/j.cej.2016.09.141. |
| [65] | CHOJNACKA K, CHOJNACKI A, GORECKA H. Biosorption of Cr3+, Cd2+ and Cu2+ ions by blue-green algae Spirulina sp.: kinetics, equilibrium and the mechanism of the process[J]. Chemosphere, 2005, 59(1): 75-84 DOI:10.1016/j.chemosphere.2004.10.005. |
| [66] |
裘红权, 胡美瑶, 黄益丽. 微生物胞外多糖在修复重金属污染中的潜力及其生物化学机制[J]. 生命的化学, 2021, 41(12): 2545-2555.
QIU HQ, HU MY, HUANG YL. Potential of microbial extracellular polysaccharides in the bioremediation of heavy metals and the underlying biochemical mechanism[J]. Chemistry of Life, 2021, 41(12): 2545-2555 (in Chinese). |
| [67] | PAL A, PAUL AK. Microbial extracellular polymeric substances: central elements in heavy metal bioremediation[J]. Indian Journal of Microbiology, 2008, 48(1): 49-64 DOI:10.1007/s12088-008-0006-5. |
| [68] | SHENG GP, YU HQ, LI XY. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: a review[J]. Biotechnology Advances, 2010, 28(6): 882-894 DOI:10.1016/j.biotechadv.2010.08.001. |
| [69] | BANERJEE S, MISRA A, CHAUDHURY S, DAM B. A Bacillus strain TCL isolated from Jharia coalmine with remarkable stress responses, chromium reduction capability and bioremediation potential[J]. Journal of Hazardous Materials, 2019, 367: 215-223 DOI:10.1016/j.jhazmat.2018.12.038. |
| [70] | BOGGS MA, JIAO YQ, DAI ZR, ZAVARIN M, KERSTING AB. Interactions of plutonium with Pseudomonas sp. strain EPS-1W and its extracellular polymeric substances[J]. Applied and Environmental Microbiology, 2016, 82(24): 7093-7101 DOI:10.1128/AEM.02572-16. |
| [71] | DIMKPA CO, CALDER A, GAJJAR P, MERUGU S, HUANG WJ, BRITT DW, MCLEAN JE, JOHNSON WP, ANDERSON AJ. Interaction of silver nanoparticles with an environmentally beneficial bacterium, Pseudomonas chlororaphis[J]. Journal of Hazardous Materials, 2011, 188(1-3): 428-435 DOI:10.1016/j.jhazmat.2011.01.118. |
| [72] | KANG FX, QU XL, ALVAREZ PJ, ZHU DQ. Extracellular saccharide-mediated reduction of Au3+ to gold nanoparticles: new insights for heavy metals biomineralization on microbial surfaces[J]. Environmental Science & Technology, 2017, 51(5): 2776-2785. |
| [73] | KANG FX, ALVAREZ PJ, ZHU DQ. Microbial extracellular polymeric substances reduce Ag+ to silver nanoparticles and antagonize bactericidal activity[J]. Environmental Science & Technology, 2014, 48(1): 316-322. |
| [74] | GADD GM. Metals, minerals and microbes: geomicrobiology and bioremediation[J]. Microbiology, 2010, 156(3): 609-643 DOI:10.1099/mic.0.037143-0. |
| [75] | BAO P, XIA MC, LIU AJ, WANG MW, SHEN L, YU RL, LIU YD, LI JK, WU XL, FANG CM, CHEN M, QIU GZ, ZENG WM. Extracellular polymeric substances (EPS) secreted by Purpureocillium lilacinum strain Y3 promote biosynthesis of jarosite[J]. RSC Advances, 2018, 8(40): 22635-22642 DOI:10.1039/C8RA03060J. |
| [76] | TCHOUNWOU PB, YEDJOU CG, PATLOLLA AK, SUTTON DJ. Heavy metal toxicity and the environment[M]//LUCH A. Molecular, Clinical and Environmental Toxicology. Volume 3: Environmental Toxicology. Basel: Springer Basel AG, 2012: 133-164. |
| [77] | DO HT, CHE C, ZHAO ZJ, WANG YQ, LI MT, ZHANG XF, ZHAO XM. Extracellular polymeric substance from Rahnella sp. LRP3 converts available Cu into Cu5(PO4)2(OH)4 in soil through biomineralization process[J]. Environmental Pollution, 2020, 260: 114051 DOI:10.1016/j.envpol.2020.114051. |
| [78] | MAHAPATRA B, DHAL NK, PRADHAN A, PANDA BP. Application of bacterial extracellular polymeric substances for detoxification of heavy metals from contaminated environment: a mini-review[J]. Materials Today: Proceedings, 2020, 30: 283-288 DOI:10.1016/j.matpr.2020.01.490. |
| [79] | CHAUHAN M, SOLANKI M, NEHRA K. Putative mechanism of cadmium bioremediation employed by resistant bacteria[J]. Jordan Journal of Biological Sciences, 2017, 10: 101-107. |
| [80] | CONCÓRDIO-REIS P, REIS MAM, FREITAS F. Biosorption of heavy metals by the bacterial exopolysaccharide FucoPol[J]. Applied Sciences, 2020, 10(19): 6708 DOI:10.3390/app10196708. |
| [81] | HUËT MAL, PUCHOOA D. Bioremediation of heavy metals from aquatic environment through microbial processes: a potential role for probiotics?[J]. Journal of Applied Biology and Biotechnology, 2017, 5(6): 14-23. |
| [82] | de PHILIPPIS R, COLICA G, MICHELETTI E. Exopolysaccharide-producing cyanobacteria in heavy metal removal from water: molecular basis and practical applicability of the biosorption process[J]. Applied Microbiology and Biotechnology, 2011, 92(4): 697-708 DOI:10.1007/s00253-011-3601-z. |
| [83] | EL-SHEEKH MM, EL-SHOUNY WA, OSMAN MEH, EL-GAMMAL EW. Growth and heavy metals removal efficiency of Nostoc muscorum and Anabaena subcylindrica in sewage and industrial wastewater effluents[J]. Environmental Toxicology and Pharmacology, 2005, 19(2): 357-365 DOI:10.1016/j.etap.2004.09.005. |
| [84] | JIANG JH, ZHANG N, YANG XJ, SONG LR, YANG S. Toxic metal biosorption by macrocolonies of cyanobacterium Nostoc sphaeroides Kutzing[J]. Journal of Applied Phycology, 2016, 28(4): 2265-2277 DOI:10.1007/s10811-015-0753-8. |
| [85] | TRAN HT, VU ND, MATSUKAWA M, OKAJIMA M, KANEKO T, OHKI K, YOSHIKAWA S. Heavy metal biosorption from aqueous solutions by algae inhabiting rice paddies in Vietnam[J]. Journal of Environmental Chemical Engineering, 2016, 4(2): 2529-2535 DOI:10.1016/j.jece.2016.04.038. |
| [86] | KUMAWAT TK, KUMAWAT V, SHARMA S, KANDWANI N, BIYANI M. Applications of EPS in environmental bioremediations[M]//NADDA AK, SAJNA KV, SHARMA S. Microbial Exopolysaccharides as Novel and Significant Biomaterials. Switzerland: Springer Nature, 2021: 285-302. |
| [87] | MISHRA J, SINGH R, ARORA NK. Alleviation of heavy metal stress in plants and remediation of soil by rhizosphere microorganisms[J]. Frontiers in Microbiology, 2017, 8: 1706 DOI:10.3389/fmicb.2017.01706. |
| [88] | CAO RW, ZHANG YL, JU YH, WANG W, ZHAO YQ, LIU N, ZHANG GR, WANG XB, XIE XS, DAI CX, LIU Y, YIN HF, SHI KY, HE CC, WANG WY, ZHAO LY, JEON CO, HAO LJ. Exopolysaccharide-producing bacteria enhanced Pb immobilization and influenced the microbiome composition in rhizosphere soil of pakchoi (Brassica chinensis L.)[J]. Frontiers in Microbiology, 2023, 14: 1117312 DOI:10.3389/fmicb.2023.1117312. |
| [89] | MUKHERJEE P, MITRA A, ROY M. Halomonas rhizobacteria of Avicennia marina of Indian Sundarbans promote rice growth under saline and heavy metal stresses through exopolysaccharide production[J]. Frontiers in Microbiology, 2019, 10: 1207 DOI:10.3389/fmicb.2019.01207. |
| [90] |
孙科, 沙凤, 谭芳美, 熊美惠. 黏着剑菌CN-02胞外多糖在缓解水稻Cu2+胁迫中的作用[J]. 当代化工研究, 2022(9): 33-35.
SUN K, SHA F, TAN FM, XIONG MH. Effect of extracellular polysaccharide of sword fungus CN-02 on alleviating Cu2+ stress in rice[J]. Modern Chemical Research, 2022(9): 33-35 (in Chinese). |
| [91] | ZAINAB N, AMNA, DIN BU, JAVED MT, AFRIDI MS, MUKHTAR T, KAMRAN MA, UL AIN Q, KHAN AA, ALI J, JATOI WN, MUNIS MFH, CHAUDHARY HJ. Deciphering metal toxicity responses of flax (Linum usitatissimum L.) with exopolysaccharide and ACC-deaminase producing bacteria in industrially contaminated soils[J]. Plant Physiology and Biochemistry, 2020, 152: 90-99 DOI:10.1016/j.plaphy.2020.04.039. |
| [92] | KARTHIK C, OVES M, THANGABALU R, SHARMA R, SANTHOSH SB, ARULSELVI PL. Cellulosimicrobium funkei-like enhances the growth of Phaseolus vulgaris by modulating oxidative damage under chromium(Ⅵ) toxicity[J]. Journal of Advanced Research, 2016, 7(6): 839-850. |
| [93] |
ZHANG YL. Extracellular polysaccharide-producing marine bacteria inhibit Cd2+ absorption in lettuce and basic research on the preparation of its complex microbial inoculants[D]. Jinan: Master's Thesis of Qilu University of Technology, 2023 (in Chinese). 张艺龄. 产胞外多糖海洋细菌阻控生菜吸收Cd2+的作用及其复合菌剂制备的基础研究[D]. 济南: 齐鲁工业大学硕士学位论文, 2023. |
| [94] | UPADHYAY A, KOCHAR M, RAJAM MV, SRIVASTAVA S. Players over the surface: unraveling the role of exopolysaccharides in zinc biosorption by fluorescent Pseudomonas strain psd[J]. Frontiers in Microbiology, 2017, 8: 284. |
| [95] | DOBROWOLSKI R, SZCZEŚ A, CZEMIERSKA M, JAROSZ-WIKOŁAZKA A. Studies of cadmium(Ⅱ), lead(Ⅱ), nickel(Ⅱ), cobalt(Ⅱ) and chromium(Ⅵ) sorption on extracellular polymeric substances produced by Rhodococcus opacus and Rhodococcus rhodochrous[J]. Bioresource Technology, 2017, 225: 113-120. |
| [96] | DEY P, GOLA D, MISHRA A, MALIK A, KUMAR P, SINGH DK, PATEL N, von BERGEN M, JEHMLICH N. Comparative performance evaluation of multi-metal resistant fungal strains for simultaneous removal of multiple hazardous metals[J]. Journal of Hazardous Materials, 2016, 318: 679-685. |
| [97] | LI Q, LI YM, HAN S, LIU YZ, SONG DX, HAO D, WANG JJ, QU YH, ZHENG YX. Optimization of fermentation conditions and properties of an exopolysaccharide from Klebsiella sp. H-207 and application in adsorption of hexavalent chromium[J]. PLoS One, 2013, 8(1): e53542. |
| [98] | BALAJI S, KALAIVANI T, RAJASEKARAN C, SIVA R, SHALINI M, DAS R, MADNOKAR V, DHAMORIKAR P. Bioremediation potential of Arthrospira platensis (Spirulina) against chromium (Ⅵ)[J]. CLEAN-Soil, Air, Water, 2015, 43(7): 1018-1024. |
| [99] | HINDERSAH R, MULYANI O, OSOK R. Proliferation and exopolysaccharide production of Azotobacter in the presence of mercury[J]. Biodiversity Journal, 2017, 8(1): 21-26. |
| [100] | AKHTER K, GHOUS T, ANDLEEB S, NASIM FU, EJAZ S, ULABDIN Z, KHAN BA, AHMED MN. Bioaccumulation of heavy metals by metal-resistant bacteria isolated from Tagetes minuta rhizosphere, growing in soil adjoining automobile workshops[J]. Pakistan Journal of Zoology, 2017, 49(5): 1841-1846. |
| [101] | MAALEJ H, HMIDET N, BOISSET C, BUON L, HEYRAUD A, NASRI M. Optimization of exopolysaccharide production from Pseudomonas stutzeri AS22 and examination of its metal-binding abilities[J]. Journal of Applied Microbiology, 2015, 118(2): 356-367. |
| [102] |
马莹, 骆永明, 滕应, 李秀华. 内生细菌强化重金属污染土壤植物修复研究进展[J]. 土壤学报, 2013, 50(1): 195-202.
MA Y, LUO YM, TENG Y, LI XH. Effects of endophytic bacteria enhancing phytoremediation of heavy metal contaminated soils[J]. Acta Pedologica Sinica, 2013, 50(1): 195-202 (in Chinese). |
| [103] |
贾伟涛, 吕素莲, 林康祺, 马茂华, 吴胜军, 汤叶涛, 仇荣亮, 李银心. 高生物量经济植物修复重金属污染土壤研究进展[J]. 生物工程学报, 2020, 36(3): 416-425.
JIA WT, LV SL, LIN KQ, MA MH, WU SJ, TANG YT, QIU RL, LI YX. Research progress in phytoremediation of heavy-metal contaminated soils with high-biomass economic plants[J]. Chinese Journal of Biotechnology, 2020, 36(3): 416-425 (in Chinese). |
| [104] | RASHID MI, MUJAWAR LH, SHAHZAD T, ALMEELBI T, ISMAIL IMI, OVES M. Bacteria and fungi can contribute to nutrients bioavailability and aggregate formation in degraded soils[J]. Microbiological Research, 2016, 183: 26-41. |
| [105] | BHAGAT N, RAGHAV M, DUBEY S, BEDI N. Bacterial exopolysaccharides: insight into their role in plant abiotic stress tolerance[J]. Journal of Microbiology and Biotechnology, 2021, 31(8): 1045-1059. |
| [106] | NAJM-UL-SEHER, MAQSHOOF A, AZHAR H, MOAZZAM J. Potential of exopolysaccharides producing-lead tolerant Bacillus strains for improving spinach growth under lead stress[J]. International Journal of Agriculture and Biology, 2020, 24(6): 1845-1854. |
 2024, Vol. 64
2024, Vol. 64