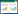中国科学院微生物研究所,中国微生物学会
文章信息
- 董欣楠, 邓思敏, 宋厚辉, 徐加利, 程昌勇. 2024
- DONG Xinnan, DENG Simin, SONG Houhui, XU Jiali, CHENG Changyong.
- 细菌金属离子外排系统及金属稳态调控
- Bacterial metal ion efflux systems and metal homeostasis
- 微生物学报, 64(3): 672-686
- Acta Microbiologica Sinica, 64(3): 672-686
-
文章历史
- 收稿日期:2023-09-02
- 网络出版日期:2023-12-04
金属离子在生物体内作为蛋白质的催化辅助因子发挥关键作用[1]。细菌内外环境中,金属离子的匮乏和胁迫都可改变相关蛋白质的物理化学性质,如催化酶促反应过程、破坏蛋白的稳定结构、影响离子转运过程等[2]。以金属离子及金属团簇为辅因子或辅基的蛋白质约占总量的25%,包括含铁蛋白、蓝铜蛋白、铁硫蛋白及金属酶等。此外,金属蛋白在细胞生理过程中通过结合金属离子发挥作用,如呼吸作用、转录翻译、信号转导及增殖等[3]。
在感染期间,细菌作为病原从宿主的组织细胞环境中通过金属转运蛋白等方式吸收、利用、储存和外排金属离子,维持自身离子稳态。据报道,环境中的金属离子可协助宿主免疫细胞对细菌施加毒性作用,抑制细菌生长,其机制包括活性氧(reactive oxygen species, ROS)的过量产生[4]、金属蛋白酶的过度催化、金属蛋白结构位点的竞争置换[5]等。因此,近年来“营养免疫学”的研究广度逐渐扩宽,突破过去宿主免疫细胞限制金属利用水平的观念。
研究发现,宿主免疫系统于不同组织位点具有不同的抗菌策略,如小鼠感染鲍曼不动杆菌后,在呼吸系统内表现锌饥饿,在脾脏组织内表现锌中毒[6]。目前认为,宿主的金属中毒抗菌机制常涉及锌离子和铜离子,吞噬小体内化细菌后特异性形成高浓度金属离子环境,推测其在保护宿主组织细胞的同时利用金属离子毒性抑制细菌增殖[7]。铁死亡是一种依赖铁离子介导氧化损伤的调节性细胞死亡。细菌感染早期,巨噬细胞内亚铁离子浓度和脂质过氧化水平急剧上升,感染后期降至正常水平,且在巨噬细胞中加入铁死亡诱导剂可进一步抑制细菌增殖[8]。
细菌为应对金属中毒进化出多种重金属解毒机制,可根据细胞结构分类为细胞外部沉淀机制、细胞表面吸附机制和细胞内部解毒机制[9]。细菌的内部解毒机制主要区分为促进重金属外排作用、阻遏重金属内流作用、重金属转化作用及细胞内部区域化作用等[10-11]。作为细菌金属抗性机制的第二道防线,金属螯合蛋白和金属外排蛋白通常由MerR或ArsR/SmtB转录调控因子家族成员调控其表达水平[12-13]。MerR家族同源物通过金属依赖性的构象变化改变长间隔启动子区以促进转录,相反,ArsR/SmtB家族同源物未结合金属离子时抑制转录[14]。
细菌的金属外排系统结构复杂且相互协作,针对胞内外金属离子浓度起调控作用,因此革兰氏阴性菌和革兰氏阳性菌的金属外排系统有明显差异。革兰氏阴性菌的细胞壁特有周质间隙及外膜结构,可在周质间隙中表达具有金属结合能力的蛋白作为胞内外金属离子转运的中间站[15],如通过锌外排蛋白CzcD将锌离子从胞质运输到周质间隙中,与锌结合转运蛋白CzcI结合暂时储存隔离,再由锌外排蛋白CzcCBA转运至胞外[6];而革兰氏阳性菌中的外排系统结构大多较为简单,即通过相应外排蛋白直接转运。细菌的金属外排系统不仅输出特定的金属离子,并且在金属稳态调控、病原毒力、细菌运动性及应对免疫细胞杀灭等方面都有重要影响。本文将以常见金属离子铁、铜、锌和锰为例,详细阐述其在细菌感染过程中的相关外排系统,对于金属离子外排系统展开详细论述,有助于后续深入研究细菌金属稳态调控的相关分子机制。
1 铁外排系统 1.1 宿主通过提高胞内亚铁离子浓度杀伤细菌铁是生物体中大量存在的过渡金属,细菌胞外环境及其胞内的铁水平稳态在感染宿主期间起到关键作用。铁离子的重要性很大程度上归因于二价铁和三价铁之间的氧化还原转换,此特性也使铁成为许多功能酶中的辅因子[16]。巨噬细胞对抗细菌感染的一个关键策略即隔离胞内铁离子、维持较低胞外铁浓度进而限制病原对于铁的吸收利用[17-18]。铁作为细菌繁殖的必要营养元素被宿主限制可用性,这符合传统营养免疫学观念,但近年研究发现,巨噬细胞可通过海普西丁转铁蛋白将胞浆内亚铁转运至细菌感染位点,并诱导NADH氧化酶2 (NADH oxidase 2, Nox2)和芬顿催化反应局部催化ROS产生[19],从而导致细菌铁死亡。宿主细胞通过亚铁而不是三价铁表现出抗菌活性,这与大部分细菌可通过铁吸收系统或铁螯合蛋白结合三价铁,并运输至细菌胞内作为营养来源的铁吸收机制相符合[20]。
1.2 细菌中存在多种铁离子外排系统增强环境适应性随着对细胞铁死亡和凋亡模型及铁稳态调控等研究的深入,铁作为细菌感染过程中必需的金属元素,与其相关的摄取、利用、外排等机制被广泛关注。面对免疫细胞杀伤作用时,细菌如何精确调节自身铁稳态,保证足够铁元素供给自身生长代谢,同时防止高浓度铁离子引起的氧化应激细胞损伤,是目前具有重要研究价值的方向。
细菌体内已知存在4类铁外排系统(图 1)。(1) P型ATP酶是包含跨细胞膜离子蛋白和脂质蛋白的蛋白质家族,由三部分组成:6−8个跨膜螺旋构成的TM结构域、ATP结合结构域和细胞质催化域[21]。P1B-ATPase亚族与金属离子的运输关系密切,P1B4家族蛋白在枯草芽胞杆菌[22]、单核细胞增生李斯特菌[23]、结核分枝杆菌[24]和A组乙型溶血性链球菌等细菌中均表现出铁外排特性,这些基因转录水平受Fur或PerR家族蛋白调控,在铁介导的氧化应激中具有双重作用。(2) 阳离子扩散促进因子家族(cation diffusion facilitator family, CDF)是各生命体中普遍存在的金属转运蛋白家族,其成员多为金属专一性转运蛋白,主要负责锌、钴、镉和镍等离子的转运[25]。2005年,大肠埃希菌(又称大肠杆菌)体内CDF家族蛋白FieF (YiiP)作为首个外排铁离子以缓解细菌铁胁迫的转运蛋白被报道[26]。铁摄取调控蛋白Fur是大肠杆菌及多种细菌中广泛存在且调控铁稳态的转录调节因子[27],FieF同时作用于铁离子和锌离子的外排,它表现出明显的铁浓度依赖性表达但不受Fur调控。FieF利用呼吸链产生的质子梯度将高浓度铁转运至胞膜外,和Fur分别从外排和摄取两个角度共同维持大肠杆菌的铁稳态平衡[26]。已有多篇文献报道铜绿假单胞菌[28]和奥奈达希瓦氏菌[29]等细菌中针对铁外排的CDF蛋白,但其具体的调控机制未知。(3) 转运蛋白超家族(major facilitator superfamily, MFS)由2个结构域组成,每个结构域包括6个跨膜螺旋结构。此蛋白家族中唯一被报道与铁外排相关的成员是鼠伤寒沙门氏菌中的IceT,IceT被调控抗生素耐药性及外排的BaeSR系统控制转录[30]。(4) 膜结合铁蛋白作为特殊的外排蛋白,由两对同源的反平行螺旋结构构成,为类铁蛋白家族(erritin-like superfamily)[31]。在根癌农杆菌[32]和慢生性大豆根瘤菌[33]中表现出重要的铁离子转运作用,并在植物宿主感染期间的氧化应激机制中扮演主要角色。

|
| 图 1 细菌中存在的铁外排系统组成示意图 Figure 1 Diagram of iron efflux systems in bacteria. |
单核细胞增生李斯特菌存在与枯草芽胞杆菌铁外排蛋白PfeT高同源性的转运蛋白FrvA (Lmo0641)[23],属于金属转运ATPases亚家族P1B4成员。FrvA的表达可被高浓度亚铁环境诱导,并且在体外及其他细菌中表现明显的铁离子抗性,同时FrvA可以针对锌离子和钴离子进行转运,在单核细胞增生李斯特菌感染宿主过程中起重要作用。研究表明,细菌的铁外排蛋白多作为毒力因子发挥作用,在单核细胞增生李斯特菌、化脓性链球菌和结核分枝杆菌等病原中,对于细菌胞内铁浓度水平有严格要求,细菌需要高效敏感的铁转运蛋白才能适应宿主细胞内快速变化的铁可利用性水平[34]。
2 铜外排系统 2.1 免疫细胞吞噬体内的铜积累影响细菌蛋白结构和功能铜是Irving-Williams序列中结合能力最强的金属元素,作为酶辅因子在氧化磷酸化、色素沉着、超氧化物歧化和维持金属稳态等细胞生理活动中起重要作用。铜可以通过氧化还原反应在不同价态中转化,一价铜和二价铜皆易与生物配体相互作用[35],因此,宿主免疫细胞可通过升高环境铜浓度抑制病原增殖。在宿主体内,铜离子可通过转运蛋白CTR1运输至巨噬细胞等免疫细胞胞质内,随后被铜伴侣蛋白ATOX1携带至吞噬体膜表面并由ATP7A转运至吞噬体中[36]。
免疫细胞通过吞噬体内的铜积累对抗细菌感染的具体机制尚未阐明。根据文献报道推测,高浓度铜离子可破坏铁硫团簇结构[37]及催化非天然二硫键产生,从而破坏蛋白质的正常折叠结构并影响蛋白功能[38]。由于铜离子对于硫醇配体有高亲和力,可以诱导金属蛋白发生错误金属化,因此细菌蛋白成熟过程中也遭受铜胁迫威胁[37]。此外,高浓度铜导致脂蛋白和肽聚糖等细胞膜结构和细胞膜表面蛋白缺陷。目前研究结果显示,与过量铁毒性类似,体外实验中铜离子可诱导ROS的过量产生,但尚未明确其在体内实验中和氧化应激相关的作用机制[39]。
2.2 铜外排系统影响细菌的致病力和抗应激能力病原在铜胁迫环境中不仅需要处理高浓度铜离子,同时对与铜协作的金属离子如铁和锌的敏感性也会增高[40]。针对上述情况,细菌已进化出多种针对铜胁迫的外排系统,如大肠杆菌中的多铜氧化酶CueO可将高毒性的一价铜转化为低毒性的二价铜[41],从而氧化肠杆菌素前体减少亚铜离子累积[42]。
细菌中常见的铜外排蛋白主要属于P型ATP酶家族,如大肠杆菌中的CopA,铜绿假单胞菌中的CopA1和CopA2,以及金黄色葡萄球菌[43]、鼠伤寒沙门氏菌等细菌中的同源蛋白。CopA、CopB与真菌的高尔基体铜转运蛋白Ccc2相似[44],但两者的铜离子结合基序同源性较低,CopB中存在富含组氨酸的N末端铜离子结合结构域,CopA则具有Cys-Pro-Cys铜离子结合基序[45-46]。当铜外排相关基因发生突变导致蛋白功能缺陷时,细菌面对免疫细胞杀伤的存活率显著降低。以大肠杆菌CusABC[47]为代表的耐药-结瘤-细胞分裂(resistance-nodulation-cell division, RND)家族外排蛋白是一类由内膜转运蛋白、周质融合蛋白、外膜外排蛋白组成的蛋白复合体,在革兰氏阴性菌中部分表现出铜离子外排特性[48]。细菌中存在以CueR为代表的转录调控因子控制上述铜离子外排蛋白表达,以维持细菌胞内铜离子浓度稳定。此外,富含半胱氨酸的金属硫蛋白可与亚铜离子结合,调节离子浓度水平,如分枝杆菌中的MymT和SmtA[49]及大肠杆菌中的CusF[47]等。在大肠杆菌的铜外排系统CusFABC中,CusF可以结合周质中的亚铜离子并运输至CusA,再外排至胞外[50] (图 2)。
|
| 图 2 细菌中存在的铜外排系统组成示意图 Figure 2 Diagram of copper efflux systems in bacteria. |
Katumba等研究发现铜解毒机制也与铁载体相关,铁载体-耶尔森杆菌素(yersiniabactin, Ybt)是一种与肠杆菌科病菌致病能力增强相关的铁载体,在动物模型感染期间表现结合铜离子的特性。过量二价铜刺激大肠杆菌分泌Ybt,并形成稳定络合物,通过TonB相关外膜转运蛋白内化进入胞内,从宿主尿液样本中可检测发现该络合物[51]。Ybt可限制巨噬细胞中铜离子的积累,保护大肠杆菌免受ROS杀伤。在沙门氏菌感染过程中,添加特定的铜络合物将显著提升病原的存活能力和感染效率。而铜抗性关键基因缺失株在感染过程中相比野生株表现出较弱的致病力和存活能力[7]。
单核细胞增生李斯特菌中存在高度保守的csoR-copA-copZ铜抗性操纵子,编码P1B-1-type ATPase铜外排蛋白CopA (Lmo1853)和金属伴侣蛋白CopZ (Lmo1852)。当细菌受到过量铜胁迫时,CsoR作为铜浓度依赖性转录抑制因子调控CopA的表达水平,单核细胞增生李斯特菌CsoR和金黄色葡萄球菌的一致性为36.5%,两者区别在于单核细胞增生李斯特菌的CsoR转录抑制子不完全与csoR-copA-copZ铜抗性操纵子解离,而是与铜离子结合后发生构象改变。值得注意的是,与多数革兰氏阳性菌情况不同,CopZ并不负责铜离子的运输或增强外排蛋白表达,反而作为铜存储蛋白减缓CopA的铜外排作用[52]。经鉴定,部分单核细胞增生李斯特菌(AT3E、MF4626和HPB5415等)菌株携带额外的铜抗性质粒(如copB、mco和copL),且与金黄色葡萄球菌等共享生存环境的病原铜抗性基因有较高的同源性,说明各菌种间可能存在抗性基因的交换,从而极大增强了李斯特菌在自然环境及食品加工环节中的污染能力[53]。
3 锌外排系统 3.1 锌中毒影响细菌的氧化应激敏感性和碳源利用能力锌是细菌合成重要功能蛋白的必需金属元素,锌离子浓度可以影响细菌的基因转录、蛋白表达、细胞分裂分化、糖酵解和抗氧化应激等生理过程[54]。当细菌处于锌饥饿状态时,其耐药性如抗碳青霉烯类抗生素和毒力蛋白表达水平表现显著减弱,然而,锌过量同样产生细胞毒性[6],锌离子毒性主要体现于结合非锌金属蛋白、增强细菌氧化应激敏感性、减弱碳源利用能力[55]和破坏其他金属离子如铜离子的胞内稳态。锌毒性的产生机制尚未明确,目前研究认为锌离子的高亲和力和氧化还原惰性可引起蛋白质错误金属化,降低蛋白酶活性[56]。锌离子过量情况下,可以在关键结合位点与铁等金属离子竞争结合,如拓扑异构酶[57]。链球菌感染过程中,锌胁迫环境可抑制糖酵解酶和磷酸葡萄糖变位酶活性,导致生物被膜形成能力减弱、生长繁殖速度减慢,细菌存活能力减弱[58]。同时,铁硫团簇蛋白在DNA复制转录和能量代谢等多种生理过程中不可或缺,而锌离子对于铁硫团簇蛋白表达具有显著影响。锌离子胁迫可以抑制大肠杆菌的铁硫团簇结构蛋白如IscU、IscA的表达,从而破坏脱水酶的铁硫团簇。锌离子通过破坏铁硫团簇结构引起细胞中毒,对于细菌增殖形成严重威胁[59]。
研究发现,巨噬细胞被结核分枝杆菌感染后,吞噬小体将内化结核分枝杆菌且特异性主导锌离子内流[60],使巨噬细胞的胞内锌离子浓度显著上升。目前锌离子在巨噬细胞内转运机制仍未明确阐述,可能是宿主细胞内金属硫蛋白复合体在NADPH氧化酶作用下释放过量锌离子,SLC30a1等锌转运体以脂多糖依赖性的转运形式介导巨噬细胞内锌离子累积[56, 61]。
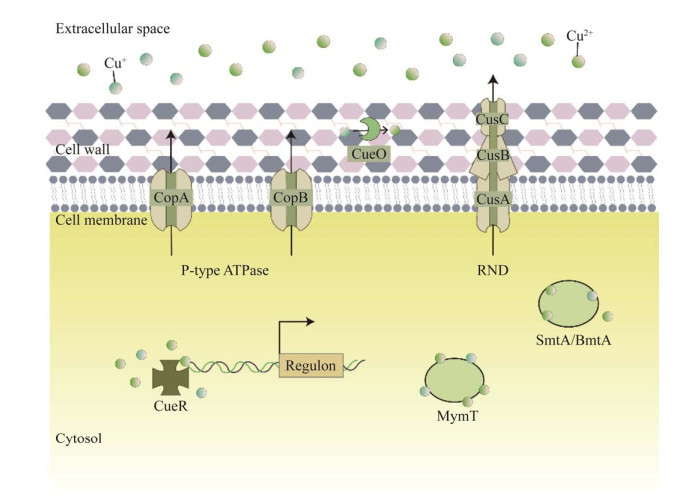
3.2 细菌锌外排系统呈现多底物多系统调控外排以维持细胞稳态细菌体内存在复杂且高效的锌离子外排系统(图 3),由转录调节因子、外排蛋白、金属硫蛋白等元件构成。锌外排蛋白常见类型为P型ATP酶、RND家族外排蛋白和CDF家族外排蛋白,在革兰氏阳性菌和革兰氏阴性菌中存在一定差异。革兰氏阴性菌中常见由ZntR等转录调控因子调控的P型ATP酶ZntA和CDF家族蛋白,如大肠杆菌中的ZitB和CzcD,两者协作外排锌离子以维持细菌胞内锌离子稳态[62]。革兰氏阳性菌中常见由CzrA转录调控因子调控的P型ATP酶CadA和CDF家族蛋白CzcD,如枯草芽胞杆菌和单核细胞增生李斯特菌中的CadA和CzcD[14, 63]。
|
| 图 3 细菌中存在的锌外排系统组成示意图 Figure 3 Diagram of zinc efflux systems in bacteria. |
值得注意的是,上述锌离子外排系统不只作用于锌离子的转运。例如枯草芽胞杆菌中的CzrA能够感知多种阳离子存在并响应其上调表达,而CadA和CzcD可以外排镉、铜等金属离子[63];大肠杆菌中的CDF外排蛋白ZitB对镉、镍和铜等离子具有转运功能[64]。鲍曼不动杆菌作为临床常见的多重耐药菌株受到广泛关注,其外排蛋白CzcICBAD被报道能够根据不同锌浓度环境调控外排锌离子的能力。其中,CzcD将细菌胞质内锌离子外排至周质,并由富含组氨酸残基和跨膜转运信号肽Sec的CzcI负责隔离锌离子,又经HME系统蛋白CzcCBA作用,转运锌离子外排至胞外[6]。铜绿假单胞菌则具有4个锌离子外排系统:CadA、CzcD、YiiP和CzcRS双组分系统调控的CzcCBA。研究发现,CadA和CzcCBA作为主要的锌离子外排系统,两者受锌离子诱导表达的程度不同,且功能上互补冗余[65]。同时,CzcRS被证明与细菌的耐药性相关,直接抑制与碳青霉烯类抗生素作用相关的OprD通道蛋白[66]。在天蓝色链霉菌中,Zur作为细菌锌吸收系统中常见的转录调节因子,可以同时调控锌吸收蛋白ZitA和锌外排蛋白ZitB。这突破了锌饥饿和锌过量的相关调节因子分属不同系统的认识,表明锌可作为单一的环境条件通过Zur调控天蓝色链霉菌中锌吸收及外排基因的表达[67]。
通过查阅文献和生物信息学分析,针对单核细胞增生李斯特菌中可能存在的锌外排系统开展研究,凝胶迁移阻滞实验(electrophoretic mobility shift assays, EMSA)表明锌外排调控蛋白CzrA (由lmo2493基因编码)可以直接结合lmo1100和lmo2575启动子序列,证实锌外排调控蛋白CzrA调控锌外排蛋白CadA (由lmo1100基因编码)和CzcD (由lmo2575基因编码)表达。锌外排蛋白系统能够影响单核细胞增生李斯特菌胞内锌和铁离子的稳态(相关数据未发表),通过探究CzrA结合靶基因的关键位点及调节靶基因表达的分子基础,影响细菌耐药性或致病力,进而阐明单核细胞增生李斯特菌中锌离子浓度及相关调控机制在细菌感染及致病力方面的影响。
4 锰外排系统 4.1 细菌锰离子动态平衡在应激反应和感染过程中维持蛋白正常功能锰离子稳态在细菌感染过程中对氧化应激应答、毒力基因表达、致病力等表型有重要影响[68-69]。锰具有较强催化特性,可在铁离子失衡及应激条件下维持部分功能蛋白的正常表达,如超氧化物歧化酶和核糖核苷酸还原酶[70]。与其他金属离子类似,锰在细菌体内作为营养元素存在;当锰过量时,对细菌表现一定毒性作用。锰是细菌抵抗氧化还原应激的重要离子,缺失锰外排蛋白MntE的猪链球菌较野生株的氧化应激敏感性明显增强[71]。高浓度锰诱导细胞毒性可干扰细菌正常铁代谢,影响其他金属离子稳态,易发生金属错配降低金属酶活性[68]。在大肠杆菌中,过量锰离子破坏铁硫团簇结构和含血红素的蛋白质结构,进而抑制电子传递链相关蛋白质功能,影响能量代谢[72]。
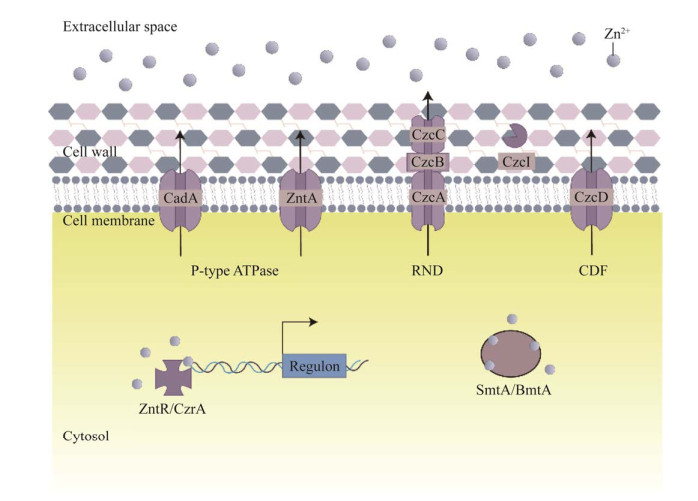
4.2 细菌锰离子外排系统影响细菌的环境适应能力和毒力细菌可通过锰离子吸收和外排系统调控金属动态平衡,抵抗免疫细胞锰离子过量的抗菌策略。与锰离子相关的外排系统(图 4)基本由锰依赖性转录调节因子、锰敏感型核糖开关、锰转运体和锰外排蛋白组成[73]。MntR作为主要传感器和转录调节因子,与足量锰离子结合后作用于靶基因的启动子区,从而抑制或诱导靶蛋白的表达[74]。锰离子外排蛋白家族在近几年研究中被不断扩充,CDF家族的MntE作为首个锰离子外排蛋白在肺炎链球菌中发现,它受MntR调控并且对细菌毒力具有正向作用[75]。枯草芽胞杆菌中存在CDF家族锰外排蛋白MneP和MneS,它们同样受MntR调控,在高锰环境下表达水平上调[76]。细菌体内锰敏感型核糖开关yybP-ykoY的发现确定了第二类锰外排蛋白MntP[77],核糖开关yybP-ykoY可与锰离子结合并受环境锰离子水平调控[78]。针对锰离子依赖性核糖开关开展研究,研究者逐渐发现更多的锰外排蛋白,如PⅡ型ATP酶在乳酸菌中被命名YoaB,而肺炎链球菌中存在它的同源蛋白MgtA,值得注意的是,MgtA上游的核糖开关在锰胁迫条件下可调节钙离子外排,这或许说明锰离子和钙离子的动态平衡存在一定关联[79]。另一类锰外排蛋白MneA在弧菌属中被报道,它在霍乱弧菌中序列高度保守,且突变体仅对锰离子表现出高敏感性[80]。除了大肠杆菌的MntP锰外排蛋白在转录前后分别受MntR和yybP-ykoY核糖开关调控,其余几类已被报道的锰外排蛋白目前均认为只受特定转录调节因子调控[81],对于细菌锰外排调控机制的研究有待进一步探索。
|
| 图 4 细菌中存在的锰外排系统组成示意图 Figure 4 Diagram of manganese efflux systems in bacteria. |
本团队对于单核细胞增生李斯特菌中锰外排蛋白展开深入研究,发现缺失锰外排蛋白Lmo2423影响单核细胞增生李斯特菌的鞭毛生成,从而降低其运动能力。在30 ℃培养24 h和48 h后,缺失株的运动圈直径较野生株EGD-e分别下降46.05%和42.61%。缺失株对过氧化氢的抵抗能力较野生株显著下降,表明锰外排蛋白Lmo2423能够增强单核细胞增生李斯特菌的抗氧化应激能力。在体内实验中,发现缺失lmo2423基因后单核细胞增生李斯特菌的细胞黏附、侵袭及胞内迁移能力增强,且内化素InlB蛋白表达量增高,表明锰外排蛋白Lmo2423参与介导单核细胞增生李斯特菌的致病力(相关数据未发表)。
5 展望本团队主要致力于单核细胞增生李斯特菌金属外排系统的鉴定以及影响细菌毒力和环境适应能力的分子机制研究。结合文献报道及团队研究成果,发现在细菌感染过程中,宿主通过调控微量金属元素浓度杀伤或抑制病原菌定殖,引发细菌蛋白的错误金属化和氧化应激损伤。病原菌利用自身编码的金属转运系统发挥重要作用,通过外排细菌胞内金属离子,稳定胞内金属离子的动态平衡,适应宿主体内复杂的环境变化。聚焦细菌金属外排蛋白系统的研究,不仅有助于深入理解该菌在体内外环境中的生存机制,对于阐明体内金属稳态调控机制也十分重要。
金属离子稳态调控在微生物生态学领域具有广泛的应用和深远的影响。微生物群落的多样性对于生态系统的稳定性至关重要,金属离子可以影响微生物的多样性和分布[82]。在生物体内同样,例如人体肠道内的致病菌不仅与宿主共享金属离子资源,并且存在微生物间拮抗、协同等现象[83]。一些微生物对于金属的需求较高,其他一些微生物则对金属敏感。通过调控金属离子的供应,可以选择性地促进或抑制特定微生物的生长,从而塑造微生物群落的结构和功能。研究发现,致病菌可以通过竞争、代谢和信号分子的释放来影响宿主的金属离子代谢,进而影响免疫系统和整体健康[7]。综上所述,金属离子调控研究从微生物生态角度对于理解和干预微生物群落的生态学、医学和环境学重要性巨大,在这个领域开展深入研究有望为疾病治疗、生态保护和可持续发展提供新的方法和洞察。
目前,研究者把破坏致病菌金属稳态视为抗菌药物的重要靶点,用于开发治疗多重耐药菌株感染的新策略。美国食品药品监督管理局(US Food and Drug Administration, FDA)已批准头孢地洛用于临床治疗[84],意味着通过细菌铁载体转运系统提高抗生素疗效成为落地实施的可行方案,这将进一步推动微生物金属代谢相关的基础研究和临床抗感染应用。
随着金属外排系统相关研究成果的陆续出现,拓宽了研究者对其相关研究领域的认识,但仍有许多未知部分需要进一步研究。镉、镓、铬等微量金属离子虽然在胞内含量较少,但同样作为金属稳态的主要成员存在,在许多病原菌中相关外排蛋白的作用机制尚未明确。同样,对于已报道的金属外排系统,其内部调控机制和离子稳态的相关分子机制仍有待挖掘。综上所述,目前对于金属外排蛋白的系统性研究仍然缺乏,能否揭示各类金属外排系统调控的分子细节,对于了解病原微生物和宿主之间的相互作用具有重要意义,能够帮助人类在耐药菌显著增多的当下,更精确有效地维持微生物生态、抵抗细菌感染、提高临床疗效和合理用药。
| [1] | ANDREINI C, BERTINI I, CAVALLARO G, HOLLIDAY GL, THORNTON JM. Metal ions in biological catalysis: from enzyme databases to general principles[J]. JBIC Journal of Biological Inorganic Chemistry, 2008, 13(8): 1205-1218 DOI:10.1007/s00775-008-0404-5. |
| [2] | MARET W. Metalloproteomics, metalloproteomes, and the annotation of metalloproteins[J]. Metallomics: Integrated Biometal Science, 2010, 2(2): 117-125 DOI:10.1039/B915804A. |
| [3] | ZHANG Y, ZHENG JG. Bioinformatics of metalloproteins and metalloproteomes[J]. Molecules (Basel, Switzerland), 2020, 25(15): 3366 DOI:10.3390/molecules25153366. |
| [4] | MACOMBER L, IMLAY JA. The iron-sulfur clusters of dehydratases are primary intracellular targets of copper toxicity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(20): 8344-8349. |
| [5] | RANQUET C, OLLAGNIER-DE-CHOUDENS S, LOISEAU L, BARRAS F, FONTECAVE M. Cobalt stress in Escherichia coli. The effect on the iron-sulfur proteins[J]. Journal of Biological Chemistry, 2007, 282(42): 30442-30451 DOI:10.1074/jbc.M702519200. |
| [6] | ALQUETHAMY SF, ADAMS FG, NAIDU V, KHORVASH M, PEDERICK VG, ZANG MG, PATON JC, PAULSEN IT, HASSAN KA, CAIN AK, MCDEVITT CA, EIJKELKAMP BA. The role of zinc efflux during Acinetobacter baumannii infection[J]. ACS Infectious Diseases, 2020, 6(1): 150-158 DOI:10.1021/acsinfecdis.9b00351. |
| [7] | MURDOCH CC, SKAAR EP. Nutritional immunity: the battle for nutrient metals at the host-pathogen interface[J]. Nature Reviews Microbiology, 2022, 20(11): 657-670 DOI:10.1038/s41579-022-00745-6. |
| [8] | MA RN, FANG L, CHEN L, WANG XN, JIANG J, GAO LZ. Ferroptotic stress promotes macrophages against intracellular bacteria[J]. Theranostics, 2022, 12(5): 2266-2289 DOI:10.7150/thno.66663. |
| [9] |
王泽煌, 王蒙, 蔡昆争, 蔡一霞, 黄飞. 细菌对重金属吸附和解毒机制的研究进展[J]. 生物技术通报, 2016, 32(12): 13-18.
WANG ZH, WANG M, CAI KZ, CAI YX, HUANG F. Research advances on biosorption and detoxification mechanisms of heavy metals by bacteria[J]. Biotechnology Bulletin, 2016, 32(12): 13-18 (in Chinese). |
| [10] | BALDI F, GALLO M, MARCHETTO D, FANI R, MAIDA I, HORVAT M, FAJON V, ZIZEK S, HINES M. Seasonal mercury transformation and surficial sediment detoxification by bacteria of Marano and Grado lagoons[J]. Estuarine, Coastal and Shelf Science, 2012, 113: 105-115 DOI:10.1016/j.ecss.2012.02.008. |
| [11] | OSMAN D, WALDRON KJ, DENTON H, TAYLOR CM, GRANT AJ, MASTROENI P, ROBINSON NJ, CAVET JS. Copper homeostasis in Salmonella is atypical and copper-CueP is a major periplasmic metal complex[J]. Journal of Biological Chemistry, 2010, 285(33): 25259-25268 DOI:10.1074/jbc.M110.145953. |
| [12] | BROWN NL, STOYANOV JV, KIDD SP, HOBMAN JL. The MerR family of transcriptional regulators[J]. FEMS Microbiology Reviews, 2003, 27(2/3): 145-163. |
| [13] | BUSENLEHNER LS, PENNELLA MA, GIEDROC DP. The SmtB/ArsR family of metalloregulatory transcriptional repressors: structural insights into prokaryotic metal resistance[J]. FEMS Microbiology Reviews, 2003, 27(2/3): 131-143. |
| [14] | MOORE CM, GABALLA A, HUI M, YE RW, HELMANN JD. Genetic and physiological responses of Bacillus subtilis to metal ion stress[J]. Molecular Microbiology, 2005, 57(1): 27-40 DOI:10.1111/j.1365-2958.2005.04642.x. |
| [15] | MONTANINI B, BLAUDEZ D, JEANDROZ S, SANDERS D, CHALOT M. Phylogenetic and functional analysis of the cation diffusion facilitator (CDF) family: improved signature and prediction of substrate specificity[J]. BMC Genomics, 2007, 8(1): 1-16 DOI:10.1186/1471-2164-8-1. |
| [16] | BEINERT H, HOLM RH, MÜNCK E. Iron-sulfur clusters: nature's modular, multipurpose structures[J]. Science, 1997, 277(5326): 653-659 DOI:10.1126/science.277.5326.653. |
| [17] | HALEY KP, SKAAR EP. A battle for iron: host sequestration and Staphylococcus aureus acquisition[J]. Microbes and Infection, 2012, 14(3): 217-227 DOI:10.1016/j.micinf.2011.11.001. |
| [18] | MU QD, CHEN LY, GAO XT, SHEN SY, SHENG WJ, MIN JX, WANG FD. The role of iron homeostasis in remodeling immune function and regulating inflammatory disease[J]. Science Bulletin, 2021, 66(17): 1806-1816 DOI:10.1016/j.scib.2021.02.010. |
| [19] | LIM D, KIM KS, JEONG JH, MARQUES O, KIM HJ, SONG M, LEE TH, KIM JI, CHOI HS, MIN JJ, BUMANN D, MUCKENTHALER MU, CHOY HE. The hepcidin-ferroportin axis controls the iron content of Salmonella-containing vacuoles in macrophages[J]. Nature Communications, 2018, 9(1): 2091 DOI:10.1038/s41467-018-04446-8. |
| [20] | HOLDEN VI, BACHMAN MA. Diverging roles of bacterial siderophores during infection[J]. Metallomics: Integrated Biometal Science, 2015, 7(6): 986-995 DOI:10.1039/C4MT00333K. |
| [21] | BRADLEY JM, SVISTUNENKO DA, WILSON MT, HEMMINGS AM, MOORE GR, LE BRUN NE. Bacterial iron detoxification at the molecular level[J]. Journal of Biological Chemistry, 2020, 295(51): 17602-17623 DOI:10.1074/jbc.REV120.007746. |
| [22] | GUAN GH, PINOCHET-BARROS A, GABALLA A, PATEL SJ, ARGÜELLO JM, HELMANN JD. PfeT, a P1B4-type ATPase, effluxes ferrous iron and protects Bacillus subtilis against iron intoxication[J]. Molecular Microbiology, 2015, 98(4): 787-803 DOI:10.1111/mmi.13158. |
| [23] | PI HL, PATEL SJ, ARGÜELLO JM, HELMANN JD. The Listeria monocytogenes Fur-regulated virulence protein FrvA is an Fe(Ⅱ) efflux P1B4-type ATPase[J]. Molecular Microbiology, 2016, 100(6): 1066-1079 DOI:10.1111/mmi.13368. |
| [24] | PATEL SJ, LEWIS BE, LONG JE, NAMBI S, SASSETTI CM, STEMMLER TL, ARGÜELLO JM. Fine-tuning of substrate affinity leads to alternative roles of Mycobacterium tuberculosis Fe2+-ATPases[J]. Journal of Biological Chemistry, 2016, 291(22): 11529-11539 DOI:10.1074/jbc.M116.718239. |
| [25] | ANTON A, GROSSE C, REISSMANN J, PRIBYL T, NIES DH. CzcD is a heavy metal ion transporter involved in regulation of heavy metal resistance in Ralstonia sp. strain CH34[J]. Journal of Bacteriology, 1999, 181(22): 6876-6881 DOI:10.1128/JB.181.22.6876-6881.1999. |
| [26] | GRASS G, OTTO M, FRICKE B, HANEY CJ, RENSING C, NIES DH, MUNKELT D. FieF (YiiP) from Escherichia coli mediates decreased cellular accumulation of iron and relieves iron stress[J]. Archives of Microbiology, 2005, 183(1): 9-18 DOI:10.1007/s00203-004-0739-4. |
| [27] | SCHÄFFER S, HANTKE K, BRAUN V. Nucleotide sequence of the iron regulatory gene fur[J]. Molecular and General Genetics MGG, 1985, 200(1): 110-113 DOI:10.1007/BF00383321. |
| [28] | SALUSSO A, RAIMUNDA D. Defining the roles of the cation diffusion facilitators in Fe2+/Zn2+ homeostasis and establishment of their participation in virulence in Pseudomonas aeruginosa[J]. Frontiers in Cellular and Infection Microbiology, 2017, 7: 84. |
| [29] | BENNETT BD, BRUTINEL ED, GRALNICK JA. A ferrous iron exporter mediates iron resistance in Shewanella oneidensis MR-1[J]. Applied and Environmental Microbiology, 2015, 81(22): 7938-7944 DOI:10.1128/AEM.02835-15. |
| [30] | FRAWLEY ER, CROUCH ML V, BINGHAM-RAMOS LK, ROBBINS HF, WANG WL, WRIGHT GD, FANG FC. Iron and citrate export by a major facilitator superfamily pump regulates metabolism and stress resistance in Salmonella Typhimurium[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(29): 12054-12059. |
| [31] | ANDREWS SC. The ferritin-like superfamily: evolution of the biological iron storeman from a rubrerythrin-like ancestor[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2010, 1800(8): 691-705 DOI:10.1016/j.bbagen.2010.05.010. |
| [32] | RUANGKIATTIKUL N, BHUBHANIL S, CHAMSING J, NIAMYIM P, SUKCHAWALIT R, MONGKOLSUK S. Agrobacterium tumefaciens membrane-bound ferritin plays a role in protection against hydrogen peroxide toxicity and is negatively regulated by the iron response regulator[J]. FEMS Microbiology Letters, 2012, 329(1): 87-92 DOI:10.1111/j.1574-6968.2012.02509.x. |
| [33] | SANKARI S, O'BRIAN MR. A bacterial iron exporter for maintenance of iron homeostasis[J]. Journal of Biological Chemistry, 2014, 289(23): 16498-16507 DOI:10.1074/jbc.M114.571562. |
| [34] | PINOCHET-BARROS A, HELMANN JD. Bacillus subtilis fur is a transcriptional activator for the PerR-repressed pfeT gene, encoding an iron efflux pump[J]. Journal of Bacteriology, 2020, 202(8): e00697-e00619. |
| [35] | BESWICK PH, HALL GH, HOOK AJ, LITTLE K, MCBRIEN DC, LOTT KA. Copper toxicity: evidence for the conversion of cupric to cuprous copper in vivo under anaerobic conditions[J]. Chemico-Biological Interactions, 1976, 14(3/4): 347-356. |
| [36] | HODGKINSON V, PETRIS MJ. Copper homeostasis at the host-pathogen interface[J]. Journal of Biological Chemistry, 2012, 287(17): 13549-13555 DOI:10.1074/jbc.R111.316406. |
| [37] | FUNG DKC, LAU WY, CHAN WT, YAN AX. Copper efflux is induced during anaerobic amino acid limitation in Escherichia coli to protect iron-sulfur cluster enzymes and biogenesis[J]. Journal of Bacteriology, 2013, 195(20): 4556-4568 DOI:10.1128/JB.00543-13. |
| [38] | GIACHINO A, WALDRON KJ. Copper tolerance in bacteria requires the activation of multiple accessory pathways[J]. Molecular Microbiology, 2020, 114(3): 377-390 DOI:10.1111/mmi.14522. |
| [39] | MACOMBER L, RENSING C, IMLAY JA. Intracellular copper does not catalyze the formation of oxidative DNA damage in Escherichia coli[J]. Journal of Bacteriology, 2007, 189(5): 1616-1626 DOI:10.1128/JB.01357-06. |
| [40] | KOH EI, ROBINSON AE, BANDARA N, ROGERS BE, HENDERSON JP. Copper import in Escherichia coli by the yersiniabactin metallophore system[J]. Nature Chemical Biology, 2017, 13(9): 1016-1021 DOI:10.1038/nchembio.2441. |
| [41] | GRASS G, THAKALI K, KLEBBA PE, THIEME D, MÜLLER A, WILDNER GF, RENSING C. Linkage between catecholate siderophores and the multicopper oxidase CueO in Escherichia coli[J]. Journal of Bacteriology, 2004, 186(17): 5826-5833 DOI:10.1128/JB.186.17.5826-5833.2004. |
| [42] | TREE JJ, KIDD SP, JENNINGS MP, MCEWAN AG. Copper sensitivity of cueO mutants of Escherichia coli K-12 and the biochemical suppression of this phenotype[J]. Biochemical and Biophysical Research Communications, 2005, 328(4): 1205-1210 DOI:10.1016/j.bbrc.2005.01.084. |
| [43] | SITTHISAK S, KNUTSSON L, WEBB JW, JAYASWAL RK. Molecular characterization of the copper transport system in Staphylococcus aureus[J]. Microbiology, 2007, 153(12): 4274-4283 DOI:10.1099/mic.0.2007/009860-0. |
| [44] | ESPARIZ M, CHECA SK, AUDERO MEP, PONTEL LB, SONCINI FC. Dissecting the Salmonella response to copper[J]. Microbiology, 2007, 153(9): 2989-2997 DOI:10.1099/mic.0.2007/006536-0. |
| [45] | FAN B, ROSEN BP. Biochemical characterization of CopA, the Escherichia coli Cu(Ⅰ)-translocating P-type ATPase[J]. Journal of Biological Chemistry, 2002, 277(49): 46987-46992 DOI:10.1074/jbc.M208490200. |
| [46] | MANA-CAPELLI S, MANDAL AK, ARGÜELLO JM. Archaeoglobus fulgidus CopB is a thermophilic Cu2+-ATPase: functional role of its histidine-rich-N-terminal metal binding domain[J]. Journal of Biological Chemistry, 2003, 278(42): 40534-40541 DOI:10.1074/jbc.M306907200. |
| [47] | FRANKE S, GRASS G, RENSING C, NIES DH. Molecular analysis of the copper-transporting efflux system CusCFBA of Escherichia coli[J]. Journal of Bacteriology, 2003, 185(13): 3804-3812 DOI:10.1128/JB.185.13.3804-3812.2003. |
| [48] |
杜静怡, 王铖, 郭君慧, 谢浩. 细菌RND外排泵的结构与作用机制研究进展[J]. 中国抗生素杂志, 2022, 47(10): 994-1001.
DU JY, WANG C, GUO JH, XIE H. Research progress in the structure and function of RND efflux pump[J]. Chinese Journal of Antibiotics, 2022, 47(10): 994-1001 (in Chinese). |
| [49] | GOLD B, DENG HT, BRYK R, VARGAS D, ELIEZER D, ROBERTS J, JIANG XJ, NATHAN C. Identification of a copper-binding metallothionein in pathogenic mycobacteria[J]. Nature Chemical Biology, 2008, 4(10): 609-616 DOI:10.1038/nchembio.109. |
| [50] | DELMAR JA, SU CC, YU EW. Heavy metal transport by the CusCFBA efflux system[J]. Protein Science: a Publication of the Protein Society, 2015, 24(11): 1720-1736 DOI:10.1002/pro.2764. |
| [51] | KATUMBA GL, TRAN H, HENDERSON JP. The Yersinia high-pathogenicity island encodes a siderophore-dependent copper response system in uropathogenic Escherichia coli[J]. mBio, 2022, 13(1): e0239121 DOI:10.1128/mBio.02391-21. |
| [52] | CORBETT D, SCHULER S, GLENN S, ANDREW PW, CAVET JS, ROBERTS IS. The combined actions of the copper-responsive repressor CsoR and copper-metallochaperone CopZ modulate CopA-mediated copper efflux in the intracellular pathogen Listeria monocytogenes[J]. Molecular Microbiology, 2011, 81(2): 457-472 DOI:10.1111/j.1365-2958.2011.07705.x. |
| [53] | KAUR I, PURVES J, HARWOOD M, KETLEY JM, ANDREW PW, WALDRON KJ, MORRISSEY JA. Role of horizontally transferred copper resistance genes in Staphylococcus aureus and Listeria monocytogenes[J]. Microbiology, 2022, 168(4): 001162. |
| [54] |
李博, 李晶, 沈立新. 细菌锌离子调控体系与感染[J]. 微生物学报, 2016, 56(8): 1211-1221.
LI B, LI J, SHEN LX. Zinc regulation system in bacteria and its relationship with infection-a review[J]. Acta Microbiologica Sinica, 2016, 56(8): 1211-1221 (in Chinese). |
| [55] | EIJKELKAMP BA, MOREY JR, WEEN MP, ONG CL Y, MCEWAN AG, PATON JC, MCDEVITT CA. Extracellular zinc competitively inhibits manganese uptake and compromises oxidative stress management in Streptococcus pneumoniae[J]. PLoS One, 2014, 9(2): e89427 DOI:10.1371/journal.pone.0089427. |
| [56] | STOJILJKOVIC I, PERKINS-BALDING D. Processing of heme and heme-containing proteins by bacteria[J]. DNA and Cell Biology, 2002, 21(4): 281-295 DOI:10.1089/104454902753759708. |
| [57] | ONG CL Y, GILLEN CM, BARNETT TC, WALKER MJ, MCEWAN AG. An antimicrobial role for zinc in innate immune defense against group A Streptococcus[J]. Journal of Infectious Diseases, 2014, 209(10): 1500-1508 DOI:10.1093/infdis/jiu053. |
| [58] | ONG CL Y, WALKER MJ, MCEWAN AG. Zinc disrupts central carbon metabolism and capsule biosynthesis in Streptococcus pyogenes[J]. Scientific Reports, 2015, 5: 10799 DOI:10.1038/srep10799. |
| [59] | LI JH, REN XJ, FAN BQ, HUANG ZY, WANG W, ZHOU HB, LOU ZF, DING HG, LYU JX, TAN GQ. Zinc toxicity and iron-sulfur cluster biogenesis in Escherichia coli[J]. Applied and Environmental Microbiology, 2019, 85(9): e01967-18. |
| [60] | BOTELLA H, PEYRON P, LEVILLAIN F, POINCLOUX R, POQUET Y, BRANDLI I, WANG C, TAILLEUX L, TILLEUL S, CHARRIÈRE GM, WADDELL SJ, FOTI M, LUGO-VILLARINO G, GAO Q, MARIDONNEAU-PARINI I, BUTCHER PD, CASTAGNOLI PR, GICQUEL B, de CHASTELLIER C, NEYROLLES O. Mycobacterial P1-type ATPases mediate resistance to zinc poisoning in human macrophages[J]. Cell Host & Microbe, 2011, 10(3): 248-259. |
| [61] | STOCKS CJ, von PEIN JB, CURSON JEB, RAE J, PHAN MD, FOO D, BOKIL NJ, KAMBE T, PETERS KM, PARTON RG, SCHEMBRI MA, KAPETANOVIC R, SWEET MJ. Frontline science: LPS-inducible SLC30A1 drives human macrophage-mediated zinc toxicity against intracellular Escherichia coli[J]. Journal of Leukocyte Biology, 2021, 109(2): 287-297 DOI:10.1002/JLB.2HI0420-160R. |
| [62] | ANTON A, WELTROWSKI A, HANEY CJ, FRANKE S, GRASS G, RENSING C, NIES DH. Characteristics of zinc transport by two bacterial cation diffusion facilitators from Ralstonia metallidurans CH34 and Escherichia coli[J]. Journal of Bacteriology, 2004, 186(22): 7499-7507 DOI:10.1128/JB.186.22.7499-7507.2004. |
| [63] | LONERGAN ZR, SKAAR EP. Nutrient zinc at the host-pathogen interface[J]. Trends in Biochemical Sciences, 2019, 44(12): 1041-1056 DOI:10.1016/j.tibs.2019.06.010. |
| [64] | RAHMAN M, PATCHING SG, ISMAT F, HENDERSON PJF, HERBERT RB, BALDWIN SA, MCPHERSON MJ. Probing metal ion substrate-binding to the E. coli ZitB exporter in native membranes by solid state NMR[J]. Molecular Membrane Biology, 2008, 25(8): 683-690 DOI:10.1080/09687680802495267. |
| [65] | DUCRET V, GONZALEZ MR, LEONI S, VALENTINI M, PERRON K. The CzcCBA efflux system requires the CadA P-type ATPase for timely expression upon zinc excess in Pseudomonas aeruginosa[J]. Frontiers in Microbiology, 2020, 11: 911 DOI:10.3389/fmicb.2020.00911. |
| [66] | DUCRET V, ABDOU M, GONCALVES MILHO C, LEONI S, MARTIN-PELAUD O, SANDOZ A, SEGOVIA CAMPOS I, TERCIER-WAEBER ML, VALENTINI M, PERRON K. Global analysis of the zinc homeostasis network in Pseudomonas aeruginosa and its gene expression dynamics[J]. Frontiers in Microbiology, 2021, 12: 739988 DOI:10.3389/fmicb.2021.739988. |
| [67] | CHOI SH, LEE KL, SHIN JH, CHO YB, CHA SS, ROE JH. Zinc-dependent regulation of zinc import and export genes by Zur[J]. Nature Communications, 2017, 8: 15812 DOI:10.1038/ncomms15812. |
| [68] | KEHRES DG, MAGUIRE ME. Emerging themes in manganese transport, biochemistry and pathogenesis in bacteria[J]. FEMS Microbiology Reviews, 2003, 27(2/3): 263-290. |
| [69] | PAPP-WALLACE KM, MAGUIRE ME. Manganese transport and the role of manganese in virulence[J]. Annual Review of Microbiology, 2006, 60: 187-209 DOI:10.1146/annurev.micro.60.080805.142149. |
| [70] | IMLAY JA. The mismetallation of enzymes during oxidative stress[J]. Journal of Biological Chemistry, 2014, 289(41): 28121-28128 DOI:10.1074/jbc.R114.588814. |
| [71] | XU JL, ZHENG CK, CAO MM, ZENG T, ZHAO XG, SHI GL, CHEN HC, BEI WC. The manganese efflux system MntE contributes to the virulence of Streptococcus suis serotype 2[J]. Microbial Pathogenesis, 2017, 110: 23-30 DOI:10.1016/j.micpath.2017.06.022. |
| [72] | SACHLA AJ, LUO YC, HELMANN JD. Manganese impairs the QoxABCD terminal oxidase leading to respiration-associated toxicity[J]. Molecular Microbiology, 2021, 116(3): 729-742 DOI:10.1111/mmi.14767. |
| [73] | ROSCH JW, GAO GL, RIDOUT G, WANG YD, TUOMANEN EI. Role of the manganese efflux system mntE for signalling and pathogenesis in Streptococcus pneumoniae[J]. Molecular Microbiology, 2009, 72(1): 12-25 DOI:10.1111/j.1365-2958.2009.06638.x. |
| [74] | LIESER SA, DAVIS TC, HELMANN JD, COHEN SM. DNA-binding and oligomerization studies of the manganese(Ⅱ) metalloregulatory protein MntR from Bacillus subtilis[J]. Biochemistry, 2003, 42(43): 12634-12642 DOI:10.1021/bi0350248. |
| [75] | OHBA H, SATOH K, YANAGISAWA T, NARUMI I. The radiation responsive promoter of the Deinococcus radiodurans pprA gene[J]. Gene, 2005, 363: 133-141 DOI:10.1016/j.gene.2005.07.035. |
| [76] | PITCHER RS, WILSON TE, DOHERTY AJ. New insights into NHEJ repair processes in prokaryotes[J]. Cell Cycle, 2005, 4(5): 675-678 DOI:10.4161/cc.4.5.1676. |
| [77] | MENNECIER S, COSTE G, SERVANT P, BAILONE A, SOMMER S. Mismatch repair ensures fidelity of replication and recombination in the radioresistant organism Deinococcus radiodurans[J]. Molecular Genetics and Genomics, 2004, 272(4): 460-469 DOI:10.1007/s00438-004-1077-6. |
| [78] | NARUMI I, SATOH K, CUI SZ, FUNAYAMA T, KITAYAMA S, WATANABE H. PprA: a novel protein from Deinococcus radiodurans that stimulates DNA ligation[J]. Molecular Microbiology, 2004, 54(1): 278-285 DOI:10.1111/j.1365-2958.2004.04272.x. |
| [79] | MARTIN JE, LE MT, BHATTARAI N, CAPDEVILA DA, SHEN JC, WINKLER ME, GIEDROC DP. A Mn-sensing riboswitch activates expression of a Mn2+/Ca2+ ATPase transporter in Streptococcus[J]. Nucleic Acids Research, 2019, 47(13): 6885-6899 DOI:10.1093/nar/gkz494. |
| [80] | FISHER CR, WYCKOFF EE, PENG ED, PAYNE SM. Identification and characterization of a putative manganese export protein in Vibrio cholerae[J]. Journal of Bacteriology, 2016, 198(20): 2810-2817 DOI:10.1128/JB.00215-16. |
| [81] | WYMAN C, RISTIC D, KANAAR R. Homologous recombination-mediated double-strand break repair[J]. DNA Repair, 2004, 3(8/9): 827-833. |
| [82] | MUHAMMAD S, NAILA A, SARAJ B, MUHAMMAD R, QIAN Y, CHANG X. Variation and succession of microbial communities under the conditions of persistent heavy metal and their survival mechanism[J]. Microbial Pathogenesis, 2021, 150: 104713 DOI:10.1016/j.micpath.2020.104713. |
| [83] | MONY C, VANDENKOORNHUYSE P, BOHANNAN BJM, PEAY K, LEIBOLD MA. A landscape of opportunities for microbial ecology research[J]. Frontiers in Microbiology, 2020, 11: 561427 DOI:10.3389/fmicb.2020.561427. |
| [84] | ZHANEL GG, GOLDEN AR, ZELENITSKY S, WIEBE K, LAWRENCE CK, ADAM HJ, IDOWU T, DOMALAON R, SCHWEIZER F, ZHANEL MA, LAGACÉ-WIENS PRS, WALKTY AJ, NOREDDIN A, KARLOWSKY JA. Cefiderocol: a siderophore cephalosporin with activity against carbapenem-resistant and multidrug-resistant Gram-negative bacilli[J]. Drugs, 2019, 79(3): 271-289 DOI:10.1007/s40265-019-1055-2. |
 2024, Vol. 64
2024, Vol. 64