中国科学院微生物研究所,中国微生物学会
文章信息
- 管付瑶, 陆佳杰, 朱志文, 王配泽, 鄢楚洋, 于平. 2024
- GUAN Fuyao, LU Jiajie, ZHU Zhiwen, WANG Peize, YAN Chuyang, YU Ping.
- 产γ-氨基丁酸基因工程重组大肠杆菌的构建及其发酵特性
- Construction and fermentation characterization of γ-aminobutyrate-producing recombinant strains of Escherichia coli
- 微生物学报, 64(2): 489-501
- Acta Microbiologica Sinica, 64(2): 489-501
-
文章历史
- 收稿日期:2023-06-26
- 网络出版日期:2023-10-16
γ-氨基丁酸(γ-aminobutyrate, GABA)是一种四碳非蛋白氨基酸,它在抑制脑神经传导方面起着重要作用,是人体大脑皮层主要的抑制神经递质。摄入γ-氨基丁酸有助于维持大脑的神经传递稳定性,从而帮助高血压患者降低血压。此外,由于其具有降低血压、减轻焦虑和抑制糖尿病等功能,因此被用作食品添加剂或膳食补充剂[1]。γ-氨基丁酸在大脑皮层神经元间是一种抑制性氨基酸的神经递质[2-4]。在疾病治疗方面,它和5-羟色胺对肝病及由此产生的神经系统损伤有治疗作用[5-9]。γ-氨基丁酸还可促进人的胰岛β细胞上升[10-12],从而降低血糖、减轻糖尿病症状,并为治愈由缺乏胰岛β细胞引发的I型糖尿病提供可能。γ-氨基丁酸还能为多种化工产品的生产提供一种不依赖石油资源、安全环保和节能高效的底物,具有重要的经济价值。如γ-氨基丁酸可以通过简单的化学反应转化为对环境友好的塑料溶剂N-毗咯烷酮和生物可降解材料聚酰胺-4[13]。因此,γ-氨基丁酸的制备已成为当前国内外研究的热点之一。
目前γ-氨基丁酸的制备方法主要有化学合成法、植物富集法和微生物合成法。化学合成法反应条件苛刻,对环境污染大,制备的γ-氨基丁酸不能用于食品领域。植物富集法产量低,无法大规模生产。利用微生物法制备γ-氨基丁酸具有安全和高效的优点,展现出广阔的应用前景。该方法以L-谷氨酸(L-glutamate)作为前体物质,在微生物细胞的内源性谷氨酸脱羧酶(glutamate decarboxylase, GAD)催化下发生特异性的脱羧反应合成γ-氨基丁酸。与植物富集提取法和化学合成法相比,微生物发酵法具有反应条件温和、副产物少和对环境友好等优点。目前,通过微生物发酵法制备γ-氨基丁酸的主要菌株是乳酸菌,主要包括短乳杆菌、植物乳杆菌和乳酸乳球菌等[14-15]。然而来源于野生型的菌株的内源性L-谷氨酸脱羧酶的活力均较低,成为其催化L-谷氨酸高效制备γ-氨基丁酸主要限制因素。近年来,随着基因工程和代谢工程的发展,通过在大肠杆菌、酵母菌和谷氨酸棒状杆菌中过量表达L-谷氨酸脱羧酶基因,实现γ-氨基丁酸的高效制备,已成为其生产的主要方法。
L-谷氨酸脱羧酶在生物界中分布非常广泛,无论是单细胞生物,还是哺乳动物体内都存在[16]。它能催化谷氨酸进行新陈代谢,不同细菌中的L-谷氨酸脱羧酶的性质具有相同点[17],同时也有区别。乳酸乳球菌中的L-谷氨酸脱羧酶,其亚基的相对分子质量为65 kDa,且具有高度的专一性[18]。在18种氨基酸中,L-谷氨酸是唯一的作用底物。当pH值超过6.0时,L-谷氨酸脱羧酶会失去活力。L-谷氨酸脱羧酶包含2个亚基单位GadA和GadB。GadB催化L-谷氨酸脱羧是生物体合成γ-氨基丁酸的重要途径之一。绝大多数生物合成γ-氨基丁酸的研究都基于该途径[19-20]。除了L-谷氨酸外,L-谷氨酸钠(l-monosodium glutamate, l-MSG)也可作为L-谷氨酸脱羧酶GadB的底物。L-谷氨酸和L-谷氨酸钠都没有毒性,经济上L-谷氨酸钠价格更便宜,且L-谷氨酸脱羧酶GadB对Na+具有一定的耐受性,因此不少研究将L-谷氨酸钠作为发酵底物,直接添加以促进γ-氨基丁酸生物合成[21-22]。
磷酸吡哆醛(pyridoxal phosphate, PLP)是L-谷氨酸脱羧酶的辅基[23]。在生物体内,磷酸吡哆醛与脱辅基酶蛋白能够发生解离和聚合作用,从而调节L-谷氨酸脱羧酶的活性。磷酸吡哆醛合酶基因SNO1和SNZ1来源于酿酒酵母,具有催化3-磷酸甘油醛和l-谷氨酰胺转化为磷酸吡哆醛的能力。当2个基因SNO1和SNZ1在大肠杆菌中同时异源表达时,2种蛋白产物能够形成复合物,并能够提高L-谷氨酸脱羧酶的活性,单独表达时不能形成相应的复合物。
在大肠杆菌(E. coli)中[24],gab操纵子是γ-氨基丁酸分解代谢支路的重要组成部分。gab操纵子的结构基因主要包括gabT和gabP,gabT编码的酶GABA-T的同工酶为PuuE (由基因puuE编码)。GABA-T能够催化γ-氨基丁酸生成琥珀酸半醛。gabP编码的γ-氨基丁酸通透酶能够使γ-氨基丁酸进入细胞内,因此gabT、gabP和puuE三个基因在大肠杆菌中的敲除可使γ-氨基丁酸积累。在前期研究中,本实验室已成功构建这3个基因敲除的重组菌株E. coli K12ΔgabTΔgabPΔpuuE[25]。
鉴于此,本研究通过加强L-谷氨酸脱羧酶GadB的过量表达和引入辅酶因子磷酸吡哆醛高效再生的2个关键基因SNO1和SNZ1,实现γ-氨基丁酸的高效生产。为此,首先构建了pTrc99a-gadB和pTrc99a-gadB-SNO1-SNZ1两个重组质粒,然后将它们分别导入基因敲除菌株E. coli K12ΔgabTΔgabPΔpuuE中,并利用不同底物浓度的L-谷氨酸钠对重组菌株进行发酵培养,再通过高效液相色谱法检测γ-氨基丁酸的产量,以期得到重组菌产γ-氨基丁酸的最佳发酵条件。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒Escherichia coli K12 (MG1655)和E. coli DH5α均购自杭州宝赛生物工程有限公司,E. coli K12ΔgabTΔgabPΔpuuE由本实验室自行构建[25],酿酒酵母菌株S288C购自生工生物工程(上海)股份有限公司,质粒pTrc99a购自Novagen有限公司。
1.1.2 培养基和试剂LB液体培养基:0.5%酵母提取物,1.0%蛋白胨和1.0%氯化钠。用1 mol/L的氢氧化钠调节pH至7.0,然后于121 ℃灭菌20 min。
LB固体培养基:1.5%的琼脂粉加入至LB液体培养基中,121 ℃灭菌20 min,灭菌后冷却至合适温度,然后倒入平板中。
氨苄青霉素溶液:称取1.0 g氨苄青霉素,用无菌水配制成10 mL溶液,然后用0.22 μm的滤膜过滤,−20 ℃保存。
发酵培养基:0.5%酵母提取物,1.0%蛋白胨和1.0%氯化钠,适量浓度的L-谷氨酸钠(5、10、20、30、40 g/L)。用1 mol/L的氢氧化钠调节pH至7.0,然后于121 ℃灭菌20 min。
磷酸缓冲液(pH 7.4):称取KH2PO4 0.27 g,Na2HPO4 1.42 g,氯化钠8 g,氯化钾0.2 g,定容到1 L,然后用浓盐酸调节pH值至7.4,灭菌后4 ℃冰箱放置。
异丙基-β-d-硫代半乳糖苷(isopropyl-β-d-galactothioglycoside, IPTG)母液配制:称取1.19 g异丙基-β-d-硫代半乳糖苷,加入至5 mL灭菌的双蒸水中,溶解均匀后,置于−80 ℃的冰箱中保存。
甘氨酸、考马斯亮蓝R-250、L-谷氨酸钠、核酸染料4S Red Plus染色剂(10 000×水溶液)、琼脂糖M、蛋白胨、酵母提取物、氯化钠、琼脂粉和氨苄青霉素均购自生工生物工程(上海)股份有限公司。γ-氨基丁酸标准品购自Sigma公司。
细菌基因组提取试剂盒、细菌感受态制备试剂盒、酵母细胞提取试剂盒、质粒提取试剂盒、PCR产物纯化试剂盒、割胶回收试剂盒、高保真rTaq酶、限制性内切酶Nco I、Kpn I、BamH I和Xba I均购自大连宝生物工程有限公司。
1.1.3 仪器恒温金属浴,上海一恒科技有限公司;高速冷冻离心机,Sigma公司;Mastercycler梯度PCR仪,Eppendorf公司;紫外分光光度计,Mapada公司;生化培养箱,上海一恒科技有限公司;岛津高效液相色谱仪,岛津公司;恒温摇床,上海苏坤实业有限公司;恒温水槽,杭州博日科技有限公司;酶标仪,Tecan公司。
1.2 gadB、SNO1和SNZ1基因的克隆从NCBI上分别找出大肠杆菌K12和酿酒酵母中gadB (GenBank登录号:NC-000913,1 401 bp)、SNO1 (GenBank登录号:NC-001145,675 bp)和SNZ1 (GenBank登录号:NC-001145,3 894 bp)的基因序列,并设计相应的引物来扩增这3个基因序列。设计的引物序列如表 1所示,由生工生物工程(上海)股份有限公司合成。
| Primers | Sequences (5ʹ→3ʹ) | Digestion sites |
| gadB-F | TCGCCCATGGCCATGGATAAGAAGCAAGTAACGG | Nco I |
| gadB-R | CTTCGGTACCTTAGGTATGTTTAAAGCTGTTCT | Kpn I |
| SNO1-F | TCGCGGTACCAAGGAGATATACCATGCAC AAAACCCACAGTACAATGT |
Kpn I |
| SNO1-R | CTTCGGATCCTTAATTAGAAACAAACTGTCTGATA | BamH I |
| SNZ1-F | CTAAGGATCCGAAGGAGATATACCATGA CTGGAGAAGACTTTAAGATCA |
BamH I |
| SNZ1-R | CCTTCTCTAGATTACCACCCAATTTCGGAAAGTCTT | Xba I |
| Underlined letters indicate the restriction endonucleases-digested sites. | ||
PCR扩增目的基因片段gadB、SNO1和SNZ1,反应体系:上下游引物各1 μL,模板1 μL,Primer STAR Premix 25 μL,补水至50 μL。PCR反应程序:95 ℃预变性5 min;95 ℃变性40 s,58 ℃退火1 min,72 ℃延伸1.5 min,共30个循环;72 ℃进一步延伸10 min。取2.0 μL的扩增产物进行琼脂糖凝胶电泳检测。采用大连宝生物工程有限公司的凝胶回收试剂盒进行纯化回收,得到单一条带的目的片段。
1.3 双酶切与连接将纯化后的gadB和pTrc99a质粒分别用限制性内切酶Nco I和Kpn I进行双酶切,温度37 ℃,时间6 h。将酶切好的片段用纯化试剂盒进行纯化回收,回收产物按照片段: 载体=7:1的比例混合,混合后使用T4 DNA连接酶于16 ℃连接12 h。使用细菌感受态制备试剂盒制备大肠杆菌DH5α感受态细胞,并将连接产物转化至大肠杆菌DH5α感受态细胞中。将转化后的细胞涂布于含有氨苄青霉素的抗性平板上,培养得到阳性转化菌落。挑取克隆菌落,采用质粒提取试剂盒提取转化菌株质粒,进行双酶切验证得到重组质粒pTrc99a-gadB。在此基础上,对重组质粒pTrc99a-gadB和SNO1分别用Kpn I和BamH I在37 ℃条件下进行双酶切,然后用T4 DNA连接酶于16 ℃连接12 h后,转化大肠杆菌DH5α,得到重组质粒pTrc99a-gadB-SNO1。提取重组质粒pTrc99a-gadB-SNO1,再按照同样的步骤克隆得到质粒pTrc99a-gadB-SNO1-SNZ1。
1.4 重组质粒的转化与表达将得到的2个重组质粒分别转化至E. coli K12ΔgabTΔgabPΔpuuE中。再将E. coli K12、E. coli K12ΔgabTΔgabPΔpuuE、E. coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB和E. coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB-SNO1-SNZ1分别于37 ℃、180 r/min条件下培养12 h,然后按1.0% (体积比)的接种量转接至装有50 mL/250 mL的LB液体培养基中,37 ℃、180 r/min培养至OD600值为0.6时,向培养基中加入异丙基-β-d-硫代半乳糖苷至终浓度为1 mol/L,然后调温至30 ℃进行诱导培养12 h。取菌液50 mL离心去上清,加入10 mL pH 7.4的磷酸缓冲液重悬菌体沉淀,超声破碎仪破碎菌体。
1.5 四个菌株产γ-氨基丁酸能力的比较将上述4个菌株分别接种于含10 g/L L-谷氨酸钠的发酵培养基中,于30 ℃诱导3 h后,用盐酸调节发酵液的pH至4.2,继续发酵18 h。取1 mL发酵液,采用高效液相色谱法测定生成的γ-氨基丁酸的含量。
1.6 γ-氨基丁酸摇瓶水平发酵优化将重组菌株E. coli K12ΔgabTΔgabPΔpuuE/ pTrc99a-gadB和E. coli K12ΔgabTΔgabPΔpuuE/ pTrc99a-gadB-SNO1-SNZ1分别接种于含5、10、20、30和40 g/L L-谷氨酸钠的发酵培养基中,于30 ℃、180 r/min条件下培养48 h。取1 mL发酵液,采用高效液相色谱法测定生成的γ-氨基丁酸的含量。
1.7 1 L摇瓶体系扩大发酵培养将重组菌株E. coli K12ΔgabTΔgabPΔpuuE/ pTrc99a-gadB接种于含20 g/L L-谷氨酸钠的1 L发酵培养基中,于30 ℃、180 r/min条件下培养,每隔6 h进行取样,采用高效液相色谱法测定生成的γ-氨基丁酸的含量。
1.8 琼脂糖凝胶电泳和SDS-PAGE琼脂糖凝胶电泳和SDS-PAGE参照参考文献[26]的方法。
1.9 发酵液中L-谷氨酸钠和γ-氨基丁酸含量的测定发酵液样品首先进行衍生化处理:将发酵液12 000 r/min离心5 min,然后取100 μL上清液加入到离心管中,分别加入200 μL pH为10.0的1 mol/L的碳酸氢钠缓冲液、100 μL 40 g/L的丹磺酰氯的丙酮溶液以及600 μL双蒸水,制成1 mL反应混合物。将混合物在80 ℃下避光反应40 min,随后加入100 μL 10%乙酸终止反应。将混合物12 000 r/min离心5 min后,将上清液通过0.22 μm Millipore过滤器过滤,然后通过高效液相色谱法检测样品中的L-谷氨酸钠和γ-氨基丁酸含量。高效液相色谱法检测条件如下:洗脱液A为甲醇,洗脱液B为四氢呋喃/甲醇/50 mmol/L乙酸钠(pH为6.2,体积比为5:75:420)。柱温设定为30 ℃,洗脱条件如下:平衡(6 min, 20% A),梯度(20 min, 20%−80% B)和清洗(3 min, 100% A)。流速为1 mL/min,检测波长为254 nm[27]。
1.10 数据处理和统计分析试验结果以平均值±标准偏差表示。数据分析采用SPSS 17.0软件,数据绘图采用Origin 8.5软件。
2 结果与分析 2.1 重组质粒的构建及鉴定重组质粒的构建过程如图 1所示。分别以大肠杆菌K12和酿酒酵母的基因组为模板,采用PCR技术克隆出编码L-谷氨酸脱羧酶的基因gadB和编码磷酸吡哆醛合酶的基因SNO1和SNZ1,将这3个基因分别克隆至质粒pTrc99a中,构建2个重组质粒pTrc99a-gadB和pTrc99a-gadB-SNO1-SNZ1。
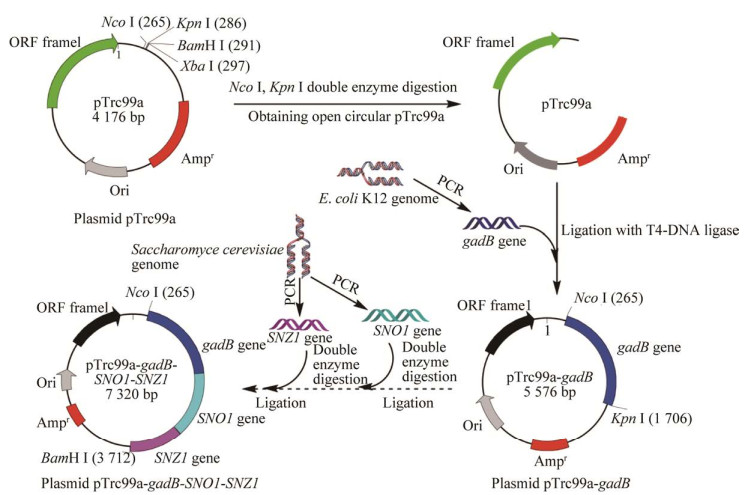
|
| 图 1 重组质粒构建流程图 Figure 1 Flow chart of the recombinant plasmid construction. |
构建的重组质粒pTrc99a-gadB和pTrc99a-gadB-SNO1-SNZ1通过双酶切鉴定,结果如图 2所示。图 2A中泳道1、2和3分别是用限制性内切酶Kpn I酶切质粒pTrc99a、pTrc99a-gadB和pTrc99a-gadB-SNO1-SNZ1的结果,可以看出三者的酶切条带大小分别为4 176、5 576和7 320 bp,与预期大小符合,可以初步判断为阳性质粒。图 2B中泳道1的条带大小约为4 176 bp,是限制性内切酶Kpn I单酶切质粒pTrc99a所得。泳道2获得了大小分别为4 176 bp和1 401 bp的2条带,是用限制性内切酶Nco I和Kpn I双酶切重组质粒pTrc99a-gadB所得。酶切获得的2个条带的大小与线性质粒pTrc99a和gadB基因大小相符,说明载体pTrc99a整合了外源基因片段gadB。泳道3为限制性内切酶BamH I和Xba I双酶切重组质粒pTrc99a-gadB-SNO1-SNZ1的结果,泳道4为限制性内切酶Kpn I和BamH I双酶切重组质粒pTrc99a-gadB-SNO1-SNZ1的结果。泳道3和4的第2条带大小分别为894 bp和675 bp,说明载体pTrc99a整合了外源基因片段SNZ1和SNO1,因此可以确定重组质粒pTrc99a-gadB-SNO1-SNZ1构建成功。
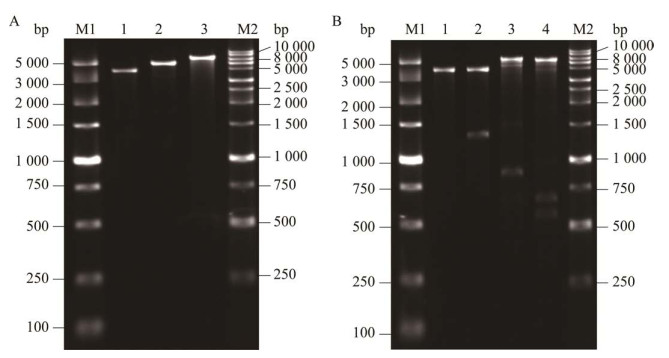
|
| 图 2 重组质粒的单酶切验证(A)和双酶切验证(B) Figure 2 Single (A) and double (B) restriction digestion analysis of recombinant plasmids. A, Lane M1 and M2: Marker; Lane 1: Linearized pTrc99a by Kpn I (4 176 bp); Lane 2: Linearized pTrc99a-gadB by Kpn I (5 576 bp); Lane 3: Linearized pTrc99a-gadB-SNO1-SNZ1 by Kpn I (7 320 bp). B, Lane M1 and M2: Marker; Lane 1: pTrc99a digested by Kpn I (4 176 bp); Lane 2: pTrc99a-gadB digested by Nco I and Kpn I (4 176 bp+ 1 401 bp); Lane 3: pTrc99a-gadB-SNO1-SNZ1 digested by BamH I and Xba I (6 426 bp+894 bp); Lane 4: pTrc99a-gadB-SNO1-SNZ1 digested by BamH I and Kpn I (6 645 bp+675 bp). |
2.2 重组蛋白电泳分析
重组蛋白的聚丙烯酰胺凝胶电泳分析结果如图 3所示。泳道1、2、3和4分别表示E. coliK12、E. coli K12ΔgabTΔgabPΔpuuE、E. coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB和E. coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB-SNO1-SNZ1诱导表达后产生的蛋白条带。L-谷氨酸脱羧酶GadB包含466个氨基酸,分子量为52.6 kDa。磷酸吡哆醛合酶SNO1包含224个氨基酸,分子量为24.9 kDa;磷酸吡哆醛合酶SNZ1包含297个氨基酸,分子量为31.8 kDa。从电泳图可以看出,重组菌株表达的3个蛋白分子量与预期分子量大小一致,说明3个蛋白在重组菌株中均表达成功。
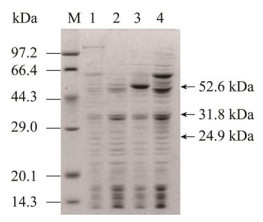
|
| 图 3 重组蛋白的SDS-PAGE电泳图 Figure 3 SDS-PAGE analysis of recombinant proteins. Lane M: Protein molecular weight marker; Lane 1: Culture lysate from E. coli K12; Lane 2: Culture lysate from E. coli K12ΔgabTΔgabPΔpuuE; Lane 3: Culture lysate from E. coli K12ΔgabT ΔgabPΔpuuE/pTrc99a-gadB; Lane 4: Culture lysate from E. coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB-SNO1-SNZ1. |
2.3 L-谷氨酸钠和γ-氨基丁酸标准曲线
底物L-谷氨酸钠的线性回归方程为y= 1 925 820x+93 191,相关系数R2为0.999 1。产物γ-氨基丁酸的线性回归方程为y=4 687 190x+ 386 944,相关系数R2为0.999 3。2个回归方程的线性相关系数均超过0.99,表明线性关系良好,可用作标准曲线。
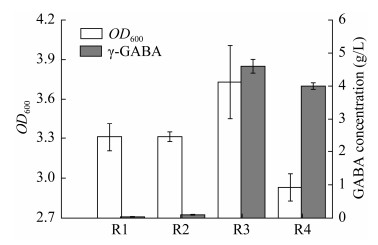
2.4 四个菌株发酵产γ-氨基丁酸能力的比较通过高效液相色谱法检测4个重组菌发酵液中γ-氨基丁酸含量,结果如图 4所示。从图 4可以看出,重组菌E. coli K12ΔgabTΔgabPΔpuuE/ pTrc99a-gadB (R3)发酵液中的γ-氨基丁酸浓度达到4.6 g/L,是4个菌株中产γ-氨基丁酸能力最强的一个菌株。出发菌株E. coli K12 (R1)发酵液中γ-氨基丁酸浓度为0.05 g/L,相对较低。基因敲除菌E. coli K12ΔgabTΔgabPΔpuuE (R2)的发酵液中γ-氨基丁酸的含量为0.21 g/L。相对于原始菌株,提高了4.2倍。该结果表明,基因敲除之后代谢流朝着有利于γ-氨基丁酸的方向生成。在基因敲除菌株的基础上,构建了2个重组菌株E. coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB (R3)和E. coli K12ΔgabTΔgabPΔpuuE/ pTrc99a-gadB-SNO1-SNZ1 (R4)。从图 4可知,重组菌株E. coli K12 ΔgabTΔgabPΔpuuE/pTrc99a-gadB-SNO1-SNZ1的发酵液中γ-氨基丁酸的含量为4.2 g/L (R4),低于重组菌株E. coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB (R3),可能的原因是虽然2个基因SNO1和SNZ1的表达能够提高辅酶因子磷酸吡哆醛的含量,进而提高L-谷氨酸脱羧酶GadB的活性,但却消耗了大量的能量,从而使菌体的代谢负担加重,最终导致γ-氨基丁酸的生产能力下降。
|
| 图 4 四个菌株发酵产γ-氨基丁酸能力的比较 Figure 4 Comparison of the GABA content in fermentation broth of four strains. The error bar represents the standard deviation of three replications. R1: E. coli K12; R2: E. coli K12ΔgabTΔgabPΔpuuE; R3: E. coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB; R4: E. coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB-SNO1-SNZ1. |
2.5 菌株Escherichia coli K12ΔgabTΔgabP ΔpuuE/pTrc99a-gadB的发酵特性
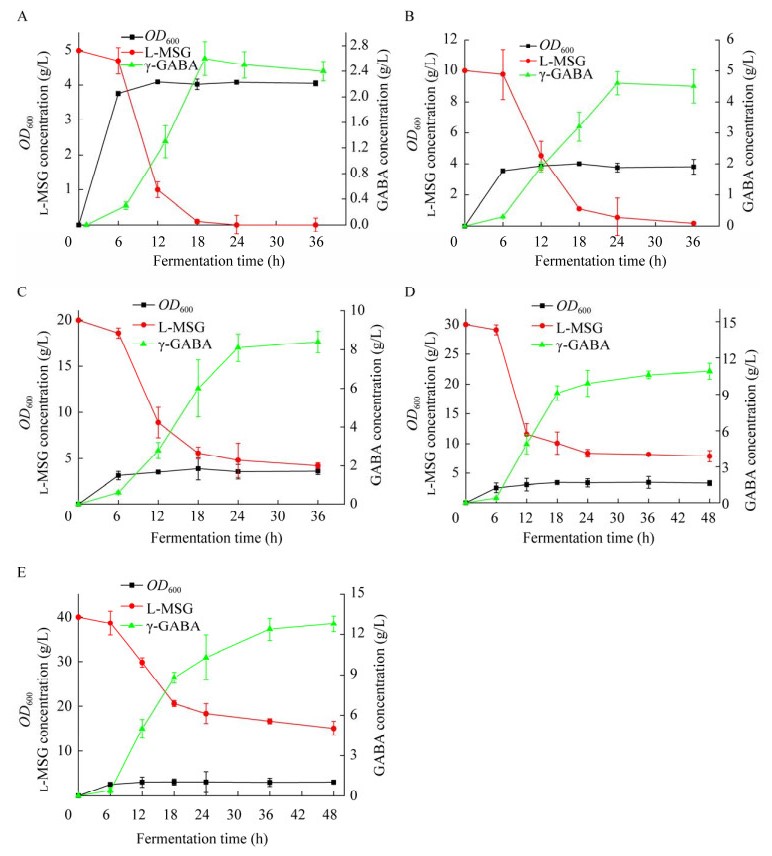
菌株E. coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB在含5 g/L底物L-谷氨酸钠的发酵培养基中的发酵特性如图 5A所示。由图 5可以看出,该菌株的OD600在初始的6 h内达到4.0,这时调整发酵液的pH至4.2,随着培养时间的增加,菌体的光密度值有微量的增长。底物L-谷氨酸钠在18 h内就消耗殆尽,相应的发酵液中γ-氨基丁酸的含量快速积累,也是在18 h达到了峰值,为2.6 g/L,之后略有下降。可能的原因是发酵培养基中菌体所需的营养物质不多,且18 h底物已消耗完全。在γ-氨基丁酸合成之后,后续的菌体可能部分利用了γ-氨基丁酸作为一种能源物质,以供菌体后续的生长。由图 5B可以看出,10 g/L的底物L-谷氨酸钠在24 h时基本耗尽,γ-氨基丁酸含量在6–24 h内有显著的提高,峰值达到了4.6 g/L,之后的12 h内,其含量变化较小。由图 5C可知,OD600在开始之后的12 h已经达到最大值,之后变化平稳。底物L-谷氨酸钠在6–18 h快速消耗,之后保持平稳,最终底物并没有完全被菌体消耗。产物γ-氨基丁酸的浓度在30 h时达到最大值,为8.4 g/L。由图 5D可知,30 g/L的底物L-谷氨酸钠在培养基中并没有消耗完全。在摇瓶发酵过程中,菌体的光密度值OD600也比较低,说明由于底物浓度增大,菌体的代谢受到了一定的影响,进而影响到菌体的光密度值。产物γ-氨基丁酸的最高浓度为10.6 g/L。由图 5E可知,随着底物L-谷氨酸钠浓度的进一步增大,菌体的光密度值OD600进一步减小,且发酵液中还残留较高浓度的L-谷氨酸钠。产物γ-氨基丁酸的产量在36 h达到最大值,之后变化平稳。
|
| 图 5 菌株Escherichia coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB的发酵特性 Figure 5 Fermentation characteristics of the strain Escherichia coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB. The error bar represents the standard deviation of three replications. A: 5 g/L l-MSG. B: 10 g/L l-MSG. C: 20 g/L l-MSG. D: 30 g/L l-MSG. E: 40 g/L l-MSG. |
2.6 菌株Escherichia coli K12ΔgabTΔgabP ΔpuuE/pTrc99a-gadB-SNO1-SNZ1的发酵特性
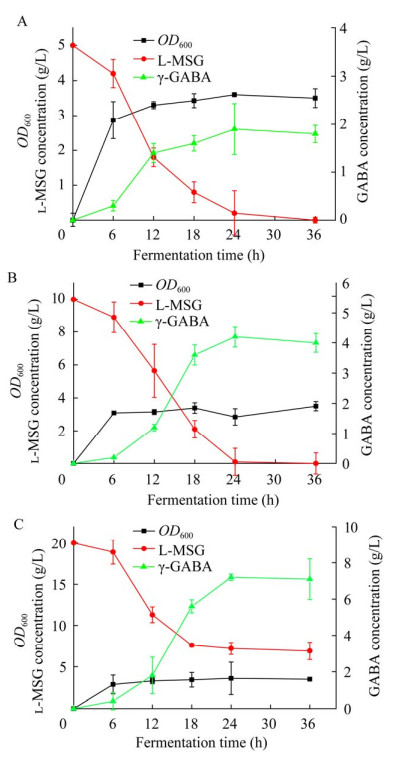
从重组菌株E. coli K12ΔgabTΔgabPΔpuuE/ pTrc99a-gadB-SNO1-SNZ1的蛋白电泳图可以看出,L-谷氨酸脱羧酶基因gadB和磷酸吡哆醛合酶基因SNO1和SNZ1均得到了表达。每隔6 h对该菌株发酵液中的光密度值OD600以及γ-氨基丁酸和L-谷氨酸钠的含量进行测定,结果如图 6所示。由图 6A可知,5 g/L的底物L-谷氨酸钠在发酵24 h就被基本耗尽,菌株的OD600值在发酵24 h达到最高值,此时产物γ-氨基丁酸的浓度达到2.0 g/L。由图 6B可以看出,10 g/L的底物L-谷氨酸钠在发酵24 h后被完全耗尽,此时γ-氨基丁酸的产量达到4.1 g/L。从图 6C可以看出,20 g/L的底物L-谷氨酸钠在发酵前20 h内逐渐被消耗,之后变化较小,而产物γ-氨基丁酸的产量达到了6.8 g/L。
|
| 图 6 菌株Escherichia coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB-SNO1-SNZ1的发酵特性 Figure 6 Fermentation characteristics of the strain Escherichia coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB-SNO1-SNZ1. The error bar represents the standard deviation of three replications. A: 5 g/L l-MSG. B: 10 g/L l-MSG. C: 20 g/L l-MSG. |
2.7 菌株Escherichia coli K12ΔgabTΔgabP ΔpuuE/pTrc99a-gadB在1 L摇瓶体系中的发酵特性
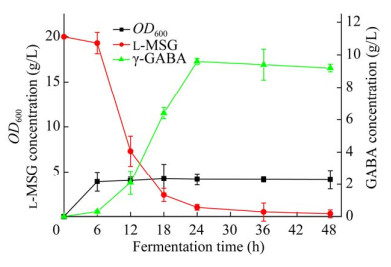
菌株E. coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB在含有20 g/L底物L-谷氨酸钠的1 L发酵培养基(300 mL/1 000 mL)中进行扩大培养,每隔6 h对发酵液的光密度值OD600、L-谷氨酸钠浓度和γ-氨基丁酸的浓度进行测定,结果如图 7所示。从图 7可以看出,菌体的光密度值OD600在初始的6 h增长较快,在第6小时达到最大值3.9。随着培养时间的增加,菌体的光密度值基本保持稳定。底物L-谷氨酸钠的浓度在培养的前24 h迅速下降,在第36小时基本耗尽。发酵液中γ-氨基丁酸的含量在培养的第24小时达到了峰值,为9.4 g/L。之后,随着培养时间的增加,γ-氨基丁酸的含量略有下降。
|
| 图 7 菌株Escherichia coli K12ΔgabTΔgabP ΔpuuE/pTrc99a-gadB的发酵时间曲线 Figure 7 Time-course analysis of the fermentation of the strain Escherichia coli K12ΔgabTΔgabP ΔpuuE/pTrc99a-gadB. The error bar represents the standard deviation of three replications. |
3 讨论与结论
本研究通过构建重组大肠杆菌来提高其合成γ-氨基丁酸的能力。将编码L-谷氨酸脱羧酶的基因gadB和磷酸吡哆醛合酶的基因SNO1和SNZ1引入大肠杆菌,得到重组菌E. coli K12ΔgabTΔgabPΔpuuE/pTrc99a-gadB和E. coli K12ΔgabTΔgabP ΔpuuE/pTrc99a-gadB-SNO1-SNZ1。前者发酵生产γ-氨基丁酸的最高含量为9.4 g/L。与原始菌(0.429 g/L)相比,提高了21.9倍。当SNO1和SNZ1同时引入时,由于能量的过度消耗,重组菌合成γ-氨基丁酸的能力略有下降。
鉴于γ-氨基丁酸具有重要的生理功能,许多研究组也开展了相关研究工作。将来自植物乳杆菌的谷氨酸脱羧酶基因引入清酒乳杆菌后,重组菌合成γ-氨基丁酸的能力提高了1.35倍,产量最高达265.3 mmol/L[28]。将来自水稻的谷氨酸脱羧酶基因引入长双歧杆菌,重组菌在含30 g/L L-谷氨酸钠的培养基中发酵生产了0.1 g/L的γ-氨基丁酸[29]。当大肠杆菌XL1的谷氨酸脱羧酶基因在大肠杆菌XB中表达时,重组菌发酵生产了5.09 g/L的γ-氨基丁酸[30]。当大肠杆菌Xl-1的谷氨酸脱羧酶B和C的基因同时在大肠杆菌XBT中表达时,重组菌发酵生产γ-氨基丁酸的产量为5.46 g/L[31]。将谷氨酸脱羧酶A和C的基因同时引入大肠杆菌,重组菌发酵生产了5.65 g/L的γ-氨基丁酸[32]。与这些研究相比,本研究构建的重组菌在1 L摇瓶中产生了9.4 g/L γ-氨基丁酸。该研究结果为γ-氨基丁酸的产业化生产和应用奠定了良好基础。
| [1] | PHAM VD, SOMASUNDARAM S, PARK SJ, LEE SH, HONG SH. Co-localization of GABA shunt enzymes for the efficient production of gamma-aminobutyric acid via GABA shunt pathway in Escherichia coli[J]. Journal of Microbiology and Biotechnology, 2016, 26(4): 710-716 DOI:10.4014/jmb.1511.11037. |
| [2] | KRNJEVIĆ K, SCHWARTZ S. Is γ-aminobutyric acid an inhibitory transmitter?[J]. Nature, 1966, 211(5056): 1372-1374 DOI:10.1038/2111372a0. |
| [3] | PETROFF OAC. Book review: GABA and glutamate in the human brain[J]. The Neuroscientist, 2002, 8(6): 562-573 DOI:10.1177/1073858402238515. |
| [4] | OTTERSEN OP, STORM-MATHISEN J. Glutamate- and GABA-containing neurons in the mouse and rat brain, as demonstrated with a new immunocytochemical technique[J]. The Journal of Comparative Neurology, 1984, 229(3): 374-392 DOI:10.1002/cne.902290308. |
| [5] |
YAO CZ. Metabolic engineering of Corynebacterium glutamicum for γ-aminobutyric acid production[D]. Wuxi: Doctoral Dissertation of Jiangnan University, 2022 (in Chinese). 姚城镇. 代谢工程改造谷氨酸棒杆菌生产γ-氨基丁酸[D]. 无锡: 江南大学博士学位论文, 2022. |
| [6] | ADEGHATE E, PONERY AS. GABA in the endocrine pancreas: cellular localization and function in normal and diabetic rats[J]. Tissue and Cell, 2002, 34(1): 1-6 DOI:10.1054/tice.2002.0217. |
| [7] | TING WONG CG, BOTTIGLIERI T, SNEAD OC. GABA, γ-hydroxybutyric acid, and neurological disease[J]. Annals of Neurology, 2003, 54(S6): S3-S12 DOI:10.1002/ana.10696. |
| [8] | OKADA T, SUGISHITA T, MURAKAMI T, MURAI H, SAIKUSA T, HORINO T, ONODA A, KAJIMOTO O, TAKAHASHI R, TAKAHASHI T. Effect of the defatted rice germ enriched with GABA for sleeplessness, depression, autonomic disorder by oral administration[J]. Nippon Shokuhin Kagaku Kogaku Kaishi, 2000, 47(8): 596-603 DOI:10.3136/nskkk.47.596. |
| [9] | WANG QP, JAMMOUL F, DUBOC A, GONG J, SIMONUTTI M, DUBUS E, CRAFT CM, YE W, SAHEL JA, PICAUD S. Treatment of epilepsy: the GABA-transaminase inhibitor, vigabatrin, induces neuronal plasticity in the mouse retina[J]. The European Journal of Neuroscience, 2008, 27(8): 2177-2187 DOI:10.1111/j.1460-9568.2008.06175.x. |
| [10] | SASAKI S, YOKOZAWA T, CHO EJ, OOWADA S, KIM M. Protective role of γ-aminobutyric acid against chronic renal failure in rats[J]. Journal of Pharmacy and Pharmacology, 2010, 58(11): 1515-1525 DOI:10.1211/jpp.58.11.0013. |
| [11] | PURWANA I, ZHENG J, LI XM, DEURLOO M, SON DO, ZHANG ZY, LIANG C, SHEN E, TADKASE A, FENG ZP, LI YM, HASILO C, PARASKEVAS S, BORTELL R, GREINER DL, ATKINSON M, PRUD'HOMME GJ, WANG QH. GABA promotes human β-cell proliferation and modulates glucose homeostasis[J]. Diabetes, 2014, 63(12): 4197-4205 DOI:10.2337/db14-0153. |
| [12] | BOONSTRA E, de KLEIJN R, COLZATO LS, ALKEMADE A, FORSTMANN BU, NIEUWENHUIS S. Neurotransmitters as food supplements: the effects of GABA on brain and behavior[J]. Frontiers in Psychology, 2015, 6: 1520. |
| [13] | PARK SJ, KIM EY, NOH W, OH YH, KIM HY, SONG BK, CHO KM, HONG SH, LEE SH, JEGAL J. Synthesis of nylon 4 from gamma-aminobutyrate (GABA) produced by recombinant Escherichia coli[J]. Bioprocess and Biosystems Engineering, 2013, 36(7): 885-892 DOI:10.1007/s00449-012-0821-2. |
| [14] | SIRAGUSA S, de ANGELIS M, di CAGNO R, RIZZELLO CG, CODA R, GOBBETTI M. Synthesis of γ-aminobutyric acid by lactic acid bacteria isolated from a variety of Italian cheeses[J]. Applied and Environmental Microbiology, 2007, 73(22): 7283-7290 DOI:10.1128/AEM.01064-07. |
| [15] | LI HX, QIU T, HUANG GD, CAO YS. Production of gamma-aminobutyric acid by Lactobacillus brevis NCL912 using fed-batch fermentation[J]. Microbial Cell Factories, 2010, 9: 85 DOI:10.1186/1475-2859-9-85. |
| [16] | YOUNGS TL, TUNNICLIFF G. Substrate analogues and divalent cations as inhibitors of glutamate decarboxylase from Escherichia coli[J]. Biochemistry International, 1991, 23(5): 915-922. |
| [17] | UENO Y, HAYAKAWA K, TAKAHASHI S, ODA K. Purification and characterization of glutamate decarboxylase from Lactobacillus brevis IFO 12005[J]. Bioscience, Biotechnology, and Biochemistry, 1997, 61(7): 1168-1171 DOI:10.1271/bbb.61.1168. |
| [18] | STRAUSBAUCH PH, FISCHER EH. Structure of the binding site of pyridoxal 5′-phosphate to Escherichia coli glutamate decarboxylase[J]. Biochemistry, 1970, 9(2): 233-238 DOI:10.1021/bi00804a007. |
| [19] | MARTEL A, BOUTHIER dela TOUR C, le GOFFIC F. Pyridoxal 5′-phosphate binding site of Escherichia coli beta cystathionase and cystathionine gamma synthase comparison of their sequences[J]. Biochemical and Biophysical Research Communications, 1987, 147(2): 565-571 DOI:10.1016/0006-291X(87)90968-5. |
| [20] | ANAI M, FUJIYOSHI T, NAKAYAMA J, TAKAGI Y. Inhibition of the recBC enzyme of Escherichia coli by specific binding of pyridoxal 5′-phosphate to DNA binding site[J]. Journal of Biological Chemistry, 1979, 254(21): 10853-10856 DOI:10.1016/S0021-9258(19)86599-7. |
| [21] | BERTOLDI M, CELLINI B, LAURENTS DV, BORRI VOLTATTORNI C. Folding pathway of the pyridoxal 5′-phosphate C-S lyase MalY from Escherichia coli[J]. The Biochemical Journal, 2005, 389(3): 885-898 DOI:10.1042/BJ20050279. |
| [22] | UPPULURI P, SARMAH B, LAJEAN CHAFFIN W. Candida albicans SNO1 and SNZ1 expressed in stationary-phase planktonic yeast cells and base of biofilm[J]. Microbiology, 2006, 152(7): 2031-2038 DOI:10.1099/mic.0.28745-0. |
| [23] | STREETER JG, THOMPSON JF. Anaerobic accumulation of γ-aminobutyric acid and alanine in radish leaves (Raphanus sativus L.)[J]. Plant Physiology, 1972, 49(4): 572-578 DOI:10.1104/pp.49.4.572. |
| [24] | WALLACE W, SECOR J, SCHRADER LE. Rapid accumulation of γ-aminobutyric acid and alanine in soybean leaves in response to an abrupt transfer to lower temperature, darkness, or mechanical manipulation[J]. Plant Physiology, 1984, 75(1): 170-175 DOI:10.1104/pp.75.1.170. |
| [25] | YU P, REN Q, WANG XX, HUANG XX. Enhanced biosynthesis of γ-aminobutyric acid (GABA) in Escherichia coli by pathway engineering[J]. Biochemical Engineering Journal, 2019, 141: 252-258 DOI:10.1016/j.bej.2018.10.025. |
| [26] | SAMBROOK J, FRITSCH EF, MANIATIS T. Molecular Cloning: a Laboratory Manual[M]. 2nd ed. Cold Spring Harbor, N. Y. : Cold Spring Harbor Laboratory, 1989. |
| [27] |
刘铁兵, 龚金炎, 朱银邦, 李博斌, 赵振, 郭小青, 黄俊. 柱前衍生化法农产品中γ-氨基丁酸的检测方法研究[J]. 中国粮油学报, 2014, 29(10): 118-121.
LIU TB, GONG JY, ZHU YB, LI BB, ZHAO Z, GUO XQ, HUANG J. The determination of aminobutyric acid after pre-column derivatization in farm products[J]. Journal of the Chinese Cereals and Oils Association, 2014, 29(10): 118-121 (in Chinese). |
| [28] | KOOK MC, SEO MJ, CHEIGH CI, LEE SJ, PYUN YR, PARK H. Enhancement of γ-amminobutyric acid production by Lactobacillus sakei B2-16 expressing glutamate decarboxylase from Lactobacillus plantarum ATCC 14917[J]. Journal of the Korean Society for Applied Biological Chemistry, 2010, 53(6): 816-820 DOI:10.3839/jksabc.2010.123. |
| [29] | PARK KB, JI GE, PARK MS, OH SH. Expression of rice glutamate decarboxylase in Bifidobacterium longum enhances γ-aminobutyric acid production[J]. Biotechnology Letters, 2005, 27(21): 1681-1684 DOI:10.1007/s10529-005-2730-9. |
| [30] | PARK KB, OH SH. Enhancement of γ-aminobutyric acid production in Chungkukjang by applying a Bacillus subtilis strain expressing glutamate decarboxylase from Lactobacillus brevis[J]. Biotechnology Letters, 2006, 28(18): 1459-1463 DOI:10.1007/s10529-006-9112-9. |
| [31] | DINH le VO T, KIM TW, HONG SH. Effects of glutamate decarboxylase and gamma-aminobutyric acid (GABA) transporter on the bioconversion of GABA in engineered Escherichia coli[J]. Bioprocess and Biosystems Engineering, 2012, 35(4): 645-650 DOI:10.1007/s00449-011-0634-8. |
| [32] | DINH le VO T, KO JS, PARK SJ, LEE SH, HONG SH. Efficient gamma-aminobutyric acid bioconversion by employing synthetic complex between glutamate decarboxylase and glutamate/GABA antiporter in engineered Escherichia coli[J]. Journal of Industrial Microbiology & Biotechnology, 2013, 40(8): 927-933. |
 2024, Vol. 64
2024, Vol. 64