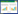中国科学院微生物研究所,中国微生物学会
文章信息
- 王海蓉, 宁年智, 王慧. 2024
- WANG Hairong, NING Nianzhi, WANG Hui.
- 鲍曼不动杆菌VI型分泌系统功能蛋白的研究及应用新进展
- Advances in functional proteins of type VI secretion system of Acinetobacter baumannii
- 微生物学报, 64(2): 391-407
- Acta Microbiologica Sinica, 64(2): 391-407
-
文章历史
- 收稿日期:2023-08-06
- 网络出版日期:2023-10-07
2. 军事科学院军事医学研究院微生物流行病研究所 病原微生物生物安全全国重点实验室, 北京 100071
2. State Key Laboratory of Pathogen and Biosecurity, Institute of Microbiology and Epidemiology, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100071, China
鲍曼不动杆菌(Acinetobacter baumannii, Ab)属于革兰氏阴性菌,是造成院内感染的重要条件致病菌之一,主要感染人体肺部,也会造成伤口、尿路等其他部位的感染,最终引起肺炎、脑膜炎、脓毒症和菌血症等疾病,严重威胁患者的生命。该菌强大的克隆传播能力、获得耐药性及致病性使其成为重症患者的噩梦,攻破这一难题显得迫在眉睫[1-2]。本课题组长期致力于病原体的感染与防治研究,发现Ab的流行与其序列分型(sequence types, STs)相关,Ab临床分离株ST191和ST195可在医院内传播,是医院早期潜在的暴发菌株[3]。对肠出血性大肠杆菌(enterohemorrhagic Escherichia coli, EHEC)利用III型分泌系统(type III secretion system, T3SS)将效应蛋白真核样激酶(eukaryotic-like kinase)转移至肠上皮细胞,增强宿主攻击性炎症反应潜力[4]的探索,进一步加深我们对细菌致病机理的理解,为后续研究防治细菌感染手段提供了新的视角。同时参与更新的SecReT6数据库应用实例表明,鲍曼不动杆菌JS-A5依赖VI型分泌系统(type VI secretion system, T6SS)对大肠杆菌(Escherichia coli) J53进行杀伤[5]。因此对于Ab的感染与防治,本课题组将目光聚焦在T6SS的功能蛋白上,以期找出针对Ab感染的预防和治疗突破口。过去对T6SS的认识普遍停留在细菌关键的毒力因子上[6],伴随着生物信息学、蛋白质组学、基因组学等方法的开发应用,其定义进一步延伸,认为是细菌用来对抗竞争对手的一种可收缩接触性蛋白质传递装置,主要存在于革兰氏阴性菌中[7-8],通过将不同功能的效应蛋白传递到不同类别的靶细胞或胞外环境中,直接影响宿主细胞的功能并帮助自身逃逸宿主免疫,使其长期定殖在宿主中,获得适应性生长优势。因此T6SS在参与细菌间的竞争、增强致病菌毒力、细菌与真核细胞的相互作用及介导各种金属离子转运中发挥关键作用[9-10]。T6SS的各蛋白元件和功能具有多样性,效应-免疫对(effector-immunity pair, E-I)提供T6SS进攻和特异性防御的能力[11],由缬氨酸-甘氨酸-精氨酸G蛋白三聚体(valine-glycine repeat protein G, VgrG)和脯氨酸-丙氨酸-丙氨酸-精氨酸重复序列蛋白(proline-alanine-alanine-arginine, PAAR)组成的穗尖穿刺结构以及溶血素共调节蛋白(hemolysin-coregulated protein, Hcp)内管既可以与其C-末端结构域延伸多态性的毒素翻译融合形成特殊的效应蛋白发挥功能,也可以直接或通过伴侣蛋白/衔接子间接结合货物效应蛋白作为递送载体发挥作用[12]。T6SS具有菌株特异性,通过转运的各种效应蛋白在不同菌株的生态位中起着不同的作用[13],因此研究鲍曼不动杆菌T6SS的分布和主要功能蛋白并不是一个微不足道的问题,反而是最重要的问题之一。目前对Ab中T6SS的结构及组装过程、功能、调控机制等方面的研究总结较多,但针对其应用的概述较少。本文从Ab中T6SS阳性株和基因的分布出发,指出其在Ab耐药进化及致病过程中的相关性,并就主要功能蛋白的特性、转运机制及相关应用案例等方面的研究进展作一综述。本文探究其与细菌的耐药进化、致病性之间的关系;研究主要功能蛋白的特性、转运过程中的特异性和局限性,可以为开发新型抗感染药物或疫苗、筛选合适的靶点抑制剂及生产工程化药物递送工具提供新的思路。
1 鲍曼不动杆菌T6SS的分布 1.1 T6SS阳性株的流行分布在现代医疗系统中,鲍曼不动杆菌无疑是导致医院获得性感染的主要病原体之一。国内某家医院血流感染患者血液标本分离的Ab中,T6SS阳性株广泛存在于耐药菌株中且对抗生素的耐药率远大于T6SS阴性株[14],提示T6SS与Ab耐药性之间的相关性。Lin等[15]通过对2016−2020年中国某教学医院引起血流感染的Ab临床分离样本的回顾性队列研究发现,与T6SS阴性株相比,T6SS阳性株表现出更强的耐药性,再次佐证了这一观点。Dong等[16]通过分析国内77株Ab临床分离株的T6SS发现,多重耐药(multi-drug resistance, MDR)分离株中T6SS阳性株占比为62% (8/13)、广泛耐药(extensively drug-resistant, XDR)分离株占比为90% (36/40)以及抗生素敏感分离株占比为26% (6/23)。XDR-Ab中T6SS阳性株的存在率明显高于MDR-Ab和抗生素敏感株,表明Ab临床分离株耐药表型与T6SS的存在密切相关。Kongthai等[17]直接对泰国4家三级医院的27株XDR-Ab分离株进行耐药基因表征,其中作为T6SS活性标志的Hcp占比更是达到了100%。因此,通过分析国内外不同耐药表型T6SS阳性株的流行分布情况,提示我们Ab耐药性的获得可能是通过T6SS在短时间内获得多种抗生素的耐药基因,进而实现从抗生素敏感分离株到耐药分离株表型的转变。然而在Ab标准菌株ATCC 17978中,耐药质粒与T6SS之间存在负调节关系。耐药质粒的存在会沉默T6SS的功能,质粒的丢失会活化T6SS使其杀死竞争细菌,但是对抗生素的耐药性显著降低[18]。多重耐药质粒通过抑制染色体编码的T6SS,促进MDR-Ab在不动杆菌分离株中的广泛传播[19]。在Ab152中,具有完整T6SS的菌株能有效地击败大肠杆菌,获得大肠杆菌释放的耐药质粒[16]。因此,耐药质粒抑制T6SS活性这一调节机制具有特异性[13],T6SS在耐药质粒传播中发挥不同作用的原因和其耐药机制需要进一步研究阐明。研究T6SS的耐药机制,可以使其成为一种治疗靶点,绕过现有某些抗生素的耐药性。
T6SS阳性株的流行分布情况同样揭示了这一新生基因集群的潜在致病性,在韩国2家三级医院菌血症患者分离的162株Ab中,T6SS阳性株在导管相关血流感染患者、造血干细胞移植受者和免疫抑制剂接受患者中更容易被检测到。功能性T6SS的存在会导致免疫功能低下患者和植入医疗器械患者的Ab感染,但与患者最终死亡结局的发生没有必然联系[13]。在中国某医院血流感染患者分离的182株Ab中,T6SS阳性株表现出更高的血清抗性和毒力,表明T6SS可能增强Ab在宿主体内存活和侵袭的能力。与T6SS阴性株组相比,T6SS阳性株组患者的死亡率较高,提示T6SS的存在可能影响患者的死亡率[15]。从国内某医院上呼吸道感染患者痰液中分离的77株Ab中,T6SS阳性株占比78%,在引起呼吸道感染的Ab中明显占据主导地位[20]。Ab非临床分离株DSM 30011也可以通过T6SS分泌效应蛋白在大蜡螟中定殖,造成宿主感染[21]。这些为研究T6SS的致病机制指明了许多新方向:T6SS影响患者死亡率这一结论的差异是否可以用菌株来源部位的不同、地域的区别等来解释?T6SS通过什么途径在这些患者的感染过程中起作用?患者的感染为什么具有特异性?为什么他们比其他住院患者更容易受到感染?此外,在某些物种中T6SS的存在可以是一个动态过程,细菌可以通过水平基因转移获得T6SS基因从一个状态转变到另一个状态。这种转变可能与组装和激发T6SS基因表达的能量成本、基因突变及可移动遗传元件之间的不相容性等因素相关[22],需要在未来的研究中解释清楚。
1.2 T6SS基因分布在Ab中,存在大量菌株T6SS基因部分或完全缺失[16, 23]且与Ab的ST分型密切相关[13]。出现该现象可能的假设是:在抗生素治疗过程中,细菌间竞争很可能减少,耐药基因库赋予细菌的多重耐药性使得T6SS不那么重要[24];另一种假设是:抗生素治疗时,细菌感受到压力,为逃避宿主固有的免疫反应和细菌竞争,导致T6SS相关基因的丢失[13]。某些特定的细菌可以携带多个T6SS,通常在功能上不是冗余的[25]。目前发现Ab只含有1个T6SS,基因主簇上包含18个与T6SS结构组装有关的基因,排列顺序为AsaA-TssBC-Hcp(TssD)-TssEFG-AsaB-TssM-TagFN-AsaC-TssHAKL-AsaDE。13个结构基因(Tss和Tag)高度保守,不同Ab菌株之间的核苷酸序列相似性高达99%[26] (图 1)。5个Asa基因仅在不动杆菌中发现,编码的周质蛋白可以与TssM (核心结构蛋白)相互作用影响T6SS的组装或稳定性[27]。此外,整个T6SS基因组中尚存在许多待功能表征的基因,如在Ab ATCC 17978 (ACX60_11600)中发现的保守基因可以编码具有肽聚糖水解酶(peptidoglycan hydrolase)活性的TagX蛋白,促进T6SS装置通过细胞壁[28]。VgrG和PAAR基因分散在整个基因组中,通常每个基因组不止1个;其侧翼区域作为效应-免疫基因的进化热岛,存在多种毒素结构域(toxindomain),在不动杆菌属菌株之间的保守性低[29],编码各种效应-免疫对[30],介导细菌水平基因转移,加快Ab的耐药进化和宿主侵袭感染进程[31]。
2 鲍曼不动杆菌T6SS主要功能蛋白
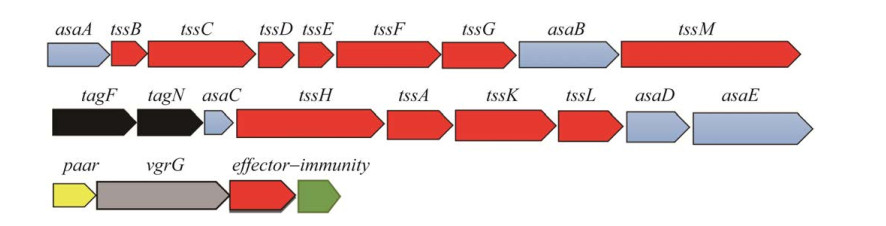
T6SS结构包括几个不同的子组件:跨膜复合物(TssLMJ)、细胞质基板(TssKEFG)、细胞质收缩鞘(TssBC)和驱逐穿刺结构(Hcp-VgrG-PAAR)[32]。Ab缺乏对大肠杆菌T6SS功能至关重要的跨膜蛋白TssJ[33],但并未影响其功能性组装。T6SS的多功能性主要来自多样化效应蛋白的分泌,并通过不同方式与Hcp-VgrG-PAAR相互作用。外鞘收缩时释放的巨大的能量(44 000 kcal/mol)[34],能将Hcp管连同VgrG和PAAR形成的穗尖弹射推进外环境或靶细胞内,效应蛋白随之被送出,实现细胞间易位[35]。效应蛋白与Hcp-VgrG-PAAR的不同结合方式代表着其不同的递送机制,为实现更多效应蛋白的功能表征和实际应用,有必要对这些主要功能蛋白的特性及转运机制展开详细的叙述——各蛋白的特性是什么?T6SS各组件如何识别这些蛋白?如何特异性选择?多种蛋白如何协调转运?
2.1 HcpHcp涉及细菌多个生物过程,包括定殖、生长能力、竞争、生物膜形成和三价铁吸收等[36]。其表达和分泌受温度、pH值和金属离子含量等多种因素影响[37]。在霍乱弧菌(Vibrio cholerae)中,细菌可以通过调控因子VasH感应Hcp在胞内的积累量,实现对T6SS表达和活性的精准调控[38]。在Ab ATCC 17978中可能通过铁离子对Hcp的正调控作用,促进细菌生物膜的形成和与宿主之间的黏附和侵袭作用[39]。在效应蛋白的转运过程中,Hcp互相堆叠形成直径约4 nm的中空管状结构,直接或通过伴侣蛋白/衔接子的间接作用在管内壁结合和稳定效应蛋白[40]。伴侣蛋白或衔接子可以介导特定货物效应蛋白的运输,两者之间存在遗传连锁(genetic linkage),可以将特定的效应蛋白加载到正确的T6SS元件上[41]。编码衔接子的基因和编码同源效应蛋白的基因通常在基因组中相邻,DUF4123[42]、DUF1795[43]、DUF2169[44]作为衔接子中高度保守的结构域均可促进新效应蛋白的发现。此外,PRK06147可能是一种新的衔接子保守结构域,也可以作为识别效应蛋白的有效标记物[45]。利用这4种衔接子保守结构域,Liu等[45]在选取的11 495个代表性原核基因组中先鉴定出5 297个编码衔接子的基因,并在其相邻位置中鉴定出与衔接子有关的1 356个效应基因。对Hcp内环表面关键残基的修饰,可以破坏与管内效应蛋白的相互作用[46]。Hcp作为效应蛋白的输出载体和伴侣[47],利用外鞘收缩时产生的惊人力量分泌到外环境或靶细胞中,并可在培养上清液中检测出。外鞘和Hcp独特的螺旋结构,使其产生每分钟约12万转的高旋转角速度,极大增强了其在受体细胞的细胞膜和细胞壁之间穿透的能力[34]。管内效应蛋白的尺寸受到严格限制,一旦超过Hcp管道大小,便会造成堵塞,使T6SS功能丧失[48]。因此,Hcp空管虽然是T6SS货物效应蛋白交付的策略之一,但具有局限性,不允许大的效应蛋白易位。位于试管内的效应蛋白被认为处于未折叠状态,因为它们在Hcp缺失的情况下表现出不稳定性,表明它们在从Hcp管释放之前不会采用其最终的折叠构象(puckered conformation)[46]。Hcp也可在其C-末端延伸不同的毒素结构域翻译融合形成“进化”的效应蛋白,介导细菌间的拮抗作用。目前尚不清楚这种进化的Hcp效应蛋白是如何分泌的,因为许多效应结构域太大以至于不适合Hcp腔。在Ab中,所有Hcp基因在氨基酸水平上具有100%的相似性,没有与Hcp翻译融合的效应蛋白[49] (图 2)。
2.2 VgrG
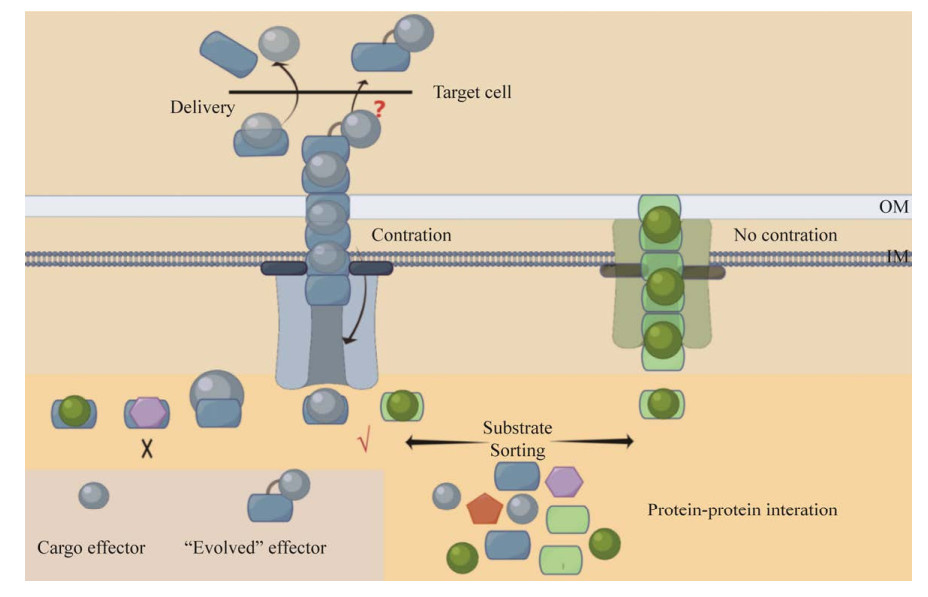
在Ab ATCC 19606中,VgrG基因的整体缺失导致细菌对氨苄西林/舒巴坦的耐药性增加,但对氯霉素的耐药性降低。VgrG突变株在小鼠体内表现出较低的生长速率、真核细胞黏附作用下降以及致死性降低[50]。VgrG穗状三聚体碱基可以作为接头招募第一个Hcp六聚体,引发Hcp内管聚合[43]。通常每个Ab菌株中含2−4个VgrG[49],并不是每个VgrG都会对Hcp的分泌造成影响,各VgrG的C末端区域存在显著的差异[51]。VgrG的C端与T4噬菌体Gp5蛋白高度同源[52],末端介导效应蛋白递送的高度特异性,交换VgrG的C末端序列,能够实现相同或不同物种中VgrG依赖型效应蛋白的传递[53]。在Ab中,VgrG的C末端是组装功能性T6SS的独特结构要求,关键残基上的点突变可以抑制T6SS活性,并且可能是破坏T6SS遗传造成其在菌株中部分或完全缺失另一个可能的机制[54]。VgrG可以通过在C末端延伸毒素结构域[55]进而具有毒素活性,或者通过延伸DUF2345和转甲状腺素(transthyretin, TTR)等伴侣蛋白/衔接子结构域,直接与特定货物效应蛋白相互作用[56]。在Ab ATCC 17978中,所有VgrG都含有C末端DUF2345结构域,稳定VgrG和效应蛋白的相互作用[28]。Ab的VgrG基因座独立于T6SS核心主簇[29],可能代表T6SS效应蛋白分泌的另一种独立形式[57],可以转运大分子效应蛋白,相比于Hcp空管局限性较小。类似于接触依赖性生长抑制(contact-dependent growth inhibition, CDI)系统,该系统仅涉及2个配偶体的组合[58]。CdiA是一种非常大的蛋白质,其C末端携带毒素活性,类似于效应蛋白,由TpsB/Omp85家族的单一转运蛋白CdiB转运;在某些情况下,VgrG可以充当CdiB转运蛋白,独立于T6SS核心组分[57]。在Ab 307-0294中,每个VgrG都是分泌和传递编码在同一基因座内的效应蛋白不可或缺的,具有绝对必要性[51] (图 3A)。
2.3 PAAR
VgrG的C末端延伸被认为是β-螺旋弯曲,在其尖端留下钝端以允许与PAAR结构域相互作用。PAAR在VgrG尖峰上形成一个锥形结构,具有锐化VgrG穗尖的功能[60]。PAAR也可以作为VgrG与效应蛋白之间的衔接子,是将效应蛋白与VgrG连接起来的蛋白质-蛋白质相互作用(protein-protein interaction, PPI)模块,携带PAAR结构域的效应蛋白可以直接结合VgrG完成递送[59]。PAAR限制传递效应蛋白的类型,募集特定的效应蛋白进行递送[39]。Rhs蛋白(rearrangement hotspot, Rhs)是T6SS中一类独特的效应蛋白家族,具有多态性的C末端毒素结构域并可在其N端连接PAAR基序[59],抑制或杀死相邻的细胞,大大多样化了T6SS的抗菌途径(图 3B)。贝氏不动杆菌(Acinetobacter baylyi)中所有PAAR基因的缺失消除了其T6SS功能,而霍乱弧菌中PAAR基因的缺失只是减少Hcp分泌和削弱杀伤能力[60]。PAAR对于某些细菌的T6SS功能是必需的,而对于其他细菌则是可有可无这个问题,Liang等[61]给出的解释是:T6SS通常包括多个PAAR,并非每个PAAR都与T6SS相关功能有关,PAAR的可变作用与共同决定T6SS组装的VgrG穗相关。既然T6SS的组装和活性发挥不需要多个PAAR,那么为什么基因座中会存在多个PAAR,这些PAAR在T6SS基因座中是否冗余需要进一步解释清楚。在Ab中,PAAR延伸的C末端区未发现任何毒素保守域,其扩展C末端区的目的和多样性仍有待阐明[49] (图 3B)。
2.4 E-I对T6SS对竞争细胞的攻击主要由效应蛋白驱动[62],效应蛋白的目标靶点是胞质和周质中保守的细胞结构和代谢物,包括细胞膜、细胞壁、核酸和核苷酸[63]。利用T6SS相关基因的遗传分析、生物信息学分析、蛋白质组学分析和突变体文库筛选等多种方法,目前在Ab的VgrG基因座下游区域已表征出一系列肽聚糖水解酶(peptidoglycan hydrolase)、脂肪酶(lipase)、核酸酶(nuclease)和核酸脱氨酶(nucleic acid deaminase)并进行功能验证(表 1)。Lewis等[49]使用蛋白质家族分选服务工具ATRIC跨属家族(PATRIC cross-genus families, PGfam)[67]系统地鉴定含有VgrG、Hcp或PAAR保守结构域的Ab菌株,然后在美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI)中搜索代表假定效应蛋白的保守功能结构域序列,使用BLAST比对保守功能域的同源性。在已鉴定的VgrG基因座下游区域,鉴定出240多个推定的效应蛋白,系统发育分析(phylogenetic analysis)表明,这些推定的效应蛋白被分成来自不同祖先的32个组,15个效应组具有表征活性的结构域,包括脂肪酶、酰胺酶(amidase)、几丁质酶(chitinase)、肽聚糖水解酶、核酸酶和核酸脱氨酶,8个效应组具有保守Rhs结构域,3个组含有DUF4123结构域;进一步研究发现,Ab ATCC 17978中鉴定出的VI型酰胺酶效应蛋白(type VI amidase effector, Tae)同时具有裂解性转糖基酶(lytic transglycosylase)和内肽酶(endopeptidase)活性,能够靶向各种细菌的细胞壁[49]。d-赖氨酸(d-lysine)的分泌可以导致胞外pH值增加,增强Tae的活性,杀灭与其竞争的革兰氏阳性细菌[66]。在Ab ATCC 17978中VI型核酸酶效应蛋白(type VI DNase and RNase effector, Tde)的敲除使Ab的抗真菌活性丧失,因此Tde同时具有核酸酶和抗真菌活性[64]。在根癌农杆菌(Agrobacterium tumefaciens) C58中,Tde负载到VgrG穗尖是分泌活性T6SS所必需的,TssBC收缩鞘的组装只有在Tde存在的情况下才会发生[68]。在贝氏不动杆菌ADP1中,T6SS的组装不需要任何效应蛋白参与,5种效应蛋白对猎物细菌的杀伤和裂解作用各不相同。从猎物到捕食者的基因转移依赖于裂解效应蛋白的传递,这可能与Ab中抗生素耐药性的传播相关[69]。细菌为了防止自我中毒,免疫蛋白通常在效应蛋白基因的下游编码,通过直接封闭效应蛋白活性部位起作用[70]。E-I对主要是防止亲缘细胞的杀伤,但是如果两者的免疫蛋白在序列和结构上极端相似,也有可能免受攻击者效应蛋白的攻击[71]。有研究表明,免疫蛋白也可以通过一种独立于E-I对之间PPI的免疫酶机制(immunoenzyme mechanism)为机体防御[72]。Lopez等[65]通过结构建模、表型实验和生化分析研究Ab ATCC 17978中功能未知的抗菌效应蛋白Tse3的同源免疫蛋白Tsi3发现,尽管Tsi同源物具有特征性的甲酰甘氨酸生成酶(formylglycine generating enzyme, FGE)结构域,但不太可能是功能性酶,不提供针对非亲缘Tse的免疫。免疫蛋白Tli在阴沟肠杆菌(Escherichia cloacae)中起到中和及激活同源VI型脂肪酶效应蛋白(type VI lipase effector, Tie)的作用,拓宽了对T6SS免疫蛋白只能作为单功能的效应蛋白中和解毒剂的理解[73]。目前免疫蛋白的分类和角色塑造的研究落后于对T6SS效应蛋白的研究,有必要额外地表征T6SS免疫蛋白家族,以更好地了解T6SS。
| Effector | Immunity | Type | Bacteria | Location | Function | References |
| LysM | LyMI | Tae/Tge | Ab 307-0294 | VgrG loci | LysM, is a predicted peptidoglycan hydrolase, within the cytoplasm of E. coli cells did not result in any cell toxicity but toxic in periplasm | [51] |
| Rhs1 | Rhs1I | Tde | Ab 307-0294 | VgrG loci | Rhs1 shares amino acid identity with several previously characterized T6SS Rhs family nuclease effectors | [51] |
| Rhs2 | Rhs2I | Tde | Ab 307-0294 | VgrG loci | Rhs2 contains an AHH (alanine-histidine-histidine) motif in the C-terminal region, which is characteristic of AHH hyperenzymes | [51] |
| Tse1 | Tli | Tle | Ab ATCC 17978 | VgrG downstream | Tse1 can catalyze hydrolysis of nucleic acid (most catalyze hydrolysis of deoxyribonucleic acid, and part hydrolyse RNA) | [28] |
| Tse2 | Tdi | Tde | Ab ATCC 17978 | VgrG downstream | Tse2 contains a nuclease domain and can kill fungi | [28, 64] |
| Tse3 | Tsi3 | Tse | Ab ATCC 17978 | VgrG downstream | Tse3 plays an important role in bacterial killing | [28, 65] |
| Tse4 | Tsi4 | Tae/Tge | Ab ATCC 17978 | VgrG downstream | Tse4 contains a LysM PG binding motif and an M23 peptidase family domain, indicating that it probably targets the PG; Tse4 exhibits both lytic transglycosylase and endopeptidase activity in vitro | [25, 66] |
3 应用策略 3.1 疫苗候选者
Ab几乎对所有的抗生素都产生了耐药性,比如碳青霉烯类、头孢菌素、替加环素等,现在又出现了黏菌素,多重、极端和泛耐药Ab的进化是全球正处于后抗生素治疗时代风口浪尖上的明显先兆。目前已研究了各种抗生素的组合方案,但几乎没有成功的治疗方案以供选择。所有这些失败的努力导致研究人员开发和实施疫苗接种来预防这种病原体引起的感染[74]。虽然未有Ab疫苗在临床实践中应用,但是大量研究表明这是一种很有前途的防治方法。目前Ab疫苗的种类主要包括全细胞疫苗、亚单位疫苗、DNA疫苗、外膜蛋白疫苗等。全细胞疫苗包括减毒活疫苗和灭活疫苗,通过诱导免疫系统引发广泛的免疫反应,因其制备方式安全性有待探索[75];DNA疫苗在宿主内利用重组质粒表达目的蛋白诱发特异性免疫应答,但存在一定安全风险[76];外膜蛋白疫苗包括外膜复合物和外膜囊泡疫苗,外膜蛋白疫苗的制备是棘手的,因为难以明确和标准化多种组分的水平,安全性也较低[77];而亚单位疫苗是一种含有病原体活性片段以刺激保护性免疫应答的疫苗,通过在病原体中筛选出能够诱发免疫反应的保护性免疫原组分后重组表达,因此也叫组分疫苗[78]。与常规弱毒疫苗、灭活疫苗相比,亚单位疫苗由于仅包含抗原的部分——蛋白质、多糖或者多肽,因而无法侵入宿主内繁殖,致病风险极低。同时具有高纯度、安全性、稳定性、易于生产和高度靶向诱导免疫应答等突出优点[79]。疫苗的研制侧重于对病原体致病机理的研究,以筛选合适的靶点部位阻碍细菌对宿主的侵袭感染。Ab亚单位疫苗候选者一般是蛋白质,T6SS已被证明与Ab的致病性和耐药性密切相关,核心蛋白VgrG由798个氨基酸组成,是Ab致病力的有效介体。其免疫原性选择区域在不同Ab中高度保守(同一性≥97.63%)[80],因此成为合适的亚单位疫苗候选者。Pazoki等[80]从VgrG的C-末端选择了2个保守的免疫原性区域VgrG 1263-2295和VgrG 1263-1608,其中VgrG 1263-1608序列植入脑膜炎奈瑟菌(Neisseria meningitidis)的无环C叶(loopless C lobe, LCL),使其更好地暴露于功能性表位。将蛋白表达纯化后,进行小鼠Ab感染和免疫实验,结果显示,用LCL-VgrG免疫的小鼠产生特异性抗体(immunoglobulin G, IgG)。在用致死剂量Ab攻击后,主动免疫组和被动免疫组小鼠的存活率分别为33.3%和66.6%。因此,VgrG的保守区域可能是有效开发疫苗的安全免疫原,可以针对利用T6SS进行宿主感染的革兰氏阴性病原体引起免疫反应;VgrG的保守区域还可以作为抗体使用来控制Ab感染,但无法对于致死剂量细菌的攻击提供完全的保护作用;Alipouri等[81]在小鼠模型中进一步评估重组VgrG的免疫保护效果,全细胞酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)、主动免疫和被动免疫的动物存活率、小鼠组织中的细菌负荷量等结果表明,用重组VgrG免疫的小鼠具有更高的血清IgG水平,肺和脾中的细菌负荷量较低,3 d存活率为75%。VgrG是一种保护抗原,虽然不足以作为一种单独的抗原来提供全面的保护,但是它可以参与多价疫苗的发展来提高疗效。因此,相比于菌毛组装蛋白FilF、四肽重复序列蛋白PcTPRs1、毒力因子结构蛋白CsuA/B[82]等疫苗候选者,VgrG产生的被动免疫效果可能提供即时的保护性免疫,对一些特殊的目标人群更具有价值。例如已经受到免疫抑制,无法接受疫苗接种的重症监护病房(intensive care unit, ICU)人群;在创伤、严重烧伤或紧急手术中具有感染风险的患者以及具有潜在疾病的老年人等[83]。Hcp作为T6SS活性标志,已被证明是空肠弯曲杆菌(Campylobacter jejuni)关键的双功能蛋白,以该致病组分为靶点制备相应疫苗可以阻断细菌附着和清除多种高致病性空肠弯曲杆菌来降低对宿主的致病性,进而达到预防和治疗的目的。Gorain等[84]利用小鼠模型推断空肠弯曲杆菌的Hcp作为人类潜在候选疫苗物的益处,实验证明其可在肠道中诱导高水平抗原特异性中和抗体的产生并可能有效减少小鼠盲肠中细菌负荷量。然而,目前还未有明确研究能证明Hcp在Ab中的关键致病力,并且PAAR在Ab中的生物学功能还需要进一步明确。此外E-I对在Ab中具有极端多样性,通常参与抗菌药物或靶点抑制剂的研发。因而Hcp、PAAR以及E-I这些功能蛋白暂未被纳入Ab疫苗候选物清单中。
3.2 靶向递送系统使用细菌蛋白质分泌系统作为穿梭物以靶向方式递送蛋白质一直是药物递送领域研究的热点。Wettstadt等[85]提出将T6SS工程化为递送系统以将目标物穿梭到细菌病原体或肿瘤细胞中实现递送的想法。利用VgrG可以特异性募集并驱动其同源效应蛋白进入靶细胞这一较为明确的传递机制[53],将各种效应结构域融合到一个典型VgrG的C末端,虽然在递送效果上可能差异较大,但均可在细菌培养物上清液检测出。进一步强调了T6SS纳米武器装载目标蛋白的灵活性,通过改进参数以优化目标乘客蛋白的递送将是极具吸引力的医学和工业应用策略。Ting等[86]开发程序性抑制细胞(programmed inhibitor cells, PICs)通过表面纳米抗体特异性识别靶细胞,使T6SS具有特异性靶向功能,以最小的脱靶效应耗尽复杂群落中的靶细胞。Hersch等[87]利用霍乱弧菌的VgrG1 (含有肌动蛋白交联结构域)、VgrG3 (含有溶菌酶结构域)、PAAR2[42, 88-90]与Cre重组酶融合,成功将活性Cre递送到受体细胞中,并重点研究PAAR2传递外源T6SS效应蛋白的能力,进一步表明T6SS作为递送系统的多功能性。Kreitz等[91]将细菌来源的胞外可收缩注射系统(extracellular contractile injection systems, eCISs)通过人工智能AlphaFold手段进行系统性的研究和改造后,成功将多种功能性蛋白如核酸内切酶Cas9、碱基编辑器及毒素蛋白向人源细胞及动物体内特异性递送。近年来在阿米巴寄生菌(Amoebophilus)中发现的T6SSiv在基因构成和分子进化等方面均呈现出与eCIS系统的显著相似性[92],那么T6SS是否也可以利用编程手段将一系列有用的蛋白质输送进不同类型的细胞之中,有待进一步研究。目前Ab相关功能蛋白作为工业化递送工具的研究还较为空白。
4 展望首先,T6SS阳性株的流行分布显示,T6SS在Ab中发挥的功能具有菌株特异性,需要进一步研究其流行差异背后的原因,以更好地了解T6SS的耐药和致病机制。其次,T6SS基因分布差异与Ab序列分型密切相关,不同分型的Ab中T6SS基因存在或缺失的原因需要进一步证实。Ab中T6SS基因是否存在动态转移以及这种转移是否可能是Ab进行种内竞争的关键,是造成不同分型的Ab克隆株流行暴发的原因之一,需要展开更进一步的研究。
当然,不考虑效应蛋白,直接推测T6SS的功能几乎是不可能的,因为T6SS是通过分泌多样化的效应蛋白在靶细胞中发挥作用。效应蛋白在序列和功能上具有多样性,系统地预测它们曾经是该领域的一个主要挑战,但是目前已经开发了多种方法来克服这个早期的挑战。Ab中的效应蛋白仅部分被详细表征,在该领域的研究仍然为效应蛋白的发现及功能表征留下了很大的空间。目前仍存在大量推定的效应蛋白活性未知,生物信息学数据库是目前研究T6SS使用较多的工具,并且利用机器学习等方法进行相关数据库的进一步开发更新也将是学者们的重点研究方向。通过数据库进行资源整合,有助于研究者识别T6SS核心结构蛋白周围假定的效应蛋白,促进更多效应蛋白的发现和功能表征,以期在未来对这些效应蛋白详细的角色塑造可以鉴定出具有新型抗菌特性的蛋白质,为新型细菌抗生素和治疗剂的开发提供有用的信息。免疫蛋白因为没有显示功能的结构域,一直被认为是效应蛋白的中和剂,但是最近的研究表明其角色也有多样性。未来可以对这一领域展开详细的研究,以期作为新的靶点,使Ab进行自我攻击。
效应蛋白递送的动力学一直是一个悬而未决的问题,虽然大量研究表明Hcp、VgrG、PAAR在递送中发挥关键作用,但是关于它们的转移是否需要通过宿主环境或质粒等方式调节、转移的能量成本以及如何触发分泌的信号等知之甚少。对于T6SS的实际应用,VgrG已被证明是主动和被动免疫合适的亚单位疫苗抗原候选者,但此类疫苗在活体内容易降解且免疫原性较弱,后续选取合适的佐剂或运载工具制备Ab亚单位疫苗以减缓降解并改善免疫原性将是促进该类疫苗早日进入临床的重要手段。此外,对Hcp、VgrG、PAAR周围的组织也需要有更好的分子理解,以便将其作为有用的递送载体,进一步工程化实现药物的有效递送。
| [1] | BALKHAIR A, SAADI KA, ADAWI BA. Epidemiology and mortality outcome of carbapenem- and colistin-resistant Klebsiella pneumoniae, Escherichia coli, Acinetobacter baumannii, and Pseudomonas aeruginosa bloodstream infections[J]. IJID Regions, 2023, 7: 1-5 DOI:10.1016/j.ijregi.2023.01.002. |
| [2] | LEE CR, LEE JH, PARK M, PARK KS, BAE IK, KIM YB, CHA CJ, JEONG BC, LEE SH. Biology of Acinetobacter baumannii: pathogenesis, antibiotic resistance mechanisms, and prospective treatment options[J]. Frontiers in Cellular and Infection Microbiology, 2017, 7: 55. |
| [3] | NING NZ, LIU X, BAO CM, CHEN SM, CUI EB, ZHANG JL, HUANG J, CHEN FH, LI T, QU F, WANG H. Molecular epidemiology of blaOXA-23-producing carbapenem-resistant Acinetobacter baumannii in a single institution over a 65-month period in North China[J]. BMC Infectious Diseases, 2017, 17(1): 1-8 DOI:10.1186/s12879-016-2122-x. |
| [4] | LI T, LI Z, CHEN FH, LIU X, NING NZ, HUANG J, WANG H. Eukaryotic-like kinase expression in enterohemorrhagic Escherichia coli: potential for enhancing host aggressive inflammatory response[J]. The Journal of Infectious Diseases, 2017, 216(9): 1150-1158 DOI:10.1093/infdis/jix160. |
| [5] | ZHANG JF, GUAN JH, WANG M, LI G, DJORDJEVIC M, TAI C, WANG H, DENG ZX, CHEN ZY, OU HY. SecReT6 update: a comprehensive resource of bacterial type VI secretion systems[J]. Science China Life Sciences, 2023, 66(3): 626-634 DOI:10.1007/s11427-022-2172-x. |
| [6] | HACHANI A, WOOD TE, FILLOUX A. Type VI secretion and anti-host effectors[J]. Current Opinion in Microbiology, 2016, 29: 81-93 DOI:10.1016/j.mib.2015.11.006. |
| [7] | MEIR A, MACÉ K, VEGUNTA Y, WILLIAMS SM, WAKSMAN G. Substrate recruitment mechanism by Gram-negative type III, IV, and VI bacterial injectisomes[J]. Trends in Microbiology, 2023, 31(9): 916-932 DOI:10.1016/j.tim.2023.03.005. |
| [8] | WANG J, BRODMANN M, BASLER M. Assembly and subcellular localization of bacterial type VI secretion systems[J]. Annual Review of Microbiology, 2019, 73: 621-638 DOI:10.1146/annurev-micro-020518-115420. |
| [9] | JURĖNAS D, JOURNET L. Activity, delivery, and diversity of type VI secretion effectors[J]. Molecular Microbiology, 2021, 115(3): 383-394 DOI:10.1111/mmi.14648. |
| [10] | SINGH RP, KUMARI K. Bacterial type VI secretion system (T6SS): an evolved molecular weapon with diverse functionality[J]. Biotechnology Letters, 2023, 45(3): 309-331 DOI:10.1007/s10529-023-03354-2. |
| [11] | YANG XB, LONG MX, SHEN XH. Effector-immunity pairs provide the T6SS nanomachine its offensive and defensive capabilities[J]. Molecules, 2018, 23(5): 1009 DOI:10.3390/molecules23051009. |
| [12] | CHERRAK Y, FLAUGNATTI N, DURAND E, JOURNET L, CASCALES E. Structure and activity of the type VI secretion system[M]//MARIA S, ERIC C, PETER JC. Protein Secretion in Bacteria. New York: John Wiley & Sons, Ltd, 2019: 329-342. |
| [13] | KIM J, LEE JY, LEE H, CHOI JY, KIM DH, WI YM, PECK KR, KO KS. Microbiological features and clinical impact of the type VI secretion system (T6SS) in Acinetobacter baumannii isolates causing bacteremia[J]. Virulence, 2017, 8(7): 1378-1389 DOI:10.1080/21505594.2017.1323164. |
| [14] |
喻凯航, 陈栎江, 方人驰, 毕文姿, 张秀彩, 张艺之, 周铁丽, 曹建明. Ⅵ型分泌系统在鲍曼不动杆菌致病及耐药性中的作用[J]. 中华传染病杂志, 2020, 38(4): 231-236.
YU KH, CHEN LJ, FANG RC, BI WZ, ZHANG XC, ZHANG YZ, ZHOU TL, CAO JM. The role of type VI secretory system in the pathogenesis and drug resistance of Acinetobacter baumannii[J]. Chinese Journal of Infectious Diseases, 2020, 38(4): 231-236 (in Chinese). |
| [15] | LIN YS, ZHAO DY, HUANG N, LIU SX, ZHENG JY, CAO JM, ZENG WL, ZHENG XK, WANG LB, ZHOU TL, SUN Y. Clinical impact of the type VI secretion system on clinical characteristics, virulence and prognosis of Acinetobacter baumannii during bloodstream infection[J]. Microbial Pathogenesis, 2023, 182: 106252 DOI:10.1016/j.micpath.2023.106252. |
| [16] | DONG JF, LIU CW, WANG P, LI L, ZOU QH. The type VI secretion system in Acinetobacter baumannii clinical isolates and its roles in antimicrobial resistance acquisition[J]. Microbial Pathogenesis, 2022, 169: 105668 DOI:10.1016/j.micpath.2022.105668. |
| [17] | KONGTHAI P, THUMMEEPAK R, LEUNGTONGKAM U, POOARLAI R, KITTI T, THANWISAI A, CHANTRATITA N, MILLARD AD, SITTHISAK S. Insight into molecular epidemiology, antimicrobial resistance, and virulence genes of extensively drug-resistant Acinetobacter baumannii in Thailand[J]. Microbial Drug Resistance, 2021, 27(3): 350-359 DOI:10.1089/mdr.2020.0064. |
| [18] | WEBER BS, LY PM, IRWIN JN, PUKATZKI S, FELDMAN MF. A multidrug resistance plasmid contains the molecular switch for type VI secretion in Acinetobacter baumannii[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(30): 9442-9447. |
| [19] | di VENANZIO G, MOON KH, WEBER BS, LOPEZ J, LY PM, POTTER RF, DANTAS G, FELDMAN MF. Multidrug-resistant plasmids repress chromosomally encoded T6SS to enable their dissemination[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(4): 1378-1383. |
| [20] | HU YY, LIU CX, LIU P, WU ZY, ZHANG YD, XIONG XS, LI XY. Regulation of gene expression of hcp, a core gene of the type VI secretion system in Acinetobacter baumannii causing respiratory tract infection[J]. Journal of Medical Microbiology, 2018, 67(7): 945-951 DOI:10.1099/jmm.0.000753. |
| [21] | REPIZO GD, GAGNÉ S, FOUCAULT-GRUNENWALD ML, BORGES V, CHARPENTIER X, LIMANSKY AS, GOMES JP, VIALE AM, SALCEDO SP. Differential role of the T6SS in Acinetobacter baumannii virulence[J]. PLoS One, 2015, 10(9): e0138265 DOI:10.1371/journal.pone.0138265. |
| [22] | UNNI R, PINTOR KL, DIEPOLD A, UNTERWEGER D. Presence and absence of type VI secretion systems in bacteria[J]. Microbiology, 2022, 168(4): 001151. |
| [23] | MEUMANN EM, ANSTEY NM, CURRIE BJ, PIERA KA, KENYON JJ, HALL RM, DAVIS JS, SAROVICH DS. Genomic epidemiology of severe community-onset Acinetobacter baumannii infection[J]. Microbial Genomics, 2019, 5(3): e000258. |
| [24] | WRIGHT MS, HAFT DH, HARKINS DM, PEREZ F, HUJER KM, BAJAKSOUZIAN S, BENARD MF, JACOBS MR, BONOMO RA, ADAMS MD. New insights into dissemination and variation of the health care-associated pathogen Acinetobacter baumannii from genomic analysis[J]. mBio, 2014, 5(1): e00963-13. |
| [25] | STOREY D, McNALLY A, ÅSTRAND M, SA-PESSOA GRACA SANTOS J, RODRIGUEZ-ESCUDERO I, ELMORE B, PALACIOS L, MARSHALL H, HOBLEY L, MOLINA M, CID VJ, SALMINEN TA, BENGOECHEA JA. Klebsiella pneumoniae type VI secretion system-mediated microbial competition is PhoPQ controlled and reactive oxygen species dependent[J]. PLoS Pathogens, 2020, 16(3): e1007969 DOI:10.1371/journal.ppat.1007969. |
| [26] | WEBER BS, MIYATA ST, IWASHKIW JA, MORTENSEN BL, SKAAR EP, PUKATZKI S, FELDMAN MF. Genomic and functional analysis of the type VI secretion system in Acinetobacter[J]. PLoS One, 2013, 8(1): e55142 DOI:10.1371/journal.pone.0055142. |
| [27] | LI L, WANG YN, JIA HB, WANG P, DONG JF, DENG J, LU FM, ZOU QH. The type VI secretion system protein AsaA in Acinetobacter baumannii is a periplasmic protein physically interacting with TssM and required for T6SS assembly[J]. Scientific Reports, 2019, 9: 9438 DOI:10.1038/s41598-019-45875-9. |
| [28] | WEBER BS, HENNON SW, WRIGHT MS, SCOTT NE, de BERARDINIS V, FOSTER LJ, AYALA JA, ADAMS MD, FELDMAN MF. Genetic dissection of the type VI secretion system in Acinetobacter and identification of a novel peptidoglycan hydrolase, TagX, required for its biogenesis[J]. mBio, 2016, 7(5): e01253-16. |
| [29] | EIJKELKAMP BA, STROEHER UH, HASSAN KA, PAULSEN IT, BROWN MH. Comparative analysis of surface-exposed virulence factors of Acinetobacter baumannii[J]. BMC Genomics, 2014, 15(1): 1-12 DOI:10.1186/1471-2164-15-1. |
| [30] | RUHE ZC, LOW DA, HAYES CS. Polymorphic toxins and their immunity proteins: diversity, evolution, and mechanisms of delivery[J]. Annual Review of Microbiology, 2020, 74: 497-520 DOI:10.1146/annurev-micro-020518-115638. |
| [31] | COOPER RM, TSIMRING L, HASTY J. Inter-species population dynamics enhance microbial horizontal gene transfer and spread of antibiotic resistance[J]. eLife, 2017, 6: 25950 DOI:10.7554/eLife.25950. |
| [32] | COULTHURST S. The type VI secretion system: a versatile bacterial weapon[J]. Microbiology (Reading, England), 2019, 165(5): 503-515 DOI:10.1099/mic.0.000789. |
| [33] | CARRUTHERS MD, NICHOLSON PA, TRACY EN, MUNSON RS Jr. Acinetobacter baumannii utilizes a type VI secretion system for bacterial competition[J]. PLoS One, 2013, 8(3): e59388 DOI:10.1371/journal.pone.0059388. |
| [34] | BASLER M. Type VI secretion system: secretion by a contractile nanomachine[J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2015, 370(1679): 20150021 DOI:10.1098/rstb.2015.0021. |
| [35] | NAZAROV S, SCHNEIDER JP, BRACKMANN M, GOLDIE KN, STAHLBERG H, BASLER M. Cryo-EM reconstruction of type VI secretion system baseplate and sheath distal end[J]. The EMBO Journal, 2018, 37(4): e97103 DOI:10.15252/embj.201797103. |
| [36] | FEI NY, JI WQ, YANG LL, YU CY, QIAO P, YAN JP, GUAN W, YANG YW, ZHAO TC. Hcp of the type VI secretion system (T6SS) in Acidovorax citrulli group II strain Aac5 has a dual role as a core structural protein and an effector protein in colonization, growth ability, competition, biofilm formation, and ferric iron absorption[J]. International Journal of Molecular Sciences, 2022, 23(17): 9632 DOI:10.3390/ijms23179632. |
| [37] | TANG L, YUE S, LI GY, LI J, WANG XR, LI SF, MO ZL. Expression, secretion and bactericidal activity of type VI secretion system in Vibrio anguillarum[J]. Archives of Microbiology, 2016, 198(8): 751-760 DOI:10.1007/s00203-016-1236-2. |
| [38] | MANERA K, CARO F, LI H, PEI TT, HERSCH SJ, MEKALANOS JJ, DONG TG. Sensing of intracellular Hcp levels controls T6SS expression in Vibrio cholerae[J]. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(25): e2104813118. |
| [39] | PAN P, WANG XL, CHEN Y, CHEN Q, YANG YX, WEI CX, CHENG TT, WAN HT, YU DJ. Effect of hcp iron ion regulation on the interaction between Acinetobacter baumannii with human pulmonary alveolar epithelial cells and biofilm formation[J]. Frontiers in Cellular and Infection Microbiology, 2022, 12: 761604 DOI:10.3389/fcimb.2022.761604. |
| [40] | WHITNEY JC, BECK CM, GOO YA, RUSSELL AB, HARDING BN, de LEON JA, CUNNINGHAM DA, TRAN BQ, LOW DA, GOODLETT DR, HAYES CS, MOUGOUS JD. Genetically distinct pathways guide effector export through the type VI secretion system[J]. Molecular Microbiology, 2014, 92(3): 529-542 DOI:10.1111/mmi.12571. |
| [41] | MANERA K, KAMAL F, BURKINSHAW B, DONG TG. Essential functions of chaperones and adaptors of protein secretion systems in Gram-negative bacteria[J]. The FEBS Journal, 2022, 289(16): 4704-4717 DOI:10.1111/febs.16056. |
| [42] | LIANG XY, MOORE R, WILTON M, WONG MJQ, LAM L, DONG TG. Identification of divergent type VI secretion effectors using a conserved chaperone domain[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(29): 9106-9111. |
| [43] | CIANFANELLI FR, ALCOFORADO DINIZ J, GUO MM, de CESARE V, TROST M, COULTHURST SJ. VgrG and PAAR proteins define distinct versions of a functional type VI secretion system[J]. PLoS Pathogens, 2016, 12(6): e1005735 DOI:10.1371/journal.ppat.1005735. |
| [44] | BONDAGE DD, LIN JS, MA LS, KUO CH, LAI EM. VgrG C terminus confers the type VI effector transport specificity and is required for binding with PAAR and adaptor-effector complex[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(27): E3931-E3940. |
| [45] | LIU Y, ZHANG Z, WANG F, LI DD, LI YZ. Identification of type VI secretion system toxic effectors using adaptors as markers[J]. Computational and Structural Biotechnology Journal, 2020, 18: 3723-3733 DOI:10.1016/j.csbj.2020.11.003. |
| [46] | MA JL, PAN ZH, HUANG JH, SUN M, LU CP, YAO HC. The Hcp proteins fused with diverse extended-toxin domains represent a novel pattern of antibacterial effectors in type VI secretion systems[J]. Virulence, 2017, 8(7): 1189-1202 DOI:10.1080/21505594.2017.1279374. |
| [47] | SILVERMAN JM, AGNELLO DM, ZHENG HJ, ANDREWS BT, LI M, CATALANO CE, GONEN T, MOUGOUS JD. Haemolysin coregulated protein is an exported receptor and chaperone of type VI secretion substrates[J]. Molecular Cell, 2013, 51(5): 584-593 DOI:10.1016/j.molcel.2013.07.025. |
| [48] | HOWARD SA, FURNISS RCD, BONINI D, AMIN H, PARACUELLOS P, ZLOTKIN D, COSTA TRD, LEVY A, MAVRIDOU DAI, FILLOUX A. The breadth and molecular basis of hcp-driven type VI secretion system effector delivery[J]. mBio, 2021, 12(3): e0026221 DOI:10.1128/mBio.00262-21. |
| [49] | LEWIS JM, DEVESON LUCAS D, HARPER M, BOYCE JD. Systematic identification and analysis of Acinetobacter baumannii type VI secretion system effector and immunity components[J]. Frontiers in Microbiology, 2019, 10: 2440 DOI:10.3389/fmicb.2019.02440. |
| [50] | WANG JF, ZHOU ZH, HE F, RUAN Z, JIANG Y, HUA XT, YU YS. The role of the type VI secretion system vgrG gene in the virulence and antimicrobial resistance of Acinetobacter baumannii ATCC 19606[J]. PLoS One, 2018, 13(2): e0192288 DOI:10.1371/journal.pone.0192288. |
| [51] | FITZSIMONS TC, LEWIS JM, WRIGHT A, KLEIFELD O, SCHITTENHELM RB, POWELL D, HARPER M, BOYCE JD. Identification of novel Acinetobacter baumannii type VI secretion system antibacterial effector and immunity pairs[J]. Infection and Immunity, 2018, 86(8): e00297-18. |
| [52] | LEIMAN PG, BASLER M, RAMAGOPAL UA, BONANNO JB, SAUDER JM, PUKATZKI S, BURLEY SK, ALMO SC, MEKALANOS JJ. Type VI secretion apparatus and phage tail-associated protein complexes share a common evolutionary origin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(11): 4154-4159. |
| [53] | WOOD TE, HOWARD SA, WETTSTADT S, FILLOUX A. PAAR proteins act as the 'sorting hat' of the type VI secretion system[J]. Microbiology (Reading, England), 2019, 165(11): 1203-1218 DOI:10.1099/mic.0.000842. |
| [54] | LOPEZ J, LY PM, FELDMAN MF. The tip of the VgrG spike is essential to functional type VI secretion system assembly in Acinetobacter baumannii[J]. mBio, 2020, 11(1): e02761-19. |
| [55] | PUKATZKI S, MA AT, REVEL AT, STURTEVANT D, MEKALANOS JJ. Type VI secretion system translocates a phage tail spike-like protein into target cells where it cross-links actin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(39): 15508-15513. |
| [56] | FLAUGNATTI N, RAPISARDA C, REY M, BEAUVOIS SG, NGUYEN VA, CANAAN S, DURAND E, CHAMOT-ROOKE J, CASCALES E, FRONZES R, JOURNET L. Structural basis for loading and inhibition of a bacterial T6SS phospholipase effector by the VgrG spike[J]. The EMBO Journal, 2020, 39(11): e104129 DOI:10.15252/embj.2019104129. |
| [57] | HACHANI A, ALLSOPP LP, ODUKO Y, FILLOUX A. The VgrG proteins are "à la carte" delivery systems for bacterial type VI effectors[J]. The Journal of Biological Chemistry, 2014, 289(25): 17872-17884 DOI:10.1074/jbc.M114.563429. |
| [58] | RUHE ZC, LOW DA, HAYES CS. Bacterial contact-dependent growth inhibition[J]. Trends in Microbiology, 2013, 21(5): 230-237 DOI:10.1016/j.tim.2013.02.003. |
| [59] | FILLOUX A. A weapon for bacterial warfare[J]. Nature, 2013, 500(7462): 284-285 DOI:10.1038/nature12545. |
| [60] | SHNEIDER MM, BUTH SA, HO BT, BASLER M, MEKALANOS JJ, LEIMAN PG. PAAR-repeat proteins sharpen and diversify the type VI secretion system spike[J]. Nature, 2013, 500(7462): 350-353 DOI:10.1038/nature12453. |
| [61] | LIANG XY, ZHENG HY, ZHAO YJ, ZHANG YQ, PEI TT, CUI Y, TANG MX, XU P, DONG T. VgrG spike dictates PAAR requirement for the assembly of the type VI secretion system[J]. Journal of Bacteriology, 2023, 205(2): e00356-22. |
| [62] | KAMAL F, LIANG XY, MANERA K, PEI TT, KIM H, LAM LG, PUN A, HERSCH SJ, DONG TG. Differential cellular response to translocated toxic effectors and physical penetration by the type VI secretion system[J]. Cell Reports, 2020, 31(11): 107766 DOI:10.1016/j.celrep.2020.107766. |
| [63] | KLEIN TA, AHMAD S, WHITNEY JC. Contact-dependent interbacterial antagonism mediated by protein secretion machines[J]. Trends in Microbiology, 2020, 28(5): 387-400 DOI:10.1016/j.tim.2020.01.003. |
| [64] | LUO JJ, CHU X, JIE J, SUN Y, GUAN QT, LI D, LUO ZQ, SONG L. Acinetobacter baumannii kills fungi via a type VI DNase effector[J]. mBio, 2023, 14(1): e0342022 DOI:10.1128/mbio.03420-22. |
| [65] | LOPEZ J, LE NH, MOON KH, SALOMON D, BOSIS E, FELDMAN MF. Formylglycine-generating enzyme-like proteins constitute a novel family of widespread type VI secretion system immunity proteins[J]. Journal of Bacteriology, 2021, 203(21): e00281-21. |
| [66] | LE NH, PINEDO V, LOPEZ J, CAVA F, FELDMAN MF. Killing of Gram-negative and Gram-positive bacteria by a bifunctional cell wall-targeting T6SS effector[J]. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(40): e2106555118. |
| [67] | WATTAM AR, DAVIS JJ, ASSAF R, BOISVERT S, BRETTIN T, BUN C, CONRAD N, DIETRICH EM, DISZ T, GABBARD JL, GERDES S, HENRY CS, KENYON RW, MACHI D, MAO CH, NORDBERG EK, OLSEN GJ, MURPHY-OLSON DE, OLSON R, OVERBEEK R, et al. Improvements to PATRIC, the all-bacterial bioinformatics database and analysis resource center[J]. Nucleic Acids Research, 2017, 45(D1): D535-D542 DOI:10.1093/nar/gkw1017. |
| [68] | WU CF, LIEN YW, BONDAGE D, LIN JS, PILHOFER M, SHIH YL, CHANG JH, LAI EM. Effector loading onto the VgrG carrier activates type VI secretion system assembly[J]. EMBO Reports, 2020, 21(1): e47961 DOI:10.15252/embr.201947961. |
| [69] | RINGEL PD, HU D, BASLER M. The role of type VI secretion system effectors in target cell lysis and subsequent horizontal gene transfer[J]. Cell Reports, 2017, 21(13): 3927-3940 DOI:10.1016/j.celrep.2017.12.020. |
| [70] | AHMAD S, WANG BY, WALKER MD, TRAN HK R, STOGIOS PJ, SAVCHENKO A, GRANT RA, McARTHUR AG, LAUB MT, WHITNEY JC. An interbacterial toxin inhibits target cell growth by synthesizing (p)ppApp[J]. Nature, 2019, 575(7784): 674-678 DOI:10.1038/s41586-019-1735-9. |
| [71] | ROSS BD, VERSTER AJ, RADEY MC, SCHMIDTKE DT, POPE CE, HOFFMAN LR, HAJJAR AM, PETERSON SB, BORENSTEIN E, MOUGOUS JD. Human gut bacteria contain acquired interbacterial defence systems[J]. Nature, 2019, 575(7781): 224-228 DOI:10.1038/s41586-019-1708-z. |
| [72] | TING SY, BOSCH DE, MANGIAMELI SM, RADEY MC, HUANG S, PARK YJ, KELLY KA, FILIP SK, GOO YA, ENG JK, ALLAIRE M, VEESLER D, WIGGINS PA, PETERSON SB, MOUGOUS JD. Bifunctional immunity proteins protect bacteria against FtsZ-targeting ADP-ribosylating toxins[J]. Cell, 2018, 175(5): 1380-1392.e14 DOI:10.1016/j.cell.2018.09.037. |
| [73] | JENSEN SJ, RUHE ZC, WILLIAMS AF, NHAN DQ, GARZA-SÁNCHEZ F, LOW DA, HAYES CS. Paradoxical activation of a type VI secretion system phospholipase effector by its cognate immunity protein[J]. Journal of Bacteriology, 2023, 205(6): e00113-23. |
| [74] | SINGH R, CAPALASH N, SHARMA P. Vaccine development to control the rising scourge of antibiotic-resistant Acinetobacter baumannii: a systematic review[J]. 3 Biotech, 2022, 12(3): 1-14. |
| [75] | MORAIS V, TEXEIRA E, SUAREZ N. Next-generation whole-cell pneumococcal vaccine[J]. Vaccines, 2019, 7(4): 151 DOI:10.3390/vaccines7040151. |
| [76] | KULKARNI JA, WITZIGMANN D, THOMSON SB, CHEN S, LEAVITT BR, CULLIS PR, van der MEEL R. The current landscape of nucleic acid therapeutics[J]. Nature Nanotechnology, 2021, 16(6): 630-643 DOI:10.1038/s41565-021-00898-0. |
| [77] | McCONNELL MJ, DOMÍNGUEZ-HERRERA J, SMANI Y, LÓPEZ-ROJAS R, DOCOBO-PÉREZ F, PACHÓN J. Vaccination with outer membrane complexes elicits rapid protective immunity to multidrug-resistant Acinetobacter baumannii[J]. Infection and Immunity, 2011, 79(1): 518-526 DOI:10.1128/IAI.00741-10. |
| [78] | FRANCIS MJ. Recent advances in vaccine technologies[J]. The Veterinary Clinics of North America Small Animal Practice, 2018, 48(2): 231-241 DOI:10.1016/j.cvsm.2017.10.002. |
| [79] | HAJISSA K, ZAKARIA R, SUPPIAN R, MOHAMED Z. Epitope-based vaccine as a universal vaccination strategy against Toxoplasma gondii infection: a mini-review[J]. Journal of Advanced Veterinary and Animal Research, 2019, 6(2): 174-182 DOI:10.5455/javar.2019.f329. |
| [80] | PAZOKI M, DARVISH ALIPOUR ASTANEH S, RAMEZANALIZADEH F, JAHANGIRI A, RASOOLI I. Immunoprotectivity of valine-glycine repeat protein G, a potent mediator of pathogenicity, against Acinetobacter baumannii[J]. Molecular Immunology, 2021, 135: 276-284 DOI:10.1016/j.molimm.2021.04.026. |
| [81] | ALIPOURI S, RASOOLI I, GHAINI MH, JAHANGIRI A, DARVISH ALIPOUR ASTANEH S, RAMEZANALIZADEH F. Immunity induced by valine-glycine repeat protein G imparts histoprotection of vital body organs against Acinetobacter baumannii[J]. Journal of Genetic Engineering and Biotechnology, 2022, 20(1): 1-9 DOI:10.1186/s43141-021-00283-3. |
| [82] | YANG N, JIN X, ZHU CH, GAO FL, WENG ZQ, DU XR, FENG GZ. Subunit vaccines for Acinetobacter baumannii[J]. Frontiers in Immunology, 2023, 13: 1088130 DOI:10.3389/fimmu.2022.1088130. |
| [83] | HU Y, ZHANG XQ, DENG SS, YUE CW, JIA X, LYU YH. Non-antibiotic prevention and treatment against Acinetobacter baumannii infection: are vaccines and adjuvants effective strategies?[J]. Frontiers in Microbiology, 2023, 14: 1049917 DOI:10.3389/fmicb.2023.1049917. |
| [84] | GORAIN C, KHAN A, SINGH A, MONDAL S, MALLICK AI. Bioengineering of LAB vector expressing haemolysin co-regulated protein (Hcp): a strategic approach to control gut colonization of Campylobacter jejuni in a murine model[J]. Gut Pathogens, 2021, 13(1): 1-16 DOI:10.1186/s13099-020-00395-0. |
| [85] | WETTSTADT S, FILLOUX A. Manipulating the type VI secretion system spike to shuttle passenger proteins[J]. PLoS One, 2020, 15(2): e0228941 DOI:10.1371/journal.pone.0228941. |
| [86] | TING SY, MARTÍNEZ-GARCÍA E, HUANG S, BERTOLLI SK, KELLY KA, CUTLER KJ, SU ED, ZHI H, TANG Q, RADEY MC, RAFFATELLU M, PETERSON SB, de LORENZO V, MOUGOUS JD. Targeted depletion of bacteria from mixed populations by programmable adhesion with antagonistic competitor cells[J]. Cell Host & Microbe, 2020, 28(2): 313-321.e6. |
| [87] | HERSCH SJ, LAM L, DONG TG. Engineered type six secretion systems deliver active exogenous effectors and cre recombinase[J]. mBio, 2021, 12(4): e0111521 DOI:10.1128/mBio.01115-21. |
| [88] | UNTERWEGER D, KOSTIUK B, ÖTJENGERDES R, WILTON A, DIAZ-SATIZABAL L, PUKATZKI S. Chimeric adaptor proteins translocate diverse type VI secretion system effectors in Vibrio cholerae[J]. The EMBO Journal, 2015, 34(16): 2198-2210 DOI:10.15252/embj.201591163. |
| [89] | HERSCH SJ, WATANABE N, STIETZ MS, MANERA K, KAMAL F, BURKINSHAW B, LAM L, PUN A, LI MX, SAVCHENKO A, DONG TG. Envelope stress responses defend against type six secretion system attacks independently of immunity proteins[J]. Nature Microbiology, 2020, 5(5): 706-714 DOI:10.1038/s41564-020-0672-6. |
| [90] | PUKATZKI S, MA AT, STURTEVANT D, KRASTINS B, SARRACINO D, NELSON WC, HEIDELBERG JF, MEKALANOS JJ. Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(5): 1528-1533. |
| [91] | KREITZ J, FRIEDRICH MJ, GURU A, LASH B, SAITO M, MACRAE RK, ZHANG F. Programmable protein delivery with a bacterial contractile injection system[J]. Nature, 2023, 616(7956): 357-364 DOI:10.1038/s41586-023-05870-7. |
| [92] | BÖCK D, MEDEIROS JM, TSAO HF, PENZ T, WEISS GL, AISTLEITNER K, HORN M, PILHOFER M. In situ architecture, function, and evolution of a contractile injection system[J]. Science, 2017, 357(6352): 713-717 DOI:10.1126/science.aan7904. |
 2024, Vol. 64
2024, Vol. 64