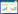中国科学院微生物研究所,中国微生物学会
文章信息
- 龚晋祥, 张仟禧, 杨子银, 王文清, 冯康, 张志榜, 杨涛涛, 李凯, 孙子龙, 张晓燕, 李鹏成. 2024
- GONG Jinxiang, ZHANG Qianxi, YANG Ziyin, WANG Wenqing, FENG Kang, ZHANG Zhibang, YANG Taotao, LI Kai, SUN Zilong, ZHANG Xiaoyan, LI Pengcheng.
- 猪流行性腹泻病毒劫持DNA损伤通路操纵细胞周期促进自身复制
- PEDV hijacks DNA damage pathways and manipulates the cell cycle to promote self-replication
- 微生物学报, 64(12): 4850-4858
- Acta Microbiologica Sinica, 64(12): 4850-4858
-
文章历史
- 收稿日期:2024-07-12
- 网络出版日期:2024-09-03
2. 山西农业大学 动物医学学院, 山西 晋中 030801
2. College of Veterinary Medicine, Shanxi Agricultural University, Jinzhong 030801, Shanxi, China
猪流行性腹泻(porcine epidemic diarrhea, PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)引起的猪的一种急性高度接触性的肠道传染病,以呕吐、腹泻、脱水为特征。PEDV为冠状病毒科单股正链RNA病毒,主要在小肠(十二指肠、空肠和回肠)的绒毛肠细胞中感染和复制,且传播迅速。各种年龄和不同品种的猪群对PEDV都有易感性,但不同年龄易感猪群的致死率不同,其中以哺乳仔猪的致死率最高;由PED引起的仔猪腹泻已经成为困扰养猪业发展的重要传染病[1-3]。
DNA损伤应答(DNA damage response, DDR)是细胞内一种非常保守的信号转导通路,对维持基因组完整性、稳定性和细胞存活至关重要[4]。DDR信号通路主要是通过2种关键的蛋白激酶启动,分别是共济失调毛细血管扩张突变蛋白(ataxia telangiectasia mutated, ATM)、共济失调毛细血管扩张突变和Rad3相关蛋白(ataxia telangiectasia and rad3-related protein, ATR)[5-7]。ATM和ATR可共同磷酸化数百种蛋白,以响应DNA损伤调节基因组稳定性[8]。ATM和ATR可分别通过激活下游检查点激酶Chk2和Chk1介导细胞周期调控。研究表明,多种病毒可引发宿主DDR,病毒可能通过操纵相关的DNA损伤通路激酶和细胞周期的策略,以创造有利的细胞环境进行复制。以往研究均集中于DNA病毒,例如:猿猴病毒40型(simian vacuolating virus 40, SV40)、单纯疱疹病毒1型(herpes simplex virus type 1, HSV-1)、人巨细胞病毒(human cytomegalovirus, HCMV)和疱疹病毒IV型(Epstein-Barr virus, EBV)[9-12],在感染期间均会激活ATM和下游信号传导,同时ATM和其他修复蛋白会募集到病毒DNA复制位点。然而,研究发现RNA病毒同样可以劫持DDR通路促进自身复制,包括丙型肝炎病毒(hepatitis c virus, HCV)[13]、传染性支气管炎病毒(infectious bronchitis virus, IBV)[14]、新城疫病病毒(newcastle disease virus, NDV)[15]和新型冠状病毒(corona virus disease 2019, COVID-19)[16]。丙型肝炎病毒感染后激活ATM和Chk2,可促进丙型肝炎病毒复制[13]。ATR信号激活介导IBV对宿主细胞S期捕获,从而促进IBV的复制[14]。例如,COVID-19会对细胞DNA造成损害,并靶向DDR通路的特定成分[16]。
最新研究显示,PEDV可激活DDR信号通路促进其自身复制[17-18],但具体的作用机制尚不明了。本研究首先通过实时彗星试验观察PEDV感染Vero细胞造成DNA损伤的情况;然后应用特异性抑制剂确证DDR通路是否参与PEDV的复制;最后经蛋白质免疫印迹和流式细胞术分别检测PEDV感染Vero细胞DDR通路中蛋白表达和细胞周期的变化,旨在研究DDR通路在PEDV复制中的作用机制,为进一步阐明PEDV感染复制机制及开发新的潜在抗病毒靶点提供重要依据。
1 材料与方法 1.1 材料非洲绿猴肾细胞Vero细胞、猪流行性腹泻病毒CV777和PEDV-N蛋白单克隆抗体均由本研究室制备并保存;DMEM培养基、青链霉素、0.25%胰酶及胎牛血清均购自Gibco公司;RIPA裂解液、蛋白酶抑制剂PMSF和BCA蛋白浓度测定试剂盒(P0010)均购自上海碧云天生物技术股份有限公司;辣根过氧化物酶(horseradish peroxidase, HRP)标记山羊抗小鼠IgG (H+L)和HRP标记山羊抗兔IgG (H+L)均购自艾比玛特生物医药(上海)有限公司;KU55933、AZD6738、VE821抑制剂均购自Selleck公司;蛋白预染Marker [M5 SuperRange Prestained Protein Ladder (10−310 kDa)]购自北京聚合美生物科技有限公司;彗星法DNA损伤分析试剂盒(3孔载玻片)购自亚科因生物技术有限公司;p-ATR (NBP2-43564)、ATR (sc-515173)、ATM (NB100-104)、p-ATM (NB100-306)、γ-H2AX (NB100-384)均购自NOVUS公司;Chk1-296 (2349T)、Chk1-317 (2344T)、p-Chk2 (2661T)、p53 (2527T)、p-p53 (82530S)一抗均购自Cell Signaling Technology公司;GAPDH (PAB45851)一抗购自武汉贝茵莱生物有限公司;0.45 μm PVDF膜购自Cytiva公司。
1.2 细胞培养Vero细胞于含有10%的胎牛血清和1%双抗(青霉素、链霉素浓度均为100 U/mL)的DMEM细胞培养液中培养(37 ℃、5% CO2)。Vero细胞接种于6孔、24孔或96孔培养板,隔天更换培养基,细胞长成单层后使用。
1.3 病毒滴度的测定病毒样品做10倍比稀释,然后将每个稀释度的病毒接种96孔细胞板,每个梯度做6个重复孔。随后放入CO2培养箱中孵育1 h,弃去原液后补加200 µL的维持液(2%胎牛血清的DMEM培养基),待细胞出现典型细胞病变效应(cytopathic effect, CPE)后根据Reed and Mench法判定病毒滴度。
1.4 抑制剂细胞毒性试验用维持液将ATM抑制剂KU55933、ATR抑制剂AZD6738和ATR抑制剂VE821按不同浓度稀释。将细胞铺于96孔培养板中,在37 ℃、5% CO2下培养。待96孔板内细胞75%融合,弃去96孔板内培养液,按相应浓度梯度加入抑制剂200 μL/孔,每种抑制剂作3个重复孔,另设3个空白对照(只加200 μL维持液)以及加入DMSO浓度为Mock组,每种梯度作3个重复。放入37 ℃、5% CO2培养箱再培养36 h。弃去96孔板内培养液,换维持液100 μL/孔,并向每孔加入10 μL CCK-8试剂,在37 ℃、5% CO2下孵育2 h,酶标仪读取OD450值。
1.5 抑制剂对病毒复制影响将细胞铺至24孔细胞培养板,待24孔板内细胞75%融合,弃去24孔板内培养液,加入相应浓度的抑制剂,同时设Mock组,单独PEDV组,每组3个重复,另设6个空白对照。预作用2 h后向抑制剂组、Mock组、PEDV alone组每孔加入等量病毒液(MOI=0.5),空白组加入维持液,60 h后冻融3次,收获病毒液。按照1.3方法测病毒滴度。
1.6 彗星试验检测PEDV对细胞DNA损伤程度PEDV感染Vero细胞后分别于4、8、12、24、36、48、60、72 h用预冷的PBS洗2遍,收集各组细胞,并单独设置不接毒空白组和4 μL博来霉素阳性对照组,每组收集1.0×104个细胞悬液。将溶解的低熔点琼脂液加到CometSlide载玻片上完全覆盖,以创建基底层,4 ℃冷却15 min。取细胞样品与琼脂糖以1:10的比例混合,再取75 μL混合液转移到CometSlide基底层的上面完全覆盖,自然冷却后4 ℃裂解过夜,用预冷的碱性解旋溶液解旋30 min,将其水平放入水平电泳槽中。使用预冷碱性电泳缓冲液电泳20 V、20 min,使DNA解链。电泳后,将CometSlide水平转移到装有预冷的0.4 mmol的Tris-HCl (pH 7.5)缓冲液(约25 mL/CometSlide)中,4 ℃中和3次,每次10 min。弃去Tris-HCl缓冲液,加入50 μL 1×PI染料,室温避光染色10 min后使用荧光显微镜观察CometSlide并拍取照片,之后使用彗星分析软件分析。
1.7 Western blotting检测蛋白表达水平Vero细胞在6孔细胞板培养至融合,用PEDV感染Vero细胞0、1、6、12、24、36、48、60 h,之后细胞用PBS清洗3次,每孔加入150 μL蛋白裂解液(提前加入PMSF),冰上作用30 min充分裂解细胞。将细胞样品刮下并收集到1.5 mL离心管中,12 000×g离心10 min后吸取上清液,使用BCA法测定蛋白浓度,调整上样量。使用SDS聚丙烯凝胶进行电泳,用湿转法将蛋白转移至PVDF膜上,5%脱脂奶粉封闭1 h,分别加入不同稀释浓度抗体,4 ℃孵育过夜,洗膜后,加入对应二抗孵育1 h,再次洗膜,用化学发光液进行显影,拍照保存。
1.8 流式细胞术检测PEDV感染Vero细胞周期的变化PEDV感染Vero细胞(MOI=0.5) 48 h后,用预冷的PBS洗2遍,用胰酶消化细胞,小心收集细胞悬液,1 000×g离心3 min沉淀细胞;小心吸除上清,加入约1 mL冰浴预冷的PBS重悬细胞,并转移到1.5 mL离心管内;再次离心沉淀细胞,小心吸除上清,可以残留约50 μL的PBS,以避免吸走细胞;轻轻弹击离心管底以适当分散细胞,避免细胞成团;然后将细胞悬液缓慢加入装有1 mL冰浴预冷70%乙醇的EP管中,轻轻吹打混匀,4 ℃固定30 min,BD FACScanto Ⅱ流式细胞仪[碧迪医疗器械(上海)有限公司]检测分析。
1.9 统计分析OpenComet软件分析彗星试验,比较DNA尾距百分比(tail DNA %)。试验数据应用GraphPad Prism 9.0进行生物学统计分析。
2 结果与分析 2.1 PEDV病毒复制依赖于ATM途径为了证实DDR通路是否参与PEDV复制,本研究选择3种DDR通路顶端激酶抑制剂研究其对PEDV复制的影响。研究发现,ATM抑制剂KU55933可极显著抑制PEDV的复制(P < 0.001),PEDV病毒滴度从(5.50±0.25) log10 TCID50/mL下降到(3.15±0.15) log10 TCID50/mL,下降约2个滴度,而ATR抑制剂AZD6738和VE821对PEDV的复制则无显著影响(图 1)。
|
| 图 1 DDR抑制剂对PEDV复制的影响 Figure 1 Effects of DDR inhibitors on PEDV replication. Mock: DMSO 100 μmol/L; KU55933: ATM kinase inhibitor 20 μmol/L; AZD6738: ATR kinase inhibitor 100 μmol/L; VE821: ATR kinase inhibitor 16 μmol/L. ns: No significance; ***: P < 0.001. |
2.2 PEDV感染显著引起Vero细胞DNA损伤
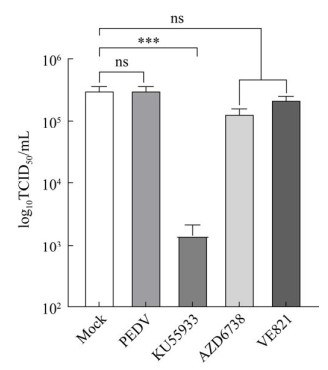
本研究应用彗星试验证实了PEDV感染可以显著引起Vero细胞DNA损伤。正常细胞的细胞核,未观察到彗星拖尾(图 2A);PEDV感染48 h后Vero细胞核的形态为典型的DNA损伤细胞产生的彗星拖尾(图 2B)。阳性对照博来霉素极显著造成细胞DNA损伤,DNA尾距占比增加83.90% (图 2C)。PEDV实时感染Vero细胞发现(图 2C),PEDV感染12 h后DNA尾距占比增加16.05% (P < 0.000 1),并且随着感染时间的增加而增加,感染60 h Tail DNA占比增加达到了34.08% (P < 0.000 1),72 h可能由于细胞破裂造成Tail DNA下降。
|
| 图 2 PEDV感染Vero细胞彗星试验 Figure 2 PEDV infected Vero cells comet assay. A: Comet with no DNA damage. B: DNA damage comet. C: DNA damage tail distance percentage. ns: No significance; ****: P < 0.000 1. |
2.3 PEDV感染对DDR通路中蛋白分子表达的影响
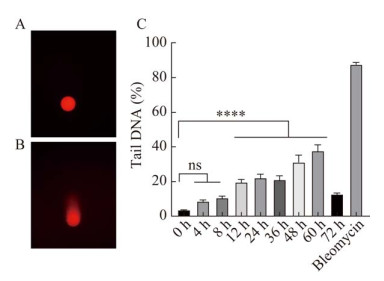
如图 3所示,感染PEDV后DNA损伤标志物γ-H2AX表达量在36 h之前并未表现出明显差异,36 h之后表达量开始增加,且维持在较高水平。ATM感染PEDV后表达量随时间逐渐降低;p-ATM感染PEDV 36 h开始有表达,48 h表达量最高,60 h表达量降低;Chk2感染PEDV后1 h表达量下降,然后一直保持不变,到60 h表达量继续降低;p-Chk2感染PEDV 24 h后激活到36 h表达量最高,然后降低。ATR感染PEDV 48 h后表达量开始降低;p-ATR感染PEDV 1 h后表达增加,之后不断激活上升;Chk1感染PEDV 24 h表达量开始增加直到60 h;Chk1-296感染PEDV 1 h和6 h表达降低,12 h之后又降低,36 h之后表达量逐渐增加;Chk1-317感染PEDV 24 h后激活36 h表达量最高,然后降低。
|
| 图 3 PEDV感染Vero细胞DNA损伤相关蛋白表达 Figure 3 Expression of DNA damage-related proteins in PEDV-infected Vero cells. |
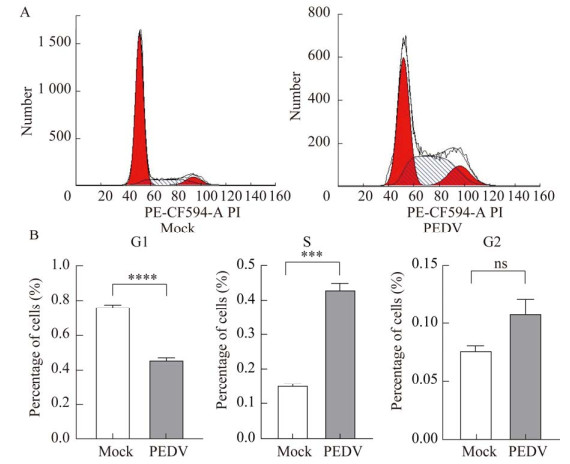
2.4 PEDV影响细胞周期停滞在S期
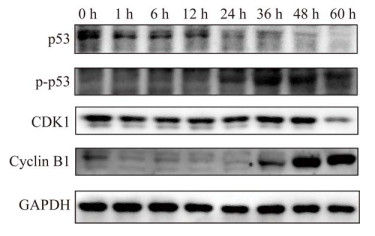
如图 4所示,48 h时PEDV感染引起G1期细胞百分比的极显著降低(P < 0.000 1),S期细胞百分比极显著升高(P < 0.001),G2期细胞占比差异不显著,表明PEDV感染导致细胞周期停滞在S期。细胞周期检查点调控蛋白表达变化发现(图 5):p53于PEDV感染Vero细胞12 h后表达开始逐渐减少,磷酸化p53 (Ser15)的表达逐渐增加;CDK1随时间表达量变化并不是很明显,仅60 h有所下降;而Cyclin B1在PEDV感染1 h后表达显著减少,直到36 h才有所升高,48 h和60 h表达极显著增多。
|
| 图 4 PEDV感染Vero细胞流式细胞检测 Figure 4 Flow cytometry of PEDV infected Vero cells. A: Vero cells were infected with PEDV for 48 h, and cell cycle distribution was analyzed by flow cytometry. B: Statistics of cell cycle results in different periods. ns: No significance; ***: P < 0.001; ****: P < 0.000 1. |
|
| 图 5 PEDV感染Vero细胞周期相关蛋白表达变化 Figure 5 Expression of cell cycle-related proteins in PEDV-infected Vero cells. |
3 讨论与结论
DNA病毒基因组在复制过程中往往需要利用细胞DNA复制系统,因此与细胞内的DNA损伤反应(DDR)信号网络发生复杂广泛的相互作用,从而创造出有利于病毒复制的细胞内环境[19-20]。然而,RNA病毒除了少数逆转录病毒,大部分RNA病毒为胞质复制,很少与DNA损伤联系起来。越来越多的最新报道显示,RNA病毒也具有诱导DNA损伤的特质,比如猪繁殖与呼吸综合征病毒[21]、冠状病毒病[16]和人肠道病毒A71[22],说明RNA病毒也具有诱导DNA损伤的特质。
在真核生物中,组蛋白H2A、H2B、H3和H4形成具有大约150 bp DNA的核小体。随着DNA损伤,H2AX (一种H2A变体)第139位的丝氨酸被磷酸化,H2AX变成p-H2AX-S139 (γ-H2AX),γ-H2AX通常作为关键的DNA损伤标志物,介导DSB位点信号转导蛋白的后续积累[23-24]。PEDV在感染后期对γ-H2AX的表达上调,表明PEDV感染导致DNA损伤的激活。ATM、ATR和DNA-PK是参与γ-H2AX激活的3种主要激酶,DNA-PK和ATM主要参与DNA双链断裂,而ATR主要响应DNA单链断裂[25]。本研究发现,ATM和ATR作为DNA损伤的顶端激酶均在PEDV复制后期表达下降,而p-ATM和p-ATR在后期表达量上升,表明PEDV感染激活了DDR途径的两条通路。为了响应受损的DNA或停滞的复制,ATR磷酸化Ser317和Ser345位点Chk1,这种磷酸化被认为可以提高Chk1的催化活性[26-27],随后是Ser296的自磷酸化。Ser296磷酸化诱导Chk1与14-3-3γ结合,从而促进Cdc25A降解来控制细胞周期停滞[28]。Chk1被上游激酶ATR磷酸化而被激活,Chk1随着时间增加表达量增高,而下游的Chk1-Ser317和Chk1-Ser296的激活又说明DNA修复和细胞周期检查点的启动。Chk2会被ATM磷酸化和激活,诱导DNA损伤后的细胞凋亡[29]。Chk2在后期表达量下降,p-Chk2后期的增加,预示着细胞凋亡的出现。聚ADP核糖聚合酶(poly ADP-ribose polymerase, PARP)是DNA修复酶,它是细胞凋亡核心成员半胱天冬酶的切割底物,在DNA损伤修复与细胞凋亡中发挥着重要作用[30]。我们发现,PARP抑制剂AZD2281会降低PEDV的复制(结果未显示),可能与PARP参与的细胞凋亡有关[18]。本研究中ATR抑制剂不影响PEDV复制,那么ATR通路激活所发挥的具体作用,有待进一步研究。
病毒严格寄生于宿主细胞,已经进化出各种策略来破坏宿主细胞周期,以确保自身的正常复制[31]。p53作为公认的抑癌基因,可被DNA损伤、癌基因和细胞应激激活,可以调节多种细胞过程,包括DNA修复、细胞周期、凋亡、氧化还原稳态、代谢和线粒体功能[32-33]。传染性支气管炎病毒(IBV)感染通过以p53非依赖性方式调节各种细胞周期蛋白和低磷酸化RB的积累,在S期和G2/M期停滞细胞周期[34]。PEDV N蛋白与p53相互作用以激活p53-DREAM通路,并随后诱导S期停滞[35]。ATM、ATR和DNA-PK会诱导p53在Ser15和Ser20位点的磷酸化,可导致细胞周期停滞和DNA修复或细胞凋亡[36-37]。Chk1和Chk2也可以磷酸化p53,影响细胞周期进程和细胞凋亡。本研究中p53 (Ser15)在PEDV感染后期被激活,说明细胞进入细胞周期阻滞和凋亡。周期蛋白依赖性激酶(cyclin-dependent kinases, CDK1)可以与Cyclin A或B结合来促进细胞周期S/G2或G2/M的转换,在调控细胞周期进程中占重要地位[38]。通常细胞周期阻滞就是对检查点激酶的破坏,从而导致不能正常复制,Cyclin B1作为调节G2/M期检查点激酶,PEDV感染导致CDK1的下调和Cyclin B1的上调表明S期检查点的破坏,导致细胞阻滞在S期。
综上所述,本研究证实PEDV感染Vero细胞后显著引起DNA损伤,并激活ATM-Chk2信号通路,通过p53的活化和极显著增加Cyclin B1的表达来操纵细胞周期促进病毒复制。该结果为进一步阐明PEDV感染复制机制,以及开发新的潜在抗病毒靶点提供了重要依据。
| [1] | JUNG K, ANNAMALAI T, LU ZY, SAIF LJ. Comparative pathogenesis of US porcine epidemic diarrhea virus (PEDV) strain PC21A in conventional 9-day-old nursing piglets vs. 26-day-old weaned pigs[J]. Veterinary Microbiology, 2015, 178(1/2): 31-40. |
| [2] | LI WT, LI H, LIU YB, PAN YF, DENG F, SONG YH, TANG XB, HE QG. New variants of porcine epidemic diarrhea virus, China, 2011[J]. Emerging Infectious Diseases, 2012, 18(8): 1350-1353 DOI:10.3201/eid1803.120002. |
| [3] | SONG D, PARK B. Porcine epidemic diarrhoea virus: a comprehensive review of molecular epidemiology, diagnosis, and vaccines[J]. Virus Genes, 2012, 44(2): 167-175 DOI:10.1007/s11262-012-0713-1. |
| [4] | STOKES MP, RUSH J, MACNEILL J, REN JM, SPROTT K, NARDONE J, YANG V, BEAUSOLEIL SA, GYGI SP, LIVINGSTONE M, ZHANG H, POLAKIEWICZ RD, COMB MJ. Profiling of UV-induced ATM/ATR signaling pathways[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(50): 19855-19860. |
| [5] | CIMPRICH KA, CORTEZ D. ATR: an essential regulator of genome integrity[J]. Nature Reviews Molecular Cell Biology, 2008, 9(8): 616-627 DOI:10.1038/nrm2450. |
| [6] | DAVIS AJ, CHEN BPC, CHEN DJ. DNA-PK: a dynamic enzyme in a versatile DSB repair pathway[J]. DNA Repair, 2014, 17: 21-29 DOI:10.1016/j.dnarep.2014.02.020. |
| [7] | LEE JH, PAULL TT. ATM activation by DNA double-strand breaks through the Mre11-Rad50-Nbs1 complex[J]. Science, 2005, 308(5721): 551-554 DOI:10.1126/science.1108297. |
| [8] | JACKSON SP, BARTEK J. The DNA-damage response in human biology and disease[J]. Nature, 2009, 461(7267): 1071-1078 DOI:10.1038/nature08467. |
| [9] | BOICHUK S, HU L, HEIN J, GJOERUP OV. Multiple DNA damage signaling and repair pathways deregulated by Simian virus 40 large T antigen[J]. Journal of Virology, 2010, 84(16): 8007-8020 DOI:10.1128/JVI.00334-10. |
| [10] | XIAOFEI E, PICKERING MT, DEBATIS M, CASTILLO J, LAGADINOS A, WANG SX, LU S, KOWALIK TF. An E2F1-mediated DNA damage response contributes to the replication of human cytomegalovirus[J]. PLoS Pathogens, 2011, 7(5): e1001342 DOI:10.1371/journal.ppat.1001342. |
| [11] | LILLEY CE, CARSON CT, MUOTRI AR, GAGE FH, WEITZMAN MD. DNA repair proteins affect the lifecycle of herpes simplex virus 1[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(16): 5844-5849. |
| [12] | LU CC, CHEN YC, WANG JT, YANG PW, CHEN MR. Xeroderma pigmentosum C is involved in Epstein Barr virus DNA replication[J]. The Journal of General Virology, 2007, 88(Pt 12): 3234-3243. |
| [13] | ARIUMI Y, KUROKI M, DANSAKO H, ABE KI, IKEDA M, WAKITA T, KATO N. The DNA damage sensors ataxia-telangiectasia mutated kinase and checkpoint kinase 2 are required for hepatitis C virus RNA replication[J]. Journal of Virology, 2008, 82(19): 9639-9646 DOI:10.1128/JVI.00351-08. |
| [14] | XU LH, HUANG M, FANG SG, LIU DX. Coronavirus infection induces DNA replication stress partly through interaction of its nonstructural protein 13 with the p125 subunit of DNA polymerase δ[J]. The Journal of Biological Chemistry, 2011, 286(45): 39546-39559 DOI:10.1074/jbc.M111.242206. |
| [15] | REN SH, REHMAN ZU, GAO B, YANG ZQ, ZHOU JY, MENG CC, SONG CP, NAIR V, SUN YJ, DING C. ATM-mediated DNA double-strand break response facilitated oncolytic Newcastle disease virus replication and promoted syncytium formation in tumor cells[J]. PLoS Pathogens, 2020, 16(6): e1008514 DOI:10.1371/journal.ppat.1008514. |
| [16] | GIOIA U, TAVELLA S, MARTÍNEZ-ORELLANA P, CICIO G, COLLIVA A, CECCON M, CABRINI M, HENRIQUES AC, FUMAGALLI V, PALDINO A, PRESOT E, RAJASEKHARAN S, IACOMINO N, PISATI F, MATTI V, SEPE S, CONTE MI, BAROZZI S, LAVAGNINO Z, CARLETTI T, et al. SARS-CoV-2 infection induces DNA damage, through CHK1 degradation and impaired 53BP1 recruitment, and cellular senescence[J]. Nature Cell Biology, 2023, 25(4): 550-564 DOI:10.1038/s41556-023-01096-x. |
| [17] | LUO YR, ZHOU ST, YANG L, LIU YP, JIANG SY, DAWULI Y, HOU YX, ZHOU TX, YANG ZB. Porcine epidemic diarrhoea virus induces cell-cycle arrest through the DNA damage-signalling pathway[J]. Journal of Veterinary Research, 2020, 64(1): 25-32 DOI:10.2478/jvetres-2020-0024. |
| [18] | MING X, CHEN H, YANG Y, ZHAO P, SUN LM, ZHANG CS, SHIN HJ, LEE JS, JUNG YS, QIAN YJ. Porcine enteric coronavirus PEDV induces the ROS-ATM and Caspase7-CAD-γH2AX signaling pathways to foster its replication[J]. Viruses, 2022, 14(8): 1782 DOI:10.3390/v14081782. |
| [19] | WEITZMAN MD, FRADET-TURCOTTE A. Virus DNA replication and the host DNA damage response[J]. Annual Review of Virology, 2018, 5(1): 141-164 DOI:10.1146/annurev-virology-092917-043534. |
| [20] | KONO T, LAIMINS L. Genomic instability and DNA damage repair pathways induced by human papillomaviruses[J]. Viruses, 2021, 13(9): 1821 DOI:10.3390/v13091821. |
| [21] | LI PC, XU CC, ZHANG XY, CAO C, WANG XJ, CAI G. Single-stranded RNA viruses activate and hijack host apical DNA damage response kinases for efficient viral replication[J]. Genome Instability & Disease, 2022, 3(2): 83-87. |
| [22] | YU JH, ZHANG WY, HUO WB, MENG XL, ZHONG T, SU Y, LIU YM, LIU JM, WANG ZY, SONG FM, ZHANG SX, LI ZL, YU XY, YU XF, HUA SC. Regulation of host factor γ-H2AX level and location by enterovirus A71 for viral replication[J]. Virulence, 2022, 13(1): 241-257 DOI:10.1080/21505594.2022.2028482. |
| [23] | COOK PJ, JU BG, TELESE F, WANG XT, GLASS CK, ROSENFELD MG. Tyrosine dephosphorylation of H2AX modulates apoptosis and survival decisions[J]. Nature, 2009, 458(7238): 591-596. |
| [24] | STIFF T, O'DRISCOLL M, RIEF N, IWABUCHI K, LÖBRICH M, JEGGO PA. ATM and DNA-PK function redundantly to phosphorylate H2AX after exposure to ionizing radiation[J]. Cancer Research, 2004, 64(7): 2390-2396. |
| [25] | POLO SE, JACKSON SP. Dynamics of DNA damage response proteins at DNA breaks: a focus on protein modifications[J]. Genes & Development, 2011, 25(5): 409-433. |
| [26] | WALKER M, BLACK EJ, OEHLER V, GILLESPIE DA, SCOTT MT. Chk1 C-terminal regulatory phosphorylation mediates checkpoint activation by de-repression of Chk1 catalytic activity[J]. Oncogene, 2009, 28(24): 2314-2323. |
| [27] | ZHAO H, PIWNICA-WORMS H. ATR-mediated checkpoint pathways regulate phosphorylation and activation of human Chk1[J]. Molecular and Cellular Biology, 2001, 21(13): 4129-4139. |
| [28] | KASAHARA K, GOTO H, ENOMOTO M, TOMONO Y, KIYONO T, INAGAKI M. 14-3-3gamma mediates Cdc25A proteolysis to block premature mitotic entry after DNA damage[J]. The EMBO Journal, 2010, 29(16): 2802-2812. |
| [29] | GUERVILLY JH, RENAUD E, TAKATA M, ROSSELLI F. USP1 deubiquitinase maintains phosphorylated CHK1 by limiting its DDB1-dependent degradation[J]. Human Molecular Genetics, 2011, 20(11): 2171-2181. |
| [30] | SATOH MS, LINDAHL T. Role of poly(ADP-ribose) formation in DNA repair[J]. Nature, 1992, 356(6367): 356-358. |
| [31] | NASCIMENTO R, COSTA H, PARKHOUSE RME. Virus manipulation of cell cycle[J]. Protoplasma, 2012, 249(3): 519-528. |
| [32] | LIU J, ZHANG C, HU WW, FENG ZH. Tumor suppressor p53 and metabolism[J]. Journal of Molecular Cell Biology, 2019, 11(4): 284-292. |
| [33] | SIONOV RV, HAUPT Y. The cellular response to p53: the decision between life and death[J]. Oncogene, 1999, 18(45): 6145-6157. |
| [34] | LI FQ, TAM JP, LIU DX. Cell cycle arrest and apoptosis induced by the coronavirus infectious bronchitis virus in the absence of p53[J]. Virology, 2007, 365(2): 435-445. |
| [35] | SU MJ, SHI D, XING XX, QI SS, YANG D, ZHANG JY, HAN YR, ZHU QH, SUN HB, WANG XR, WU HY, WANG MJ, WEI S, LI CQ, GUO DH, FENG L, SUN DB. Coronavirus porcine epidemic diarrhea virus nucleocapsid protein interacts with p53 to induce cell cycle arrest in S-phase and promotes viral replication[J]. Journal of Virology, 2021, 95(16): e0018721. |
| [36] | LEVINE AJ. p53, the cellular gatekeeper for growth and division[J]. Cell, 1997, 88(3): 323-331. |
| [37] | SHIEH SY, IKEDA M, TAYA Y, PRIVES C. DNA damage-induced Phosphorylation of p53 alleviates inhibition by MDM2[J]. Cell, 1997, 91(3): 325-334. |
| [38] | DIRIL MK, RATNACARAM CK, PADMAKUMAR VC, DU TH, WASSER M, COPPOLA V, TESSAROLLO L, KALDIS P. Cyclin-dependent kinase 1 (Cdk1) is essential for cell division and suppression of DNA re-replication but not for liver regeneration[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(10): 3826-3831. |
 2024, Vol. 64
2024, Vol. 64