中国科学院微生物研究所,中国微生物学会
文章信息
- 许慧鑫, 刘芸芸, 祁馨宇, 唐琦, 李国辉. 2023
- XU Huixin, LIU Yunyun, QI Xinyu, TANG Qi, LI Guohui.
- 家蚕核型多角体病毒BmNPV泛素基因缺失显著降低病毒增殖效率
- The absence of ubiquitin gene reduces the proliferation efficiency of Bombyx mori nucleopolyhedrovirus (BmNPV)
- 微生物学报, 63(7): 2909-2920
- Acta Microbiologica Sinica, 63(7): 2909-2920
-
文章历史
- 收稿日期:2022-12-07
- 网络出版日期:2023-02-26
细胞内主要有2条蛋白质降解途径,一条是通过细胞自噬对包裹在膜泡里的蛋白质进行降解;另一条是泛素-蛋白酶体系统(ubiquitin- proteasome system, UPS)降解途径,在泛素酶1 (E1)、泛素转移酶2 (E2)和泛素连接酶3 (E3)的级联催化作用下,泛素分子可以偶联到靶蛋白赖氨酸残基位点上,形成单泛素化和多聚泛素化的蛋白质翻译后修饰方式,泛素化的靶蛋白随后能被26S蛋白酶体识别并发生降解[1-2]。
泛素的功能在哺乳动物中已经得到广泛的解析,胞内众多的蛋白质以动态性的方式发生单泛素化或者多泛素化,泛素化发生位点也各有不同,从而调控蛋白质的稳定性、亚细胞定位及其生物功能。现有的证据表明,泛素与细胞周期控制、细胞凋亡、蛋白质转运、信号途径、DNA损伤修复、疾病发生和发展都密切相关[3-4]。泛素化修饰在调控蛋白质的稳定性和半衰期、及时清理胞内一些无功能的蛋白质过程中起重要的作用,由此可见,维持胞内蛋白质合成和降解之间的动态平衡与个体正常生长、发育直接相关。
泛素化在病毒增殖过程中是一把双刃剑,宿主细胞利用泛素化对病毒靶蛋白进行降解,限制病毒增殖;另一方面,病毒能操纵泛素-蛋白酶体系统来降解胞内的限制因子,从而促进病毒增殖[5]。一些病毒蛋白发生泛素化修饰后被降解,包括甲型流感病毒编码的NP蛋白、M2蛋白和PB1蛋白,登革热病毒编码的NP蛋白和疱疹病毒等病毒编码的一些蛋白通过泛素化修饰发生降解[5]。已有文献报道,蛋白质泛素化修饰在病毒去衣壳、病毒DNA复制、基因转录、子代病毒粒子组装、囊膜包裹及子代病毒粒子释放等多个阶段中都具有重要作用,蛋白质泛素化也能调控宿主抗病毒免疫反应[5-7]。然而,不管是宿主蛋白质还是病毒蛋白质,它们都是利用宿主编码的泛素作为蛋白质翻译后修饰的底物。病毒编码的泛素是否具有相似的功能仍不清楚,病毒编码的泛素被用作蛋白质翻译后修饰的底物来源也鲜有报道。
几乎所有的鳞翅目昆虫病毒都编码泛素分子,杆状病毒泛素与真核生物泛素序列有75%的一致性,1995年,Guarino等[8]首次发现病毒泛素分子定位于苜蓿银纹夜蛾核多角病毒(Autographa californica nucleopolyhedrovirus, AcMNPV)出芽型病毒(budded virus, BV)颗粒上,泛素与BV囊膜内部的糖基磷脂酰肌醇发生共价偶联,表明病毒编码的泛素与病毒粒子的结构组装相关。AcMNPV编码的泛素基因缺失后,BV芽生型子代病毒粒子的产量会降低到原来的1/5–1/10,推测病毒编码的泛素可能参与病毒颗粒的形成。此外,AcMNPV编码的泛素基因的生化实验结果表明,杆状病毒编码的泛素可能在病毒复制中起作用,以阻止宿主降解途径对短寿命蛋白质的破坏[9]。家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus, BmNPV)编码的泛素蛋白的氨基酸序列与AcMNPV编码的几乎完全相同,Katsuma等[10]对BmNPV泛素蛋白进行研究时发现,BmNPV基因组中缺失泛素基因后,未观察到任何表型缺陷,与AcMNPV编码的泛素基因功能不同。
BmNPV是一种囊膜包裹的DNA双链病毒,该病毒对家蚕的传染性很强,感染该病毒的家蚕会罹患血液型脓病。1999年,Gomi等[11]完成了BmNPV的基因组序列测序和分析,其基因组大小为80–180 kb,编码大约100–200个基因,其基因功能已经得到广泛注释,这些功能解析为深入了解病毒侵染、DNA复制、核衣壳组装、病毒粒子释放及与宿主之间的博弈提供科学依据[12]。BmNPV orf26基因编码一个理论序列长度为77个氨基酸的泛素,其在病毒增殖过程中的具体功能仍不清楚,为此,本研究构建泛素基因缺失的重组病毒以及融合有flag标签的泛素补回型重组病毒,检测了这些重组型病毒对家蚕卵巢细胞(BmN)增殖的影响,研究结果为阐明泛素在BmNPV增殖中的具体作用提供了实验依据。
1 材料与方法 1.1 材料 1.1.1 质粒、菌种、病毒HTB-Pie1-EGFP和pUC118-Cm质粒由本实验室构建并保存。BmNPV Bacmid由日本静冈大学Enoc Y. Park博士惠赠,BmNPV Ub缺失的Bacmid (Bm-bacmidUbKO)由本实验室构建并保存。pMON14272大质粒(即BmNPV Bacmid)、pMON7124 (提供转座酶的辅助质粒)和pBAD- gbaA (提供同源重组酶的质粒)均保存于本实验室大肠杆菌(Escherichia coli)菌株DH10Bac中。
1.1.2 试剂和抗体VP39抗体来源于中科院武汉病毒所胡志红教授惠赠、GP64单克隆抗体购自Abcam公司;卡那霉素、氨卞青霉素购自Sigma公司;限制性内切酶BamH I、EcoR I、Xho I、T4 DNA连接酶、rTaq酶和pMD19-T载体、5000 bp DNA Ladder Marker购自TaKaRa公司;质粒提取和胶回收试剂盒购自Omega公司;蛋白质预染Marker购自南京斯博慕生物科技有限公司;兔源的Mcherry抗体购自Proteintech公司;偶联有HRP的羊抗兔二抗购自北京全式金生物技术有限公司;ECL化学发光试剂购自Thermo Fisher公司。
1.2 引物设计与合成设计引物,如表 1中所示。以Ub-US-F和Ub-US-R为引物对,以BmNPV bacmid为模板扩增,PCR产物理论序列长度为565 bp的DNA片段,作为同源重组的上游片段。以Ub-DS-F和Ub-DS-R为引物对,以BmNPV bacmid为模板扩增,PCR产物理论序列长度为524 bp的DNA片段,作为同源重组的下游片段。以Ub-Flag-F和Ub-Flag-R为引物对,以BmNPV bacmid为模板进行PCR扩增,获得的DNA片段含有泛素自身启动子控制的泛素表达盒,且泛素C端融合有flag标签。引物合成和序列测定由生工生物工程(上海)股份有限公司完成。
| Primers | Primer sequence (5′→3′) | Enzyme digestion site | Targeted site |
| Ub-US-F | CCAAGCTTCAATCGGCGTGCGTGTAAC | Hind III | To amplify the 565 bp upstream fragment as a homologous recombination |
| Ub-US-R | AACTGCAGCTTCCAATTGTTTGCCCGC | Pst I | |
| Ub-DS-F | CGGGATCCATGGTGTTACGATTACGAGGAGG | BamH I | To amplify the downstream fragment of 524 bp as a homologous recombination |
| Ub-DS-R | AGGGTACCTCAAGCGACAACGCAGCA | Kpn I | |
| Ub-Flag-F | GGACTAGTTCACTTTAAAATCGTCGTCAGCTTC | Spe I | To obtain the DNA fragment containing the ubiquitin expression cassette controlled by its own promoter |
| Ub-Flag-R | TACTCGAGTTACTTATCGTCGTCATCCTTGTAATCATACCCTCCTCGTAATCGTAACACC | Xho I | |
| Cm-F | GGATCCCTTCGAATAAATACCTGTGA | BamH I | To amplify Cm fragments for homologous recombination |
| Cm-R | CTGCAGAACCAGCAATAGACATAAGC | Pst I | |
| M13-F | GTTTTCCCAGTCACGAC | In order to verify the fragments of homologous recombination | |
| M13-R | CAGGAAACAGCTATGAC | ||
| GP64-F | ATCTGCAGATGCTACTAGTAAATCAGT | Pst I | To amplify 1 700 bp of GP64 DNA fragment for qPCR |
| GP64-R | TACTCGAGTTAATATTGTCTACTATTACG | Xho I | |
| qGP64-F | CGATGCGGCGTTTCTAC | For qPCR | |
| qGP64-R | GTTGCCCTCAGCGTCCA | ||
| Underlined letters indicate restriction enzyme digestion sites. | |||
1.3 重组质粒pUC118-US-Cm-DS、HTB- Pie1-EGFP-PUb-Ub-flag的构建和BmNPV泛素基因的敲除
分别以Ub-US-F和Ub-US-R、Ub-DS-F和Ub-DS-R为引物对,从bacmid中扩增用于同源重组的上游片段US和下游片段DS,依次通过酶切连接的方法与经过同样双酶切的pUC118-Cm进行连接,产生重组质粒pUC118-US-Cm-DS。对pUC118-US-Cm-DS进行Hind III和Kpn I双酶切,回收得到三联体片段US-Cm-DS。将1 μg回收的US-Cm-DS片段电击转化DH10B感受态细胞,进行多轮PCR鉴定。将Ub-Flag-F和Ub-Flag-R从Bm-bacmid扩增的产物进行Spe I和Xho I双酶切,将回收的酶切产物与经同样双酶切的载体HTB-Pie1-EGFP进行连接,转化后进行鉴定,将鉴定正确的重组质粒命名为HTB-Pie1-EGFP-PUb-Ub-flag。
1.4 三种重组质粒BmWT-GFP、BmUbKO-GFP和BmUbRep-GFP的构建为便于观察泛素基因缺失对病毒增殖的影响,参照Li等[13]的方法构建3种重组质粒BmWT-GFP、BmUbKO-GFP和BmUbRep-GFP。在转座酶的作用下,将质粒HTB-Pie1-EGFP分别对BmWT和BmUbKO进行转座,将绿色荧光蛋白表达盒定点引入到Bm-bacmid转座位点构建BmWT-GFP和BmUbKO-GFP。另外,将HTB-Pie1-EGFP-PUb-Ub-flag转座Bm-bacmidUbKO,获得重组质粒Bm-bacmidUbRep-GFP。为获取成功转座的重组bacmid,通过蓝白斑筛选,对平板上的白斑进行PCR鉴定。以BmWT-GFP、BmUbKO-GFP和BmUbRep-GFP为模板,利用M13-F/M13-R引物对其进行PCR扩增,理论上以BmWT为模板的PCR扩增产物为283 bp,电泳结果与理论预期相符。分别以M13-F/M13-R和ie1-F/EGFP-R为引物对,以BmWT-GFP和BmUbKO-GFP为模板,扩增产物长度大约为3 600 bp和1 200 bp,电泳结果与预期相符。以BmUbRep-GFP为模板,引物对M13-F/M13-R、ie1-F/EGFP-R、M13-F/Ub-flag-R和Ub-flag-F/M13-R扩增产物长度与理论序列均完全一致。
1.5 Western blotting分析分别收集重组病毒BmNPV-Pie1-Mcherry、BmNPV-Pie1-Mcherry-Ub和BmNPV-Pie1-Ub- Mcherry感染后的BmN细胞总蛋白,蛋白浓度测定按照BCA Protein Assay Kit (Pierce)使用说明进行,每个泳道蛋白上样量为30 μg,对转膜后的蛋白进行Western blotting分析,由于BmNPV编码的泛素N端或者C端都融合有Mcherry,利用兔源的Mcherry抗体(Proteintech, 26765-1-AP)进行孵育,偶联有辣根过氧化物酶(horseradish peroxidase, HRP)的羊抗兔为二抗(北京全式金生物技术股份有限公司),利用ECL化学发光试剂(Thermo Fisher)对其进行显色。
1.6 qPCR标准曲线的建立由于BmWT-GFP和BmUbKO-GFP中含有GP64基因,为揭示泛素缺失对病毒DNA增殖的影响,利用GP64设计特异性引物对其进行qPCR验证。以Bm-bacmid为模板,利用GP64-F/GP64-R引物对进行PCR扩增,获得一条大小约1 700 bp的GP64靶DNA条带。对该条带进行切胶回收纯化,切胶回收后的扩增片段与pMD19-T载体进行连接,得到标准质粒pMD19T-GP64。根据标准质粒浓度,代入公式:copies/μL=(质粒浓度ng/μL×10–9)×(6.02×1023)/(650×质粒bp),计算出标准质粒的拷贝数。根据拷贝数稀释标准质粒,获得100 μL分子量为1×109的稀释后质粒,并由此进行梯度得到1×108、1×107…….1×102分子量的稀释质粒,利用基于SYBR Green的qPCR来分析得到标准曲线。
1.7 病毒毒力分析参照Li等[14]方法对重组病毒BmWT-GFP、BmUbKO-GFP和BmUbRep-GFP对家蚕半致死时间进行测定,以病毒感染复数(multiplicity of infection, MOI)为1注射306品系五龄家蚕起蚕,利用微量注射器从家蚕第三腹足皮下分别注射3种病毒,每种病毒注射30头,统计每天家蚕死亡头数,实验重复3次。利用SPSS 16.0软件计算各病毒的半数致死时间(median lethal time, LT50)。
2 结果与分析 2.1 BmNPV编码的泛素序列同源比对分析BmNPV编码的泛素只有77个氨基酸,理论分子量为8.6 kDa,为阐明家蚕杆状病毒编码泛素的具体功能,对家蚕杆状病毒编码的泛素序列之间的同源性进行分析。在NCBI网站(https://www. ncbi.nlm.nih.gov)搜寻其同源蛋白,分别为BmNPV (Bombyx mori nucleopolyhedrovirus) NP_047441.1、AcMNPV (Autographa californica nucleopolyhedrovirus) AAA46751.1、AgMNPV (Anticarsia gemmatalis multiple nucleopolyhedrovirus) YP_009316153.1、HcNPV (Hyphantria cunea nucleopolyhedrovirus) UIX56252.1、ApNPV (Antheraea pernyi nucleopolyhedrovirus) YP_611089.1、DapuNPV (Dasychira pudibunda nucleopolyhedrovirus) AKR14208.1、CfMNPV (Choristoneura fumiferana multiple nucleopolyhedrovirus) NP_848337.1、ChocNPV (Choristoneura occidentalis alphabaculovirus) AGR57014.1、ChmuNPV (Choristoneura murinana nucleopolyhedrovirus) YP_008992217.1、EppoMNPV (Epiphyas postvittana nucleopolyhedrovirus) NP_203192.1、DkNPV (Dendrolimus kikuchii nucleopolyhedrovirus) AFS51993.1、CyunNPV (Cyclophragma undans nucleopolyhedrovirus) YP_010086717.1、LoobMNPV (Lonomia obliqua multiple nucleopolyhedrovirus) YP_009666471.1、OxocNPV (Oxyplax ochracea nucleopolyhedrovirus) YP_009666646.1、ThorNPV (Thysanoplusia orichalcea nucleopolyhedrovirus) YP_007250445.1、PaviNPV (Palpita vitrealis nucleopolyhedrovirus) USC25887.1、TraeNPV (Troides aeacus nucleopolyhedrovirus) QCF61045.1、MaviNPV (Maruca vitrata nucleopolyhedrovirus) YP_950754.1、PlxyGV (Plutella xylostella granulovirus) NP_068261.1、HearGV (Helicoverpa armigera granulovirus) YP_001649029.1、SfMNPV (Spodoptera frugiperda multiple nucleopolyhedrovirus) YP_001036416.1和Homo sapiens 4JIO_U。参照Li等[13]的方法,利用Clustal软件和Genedoc软件,对BmNPV编码的泛素(NP_047441.1)与其他昆虫病毒同源蛋白进行多序列比对并对比对结果进行编辑。多序列比对分析结果发现,BmNPV泛素(NP_001153667.1)与AcMNPV泛素(AAA46751.1)完全一致,与其他杆状病毒编码的泛素一致性为78%–99%,表明家蚕杆状病毒编码的泛素蛋白序列高度保守,推测其在病毒增殖过程中起着相同的作用。
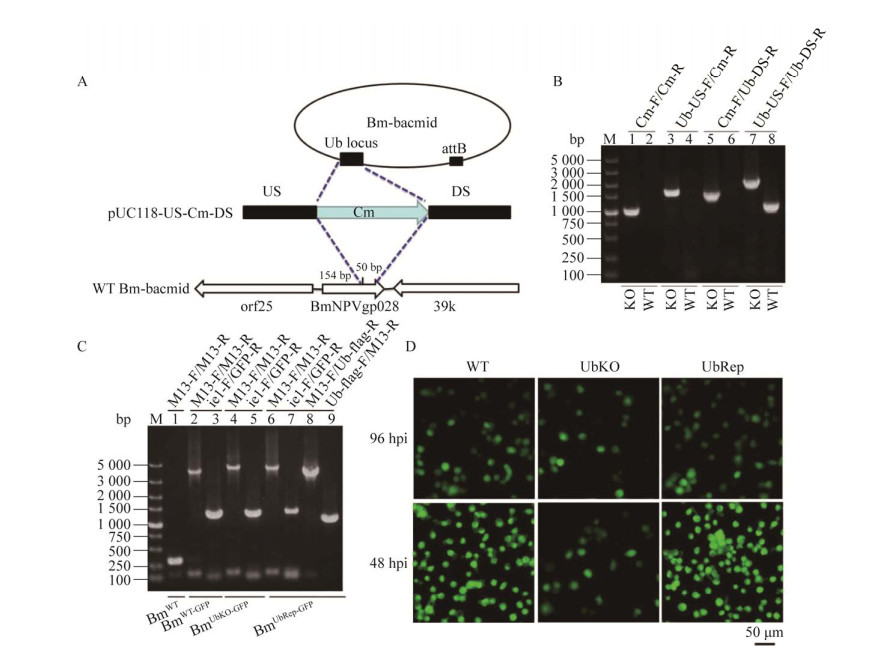
2.2 重组病毒的构建为获得泛素基因缺失的Bm-bacmid (图 1A),通过构建三联体同源片段,在同源重组酶的作用下,利用同源同组的方法将Cm表达盒取代杆状病毒泛素基因中的50 bp,结果如图 1B所示。以Cm-F/Cm-R引物对,分别对缺失型和野生型的Bm-bacmid进行PCR扩增,从缺失型Bm-bacmidUbKO中能扩增到氯霉素表达盒,其长度为1 039 bp的DNA片段;而野生型扩增不到任何片段,扩增结果表明与理论预期一致,表明Cm表达盒已成功替换Bm-bacmidUbKO中的Ub基因特定区域。
|
| 图 1 杆状病毒泛素基因缺失对病毒增殖的影响 Figure 1 Effect of the deletion of BmNPV ubiquitin gene on viral propagation. A: Strategy for the deletion of BmNPV ubiquitin gene by homologous recombination. B: PCR confirmation of ubiquitin-deleted Bm-bacmid by different primer pairs. C: PCR analysis of three recombinant plasmids Bm-bacmids of BmWT-GFP, BmUbKO-GFP and BmUbRep-GFP with different primer pairs. D: Fluorescence micrographs of BmN cells transfected with the three bacmids after transfection 96 hpi, and infected with viruses after infection 48 hpi. |
为进一步确定Cm表达盒成功取代杆状病毒泛素基因中的特定区域,分别以引物对Ub-US-F/Cm-R和Cm-F/Ub-DS-R对野生型和缺失型Bm-bacmid进行PCR扩增,理论上,野生型中无任何DNA扩增产物,缺失型中Ub-US-F/Cm-R扩增产物片段长度为1 604 bp、Cm-F/Ub-DS-R扩增产物长度为1 563 bp,电泳结果与理论预期一致。以Ub-US-F/Ub-DS-R为引物对,分别在缺失型中扩增2 124 bp和野生型中扩增1 139 bp,电泳结果(图 1B)与理论相一致。
为便于观察泛素基因缺失对病毒增殖的影响,在转座酶的作用下,将构建的转座质粒HTB-Pie1-EGFP分别对BmWT和BmUbKO进行转座,将绿色荧光蛋白表达盒定点引入到杆状病毒Bm-bacmid转座位点构建BmWT-GFP和BmUbKO-GFP。另外,将HTB-Pie-EGFP-PUb-Ub-flag转座BmUbKO,获得重组BmUbRep-GFP。为获得发生成功转座的重组bacmid,通过蓝白斑筛选,对平板上的白斑进行PCR鉴定。以BmWT-GFP、BmUbKO-GFP和BmUbRep-GFP为模板,利用M13-F/M13-R引物对其进行PCR扩增,理论上以BmWT为模板的PCR扩增产物为283 bp,电泳结果与理论预期相符。分别以M13-F/M13-R和ie1-F/EGFP-R为引物对,以BmWT-GFP和BmUbKO-GFP为模板,扩增产物长度大约为3 600 bp和1 200 bp,电泳结果与预期相符。以BmUbRep-GFP为模板,引物对M13-F/M13-R、ie1-F/EGFP-R、M13-F/Ub- flag-R和Ub-flag-F/M13-R扩增的DNA产物长度与理论序列都完全一致(图 1C)。
2.3 杆状病毒泛素基因缺失不影响感染性子代病毒粒子的产生通过脂质体转染的方法,分别将构建的3种重组质粒BmWT-GFP、BmUbKO-GFP和BmUbRep-GFP转染BmN细胞,转染96 h后进行绿色荧光显微观察,结果如图 1D所示。泛素缺失型病毒感染的BmN细胞中,绿色荧光信号数量明显少于野生型和补回型病毒感染细胞中的荧光强度,收集转染上清并感染BmN细胞,发现感染后的细胞中也有绿色荧光,荧光信号随着感染时间的延长,荧光信号越来越强。与野生型和补回型病毒相比,泛素缺失型病毒感染的细胞中荧光强度较弱,说明杆状病毒泛素基因缺失抑制病毒的增殖,其与病毒增殖效率相关。
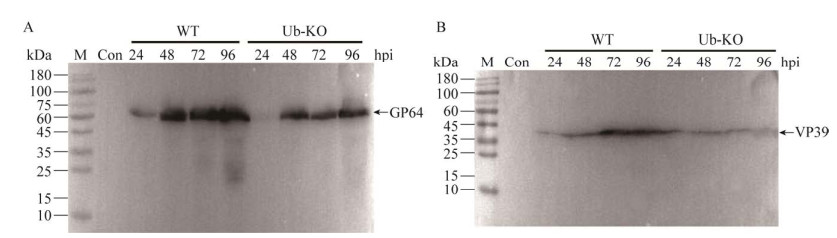
2.4 杆状病毒泛素基因缺失下调病毒结构蛋白的表达为深入研究杆状病毒泛素基因缺失对病毒结构蛋白表达的影响,将相同病毒感染复数(multiplicity of infection, MOI)为5的野生型病毒和泛素缺失型病毒感染BmN细胞,分别收集病毒感染细胞24、48、72、96 h后的细胞样品,每个泳道上样30 μg,对这些样品总蛋白进行Western blotting分析(图 2)。与野生型病毒相比,泛素缺失型的杆状病毒感染后的BmN细胞中,结构蛋白VP39和GP64的表达水平发生显著下调,表明泛素基因缺失抑制病毒结构蛋白的表达水平,影响子代病毒粒子增殖效率,与子代病毒粒子的产量直接相关。
|
| 图 2 杆状病毒泛素基因缺失下调GP64和VP39的表达 Figure 2 Downregulation of the expression of GP64 and VP39 in BmN cells infeted with ubiquitin-deleted virus. A: Western blotting analysis of GP64 from the extract of BmN cells infected with wild type BmNPV and ubiquitin-deleted BmNPV. B: Western blotting analysis of VP39 from the extract of BmN cells infected with wild BmNPV and ubiquitin-deleted BmNPV. |
2.5 qPCR分析泛素缺失对病毒DNA复制的影响
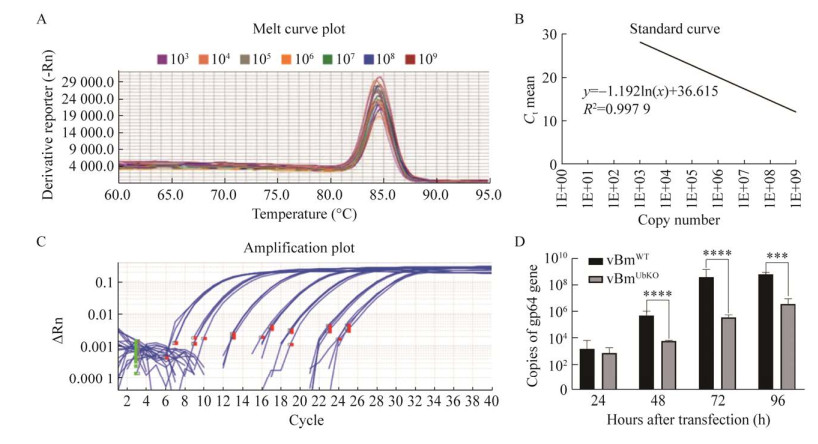
为了确保qPCR的准确性,选取1×109– 1×103 copies/μL对应的7个点构建标准曲线,通过GraphPad软件分析得到标准方程的方程式为:y=–1.192ln(x)+36.615,R2=0.997 9 (图 3B)。并得到标准质粒实时荧光定量PCR (quantitative real-time polymerase chain reaction, qPCR)溶解曲线(图 3A)和扩增曲线(图 3C)。为深入研究泛素缺失型病毒对病毒DNA复制的影响,将MOI为5的野生型病毒和泛素缺失型病毒分别感染BmN细胞,分别收集病毒感染BmN细胞后24、48、72、96 h不同时间点的细胞样品,抽提病毒感染后的细胞总基因组,以引物对qGP64-F/qGP64-R对其进行qPCR分析。如图 3D所示,在感染后24 h,野生型病毒和泛素缺失型病毒的基因组拷贝数差异不显著,而在感染后48、72、96 h,野生型病毒的基因组拷贝数明显高于泛素缺失型病毒的基因组拷贝数(P < 0.001)。
|
| 图 3 qPCR分析泛素缺失对病毒DNA复制的影响 Figure 3 qPCR analysis of ubiquitin deletion on the replication of viral DNA. A: Melt curve plot of PCR. B: Drawing of standard curve of different concentration of GP64. C: Amplication plot of GP64. D: GP64 gene copies in BmN cells infected with BmWT-GFP and BmUbKO-GFP after 24, 48, 72 and 96 hpi, respectively. |
2.6 BmNPV编码的泛素在BmN细胞中的定位分析
在本研究中,用构建的2种重组病毒BmNPV-Pie1-Mcherry-Ub和BmNPV-Pie1-Ub-Mcherry分别感染BmN细胞,对泛素N端和C端分别融合有Mcherry的融合蛋白Mcherry-Ub和Ub-Mcherry进行Western blotting分析,同时对胞内的红色荧光进行荧光显微观察,结果发现:将Mcherry融合在BmNPV泛素N端或C端,对胞内红色荧光信号观察时出现2种完全不同的结果,Mcherry融合在泛素N端,红色荧光主要分布在细胞核中(图 4A),Western blotting分析表明Mcherry融合在泛素N端时主要以融合表达的形式存在(图 4B泳道3、4);而将Mcherry融合在泛素C端时,红色荧光均匀分布在整个细胞中,Western blotting分析表明Mcherry融合在泛素C端时,通过Mcherry抗体检测到的蛋白条带主要是Mcherry自身序列长度,在其上方也显示出一条淡淡的融合有Ub分子的Mcherry融合条带(图 4B泳道5、6),其丰度明显低于融合蛋白Mcherry-Ub的丰度,以BmNPV-Pie1-Mcherry病毒感染的BmN细胞中表达的Mcherry蛋白为对照(图 4B泳道2),说明Ub分子C端融合Mcherry时,会影响Ub-Mcherry融合蛋白的稳定性,Mcherry会从Ub分子C端发生断裂或者酶切,而Ub分子N端融合有Mcherry时,Mcherry-Ub在胞内能够稳定存在。
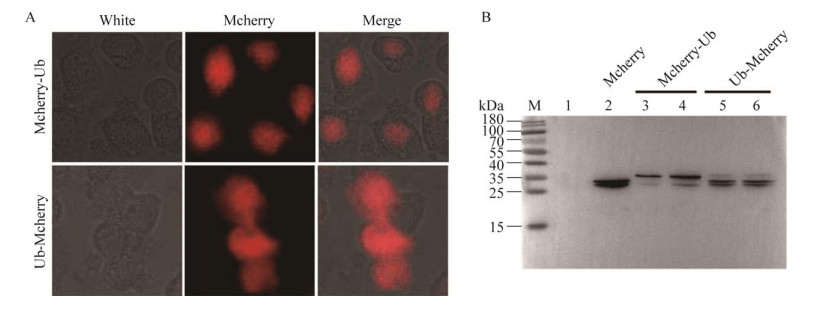
|
| 图 4 BmNPV编码的泛素亚细胞定位分析 Figure 4 Subcellular analysis of BmNPV ubiquitin in virus-infected BmN cells. A: Fluorescence microscopy observation of ubiquitin fusion with Mcherry. B: Western blotting analysis of BmN cells infected with viruses using antibodies against Mcherry. |
2.7 重组病毒毒力生物分析
将重组病毒BmWT-GFP、BmUbKO-GFP和BmUbRep-GFP,MOI为1注射306品种五龄家蚕起蚕,每种病毒注射30头,统计每天家蚕死亡头数,实验重复3次,利用SPSS 16.0软件计算各病毒的半数致死时间(median lethal time, LT50),统计结果如表 2所示,泛素缺失型的重组病毒BmUbKO-GFP较野生型BmWT-GFP相比,延缓家蚕半致死时间15 h。
| Virus | LT50 | 95% fiducial limit (h) | |
| Lower | Upper | ||
| BmUbKO-GFP | 135 | 114.48 | 144.72 |
| BmUbRep-GFP | 118 | 112.16 | 128.24 |
| BmWT-GFP | 120 | 113.28 | 127.20 |
3 讨论与结论
杆状病毒科是目前唯一已知能够编码泛素同源蛋白的一类病毒,杆状病毒BmNPV编码的泛素由77个氨基酸组成,哺乳动物编码的泛素由76个氨基酸组成,它们仅存在1个氨基酸长度的差异,且同源序列比对显示其与哺乳动物编码的泛素分子之间存在76.32%的序列一致性。因此,尽管病毒与哺乳动物之间差异很大,但它们编码的泛素分子之间具有高度同源性,推测NPV泛素分子可能参与蛋白降解和病毒侵染扩增过程。
本研究通过同源重组对BmNPV泛素基因中间序列50 bp进行敲除(图 1A),该基因敲除位点上游保留154 bp、下游位点保留30 bp,缺失序列被Cm表达盒所取代,利用Cm抗性筛选出泛素基因缺失的重组Bm-BacmidUb-KO,由于泛素基因中间序列被外源DNA所替换,基因中间插入一段外源表达盒,尽管从理论上来说插入位点上游还可能发生转录并翻译出一段截短蛋白,但是由于ORF完整性发生破坏,会影响转录因子对其进行识别,从而导致转录破坏。另外,泛素是一个高度保守的小肽,主要对靶蛋白进行翻译后修饰,调控它们的生物活性,而截短后的泛素不能作为泛素修饰底物分子,因此,发生截短的泛素肽链一般不认为具有类似的泛素修饰功能。
在本研究中,为了实验的严谨性,抽提缺失50 bp的泛素缺失型重组病毒vBmUb-KO和野生型病毒BmNPV感染的细胞总RNA,利用RT-PCR对泛素缺失位点上游154 bp进行扩增,结果未扩增到目的条带(结果未显示),而野生型中能扩增到目的条带,表明该50 bp序列缺失后,影响了泛素基因表达盒的完整性,从而导致其不被转录或者转录出来的截短转录本半衰期很短,容易发生降解。
另外,本研究发现泛素缺失后显著降低病毒晚期蛋白GP64和VP39的表达,并减低了子代病毒粒子的增殖效率,也从正面验证了泛素缺失后对病毒增殖的影响。通过转座的方法,构建携带绿色荧光标记的重组病毒,结果发现泛素基因缺失后,在转染和感染的细胞中,都能产生具有感染性的BV病毒粒子,是病毒增殖的非必需基因,但与野生型相比,细胞中的荧光信号明显减少,表明泛素缺失后,子代病毒粒子BV的产量发生显著下降。为深入探究泛素降低子代病毒粒子产量的分子机制,本研究对其在细胞中的定位进行分析,结果发现泛素N端融合有Mcherry的融合蛋白,其主要定位在BmN细胞核中,推测BmNPV编码的泛素能调控病毒基因的转录水平,从而影响病毒蛋白表达和子代病毒粒子的产量。Western blotting结果证实在泛素缺失型病毒感染的细胞中,病毒囊膜蛋白GP64和衣壳蛋白VP39表达水平明显低于野生型。Guarino等[8]发现AcMNPV病毒泛素基因缺失后,并不影响病毒DNA复制和感染性病毒粒子的产生,但会影响病毒粒子结构蛋白上偶联的泛素分子丰度,从而影响病毒粒子结构蛋白的表达水平,进而影响子代病毒粒子的产量。因此,泛素对BmNPV子代病毒粒子产量的影响在某种程度上与Guarino等[8]报道的病毒泛素对AcMNPV子代病毒粒子的影响类似。
2011年,Guo等[15]报道BmNPV和阿米格拉螺旋体核多角体病毒(Helicoverpa armigera nucleopolyhedrovirus, HaNPV)编码的泛素细胞定位模式不同,BmNPV编码的泛素在细胞质和细胞核中都有分布,而HaNPV编码的泛素主要分布在病毒感染的宿主细胞核膜上,表明它们编码的泛素在病毒增殖中具有不同的作用。本研究通过构建融合表达BmNPV泛素和红色荧光蛋白的重组病毒,对BmNPV编码的泛素亚细胞定位进行分析,结果表明Mcherry融合在泛素N端和C端,红色荧光在细胞中的分布情况完全不同(图 4A),Mcherry融合在泛素C端时,Western blotting结果(图 4B泳道5、6)显示泛素会与Mcherry之间发生断裂,因此,该红色荧光只代表Mcherry在细胞中的分布,不能代表泛素分子的亚细胞定位;而Mcherry融合表达在N端时,融合蛋白Mcherry-Ub能稳定地表达在细胞中,荧光显微观察发现红色荧光信号主要定位在细胞核中,与病毒基因的表达调控具有一定的相关性,Western blotting结果(图 2)验证了泛素缺失能下调病毒GP64和VP39基因的表达水平,从而影响子代病毒粒子的产量。泛素定位在细胞核中,对病毒基因的转录和表达起调控作用,影响病毒基因的蛋白水平,尤其是对病毒晚期基因表达调控起重要作用,从而影响子代病毒粒子的产量。另外,为研究泛素缺失的病毒对家蚕的毒力,对野生型病毒和泛素缺失型重组病毒感染后的家蚕半致死时间进行生物统计分析,结果发现泛素基因缺失后延长家蚕半致死时间15 h,表明泛素基因缺失后抑制病毒增殖效率,延缓了家蚕的半致死时间,为深入研究泛素在病毒增殖中的作用提供了实验依据。
| [1] | WANG Y, LE WD. Autophagy and ubiquitin- proteasome system[J]. Advances in Experimental Medicine and Biology, 2019, 1206: 527-550. |
| [2] | GRUMATI P, DIKIC I. Ubiquitin signaling and autophagy[J]. The Journal of Biological Chemistry, 2018, 293(15): 5404-5413 DOI:10.1074/jbc.TM117.000117. |
| [3] | van WIJK SJ, FULDA S, DIKIC I, HEILEMANN M. Visualizing ubiquitination in mammalian cells[J]. EMBO Reports, 2019, 20(2): e46520 DOI:10.15252/embr.201846520. |
| [4] | SHARMA A, KHAN H, SINGH TG, GREWAL AK, NAJDA A, KAWECKA-RADOMSKA M, KAMEL M, ALTYAR AE, ABDEL-DAIM MM. Pharmacological modulation of ubiquitin-proteasome pathways in oncogenic signaling[J]. International Journal of Molecular Sciences, 2021, 22(21): 11971 DOI:10.3390/ijms222111971. |
| [5] | TANG Q. Pleiotropic roles of the ubiquitin-proteasome system during viral propagation[J]. Life Sciences, 2018, 207: 350-354 DOI:10.1016/j.lfs.2018.06.014. |
| [6] | LANGER S, YIN X, DIAZ A, PORTILLO AJ, GORDON DE, ROGERS UH, MARLETT JM, KROGAN NJ, YOUNG JAT, PACHE L, CHANDA SK. The E3 ubiquitin-protein ligase cullin 3 regulates HIV-1 transcription[J]. Cells, 2020, 9(9): 2010 DOI:10.3390/cells9092010. |
| [7] | PROULX J, BORGMANN K, PARK IW. Role of virally-encoded deubiquitinating enzymes in regulation of the virus life cycle[J]. International Journal of Molecular Sciences, 2021, 22(9): 4438 DOI:10.3390/ijms22094438. |
| [8] | GUARINO LA, SMITH G, DONG W. Ubiquitin is attached to membranes of baculovirus particles by a novel type of phospholipid anchor[J]. Cell, 1995, 80(2): 301-309 DOI:10.1016/0092-8674(95)90413-1. |
| [9] | REILLY LM, GUARINO LA. The viral ubiquitin gene of Autographa californica nuclear polyhedrosis virus is not essential for viral replication[J]. Virology, 1996, 218(1): 243-247 DOI:10.1006/viro.1996.0185. |
| [10] | KATSUMA S, TSUCHIDA A, MATSUDA-IMAI N, KANG W, SHIMADA T. Role of the ubiquitin- proteasome system in Bombyx mori nucleopolyhedrovirus infection[J]. The Journal of General Virology, 2011, 92(Pt 3): 699-705. |
| [11] | GOMI S, MAJIMA K, MAEDA S. Sequence analysis of the genome of Bombyx mori nucleopolyhedrovirus[J]. The Journal of General Virology, 1999, 80(Pt 5): 1323-1337. |
| [12] | ONO C, KAMAGATA T, TAKA H, SAHARA K, ASANO SI, BANDO H. Phenotypic grouping of 141 BmNPVs lacking viral gene sequences[J]. Virus Research, 2012, 165(2): 197-206 DOI:10.1016/j.virusres.2012.02.016. |
| [13] | LI GH, QI XY, CHEN HQ, HU ZY, CHEN FY, DENG L, GUO ZJ, CHEN KP, TANG Q. The motif of 76KRKCSK in Bm65 is an efficient nuclear localization signal involved in production of infectious virions[J]. Frontiers in Microbiology, 2019, 10: 2739 DOI:10.3389/fmicb.2019.02739. |
| [14] | LI GH, LI MM, XU W, ZHOU Q, HU ZY, TANG Q, CHEN KP, YAO Q. Regulation of BmBDV NS1 by phosphorylation: impact of mutagenesis at consensus phosphorylation sites on ATPase activity and cytopathic effects[J]. Journal of Invertebrate Pathology, 2016, 133: 66-72 DOI:10.1016/j.jip.2015.12.006. |
| [15] | GUO ZJ, ZHU YM, LI GH, CHEN KP, ZHANG CX. Ubiquitins of Bombyx mori nucleopolyhedrovirus and Helicoverpa armigera nucleopolyhedrovirus show distinct subcellular localization in infected cells[J]. Acta Virologica, 2011, 55(2): 101-106 DOI:10.4149/av_2011_02_101. |
 2023, Vol. 63
2023, Vol. 63