中国科学院微生物研究所,中国微生物学会
文章信息
- 孙雅洁, 王梦男, 路建平, 耿榕悦, 张宝刚. 2023
- SUN Yajie, WANG Mengnan, LU Jianping, GENG Rongyue, ZHANG Baogang.
- 天然Fe(Ⅱ)矿物-生物质强化微生物还原固定五价钒研究
- Microbial reduction and fixation of pentavalent vanadium enhanced by natural Fe(Ⅱ) mineral-biomass
- 微生物学报, 63(6): 2220-2232
- Acta Microbiologica Sinica, 63(6): 2220-2232
-
文章历史
- 收稿日期:2023-05-06
- 网络出版日期:2023-06-04
钒是一种过渡金属,广泛存在于地壳中,在化学元素周期表中位于第四周期VB族[1]。钒因其优异性能被广泛应用于炼钢、药业加工、催化剂和颜料的生产等工业领域[2]。随着钒在工业中的应用增加,随之产生大量的含钒废水进入土壤和地下水环境,造成严重污染[3]。美国环境保护局关于钒的参考浓度表明,每天暴露在超过21 ppb的钒水平下可能会对人体健康产生负面影响[4]。钒在自然界中一般以+2、+3、+4和+5四种价态存在,其迁移性和毒性随着价态的升高而升高,五价钒[pentavalent vanadium, V(V)]毒性最强[5]。微生物介导的V(V)去除被认为是一种有前途的修复策略,可将V(V)转化为毒性较小的四价钒[tetravalent vanadium, V(IV)]沉淀[6-8]。
微生物还原V(V)是一个复杂的生物过程,需要通过微生物细胞呼吸作用(电子传递)以及在各种酶的协同作用下完成[9]。在此过程中V(V)作为末端电子受体,同时需要电子供体,在酶和细胞色素等物质的作用下进行电子传递,最终完成氧化还原过程[10]。可支持微生物还原V(V)的电子供体多种多样,异养微生物可以利用有机碳源作为电子供体,自养微生物则是以无机物作为电子供体。
天然Fe(Ⅱ)矿物是一种新兴的处理污染物的材料。根据之前的研究,Fe(Ⅱ)矿物本身可以通过非生物途径化学还原地下水中的V(V),表明在含Fe(Ⅱ)矿物的自然环境中,也发生着V(V)的还原解毒[11]。然而,Fe(Ⅱ)矿物在环境中极容易发生氧化钝化,反应生成的Fe(Ⅲ)氧化物会覆盖在矿物表面阻碍电子传递,致使反应停止[12]。相比于Fe(Ⅱ)的化学氧化,微生物与Fe(Ⅱ)矿物间相互作用具有明显的优势,环境中的某些自养化能微生物可以利用矿物表面的Fe(Ⅱ)或S(–Ⅱ),从而加速矿物的氧化溶解,使矿物具有较高的生物活性,还可以通过溶解部分沉淀物以减轻钝化[13]。天然生物质碳源不溶于水,释放速率受表面生物膜限制而具有缓释性,在持续提供碳源的同时还可以为微生物提供附着载体,有利于V(V)生物还原过程的进行。另一方面,混养微生物体系中,自养菌和异养菌可有效协同进一步提高污染物去除效率。自养菌可合成有机质,供异养菌利用,而异养菌放出的二氧化碳可供自养菌利用[14]。然而,天然矿物和生物质强化促进微生物菌群还原固定V(V)的特征尚未揭示。
基于以上研究基础,本研究选取具有还原特性的天然Fe(Ⅱ)矿物和天然生物质,并利用厌氧沉积物构建微生物群落,探究V(V)在上述体系中的还原规律。另外在此基础上,将优选的材料进行复配组合,探究混养生物体系中V(V)的还原过程。最后,利用16S rRNA基因测序技术,探索了微生物群落演替特征,以充分理解自养、异养和混养微生物群落的差异以及V(V)生物还原解毒的机制。
1 材料与方法 1.1 天然Fe(Ⅱ)矿物自养体系V(V)微生物还原实验四种天然Fe(Ⅱ)矿物,即磁铁矿(Fe3O4)、黄铁矿(FeS2)、磁黄铁矿(Fe1–xS)和菱铁矿(FeCO3)购自中国广州。图 1显示了矿物的结构。将4种矿物研磨并过筛以获得直径约1 mm的颗粒备用。
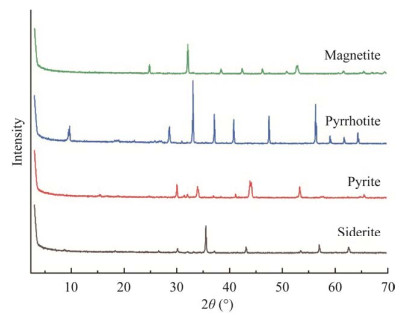
|
| 图 1 X射线衍射(XRD)分析四种Fe(Ⅱ)矿物的结构 Figure 1 X-ray diffraction (XRD) analysis of the structures of four Fe(Ⅱ) minerals. |
在生物反应器中,将天然5 g Fe(Ⅱ)矿物、20 g厌氧沉积物样品与200 mL模拟合成地下水混合,模拟合成地下水由以下成分组成:CaCl2 0.246 g/L,MgCl2·6H2O 1.057 2 g/L,NaCl 0.445 9 g/L,KCl 0.028 3 g/L,NaHCO3 0.808 2 g/L,NH4Cl 0.155 7 g/L,KH2PO4 0.029 9 g/L[15]。V(V)以NaVO3 (上海阿拉丁生化科技股份有限公司)的形式加入到合成地下水中,初始浓度为50 mg/L,此浓度考虑了人为污染地下水中的高钒特征,如中国河北省潮北河地区和美国奇斯曼溪地下水中的V浓度超过11 mg/L和58.6 mg/L[13]。为了保持厌氧环境,生物反应器用氮气吹扫20 min,然后用丁基橡胶塞子依次密封生物反应器。所有的实验均在室温条件下进行,并用铝箔包裹避光。
实验共设置了2组反应器,分别为实验组和对照组。生物组反应器分别为:(1) 磁铁矿+厌氧沉积物;(2) 黄铁矿+厌氧沉积物;(3) 磁黄铁矿+厌氧沉积物;(4) 菱铁矿+厌氧沉积物。对照组反应器分别为:(1) 单独添加磁铁矿;(2) 单独添加黄铁矿;(3) 单独添加磁黄铁矿;(4) 单独添加菱铁矿;(5) 单独添加沉积物。各个反应器一式三份。
1.2 天然生物质异养体系V(V)微生物还原实验选用4种常见的农业废弃物(木屑、稻壳、玉米芯和大豆秸秆)作为天然生物质,比较其去除V(V)的性能。图 2显示了4种生物质的傅立叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)图谱。其中,波数在1 200– 1 190 cm–1为C–O伸缩振动,1 430–1 390 cm–1为O–H和C–H弯曲振动,1 600–1 560 cm–1为C=C伸缩振动,以上官能团均具有较强吸收峰,是组成生物质中烷烃类、酚和醇等有机化合物的主要官能团[16]。以上材料均采购于江苏省东海县某农村,保证所选实验材料来自同一地区。
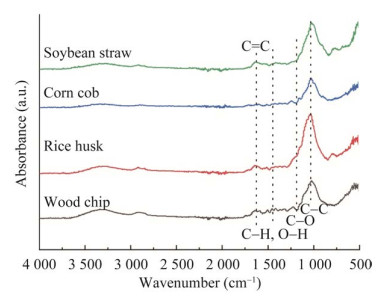
|
| 图 2 四种生物质的FTIR图谱 Figure 2 FTIR maps of four types of biomass. |
生物反应器的构建与1.1相同,每组加入5 g生物质。实验共设置了2组反应器,分别为实验组和对照组。实验组反应器分别为:(1) 木屑+厌氧沉积物;(2) 稻壳+厌氧沉积物;(3) 玉米芯+厌氧沉积物;(4) 大豆秸秆+厌氧沉积物。对照组反应器分别为:(1) 单独添加木屑;(2) 单独添加稻壳;(3) 单独添加玉米芯;(4) 单独添加大豆秸秆;(5) 单独添加沉淀物。各个反应器一式三份。
1.3 Fe(Ⅱ)矿物和生物质复配混养体系V(V)微生物还原实验在1.1和1.2的基础上,将优选的天然Fe(Ⅱ)矿物(磁黄铁矿)与生物质(木屑)组合复配,强化生物反应器的去除性能。生物反应器的构建与前文相同,按照矿物与木屑复配的不同比例,生物反应器可分为4组,分别为2:1、1:1、1:2和1:3。各个反应器一式三份。保持反应器在各自条件下稳定运行,每个周期为8 d,周期结束时更换合成地下水。
1.4 理化性质分析所有含水样品在分析前通过0.22 μm过滤器进行预处理。使用紫外分光光度计(Techcomp)在波长510 nm处测定V(V)的浓度[17]。通过电感耦合等离子体质谱法(ICP-MS, Thermo Fisher)测定溶解的总V的浓度。SO42–的测量通过阴离子色谱仪(Metrohm)测定。产生的沉淀物的形态和成分通过具有能量色散X射线(energy-dispersive X-rays, EDS)的扫描电子显微镜(scanning electron microscope, SEM, Hitachi)进行检测。通过X射线光电子能谱(XPS, Kratos)分析产生的沉淀物价态。沉积物样品中含铁矿物相和表面铁物种在反应过程中的变化通过X射线衍射(XRD, Rigaku)进行表征。利用傅立叶变换红外光谱(FTIR) (Thermo)对使用前后的木屑进行有机物表征。
1.5 微生物分析从接种物和不同操作生物反应器中采集微生物样本。根据制造商的说明,使用FastDNA® SPIN试剂盒(Arup)提取微生物DNA。使用PCR引物515F和806R扩增细菌和古细菌16S rRNA基因。所得DNA用于在MiSeq平台(Illumina)进行高通量16S rRNA基因测序,平台由Majorbio Technology (上海)提供。使用FLASH和Trimmomatic对获得的序列进行质量控制。使用QIIME对原始数据进行过滤和分析,通过UCHIME删除嵌合序列。通过UPARSE聚类操作分类单元(operational taxonomic unit, OTU) (97%相似性)。根据RDP分类器和Greengene数据库进行16S rRNA基因序列分类。将原始序列数据提交到NCBI数据库。
2 结果与讨论 2.1 Fe(Ⅱ)矿物和天然生物质的优选在收集数据之前,生物反应器已稳定运行2个月,耗尽接种沉积物中的有机质,并驯化微生物群落。在Fe(Ⅱ)矿物筛选的所有周期(图 3A),磁黄铁矿、黄铁矿、菱铁矿和磁铁矿对V(V)的平均去除效率分别为54.2%±3.4%、49.9%±4.9%、47.5%±3.8%和41.8%±4.6%。结果表明磁黄铁矿对V(V)去除效率最高。与菱铁矿和磁铁矿相比,磁黄铁矿含有的S(–Ⅱ)也可以氧化为V(V)还原提供电子,同时其具有硫化物的特征,表现出更高的还原反应活性及生物可利用性[18-19]。尽管黄铁矿也包含还原性硫物种,但其结晶度高,在厌氧条件下不容易接受电子,生物利用度较低[20]。因此,本研究最终选择磁黄铁矿作为构建生物系统还原V(V)过程中的电子供体。另外,单独添加矿石及单独添加沉积物的对照组反应器经过3个周期之后,对于V(V)几乎没有去除,表明微生物能够利用Fe(Ⅱ)矿石作为电子供体还原V(V)。根据先前的研究,矿石钝化会阻塞表面反应位点,抑制电子转移过程[21]。而微生物活动可以通过溶解部分沉淀物使矿物表面活性反应位点再生,从而使氧化还原反应继续进行。
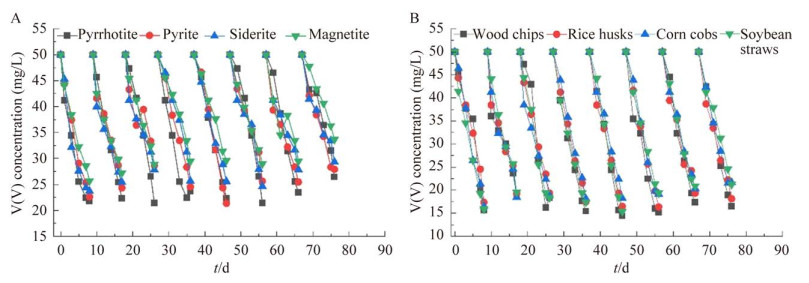
|
| 图 3 不同生物体系中V(V)的浓度变化 Figure 3 Variation of V(V) concentration in different systems. A:四种Fe(Ⅱ)矿石. B:四种天然生物质 A: Four Fe(Ⅱ) minerals. B: Four natural biomasses. |
在4种生物质优选的所有周期(图 3B),木屑、稻壳、玉米芯和大豆秸秆对V(V)的去除效率分别为67.1%±3.1%、64.1%±2.5%、62.2%±3.1%和63.0%±4.3%,其中,木屑对V(V)有更好的去除效果。而对照组反应器中没有检测到V(V)浓度的降低,表明生物质能够被微生物所利用还原V(V),这与先前的研究结果一致[7]。木屑是一种具有碳释放性的固体碳源,其主要成分为纤维素、半纤维素等,异养微生物可利用纤维素降解菌的分解产物进行V(V)还原。木屑不溶于水,碳源释放速率受表面生物膜限制而具有缓释性,可以避免反复投加,降低投加量引起水质波动的风险,其在提供碳源的同时还可以为微生物提供附着载体,有利于V(V)的生物还原过程的进行[22]。据报道,木屑也被用于重金属U(Ⅵ)的去除[23]和生物反硝化[24],并且因其成本低廉、可生物降解等优势而日益成为研究热点。另外,相比于可溶性有机碳(甲醇、乙酸等),木屑不会造成地下水污染以及水质明显波动等问题,在修复方面有更为广阔的应用前景。
2.2 混养体系中V(V)生物协同去除根据上述研究结果,将优选磁黄铁矿与木屑组合复配构建混养体系。图 4A为磁黄铁矿与木屑复配体系中8个连续操作周期V(V)的浓度变化。在最后一个周期,不同复配比的磁黄铁矿和木屑(2:1、1:1、1:2和1:3)对于V(V)的去除率分别为66.2%±3.0%、70.6%±6.6%、77.4%±2.9%和82.7%±3.1%。当矿石与木屑质量比为1:3时V(V)的去除效果相对较好。结果表明混养生物体系相比于单独的自养或异养生物体系对V(V)具有更高的去除效率。在混养体系中,自养和异养细菌存在耦合协同关系,可使微生物群落结构更加稳定、微生物多样性增加。此外也有报道称,铁矿物的添加会加速细胞间的电连接,铁矿物可代替c型细胞色素作为电连接成分参与直接种间电子转移[25-26]。
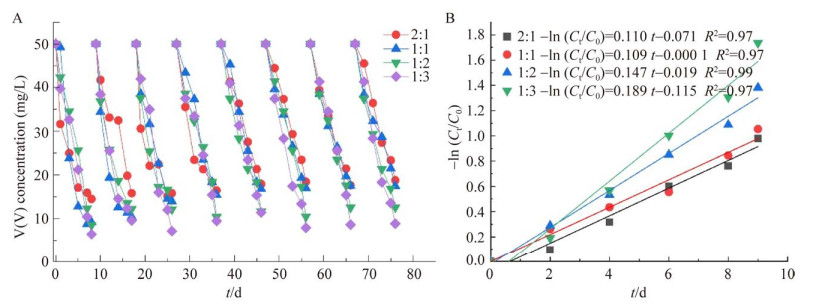
|
| 图 4 磁黄铁矿与木屑复配混养体系 Figure 4 Mixed system of pyrrhotite and wood chips compounding. A:V(V)的浓度变化. B:V(V)浓度变化的伪一级动力学拟合 A: Concentration variation of V(V). B: Pseudo first-order kinetic fitting of concentration variation of V(V). |
另外,4种复配组合下V(V)的去除过程可用伪一级动力学来描述(图 4B)。该方程如式(1)所示。
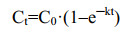
|
公式(1) |
利用式(1),得到4种不同的磁黄铁矿与木屑复配反应器的V(V)的伪一级动力学方程,磁黄铁矿与木屑复配质量比为1:3的反应器中V(V)的伪一级动力学速率常数为0.189/d,高于质量比1:2 (0.147/d)、2:1 (0.110/d)和1:1 (0.109/d),结果也进一步验证,磁黄铁矿与木屑复配质量比为1:3时,对V(V)有更好的去除效果。
2.3 产物形态分析在混养体系中,图 5A和5C均观测到微生物附着于木屑和磁黄铁矿表面,并且其表面也因被微生物利用和腐蚀而变得十分粗糙。EDS元素分析(图 5B、5D)均发现沉淀物中含有钒元素。图 6A中沉淀物的V 2p的XPS分析结果显示,在515.8 eV处出现特征峰,与先前He等[13]得到的V(IV)析出相吻合良好,进一步证明了固相V(IV)是V(V)还原的主要产物。
|
| 图 5 磁黄铁矿与木屑复配体系中沉淀物表征 Figure 5 Characterization of precipitates in the complex system of pyrrhotite and wood chips. A:矿物表面SEM图像. B:沉淀物(红色箭头) EDS谱图. C:木屑表面SEM图像. D:沉淀物(红色箭头) EDS谱图 A: SEM image of mineral surface. B: EDS spectrum of precipitates (red arrows). C: SEM image of wood chip surface. D: EDS spectrum of precipitates (red arrows). |
在生物反应器运行过程中,未检测到可溶性铁的存在。EDS谱图显示,沉淀物中存在铁元素。图 6B中Fe 2p的XPS分析结果显示,存在Fe(Ⅱ)及Fe(Ⅲ)的特征峰[27-28],进一步表明磁黄铁矿中Fe(Ⅱ)被氧化为Fe(Ⅲ)。XRD图中也显示了与FeO(OH)相关的Fe(Ⅲ)特征峰(图 6C)。同时,EDS谱图也在固体析出物中检测到元素硫,在S 2p的XPS谱中存在SO42–、S0、S2–的特征峰,表明磁黄铁矿中的硫经生物反应后主要转化为SO42–和S0的形式[28]。值得注意的是,S0还可以进一步作为电子供体来驱动V(V)的去除[13, 29],用于延长磁黄铁矿去除V(V)的可用性。XRD结果显示反应后磁黄铁矿仍是主要矿物相,FTIR图谱存在多个吸收峰(图 6D),在1 032 cm–1、1 319 cm–1、1 370 cm–1处的峰被认为是纤维素,在1 421 cm–1、1 591 cm–1处的峰与结晶纤维素有关[30]。反应后木屑相关的吸收峰强度降低,结合SEM图像观测结果(图 5C),推测微生物利用木屑参与了V(V)还原过程[31]。

|
| 图 6 磁黄铁矿与木屑复配体系表征 Figure 6 Characterization of the complex system of pyrrhotite and wood chips. A:沉淀物V 2p的XPS能谱. B:沉淀物中Fe 2p和S 2p的XPS能谱. C:反应前后磁黄铁矿的XRD图谱. D:反应前后木屑的FTIR光谱 A: XPS energy spectrum of precipitates V 2p. B: XPS energy spectrum of Fe 2p and S 2p in precipitates. C: XRD patterns of pyrrhotite before and after the reaction. D: FTIR spectra of woodchips before and after the reaction. |
2.4 微生物群落分析
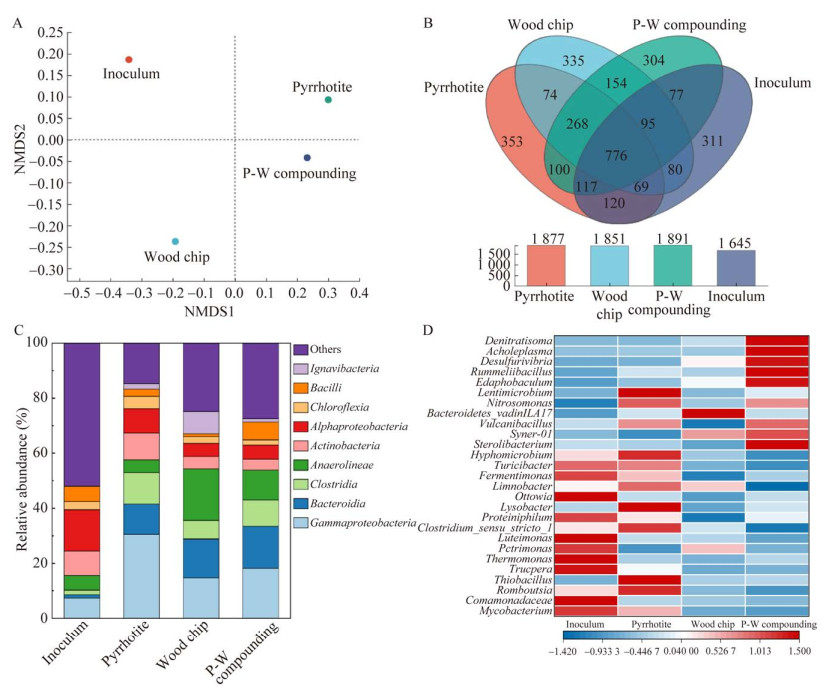
基于OTU水平的非度量多维标度(non-metric multidimensional scale, NMDS)分析显示,磁黄铁矿自养体系、木屑异养体系、混养体系微生物群落及原始接种物的微生物群落结构之间均存在显著差异(图 7A),表明不同电子供体和V(V)的存在对微生物群落组成产生明显影响。自养微生物体系与混养微生物体系距离较近,推测磁黄铁矿的添加有利于微生物群落结构的稳定。Venn图显示了原始接种物和不同营养类型的微生物群落的差异性和同质性(图 7B)。原始接种物和不同营养类型的微生物群落中分别发现1 645、1 877、1 851和1 891个OTUs,而所有培养阶段共有的OTUs共776个。所有组共有的OTUs的存在意味着具有清除V(V)能力的细菌在所使用的生物反应器中持续存在。
|
| 图 7 原始接种物和不同营养类型的微生物群落结构 Figure 7 Microbial community structure of original inoculum and different trophic types. A:微生物群落分布的非度量多维标度(NMDS)图. B:微生物丰富度维恩(Venn)图. C:纲水平相对丰度前九的微生物. D:属水平的微生物热图 A: Non-metric multidimensional scaling (NMDS) plot of microbial community distribution. B: Microbial richness Venn plot. C: Microorganisms in the top nine relative abundances at the class level. D: Microbial community composition heat map at the genus level. |
图 7C反映了微生物群落在纲层面发生了显著变化。与接种物相比,拟杆菌(Bacteroidia)在各个营养类型中均有大量富集,相对丰度维持在11.1%–14.9%;厌氧科(Anaerolineae)和Ignavibacteria也在不同营养类型的生物反应器中有明显积累,相对丰度分别为4.6%–18.1%和1.1%–8.3%。此外,Gammaproteobacteria在单独添加磁黄铁矿的自养体系中富集,其相对丰度高达30.6%。
在属水平上,Thiobacillus (17.9%)、分枝杆菌属(Mycobacterium) (11.4%)、溶菌(Lysobacter) (7.9%)和Romboutsia (7.4%)是自养体系中的优势菌属。其中,Thiobacillus、Lysobacter和Romboutsia相对于接种物均有显著富集,表明磁黄铁矿的添加改变了微生物群落结构。Thiobacillus是一类化能自养微生物,可以利用Fe(Ⅲ)/Fe(Ⅱ)氧化还原循环中的电子进行生存,且在与硫氧化相关的反硝化系统中经常被检测到[32]。He等[13]在马基诺矿(FeS)驱动的V(V)还原自养生物体系中,也监测到Thiobacillus存在显著富集,并认为Thiobacillus可以利用V(V)作为替代电子受体,并将自养Fe(Ⅱ)和S(–II)氧化耦合,实现V(V)的还原。此外,Lysobacter、Limnobacter和Hyphomicrobium也被广泛认为是一种铁氧化菌属[33-35],能够参与磁黄铁矿表面的氧化,推测其在驱动磁黄铁矿生物还原V(V)的自养体系中发挥着潜在的关键作用。
在异养生物体系中,监测到Bacteroidetes_ vadinHA17 (3.2%)和Syner-01 (0.3%)为优势菌属,远高于接种物中的微生物丰度。根据先前的报道,Bacteroidetes_vadinHA17可作为功能性物种降解木质素或纤维素[23]。Wang等[36]在其研究中发现Syner-01可通过S0的还原代谢氨基酸。以上结果表明,添加木屑的异养生物体系中富集的微生物能够利用分解木屑产生的能量用于自身代谢,并在V(V)还原过程中发挥重要作用。
Desulfurivibrio (7.0%)、Thiobacillus (6.7%)、Acholeplasma (5.6%)、Bacteroidetes_vadinHA17 (3.0%)和Rummeliibacillus (1.9%)是磁黄铁矿木屑复配的混养生物体系中丰度最高的优势菌属,均高于原始接种物中的微生物丰度。其中,Desulfurivibrio、Acholeplasma和Rummeliibacillus发现仅在混养体系中富集。据报道,Desulfurivibrio可以将Se(VI)和Se(IV)还原为Se(0)[37]。Sun等在其研究中发现了Desulfurivibrio菌可介导硫氧化与Sb(V)还原过程相结合[38]。推测Desulfurivibrio在本研究混养体系中也可发挥将磁黄铁矿氧化和V(V)还原耦合的作用。此外,Acholeplasma和Bacteroidetes_vadinHA17被广泛认为是一种具有降解木质纤维素能力的关键性功能菌属[23, 39]。此外,Bacteroidetes_vadinHA17还负责金属离子和硫酸盐的同时生物还原[40]。因此,在混养体系中富集的优势菌属可能作为潜在的V(V)还原菌,从分解木屑中的纤维素或木质素中获得能量并将V(V)作为电子受体,维持自身代谢。
3 结论(1) 将优选的天然Fe(Ⅱ)矿物(磁黄铁矿)与天然生物质(木屑)组合复配,能够强化生物反应器的V(V)去除性能。
(2) 通过SEM观察到磁黄铁矿和木屑表面均存在微生物附着,并且表面被腐蚀。XPS和XRD等表征结果得知V(V)被还原为V(Ⅳ),S(–II)与Fe(Ⅱ)的氧化产物分别为硫酸盐和Fe(Ⅲ),除新生的次生矿物FeO(OH),磁黄铁矿仍是主要矿物相。
(3) 在混养体系中,Desulfurivibrio和Thiobacillus等自养细菌可独立完成磁黄铁矿的氧化与V(V)还原,Bacteroidetes_vadinHA17等异养菌属也可还原V(V),其所需的有机碳源来自上述自养菌合成的有机代谢产物和Acholeplasma等纤维素降解菌分解木屑的产物。
| [1] | ORTIZ-BERNAD I, ANDERSON RT, VRIONIS HA, LOVLEY DR. Vanadium respiration by Geobacter metallireducens: novel strategy for in situ removal of vanadium from groundwater. Applied and Environmental Microbiology, 2004, 70(5): 3091-3095. DOI:10.1128/AEM.70.5.3091-3095.2004 |
| [2] | KONG XR, CHEN JH, TANG YJ, LV Y, CHEN T, WANG HT. Enhanced removal of vanadium(V) from groundwater by layered double hydroxide-supported nanoscale zerovalent iron. Journal of Hazardous Materials, 2020, 392: 122392. DOI:10.1016/j.jhazmat.2020.122392 |
| [3] | ZHANG BG, WANG S, DIAO MH, FU J, XIE MM, SHI JX, LIU ZQ, JIANG YF, CAO XL, BORTHWICK AGL. Microbial community responses to vanadium distributions in mining geological environments and bioremediation assessment. Journal of Geophysical Research: Biogeosciences, 2019, 124(3): 601-615. DOI:10.1029/2018JG004670 |
| [4] | ZHANG BG, HAO LT, TIAN CX, YUAN SH, FENG CP, NI JR, BORTHWICK AGL. Microbial reduction and precipitation of vanadium (V) in groundwater by immobilized mixed anaerobic culture. Bioresource Technology, 2015, 192: 410-417. DOI:10.1016/j.biortech.2015.05.102 |
| [5] | QIU R, ZHANG BG, LI JX, LV Q, WANG S, GU Q. Enhanced vanadium (V) reduction and bioelectricity generation in microbial fuel cells with biocathode. Journal of Power Sources, 2017, 359: 379-383. DOI:10.1016/j.jpowsour.2017.05.099 |
| [6] | YELTON AP, WILLIAMS KH, FOURNELLE J, WRIGHTON KC, HANDLEY KM, BANFIELD JF. Vanadate and acetate biostimulation of contaminated sediments decreases diversity, selects for specific taxa, and decreases aqueous V5+ concentration. Environmental Science & Technology, 2013, 47(12): 6500-6509. |
| [7] |
WU YS. Study on the mechanism of microbial remediation of vanadium-contaminated groundwater. China Resources Comprehensive Utilization, 2021, 39(3): 191-193.
(in Chinese) 吴玉生. 钒污染地下水的微生物修复机理研究. 中国资源综合利用, 2021, 39(3): 191-193. DOI:10.3969/j.issn.1008-9500.2021.03.055 |
| [8] | YANG ZH, REN LL, JIN LF, HUANG L, HE YJ, TANG JW, YANG WC, WANG HY. In-situ functionalization of poly(m-phenylenediamine) nanoparticles on bacterial cellulose for chromium removal. Chemical Engineering Journal, 2018, 344: 441-452. DOI:10.1016/j.cej.2018.03.086 |
| [9] | LYALKOVA NN, YURKOVA NA. Role of microorganisms in vanadium concentration and dispersion. Geomicrobiology Journal, 1992, 10(1): 15-26. DOI:10.1080/01490459209377901 |
| [10] |
CUI YL, SHI CH, ZHANG BG, ZHANG Y. Research progress in electron donors for microbial reduction of vanadium and chromium. Environmental Science and Technology, 2019, 32(3): 73-78.
(in Chinese) 崔跃琳, 施春红, 张宝刚, 张尧. 微生物还原钒、铬过程的电子供体研究进展. 环境科技, 2019, 32(3): 73-78. DOI:10.3969/j.issn.1674-4829.2019.03.015 |
| [11] | VESSEY CJ, LINDSAY MBJ. Aqueous vanadate removal by iron(II)-bearing phases under anoxic conditions. Environmental Science & Technology, 2020, 54(7): 4006-4015. |
| [12] | LU JP, ZHANG BG, HE C, BORTHWICK AGL. The role of natural Fe(Ⅱ)-bearing minerals in chemoautotrophic chromium (VI) bio-reduction in groundwater. Journal of Hazardous Materials, 2020, 389: 121911. DOI:10.1016/j.jhazmat.2019.121911 |
| [13] | HE C, ZHANG BG, LU JP, QIU R. A newly discovered function of nitrate reductase in chemoautotrophic vanadate transformation by natural mackinawite in aquifer. Water Research, 2021, 189: 116664. DOI:10.1016/j.watres.2020.116664 |
| [14] | ZHANG BG, WANG ZL, SHI JX, DONG HL. Sulfur-based mixotrophic bio-reduction for efficient removal of chromium (VI) in groundwater. Geochimica et Cosmochimica Acta, 2020, 268: 296-309. DOI:10.1016/j.gca.2019.10.011 |
| [15] | ZHANG BG, LI YN, FEI YM, CHENG YT. Novel pathway for vanadium(V) bio-detoxification by gram-positive Lactococcus raffinolactis. Environmental Science & Technology, 2021, 55(3): 2121-2131. |
| [16] | KIRTANIA K, TANNER J, KABIR KB, RAJENDRAN S, BHATTACHARYA S. In situ synchrotron IR study relating temperature and heating rate to surface functional group changes in biomass. Bioresource Technology, 2014, 151: 36-42. DOI:10.1016/j.biortech.2013.10.034 |
| [17] | ZHANG BG, QIU R, LU L, CHEN X, HE C, LU JP, REN ZJ. Autotrophic vanadium(V) bioreduction in groundwater by elemental sulfur and zerovalent iron. Environmental Science & Technology, 2018, 52(13): 7434-7442. |
| [18] | HE JX, ZHANG BG, WANG YN, CHEN SM, DONG HL. Vanadate bio-detoxification driven by pyrrhotite with secondary mineral formation. Environmental Science & Technology, 2023, 57(4): 1807-1818. |
| [19] | THOMAS JE, JONES CF, SKINNER WM, SMART RS. The role of surface sulfur species in the inhibition of pyrrhotite dissolution in acid conditions. Geochimica et Cosmochimica Acta, 1998, 62(9): 1555-1565. DOI:10.1016/S0016-7037(98)00087-8 |
| [20] | BRYCE C, BLACKWELL N, SCHMIDT C, OTTE J, HUANG YM, KLEINDIENST S, TOMASZEWSKI E, SCHAD M, WARTER V, PENG C, BYRNE JM, KAPPLER A. Microbial anaerobic Fe(Ⅱ) oxidation-ecology, mechanisms and environmental implications. Environmental Microbiology, 2018, 20(10): 3462-3483. DOI:10.1111/1462-2920.14328 |
| [21] | ZHOU L, LI A, MA F, ZHAO HP, DENG FX, PI SS, TANG AQ, YANG JX. Combining high electron transfer efficiency and oxidation resistance in nZVI with coatings of microbial extracellular polymeric substances to enhance Sb(V) reduction and adsorption. Chemical Engineering Journal, 2020, 395: 125168. DOI:10.1016/j.cej.2020.125168 |
| [22] | WANG JL, CHU LB. Biological nitrate removal from water and wastewater by solid-phase denitrification process. Biotechnology Advances, 2016, 34(6): 1103-1112. DOI:10.1016/j.biotechadv.2016.07.001 |
| [23] | HAO LT, LIU YJ, CHEN N, HAO XD, ZHANG BG, FENG CP. Microbial removal of vanadium (V) from groundwater by sawdust used as a sole carbon source. Science of the Total Environment, 2021, 751: 142161. DOI:10.1016/j.scitotenv.2020.142161 |
| [24] | HU YT, LIU T, CHEN N, FENG CP, LU W, GUO HM. Simultaneous bio-reduction of nitrate and Cr(VI) by mechanical milling activated corn straw. Journal of Hazardous Materials, 2022, 429: 128258. DOI:10.1016/j.jhazmat.2022.128258 |
| [25] | LIANG LF, SUN C, JIN Z, WANG MW, YU QL, ZHAO ZQ, ZHANG YB. Magnetite-mediated electrically connected community for shortening startup of methane-dependent denitrification in a membrane biofilm reactor. Chemical Engineering Journal, 2022, 428: 132004. DOI:10.1016/j.cej.2021.132004 |
| [26] | LIN WM, LIU HM, ZHANG YJ, CHEN YC, QIN YX. Fe(Ⅱ) improving sulfurized anammox coupled with autotrophic denitrification performance: based on interspecies and intracellular electron transfer. Bioresource Technology, 2022, 364: 128051. DOI:10.1016/j.biortech.2022.128051 |
| [27] | WANG T, ZHAO DY, CAO J, ZENG QL, LI W, LIU B, HE D, LIU YY. FeS-mediated mobilization and immobilization of Cr(Ⅲ) in oxic aquatic systems. Water Research, 2022, 211: 118077. DOI:10.1016/j.watres.2022.118077 |
| [28] | YUAN SH, LIU XX, LIAO WJ, ZHANG P, WANG XM, TONG M. Mechanisms of electron transfer from structrual Fe(Ⅱ) in reduced nontronite to oxygen for production of hydroxyl radicals. Geochimica et Cosmochimica Acta, 2018, 223: 422-436. DOI:10.1016/j.gca.2017.12.025 |
| [29] | SHI JX, ZHANG BG, QIU R, LAI CY, JIANG YF, HE C, GUO JH. Microbial chromate reduction coupled to anaerobic oxidation of elemental sulfur or zerovalent iron. Environmental Science & Technology, 2019, 53(6): 3198-3207. |
| [30] | LIU H, CHEN SM, LU JP, LI QM, LI JL, ZHANG BG. Pentavalent vanadium and hexavalent uranium removal from groundwater by woodchip-sulfur based mixotrophic biotechnology. Chemical Engineering Journal, 2022, 437: 135313. DOI:10.1016/j.cej.2022.135313 |
| [31] | LI JL, ZHANG BG. Woodchip-sulfur packed biological permeable reactive barrier for mixotrophic vanadium (V) detoxification in groundwater. Science China Technological Sciences, 2020, 63(11): 2283-2291. DOI:10.1007/s11431-020-1655-6 |
| [32] | CHAI HX, MA JC, MA HY, CHENG H, WENG ZS, KONG Z, SHAO ZY, YUAN YS, XU YH, NI QC, LI LQ. Enhanced nutrient removal of agricultural waste-pyrite bioretention system for stormwater pollution treatment. Journal of Cleaner Production, 2023, 395: 136457. DOI:10.1016/j.jclepro.2023.136457 |
| [33] | DAS S, CHOU ML, JEAN JS, LIU CC, YANG HJ. Water management impacts on arsenic behavior and rhizosphere bacterial communities and activities in a rice agro-ecosystem. Science of the Total Environment, 2016, 542: 642-652. DOI:10.1016/j.scitotenv.2015.10.122 |
| [34] | LIU L, SHEN RL, ZHAO ZQ, DING LJ, CUI HL, LI G, YANG YP, DUAN GL, ZHU YG. How different nitrogen fertilizers affect arsenic mobility in paddy soil after straw incorporation?. Journal of Hazardous Materials, 2022, 436: 129135. DOI:10.1016/j.jhazmat.2022.129135 |
| [35] | QIU XW, FENG MT, ZHOU GX, WANG HJ. Effects of mineral additives on antibiotic resistance genes and related mechanisms during chicken manure composting. Bioresource Technology, 2022, 346: 126631. DOI:10.1016/j.biortech.2021.126631 |
| [36] | WANG JJ, XU LZJ, HUANG BC, LI J, JIN RC. Multiple electron acceptor-mediated sulfur autotrophic denitrification: nitrogen source competition, long-term performance and microbial community evolution. Bioresource Technology, 2021, 329: 124918. DOI:10.1016/j.biortech.2021.124918 |
| [37] | LI LL, ZHANG BG, LI L, BORTHWICK AGL. Microbial selenate detoxification linked to elemental sulfur oxidation: independent and synergic pathways. Journal of Hazardous Materials, 2022, 422: 126932. DOI:10.1016/j.jhazmat.2021.126932 |
| [38] | SUN XX, KONG TL, LI FB, HÄGGBLOM MM, KOLTON M, LAN L, LAU VETTER MCY, DONG YR, GAO P, KOSTKA JE, LI BQ, SUN WM. Desulfurivibrio spp. mediate sulfur-oxidation coupled to Sb(V) reduction, a novel biogeochemical process. The ISME Journal, 2022, 16(6): 1547-1556. DOI:10.1038/s41396-022-01201-2 |
| [39] | WANG XQ, WANG MM, ZHANG J, KONG ZJ, WANG XS, LIU DY, SHEN QR. Contributions of the biochemical factors and bacterial community to the humification process of in situ large-scale aerobic composting. Bioresource Technology, 2021, 323: 124599. DOI:10.1016/j.biortech.2020.124599 |
| [40] | YAN ZS, HAO Z, WU HF, JIANG HL, YANG MZ, WANG CH. Co-occurrence patterns of the microbial community in polycyclic aromatic hydrocarbon-contaminated riverine sediments. Journal of Hazardous Materials, 2019, 367: 99-108. DOI:10.1016/j.jhazmat.2018.12.071 |
 2023, Vol. 63
2023, Vol. 63




