中国科学院微生物研究所,中国微生物学会
文章信息
- 秦善, 石洁, 潘徐盈, 曾宪明, 张秋勤. 2023
- QIN Shan, SHI Jie, PAN Xuying, ZENG Xianming, ZHANG Qiuqin.
- 植物乳杆菌源胺氧化酶的异源表达及功能结构分析
- Heterologous expression, function and structure of amine oxidase derived from Lactiplantibacillus plantarum
- 微生物学报, 63(12): 4698-4713
- Acta Microbiologica Sinica, 63(12): 4698-4713
-
文章历史
- 收稿日期:2023-04-24
- 网络出版日期:2023-07-13
2. 南京农业大学三亚研究院, 海南 三亚 572025
2. Sanya Institute of Nanjing Agricultural University, Sanya 572025, Hainan, China
生物胺食品发酵过程中必然会产生的一类潜在有害物质。过量摄入生物胺可能导致中毒,危害人体健康,已成为世界公认的食品安全问题[1-2]。如何降低或控制食品中生物胺的含量是食品安全领域的研究热点之一。研究发现,一些来自于传统发酵食品的乳酸菌,如乳杆菌属与片球菌属,具有降解生物胺能力[3-5]。通过强化接种降胺菌,不仅可以抑制发酵过程中生物胺的产生,而且可以降解自然菌产生的生物胺。生物胺一旦形成,难以通过加热、高压和冷冻等加工方式去除。因此,在众多控胺方法中,微生物降胺法因其便捷高效而表现出独特优势和应用潜力,开发利用降胺菌对保证发酵食品的安全具有重要意义。
研究发现大多数微生物的降胺活性归因于其产胺氧化酶(amine oxidase, AOs)特性。AOs是一类能将生物胺分解为醛和氨的氧化脱氨酶,包括含铜胺氧化酶(copper amine oxidase, CuAO)、含黄素的单胺氧化酶(monoamine oxidase, MAO)[6]。一般认为,胺氧化酶具有特定的底物,因此某些菌株降解多种生物胺的能力可能是胞内存在多种胺氧化酶,然而,研究发现多铜氧化酶(multicopper oxidase, MCO)可以降解多种生物胺,这一结果被许多研究证实,如Callejón等[7]发现戊糖片球菌中提取的MCO具有降解酪胺、精胺和组胺的能力,植物乳杆菌中异源表达的MCO具有降解酪胺、组胺、腐胺的能力[8]。徐洁等[9]表达发酵乳杆菌中的MCO能降解除精胺以外的其他7种生物胺。MCO属于含有铜结构域的氧化酶家族(cupredoxin super family),广泛存在于真菌与细菌中,然而与真菌MCO相比,细菌MCO具有更广泛的底物特异性和pH范围,并且更耐碱性环境[10]。
目前乳酸菌源的MCO研究较少,尤其缺乏酶作用模式及结构表征方面的研究,因此有必要从酶学角度解析乳酸菌的降胺机制。本课题组前期筛选得到一株具有胺氧化酶活性的降胺乳酸菌Lactobacillus plantarum JB1 (NCBI ID: CP09717, https://www.ncbi.nlm.nih.gov/)。本研究在大肠杆菌中异源表达了该菌株的胺氧化酶基因(SufI),并分析了重组酶的酶学性质、降解生物胺能力及酶结构。
1 材料与方法 1.1 材料和试剂本研究所用的菌株和质粒:L. plantarum JB1,表达宿主Escherichia coli BL21(DE3),保存于E. coli JM109的pET-28a质粒。以上菌株及质粒均由南京农业大学微生物实验室提供。
LB (Luria-Bertani)培养基:酵母提取物5 g,胰化蛋白胨10 g,氯化钠10 g,琼脂15 g,蒸馏水1 000 mL,pH调至7.0,121 ℃高压灭菌20 min。
TB (Terrific broth)发酵培养基:11.8 g胰蛋白胨,23.6 g酵母提取物,900 mL去离子水溶解,加入5 mL 80%甘油。115 ℃高压灭菌20 min,冷却后加入0.2 μm过滤除菌的100 mL磷酸盐缓冲液(9.4 g K2HPO4, 2.2 g KH2PO4)。
DNA限制性内切酶(BamH I、Nhe I)、T4连接酶均购自TaKaRa;细菌基因组提取试剂盒、质粒提取试剂盒、质粒提取试剂盒及亲和层析柱镍柱琼脂糖填料(Ni-nitrilotriacetic acid, Ni-NTA)、重力柱、咪唑、PCR扩增引物均购自生工生物工程(上海)股份有限公司;卡那霉素、氯化铜、异丙基-β-d-硫代半乳糖苷(isopropyl-β-d-thiogalactoside, IPTG)购自麦克林;4-氨基安替比林、2, 4, 6-三溴-3-羟基苯甲酸、辣根过氧化物酶购自源叶生物;十二烷基硫酸钠(sodium dodecyl sulfate, SDS)、乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)、β-巯基乙醇(β-mercaptoethanol, β-ME)、二硫苏糖醇(dithiothreitol, DTT)、苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)来自阿拉丁;BCA (bicinchoninic acid)蛋白浓度测定试剂盒为索莱宝生物科技有限公司提供。
1.2 仪器和设备Waters-2988高效液相色谱仪购自Waters公司;紫外可见光分光光度计购自济南爱来宝仪器设备有限公司;傅里叶变换红外光谱仪(Fourier transform infrared spectroscopy, FTIR)购自Thermo Fisher公司;JY92-IIDN超声波细胞粉碎机购自宁波新芝生物科技公司。
1.3 表达载体构建将L. plantarum JB1接种到MRS (de Man Rogosa Sharpe)培养基中过夜培养,收集菌体,按照细菌柱式DNA提取试剂盒说明提取总DNA。对L. plantarum JB1基因组中目的基因SufI (NCBI ID: M3L79_01475)进行PCR扩增与琼脂糖电泳,PCR引物与反应体系参考Callejón等[11]的研究。PCR纯化产物与质粒pET-28a用BamH I、Nhe I进行双酶切与T4 DNA酶连接后,转化E. coli BL21,并将转化菌液涂布于LB平板中,37 ℃培养18 h,挑取单菌落进行PCR与质粒双酶切验证,阳性重组子进一步测序验证。
1.4 诱导表达条件优化用含40 mg/L卡那霉素的LB液体培养基活化重组菌,然后将按5%的接种量转接到含有卡那霉素的TB发酵培养基中,37 ℃振荡培养8–10 h (OD600为0.6–0.8)加入1×10–4 mol/L的IPTG和1×10–3 mol/L的Cu2+,20 ℃振荡培养1 d。考察铜离子、IPTG浓度、诱导时间与温度单因素对粗酶活与菌体干重的影响。于4 ℃、6 000 r/min离心6 min收集发酵液中菌体,用PBS缓冲液洗涤菌体2遍,用1/20体积PBS充分悬浮菌体。冰浴超声破碎,破碎条件为输出功率540 W,工作4 s停4 s,破壁后12 000 r/min离心15 min收集上清即为粗酶液,参考徐洁[12]的方法测定粗酶活,并吸取50 mL发酵液离心收集菌体,置于80 ℃烘干至恒重,测定菌体干重。
1.5 重组酶的提取与纯化粗酶液提取后利用镍柱进行纯化。去离子水清洗镍柱,用8–10倍柱体积抽滤过的0.02 mol/L pH 7.5磷酸盐缓冲液[phosphate buffer (PB),含0.5 mol/L NaCl]平衡镍柱,样品与处理过的镍柱填料混合室温孵育1–2 h,上柱流穿后,用含梯度咪唑洗脱液(0.02、0.04和0.06 mol/L)洗脱5–10倍柱床体积,最后用含0.25 mol/L咪唑洗脱液洗脱目的蛋白,将粗酶液、流穿液、洗脱液及目的蛋白洗脱液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate- polyacrylamide gel electrophoresis, SDS-PAGE),收集单一条带洗脱液于4 ℃,经过透析脱盐后,进行酶活和蛋白浓度检测,参考BCA蛋白检测试剂盒。
1.6 酶学性质与降胺能力最适温度与pH:通过测量不同温度(15–65 ℃,每5 ℃为1处理)和不同pH (pH 2.0–6.0,每0.5为1处理)下重组酶的活性,绘制重组酶在不同温度或pH下的酶活曲线。其中,pH 2.0为醋酸钠缓冲液,pH 3.0–6.0为柠檬酸缓冲液,pH 6.0–8.0为磷酸缓冲液。
酶学动力学参数测定:参考徐洁[12]的方法,在最适反应条件下,分别测定体系中含有10–4–10–3 mol/L 2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2, 2-azinobis-(3-ethylbenzthiazoline-6-sulphonate), ABTS]时的酶活,根据Lineweaver- Burk双倒数作图法计算得到重组酶的Km、Vmax值。
热稳定性与酸碱稳定性:40–85 ℃ (每5 ℃为1处理)水浴处理酶30 min,测定酶活计算相对酶活。pH 2.0–8.0下(每增加1为1处理)孵育酶30 min,同上操作计算相对酶活。
金属离子对酶活影响:配制不同浓度的金属离子溶液(K+、Ca2+、Fe2+、Cu2+、Zn2+和Mg2+),最适条件下与酶反应30 min,测定残余酶活,以不添加金属离子为对照计算相对酶活。
抑制剂对酶活影响:配制不同浓度的酶抑制剂溶液(SDS、EDTA、β-ME、DTT和PMSF),与上述操作相同计算相对酶活。
乙醇与氯化钠影响:酶与含不同浓度乙醇(2.5%、5%、10%和15%)、不同浓度氯化钠(10%、15%、18%和20%)的缓冲液孵育30 min后测定酶活力,以不添加的酶活为对照计算相对酶活。
酶的降胺能力:参考Foster等[13]的方法,用过氧化物酶偶联比色法测定最适条件下重组酶对不同生物胺底物的活性。将透析过后的纯酶(128 U/L)与200 µg/mL的混合生物胺孵育,同时添加10–3 mol/L Cu2+作为辅因子,最适条件20 ℃培养36 h,每隔12 h取样利用高效液相检测生物胺含量,同时以灭活的酶作为对照,计算生物胺的降解量。生物胺的检测参考朱霞[14]的方法。
1.7 光谱表征和结构预测酶的紫外可见扫描光谱:多铜氧化酶的紫外可见光谱具有特征吸收峰,因此常被用来对纯酶进行鉴定[15]。将纯化后的重组酶溶于0.05 mol/L pH 6.5的磷酸钾缓冲液中,利用紫外-可见分光光度计扫描该溶液200–700 nm处的吸光度值。同时以磷酸钾缓冲液作为基线。
酶的傅里叶红外光谱:参考张波波等[16]的方法。将酶蛋白溶液冻干成粉,与光谱级溴化钾混合压片样品均匀地放在晶片上,扫描波数400–4 000 cm–1的吸收光谱,并采用Peakfit软件解析波谱,根据各子峰的积分面积计算二级结构的相对百分含量。
基于氨基酸序列的同源建模与模型评估:在SWISS-MODEL平台(https://swissmodel.expasy.org/)上将酶的氨基酸序列进行BLAST,以检索出同源性最高的蛋白作为模板进行同源建模,用PyMOL (2.3.0)软件可视化蛋白三维模型,并通过SAVES在线网站(https://saves.mbi.ucla.edu/)评估模型的质量,包括Procheck、Errat和Verify3D等评估方法[17]。
2 结果与分析 2.1 表达载体构建提取L. plantarum JB1基因组和保存在大肠杆菌宿主中的pET-28a质粒,通过PCR扩增目的基因SufI,并经纯化与双酶切酶连后转化至E. coli BL21,图 1中数字泳道为重组大肠杆菌菌落PCR验证结果,有目的条带者(1.5 kb)为阳性,提取质粒并进行双酶切验证,结果显示阳性重组质粒分子量更大,并且双酶切后出现了5.5 kb和1.5 kb两条带。利用通用引物(T7/T7 ter)对阳性重组子进行测序获得1 671 bp的产物,该产物与L. plantarum JB1基因组中目的基因SufI同源性100%,证明原核表达载体pET-28a-SufI构建成功。
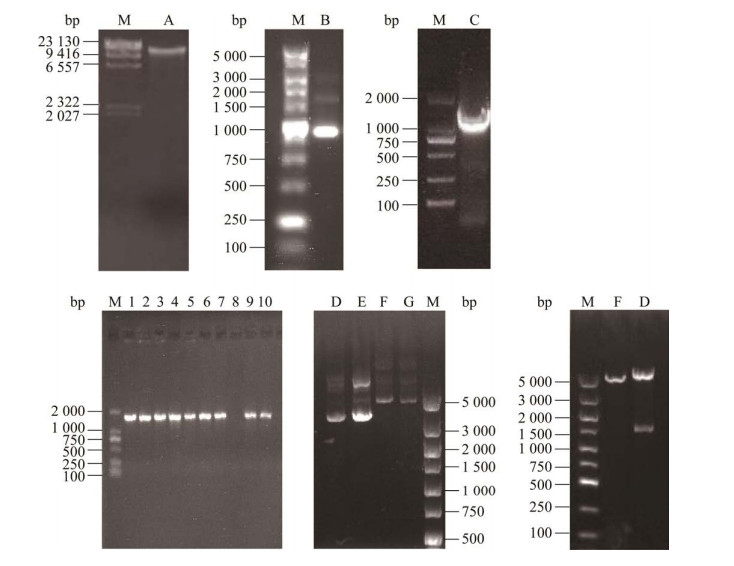
|
| 图 1 表达载体构建与重组质粒验证 Figure 1 Construction of expression vector and verification of recombinant plasmid. A: Genome DNA. B: pET-28a plasmid. C: Target gene SufI. The numbers mean PCR product of gene SufI of transformed colony. D and E: Positive recombinant plasmid. F and G: Negative recombinant plasmid. |
2.2 诱导表达条件优化
将构建成功的重组质粒pET-28a-SufI转入表达宿主E. coli BL21中,用IPTG进行诱导表达。由于异源表达大肠杆菌中容易产生包涵体导致蛋白活性和产量受到影响,因此需要对诱导条件进行优化,以提高酶的表达水平,优化因素与结果如图 2所示。
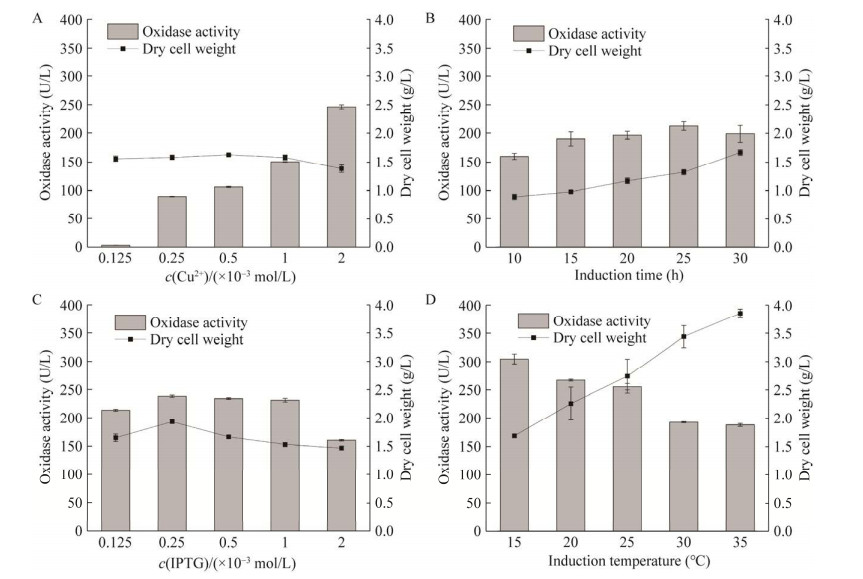
|
| 图 2 诱导表达条件对菌体干重与酶活的影响 Figure 2 Effects of induced expression conditions on dry weight and enzyme activity. A: Copper ion concentration. B: Induction time. C: IPTG concentration. D: Induction temperature. Three replicates per sample were assayed and the error bars represent standard error. |
多铜氧化酶是一种以铜为辅因子的活性蛋白,合适浓度的Cu2+对于维持其生理活性至关重要[12]。从图可以看出,随着Cu2+浓度的增加,酶的氧化活性也逐渐升高,但Cu2+浓度超过一定范围会对细胞产生毒性,菌体干重减少,因此选择2×10–3 mol/L浓度进行诱导。随着诱导时间的延长,菌体重量增加,目的蛋白增加,然而由于培养时间过长导致细胞衰老,重组酶蛋白活性下降,因此25 h为最佳时间点。IPTG浓度主要影响蛋白质表达的速率,但高浓度IPTG会使得蛋白来不及折叠,降低蛋白溶解性,从而使得重组酶活性降低,因此2.5×10–4 mol/L IPTG浓度最好。作为诱导的关键因素,温度能够影响菌体生长、蛋白结构与蛋白合成速率等,菌体干重随温度升高而增加,然而蛋白活性一直下降,因此在低温15 ℃条件下诱导。通过单因素诱导条件的优化,蛋白酶活从诱导前的73.75 U/L提高到304.35 U/L,为优化前的4.14倍。
2.3 重组酶的提取纯化构建表达载体时C端加入了6-His标签,利用该标签与镍柱的亲和力能使得重组蛋白与镍专一性的结合,改变洗脱液中咪唑梯度将杂蛋白洗脱下来从而达到纯化的目的。图 3展示了镍柱纯化过程中各洗脱液中蛋白电泳条带,由图 3可知目的蛋白洗脱液中条带单一,纯化成功可进一步透析脱盐。
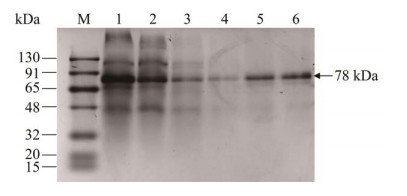
|
| 图 3 重组酶纯化SDS-PAGE电泳 Figure 3 SDS-PAGE electrophoresis of recombinant enzyme purification products. 1: Crude enzyme; 2: Perforating fluid; 3, 4 and 5: Miscellaneous protein eluents (0.02, 0.05, and 0.01 mol/L imidazole); 6: Target protein eluent (0.25 mol/L imidazole). The location and size of the target band are indicated by the arrow and number. |
由表 1可以看出,经过层析和脱盐后的重组蛋白回收率在74.18%,最终蛋白比活力为25.41 U/mg,纯化倍数超过3倍。纯化后的蛋白分子量大约为78 kDa,与理论值相似。
| Purification step | Volume(mL) | Oxidase activity (U/L) | Protein content(mg/mL) | Specific activity(U/mg) | Purification fold | Recovery rate(%) |
| Crude enzyme | 30.0 | 318.09±8.90 | 1.15±0.11 | 8.29 | 1.00 | 100 |
| Ni-NTA | 50.0 | 178.30±5.33 | 0.52±0.03 | 13.80 | 1.67 | 93.42 |
| Dialysis | 55.0 | 128.70±1.71 | 0.28±0.06 | 25.61 | 3.09 | 74.18 |
2.4 酶学性质和降胺能力
pH对酶活的影响主要是改变酶分子的蛋白结构以及酶与底物的解离状态,而温度升高会增加酶分子与底物的速率从而增加了结合几率,但温度过高也会破坏酶的空间结构导致酶失活[18]。从图 4可以看出,该酶的最适反应pH为3.5,最适反应温度为20 ℃。酶反应动力学主要是研究酶催化速度及其影响因素。以不同浓度的ABTS为底物,测定最适条件下酶的反应速率,绘制V–1与S–1对应的双倒数曲线,如图 4C所示,通过曲线拟合的参数计算出Vmax为0.292 U/mg,Km为3.6×10–4 mol/L。Km作为酶的特征常数,常用来表征酶与底物的亲和力大小,该数值说明该酶对ABTS的亲和力较高。
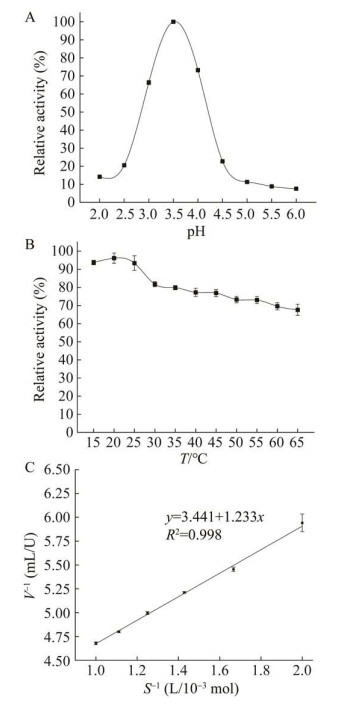
|
| 图 4 重组酶以ABTS为底物的最适pH (A)与温度(B)及酶动力学参数测定(C) Figure 4 Optimal pH (A), temperature (B) and kinetic parameter determination (C) of recombinant enzymes for ABTS as substrate. Three replicates per sample were assayed and the error bars represent standard error. |
为进一步考察重组酶的应用潜力,以初始酶活为对照,测定该酶在酸碱、高温、金属离子、酶抑制剂、氯化钠和乙醇等条件下处理30 min后的相对酶活。图 5显示了相对酶活随pH变大呈现先上升后下降的趋势,在pH 4.0–10.0范围内,相对酶活能保持在50%以上,且在低酸强碱条件下仍能保持10%以上的活性。随温度升高,酶的稳定性逐渐下降,超过60 ℃,相对酶活降低一半,70 ℃以上该酶活性仅保持在18%左右。
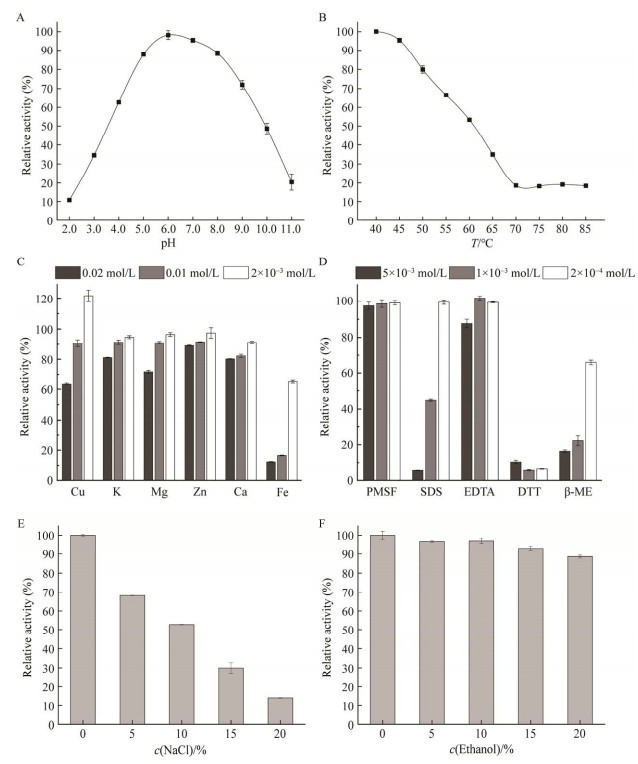
|
| 图 5 不同因素处理对重组酶酶活影响 Figure 5 Effect of different factors on the activity of recombinant enzyme. A, B, C, D, E and F are the effects of pH, temperature, metal ions, enzyme inhibitors, NaCl and ethanol on enzyme activity after 30 min treatment, respectively. Three replicates per sample were assayed and the error bars represent standard error. |
不同浓度不同种类金属离子对酶活作用不同,在低浓度条件下,K+、Mg2+、Zn2+和Ca2+对酶活影响不大,但Cu2+表现为促进酶活,这与Yamada等[19]通过透析除去Cu2+导致胺氧化酶几乎全部丧失了活性,而添加Cu2+又使得酶活恢复的结果类似。在高浓度条件下,所有金属离子对于酶活均有抑制作用,尤其是Fe2+,抑制作用随浓度增加而增大,可能是重金属离子使得蛋白变性,空间结构因此改变,酶活大大降低,这一点与徐洁等的结果相同[9, 12]。
不同浓度不同种类酶抑制剂对酶活作用也不尽相同,PMSF与EDTA无论浓度高低对酶活影响都不大,而SDS与β-巯基乙醇随着浓度增加抑制效果增大,DTT对酶活抑制最大。这种差异可能与抑制机理有关,PMSF主要与丝氨酸残基反应,EDTA能够螯合金属离子,而SDS作为解离剂能破坏蛋白的疏水结构,β-ME与DTT为还原剂,作用于蛋白的二硫键,这说明蛋白酶保持生理活性的前提是具有完整稳定的蛋白结构[7-8]。另外,随着氯化钠浓度增加,相对酶活逐渐下降,当浓度超过10%时,酶活降低一半,这可能是氯化钠浓度过高使蛋白发生盐析。乙醇几乎不影响酶活,说明该酶有望应用于含盐量10%以下的食品和酒类当中。
在单一生物胺和混合生物胺体系内分别研究了重组酶对不同生物胺的氧化活性与降解能力。图 6A显示重组酶孵育单一生物胺的氧化酶活随着时间的延长均逐渐降低,说明底物对于酶活具有一定的反馈抑制作用。另外,同一时间内重组酶对不同生物胺的氧化酶活差异显著(P < 0.05),酪胺、腐胺的酶活更高,组胺、色胺和苯乙胺次之,亚精胺、尸胺和精胺酶活相对较低,这可能与酶对底物的亲和性有关。
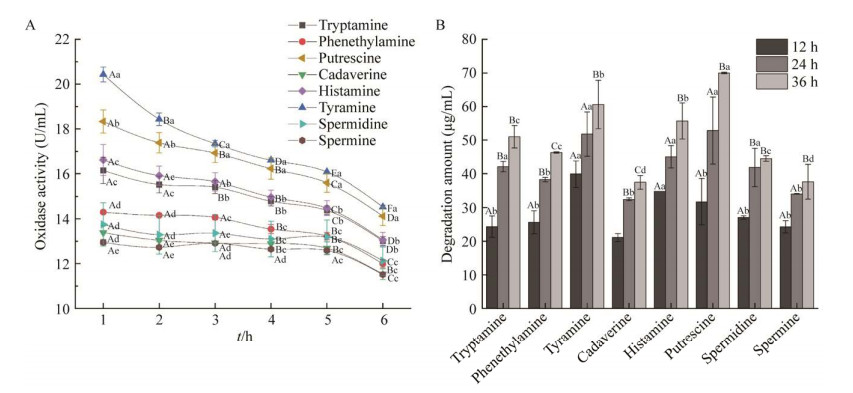
|
| 图 6 重组酶对不同生物胺的氧化活性(A)与降解能力(B) Figure 6 Oxidative activity (A) and degradation ability (B) of recombinant enzyme to different biogenic amines. The uppercase letter represents the comparison of the same biogenic amine at different times and the lowercase letter represents the comparison of different biogenic amines at the same time (P < 0.05). Three replicates per sample were assayed and the error bars represent standard error. |
将重组酶与混合生物胺(每种生物胺200 μg/mL)在最适条件下孵育,同时以灭活的酶作为阴性对照,利用(high performance liquid chromatography, HPLC)检测各生物胺含量变化,36 h内阴性对照中经灭活的酶几乎无降解作用,生物胺含量无显著变化。而图 6B显示有活性的酶对各生物胺的降解量随着时间逐渐增加,并且不同时间12、24和36 h降解生物胺总量分别达到了229.01、338.53、403.23 μg/mL。此外,不同生物胺降解量也具有显著差异性(P < 0.05),孵育36 h后,酶对腐胺、酪胺和组胺的降解最大,最大降解量超过70 μg/mL,降解率为34.99%,色胺、苯乙胺和亚精胺次之,降解量范围在44.51–50.98 μg/mL,尸胺和精胺的降解量最低,最低降解量在37 μg/mL左右,降解率约18.5%。由此可见,重组酶在混合体系中对生物胺降解能力的大小顺序与其在单一生物胺体系中氧化酶活相一致。
2.5 光谱表征和结构预测多铜氧化酶家族由于结构域中T1Cu的存在,在可见光谱600 nm处有特征吸收峰[15]。图 7A为重组酶在200–700 nm范围内的扫描光谱,可以发现有3个特征吸收峰值,在200–250 nm范围内的特征峰是由肽键引起的,250–300 nm范围内的特征峰是共轭芳香基团的氨基酸引起的,600 nm处的特征峰说明该重组蛋白属于MCO家族。
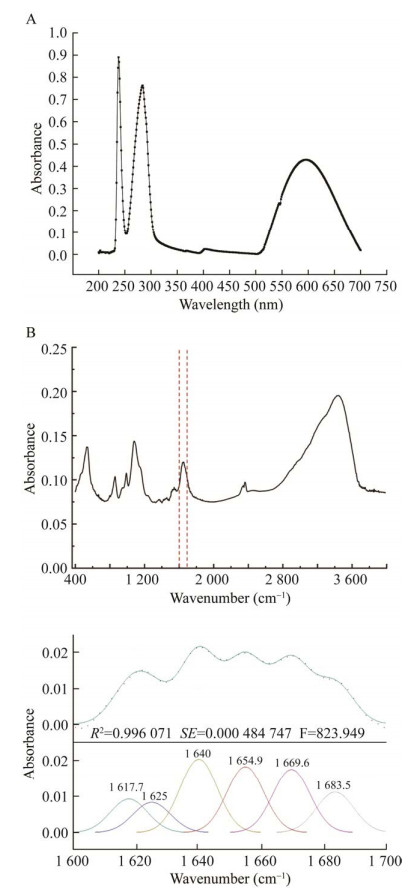
|
| 图 7 重组酶的紫外可见光谱(A)与傅里叶光谱及二级结构解析(B) Figure 7 Ultraviolet-visible spectrum (A) and fourier transform infrared spectroscopy and secondary structure analysis (B) of recombinant enzyme. |
重组酶的二级结构分析傅里叶红外光谱结果如图 7B所示,1 600–1 700 cm–1的吸收峰属于酰胺I带,对该范围内的波谱进行解析,通过基线校正,去卷积及二阶导数的处理,获得6个吸收峰,拟合图谱与原图谱残差R2为0.996,拟合度较高。根据波长对6个吸收峰进行二级结构指认与相对含量计算,α螺旋(1 654.9 cm–1)、β折叠(1 617.7 cm–1与1 625 cm–1)、β转角(1 669.6 cm–1与1 683.5 cm–1)、无规则卷曲(1 640 cm–1)这4种结构在重组酶中的相对含量分别为21.52%、20.72%、33.80%和23.97%。
经过Swiss-Model同源比对,戊糖片球菌的MCO (uniprot ID: 6xj0)[20]与L. plantarum JB1的MCO氨基酸序列相似性最高为68.21%,以该晶体结构作为模板构建三维模型,所得结果如图 8A所示。该模型的GMQE (global model quality estimate)为0.93,GMQE是一种基于目标模板对准结合性质的质量估计,数值在0–1之间,越接近1表示模型越好,同时GMEAN (qualitative model energy analysis)基于蛋白模型的局部和全局对4个结构进行计分,包括成对原子距离依赖性电位,C-β相互作用势能,残基包埋情况以及扭转角分布,从评估结果来看,该模型贴近实验晶体结构。
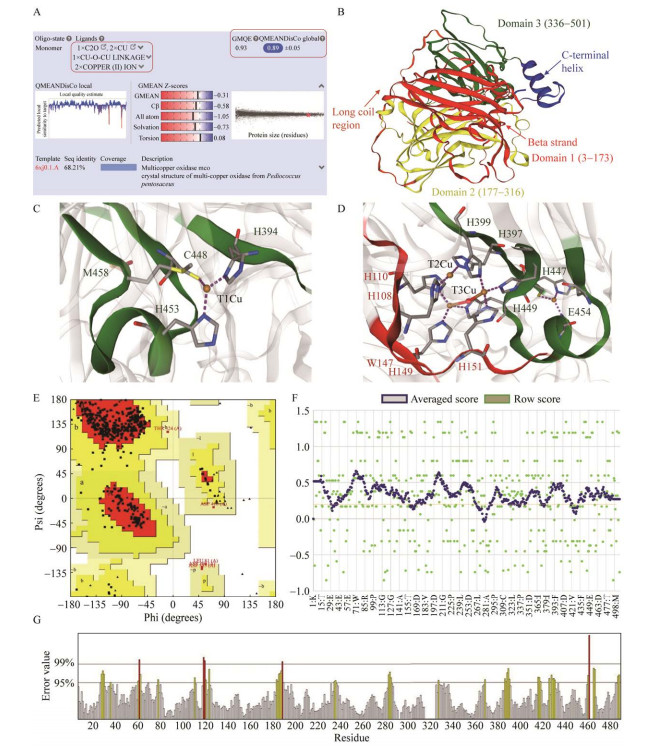
|
| 图 8 基于氨基酸序列的同源建模与模型评估 Figure 8 Homology modeling and model evaluation based on amino acid sequence. A: Model construction by SWISS-MODEL. B: Model visualization. C and D: Copper ligand binding sites prediction and different colors correspond to domain. E, F and G: Three evaluation results of the structural model by Procheck, Verify3D, and Errat. |
MCO家族具有典型的铜氧还蛋白结构域(cupredoxin),Olmeda等[20]研究的片球菌晶体结构中具有3个结构域以及相应的铜配体,重组酶模型可视化结构如图 8B所示,以6xj0模板划分结构域,结构域1 (红色)包括9条链形成的β-桶装结构(46–171),以及一个α螺旋(156–162),结构域2 (黄色)主要为12条链所形成的β桶装结构(183–316)和连接结构域3的长无规则卷曲(317–344,橙色),结构域3 (绿色)由10条链组成的β桶装(342–465)、一个短α螺旋(451–455)以及C末端的螺旋结构(478–498,蓝色)。重组酶氨基酸序列具有MCO家族典型的铜配位体保守基序(HXHG、HXH、HXXHXH和HCHXXXHXXXXXXM/L/F)[15],根据其保守基序可以预测出与铜配体结合的重要氨基酸残基位点如His、Cys、Met和Glu等,MCO结合的铜配体分别为位于结构域3表面的T1Cu,氨基酸结合位点为H394、C448、H453和M458,埋藏在结构域1和3交界处的三核铜中心(Tri-nuclear copper center, TNC),TNC包含T2Cu与2个T3aCu和T3bCu,T2Cu结合位点为H108、H110、H397和H399;T3Cu结合位点为H108、H110、W147、H149、H151、H397、H399、H447、H449和E454。研究发现这些氨基酸位点具有重要作用,TNC周围带负电的残基,如Glu、Asp被认为有助于氧气结合并为氧的还原提供质子[21-22]。MCO参与氧化反应时,由单铜离子中心T1Cu接受底物电子,并通过Cys-His蛋白路径将这些电子转移到TNC三铜中心,TNC中心的T3aCu和T3bCu还原氧原子产生水分子,然而,底物与蛋白的结合,铜离子之间的作用,氧分子的反应以及还原水的释放等细节机理还尚未清楚[23]。
为进一步评估模型的可信度,用Procheck拉氏图检查Cα两面角是否合理,该模型98.8%的残基落在允许区域(红色)和额外允许区域(黄色),超过90%即合格;Verify3D计算氨基酸残基3D/1D值,超过80%的残基平均得分大于0.2则模型合格,该模型符合要求的残基占88.76%;Errat计算0.35 nm范围之内不同原子类型对之间形成的非键相互作用的数目,得分大于85较好,该模型得分90.486;图 7 (E、F和G)显示MCO结构模型均通过以上3个软件的评估。
3 讨论L. plantarum JB1中鉴定的生物胺降解酶多铜氧化酶基因与大肠杆菌基因SufI同源,最初在大肠杆菌细胞中被鉴定为FtsI突变的多复制抑制因子[24],而L. plantarum JB1中基因SufI氨基酸序列具有MCO家族的保守基序和铜氧还结构域,并且表达纯化的蛋白具有蓝铜蛋白的280 nm与600 nm特征吸收峰标志,以及氧化ABTS、生物胺等多底物,这些表明该重组酶属于多铜氧化酶家族。L. plantarum JB1重组酶氧化ABTS的最适pH与最适温度与其他研究中类似[7-9],对ABTS的动力学参数Km与Vmax略高于其他细菌漆酶,说明ABTS是该酶的亲和底物之一。另外,重组酶能在更宽的pH范围内催化反应,表现出更高的热稳定性,更耐受有机溶剂、高盐浓度和常见抑制剂。这种热稳定可能与其蛋白结构有关,温度可以引起蛋白质构象的细微变化从而有利于铜中心对非活性分子的重组和恢复[25]。
本研究中重组酶降解生物胺的能力与其他表达的多铜氧化酶有所差异。来自发酵乳杆菌、威尔斯氏菌和解淀粉芽孢杆菌的重组酶对单一生物胺降解率分别为38.2%–51.6%,29.0%–36.2%和17.5%–46.7%,对酱油中混合生物胺总胺降解率分别为13.5%、10.6%和4.4%[9, 12];植物乳杆菌中表达的多铜氧化酶对单一生物胺(100 mg/L)降解率为58%–94%[26]。而L. plantarum JB1的重组酶对混合生物胺降解率为18.73%–34.99%,与上述研究结果相比较低,这与降胺体系中使用的酶量与反应条件有很大的关系。除pH和温度外,氧化酶活性严格依赖于生物胺浓度,氧气,铜辅基以及亲和介体等因子,尤其在有氧气的存在下,生物胺降解程度可能更高[27],并且还有研究发现添加ABTS能大幅提高降解能力,由漆酶介导的催化可以通过亲和介质的高活性阳离子自由基扩展到漆酶单独难以氧化的其他底物上[20]。因此,酶在应用前还需考虑到这些因素并进行优化。
研究发现乳酸菌源的多铜氧化酶对酪胺的亲和性更高,这可能与底物的酚醛结构利于同酶结合有关[28]。由于植物乳杆菌多铜氧化酶晶体难以获得,该三维结构上的研究尚未进行,但目前已有研究对枯草芽孢杆菌CotA[29]、大肠杆菌的CueO[30]和片球菌的MCO[20]晶体结构进行了表征和解析。三者均具有三型铜离子及相应的结构域,然而不同的是片球菌C末端有氨基酸残基延伸且富含高比例的Met与His,但CotA与CueO没有,C端延伸这一特征在乳酸菌源的MCO中较为普遍,作用尚不确定,可能涉及铜配体的结合与水通往TNC的通道[20]。另外,大肠杆菌的CueO与底物结合的位点位于T1Cu的入口,但片球菌中这一位点被2个Met所阻挡,可能限制了该酶的催化效率,因此乳酸菌源MCO可能在催化效率上有所欠缺。酶的结构一定程度上反映了酶的性质,通过对结构的改造如氨基酸突变等有望实现酶的良性提升。
4 结论本研究成功构建了原核表达载体,实现了植物乳杆菌源SufI基因在大肠杆菌中的表达。重组蛋白经诱导表达条件优化后酶活达到304.35 U/L,经纯化后比活力为25.41 U/mg,回收率在74.18%,纯化倍数超过3倍。该酶的最适pH为3.5,最适温度为20 ℃,具有较好的酸碱稳定性和热稳定性,能够在pH 2.0–11.0范围内、85 ℃条件下保持活性。以单一生物胺为底物的氧化酶活结果显示酪胺的底物亲和性最高,与混合生物胺孵育36 h,酶降解生物胺总量达到了403.23 μg/mL,其中对酪胺的降解量最多,超过70 μg/mL (34.99%),对尸胺和精胺降解量最少,为37 μg/mL左右(18.72%)。紫外-可见扫描光谱显示酶蛋白在600 nm处有多铜氧化酶家族特征吸收峰,傅里叶红外光谱解析酰胺Ⅰ带中α螺旋、β折叠、β转角、无规则卷曲的相对含量分别为21.52%、20.72%、33.80%和23.97%。基于氨基酸序列的同源建模预测了酶的高级结构,发现了铜配体结合的氨基酸残基位点,包括His、Cys、Met和Glu等重要位点。因此,植物乳杆菌源多铜氧化酶具有降解生物胺的功能,有望应用于发酵食品及饮料中生物胺的控制。
| [1] |
李志军, 吴永宁, 薛长湖. 生物胺与食品安全[J]. 食品与发酵工业, 2004, 30(10): 84-91.
LI ZJ, WU YN, XUE CH. Effects of biogenic amines on food safety and human health[J]. Food and Fermentation Industries, 2004, 30(10): 84-91 (in Chinese). |
| [2] | RUIZ-CAPILLAS C, HERRERO A. Impact of biogenic amines on food quality and safety[J]. Foods, 2019, 8(2): 62 DOI:10.3390/foods8020062. |
| [3] | CHENG SM, XU Y, LAN X. Isolation, characterization, and application of biogenic amines-degrading strains from fermented food[J]. Journal of Food Safety, 2020, 40(1): e12716 DOI:10.1111/jfs.12716. |
| [4] | HAN J, LIN XP, LIANG HP, ZHANG SF, ZHU BW, JI CF. Improving the safety and quality of Roucha using amine-degrading lactic acid bacteria starters[J]. Food Research International, 2022, 161: 111918 DOI:10.1016/j.foodres.2022.111918. |
| [5] | KUNG HF, LEE YC, HUANG YL, HUANG YR, SU YC, TSAI YH. Degradation of histamine by Lactobacillus plantarum isolated from miso products[J]. Journal of Food Protection, 2017, 80(10): 1682-1688 DOI:10.4315/0362-028X.JFP-17-135. |
| [6] | LI BB, LU SL. The importance of amine-degrading enzymes on the biogenic amine degradation in fermented foods: a review[J]. Process Biochemistry, 2020, 99: 331-339 DOI:10.1016/j.procbio.2020.09.012. |
| [7] | CALLEJÓN S, SENDRA R, FERRER S, PARDO I. Recombinant laccase from Pediococcus acidilactici CECT 5930 with ability to degrade tyramine[J]. PLoS One, 2017, 12(10): e0186019 DOI:10.1371/journal.pone.0186019. |
| [8] | CALLEJÓN S, SENDRA R, FERRER S, PARDO I. Cloning and characterization of a new laccase from Lactobacillus plantarum J16 CECT 8944 catalyzing biogenic amines degradation[J]. Applied Microbiology and Biotechnology, 2016, 100(7): 3113-3124 DOI:10.1007/s00253-015-7158-0. |
| [9] |
徐洁, 方芳. 发酵乳杆菌多铜氧化酶的异源表达及酶学性质[J]. 生物工程学报, 2019, 35(7): 1286-1294.
XU J, FANG F. Expression and characterization of a multicopper oxidase from Lactobacillus fermentum[J]. Chinese Journal of Biotechnology, 2019, 35(7): 1286-1294 (in Chinese). |
| [10] | SOLANO F, LUCAS-ELı́O P, LÓPEZ-SERRANO D, FERNÁNDEZ E, SANCHEZ-AMAT A. Dimethoxyphenol oxidase activity of different microbial blue multicopper proteins[J]. FEMS Microbiology Letters, 2001, 204(1): 175-181 DOI:10.1111/j.1574-6968.2001.tb10882.x. |
| [11] | CALLEJÓN S, SENDRA R, FERRER S, PARDO I. Identification of a novel enzymatic activity from lactic acid bacteria able to degrade biogenic amines in wine[J]. Applied Microbiology and Biotechnology, 2014, 98(1): 185-198 DOI:10.1007/s00253-013-4829-6. |
| [12] |
XU J. Characterization and heterologous expression of multicopper oxidase for degradation of biogenic amine[D]. Wuxi: Master's Thesis of Jiangnan University, 2019 (in Chinese). 徐洁. 降生物胺多铜氧化酶的异源表达及性质研究[D]. 无锡: 江南大学硕士学位论文, 2019. |
| [13] | FOSTER A, BARNES N, SPEIGHT R, KEANE MA. Identification, functional expression and kinetic analysis of two primary amine oxidases from Rhodococcus opacus[J]. Journal of Molecular Catalysis B: Enzymatic, 2012, 74(1/2): 73-82. |
| [14] |
ZHU X. Enzymatic properties and biodegradation of amine oxidase from Aspergillus niger[D]. Wuhan: Master's Thesis of Hubei Technology University, 2015 (in Chinese). 朱霞. 黑曲霉胺氧化酶的酶学性质及对生物胺降解特性研究[D]. 武汉: 湖北工业大学硕士学位论文, 2015. |
| [15] | SHARMA P, GOEL R, CAPALASH N. Bacterial laccases[J]. World Journal of Microbiology and Biotechnology, 2007, 23(6): 823-832 DOI:10.1007/s11274-006-9305-3. |
| [16] |
张波波, 王丹, 马越, 张超, 霍乃蕊, 赵晓燕. FT-IR分析超高压处理对调配草莓汁蛋白二级结构的影响[J]. 中国食品学报, 2014, 14(11): 200-206.
ZHANG BB, WANG D, MA Y, ZHANG C, HUO NR, ZHAO XY. Effect of high pressure treatments on infrared spectra of strawberry juice protein[J]. Journal of Chinese Institute of Food Science and Technology, 2014, 14(11): 200-206 (in Chinese). |
| [17] |
李芹, 王立梅, 齐斌. 淀粉酶链霉菌几丁质酶克隆表达及催化功能分析[J]. 食品与机械, 2022, 38(5): 1-7.
LI Q, WANG LM, QI B. Cloning, expression and catalytic function analysis of chitinase from Streptomyces diastaticus[J]. Food & Machinery, 2022, 38(5): 1-7 (in Chinese). |
| [18] | YAMADA H, TANAKA A, OGATA K. Putrescine oxidase of Micrococcus rubens[J]. Agricultural and Biological Chemistry, 1965, 29(3): 260-261 DOI:10.1080/00021369.1965.10858382. |
| [19] | YAMADA H, UWAJIMA T, KUMAGAI H, WATANABE M, OGATA K. Crystalline tyramine oxidase from Sarcina lutea[J]. Biochemical and Biophysical Research Communications, 1967, 27(3): 350-355 DOI:10.1016/S0006-291X(67)80105-0. |
| [20] | OLMEDA I, CASINO P, COLLINS RE, SENDRA R, CALLEJÓN S, HUESA J, SOARES AS, FERRER S, PARDO I. Structural analysis and biochemical properties of laccase enzymes from two Pediococcus species[J]. Microbial Biotechnology, 2021, 14(3): 1026-1043 DOI:10.1111/1751-7915.13751. |
| [21] | CHEN ZJ, DURãO P, SILVA CS, PEREIRA MM, TODOROVIC S, HILDEBRANDT P, BENTO I, LINDLEY PF, MARTINS LO. The role of Glu498 in the dioxygen reactivity of CotA-laccase from Bacillus subtilis[J]. Dalton Transactions, 2010, 39(11): 2875-2882 DOI:10.1039/b922734b. |
| [22] | KOMORI H, SUGIYAMA R, KATAOKA K, HIGUCHI Y, SAKURAI T. An O-centered structure of the trinuclear copper center in the Cys500Ser/Glu506Gln mutant of CueO and structural changes in low to high X-ray dose conditions[J]. Angewandte Chemie, 2012, 124(8): 1897-1900 DOI:10.1002/ange.201107739. |
| [23] |
黄瑶, 罗爱玲, 彭铭烨, 周梦舟, 胡勇, 付彩霞, 高冰, 徐宁. 微生物胺氧化酶研究进展[J]. 中国酿造, 2016, 35(9): 24-27.
HUANG Y, LUO AL, PENG MY, ZHOU MZ, HU Y, FU CX, GAO B, XU N. Advance in amine oxidase from microorganisms[J]. China Brewing, 2016, 35(9): 24-27 (in Chinese). |
| [24] | TARRY M, ARENDS SJ, ROVERSI P, PIETTE E, SARGENT F, BERKS BC, WEISS DS, LEA SM. The Escherichia coli cell division protein and model Tat substrate SufI (FtsP) localizes to the septal ring and has a multicopper oxidase-like structure[J]. Journal of Molecular Biology, 2009, 386(2): 504-519. |
| [25] | CHAUHAN PS, PURI N, SHARMA P, GUPTA N. Mannanases: microbial sources, production, properties and potential biotechnological applications[J]. Applied Microbiology and Biotechnology, 2012, 93(5): 1817-1830. |
| [26] |
TONG TT. Bacterial diversity analysis of Sichuan Pickle and screening of strains with potency for degrading biogenic amines[D]. Wuxi: Master's Thesis of Jiangnan University, 2015 (in Chinese). 佟婷婷. 四川泡菜细菌多样性分析及降生物胺菌株筛选[D]. 无锡: 江南大学硕士学位论文, 2015. |
| [27] | MOHAMMADIAN M, FATHI-ROUDSARI M, MOLLANIA N, BADOEI-DALFARD A, KHAJEH K. Enhanced expression of a recombinant bacterial laccase at low temperature and microaerobic conditions: purification and biochemical characterization[J]. Journal of Industrial Microbiology & Biotechnology, 2010, 37(8): 863-869. |
| [28] | REISS R, IHSSEN J, RICHTER M, EICHHORN E, SCHILLING B, THÖNY-MEYER L. Laccase versus laccase-like multi-copper oxidase: a comparative study of similar enzymes with diverse substrate spectra[J]. PLoS One, 2013, 8(6): e65633. |
| [29] | ROBERTS SA, WEICHSEL A, GRASS G, THAKALI K, HAZZARD JT, TOLLIN G, RENSING C, MONTFORT WR. Crystal structure and electron transfer kinetics of CueO, a multicopper oxidase required for copper homeostasis in Escherichia coli[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(5): 2766-2771. |
| [30] | EMSLEY P, LOHKAMP B, SCOTT WG, COWTAN K. Features and development of coot[J]. Acta Crystallographica Section D, Biological Crystallography, 2010, 66(Pt 4): 486-501. |
 2023, Vol. 63
2023, Vol. 63




