中国科学院微生物研究所,中国微生物学会
文章信息
- 陈琳琳, 兰金苹, 武彩霞, 王静, 贾朝霞, 曹旭, 刘开扬. 2022
- CHEN Linlin, LAN Jinping, WU Caixia, WANG Jing, JIA Zhaoxia, CAO Xu, LIU Kaiyang.
- NDV诱导HeLa细胞发生核糖体应激及对翻译起始复合体的影响
- NDV induces ribosomal stress in HeLa cells and affects the translation initiation complex
- 微生物学报, 62(9): 3576-3586
- Acta Microbiologica Sinica, 62(9): 3576-3586
-
文章历史
- 收稿日期:2022-01-24
- 修回日期:2022-04-11
- 网络出版日期:2022-06-02
癌症是当前世界范围内导致死亡最主要的原因之一,近年来,随着医药科技的不断发展,各种放、化疗药物不断涌入市场,但都不能从根本上治疗癌症[1]。溶瘤病毒疗法成为目前治疗癌症的一种新选择。新城疫病毒(Newcastle disease virus,NDV)于1926年在全球首次被发现,属于副粘病毒科禽腮腺炎病毒属,其减毒疫苗株作为重要的溶瘤病毒来治疗肿瘤[2]。NDV可以通过诱导肿瘤细胞发生凋亡、自噬、触发机体免疫等多种途径进行溶瘤反应[3–4]。同时,本课题组前期已证实,NDV F3株能够引起线粒体、微丝骨架等细胞器发生应激反应,但对核糖体的研究尚未涉及[5–6]。
核糖体应激已经成为研究热点,从核糖体应激的角度去治疗癌症已成为一种有前景的治疗方法。核糖体是一种由核糖体RNA及数十种蛋白质构成的,具有蛋白质合成功能的高度复杂的细胞机器。核糖体受到病毒感染、放线菌素D等刺激时发生应激反应,核糖体合成受阻或功能受到抑制而导致细胞内稳态受到破坏,进而抑制细胞蛋白翻译,促进病毒蛋白表达[7]。因此,了解NDV对核糖体应激及翻译起始复合体的调控有助于人们对其抗肿瘤机制的研究,为今后溶瘤病毒疗法治疗癌症提供更加扎实丰富的理论基础。
1 材料与方法 1.1 材料宫颈癌HeLa细胞及NDV F3株由生命科学研究中心生物安全二级(P2)实验室保存。DMEM基础培养基、胰酶购自Gibco公司;胎牛血清购自上海ExCellBio公司;c-Myc引物购自生工生物工程(上海)股份有限公司;FastKing cDNA第一链合成试剂盒及荧光定量PCR试剂盒购自天根生化科技(北京)有限公司;c-Myc、eIF4E、eIF2α及GAPDH抗体购自武汉ABclonal公司;RPS7与Bcl-2抗体及辣根过氧化物酶标记的二抗购自北京博奥森公司;NP抗体由本实验室制备;流式细胞周期试剂盒与流式凋亡试剂盒购自Becton Dickinson公司;CCK-8试剂盒购自同仁公司,细胞器分离试剂盒购自北京碧云天公司。
1.2 细胞培养从液氮中取出HeLa细胞株,放入37 ℃水浴箱,完全解冻后立即离心,随后用DMEM完全培养基(含10%胎牛血清和1%双抗)在37℃、5% CO2、饱和湿度的条件下培养细胞。实验室保存的NDV F3毒株原液感染复数(multiplicity of infection,MOI)为100,用DMEM基础培养基分别进行梯度稀释,使其MOI分别为10、1、0.1、0.01。用终浓度MOI=0.1的NDV F3分别作用细胞12、24、36、48 h,并在普通倒置显微镜下观察细胞形态改变。
1.3 CCK-8检测细胞凋亡选择生长状态良好的HeLa细胞,用胰酶消化后重置成细胞悬液,接种于96孔板中,在37 ℃、5% CO2条件下培养至对数生长期时,加入终浓度MOI=1、0.1、0.01、0.001的NDV F3,分别培养12、24、36、48 h。每孔加入10 μL CCK-8试剂,同时设置对照组和空白组,将培养板放于培养箱内孵育2 h,在450 nm波长处测定OD值。
1.4 流式细胞术检测细胞凋亡选取生长状态良好且处于对数生长期的HeLa细胞,用胰酶消化,制成单细胞悬液,计数1×106个/mL,接种于6孔板中。设置对照组,处理组中加入终浓度MOI=0.1的NDV F3,放入培养箱中分别培养12、24、36、48 h。收集上清,用不含EDTA的胰酶消化细胞并一起收集,磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤2遍,离心弃上清。加入500 μL染色缓冲液悬浮细胞,加入7-ADD/PI染液各5 μL混匀。室温、避光,孵育20 min后上机检测。
1.5 qRT-PCR检测c-Myc基因表达选择生长状态良好的HeLa细胞,用胰酶消化后重置成细胞悬液,加入6孔板中,培养箱培养过夜,细胞密度长到70%–80%时,设置对照组,同时给实验组加入终浓度为MOI=0.1的NDV F3并继续培养12、24、36、48 h后,提取RNA。用反转录试剂盒合成cDNA后,以GAPDH为内参,对c-Myc基因进行实时荧光定量检测。以上每组均有3个复孔并且重复实验3次。
1.6 流式细胞术检测细胞周期用6孔板接种细胞,37 ℃、5% CO2培养至细胞密度为80%左右时接种终浓度为MOI=0.1的NDV F3,培养12、24、36、48 h并设置对照组。收集细胞,加入PBS洗涤细胞2次,最后用PBS制成细胞悬液(密度为1×106个/mL)。取1 mL细胞悬液,离心后加入体积分数为70%的冷乙醇4 ℃固定过夜,第2天用PBS洗去固定液,加入500 μL PI/RNase A染液,室温避光孵育30 min后上机。以上实验均重复3次。
1.7 Western blotting检测蛋白表达在6孔板中接种培养细胞,设置对照组,同时给实验组加入终浓度为MOI=0.1的NDV F3并继续培养6、12、24、36、48 h后,收集细胞和上清液,提取蛋白。在电压160 V条件下,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE) 50 min,100 V冰浴转膜1 h。5%脱脂奶粉封闭2 h,室温孵育一抗3 h。漂洗液(tris-tween buffer saline,TTBS)洗膜3次,每次10 min。二抗在室温下孵育2 h,洗膜后上机显色,以上实验均重复3次。
1.8 NDV核蛋白(NP)亚细胞定位检测在6孔板中接种培养细胞,设置对照组,同时给实验组加入终浓度为MOI=0.1的NDV F3并继续培养12、24、48 h后,提取HeLa细胞中的总蛋白后利用试剂盒分别提取细胞膜、细胞质、线粒体、细胞核中的蛋白,最后通过Western blotting技术检测NP蛋白表达位置。另外,利用激光共聚焦显微镜观察NP蛋白亚细胞定位,具体步骤参照1.9。
1.9 免疫荧光染色观察NP与eIF4E共定位情况选择生长状态良好的HeLa细胞,用胰蛋白酶液消化细胞,完全培养基重悬细胞,接种于激光共聚焦培养皿,于培养箱放置过夜。第2天加入终浓度MOI=0.1的NDV F3继续培养24 h,同时设立对照组。24 h后用4%的多聚甲醛固定20 min,PBS洗3次,每次5 min。0.5% Triton X-100处理30 min,再用5%牛血清白蛋白(bovine serum albumin, BSA)封闭30 min。按照说明书稀释抗体,孵育过夜后用PBS洗涤细胞3次,每次5 min。在避光条件下,用PBS稀释对应的二抗,37 ℃孵育30 min后PBS洗3次,每次5 min。最后,用DAPI染液染核,孵育10 min,用PBS洗涤细胞3次,每次5 min。最后加入抗荧光淬灭剂后用激光共聚焦显微镜观察结果。
2 结果与分析 2.1 NDV F3对HeLa细胞形态、数目的影响普通光学倒置显微镜观察到(图 1),空白对照组的细胞贴壁状态良好,形态正常,边缘整齐,折光性好。NDV F3感染12 h后,细胞逐渐失去正常形态,边缘逐渐模糊,开始出现融合现象。NDV感染24 h后,细胞开始破碎、变圆并脱落。感染36 h后,细胞大部分出现融合现象,贴壁细胞减少,细胞碎裂,漂浮在培养基中,失去折光性。感染48 h后,细胞几乎全部漂浮在培养基中。
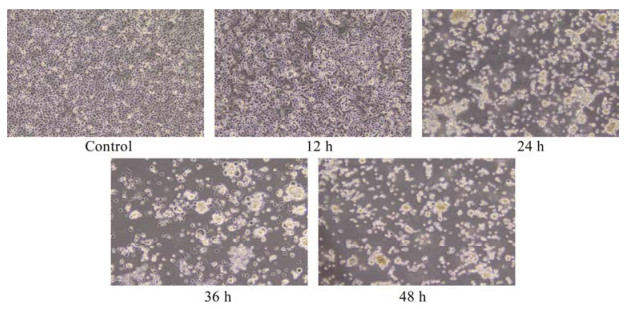
|
| 图 1 普通倒置显微镜下观察NDV F3感染HeLa细胞后形态(×100) Figure 1 Observation of the morphology of HeLa cells infected by NDV F3 under an ordinary inverted microscope (×100). |
2.2 NDV F3对HeLa细胞增殖的影响
如图 2所示,用NDV F3处理后,细胞增殖均以时间和剂量依赖性方式受到抑制。MOI=0.1和MOI=0.01组的抑制作用在36 h和48 h后清晰可见。MOI=1组在48 h后活细胞数量显著减少(P < 0.05)。
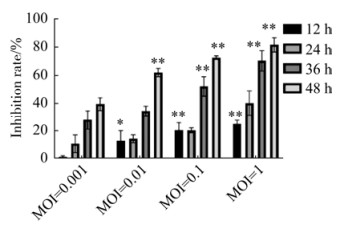
|
| 图 2 NDV F3对HeLa细胞的抑制率 Figure 2 Inhibition rate of NDV F3 on HeLa cells (*: P < 0.05; **: P < 0.01 vs. MOI=0.001 group). |
2.3 NDV F3对HeLa细胞凋亡的影响
NDV可以选择性地感染肿瘤细胞并在肿瘤细胞中复制,触发直接溶瘤作用。流式细胞凋亡结果如图 3所示,各组的凋亡率分别为:对照组(2.70±0.98)%;12 h处理组(7.10±0.78)%;24 h处理组(15.27±2.35)%;36 h处理组(33.30±1.85)%;48 h处理组(52.90±3.10)%。与对照组相比,12 h处理组无显著性差异,24 h、36 h、48 h处理组差异性显著(P < 0.01)。从图中可发现,随着作用时间的延长,凋亡率不断增加。
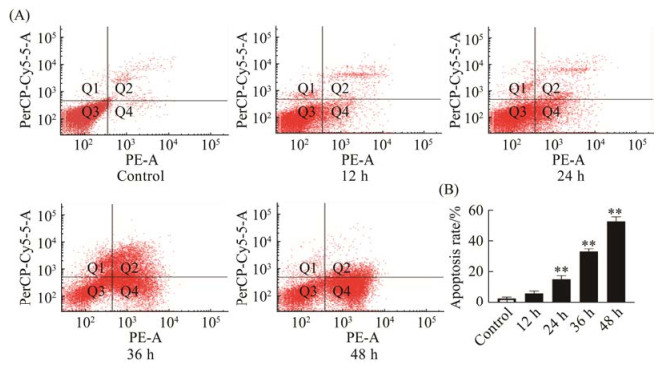
|
| 图 3 NDV F3对HeLa细胞凋亡的影响 Figure 3 Effect of NDV F3 on HeLa apoptosis. A: the apoptosis of control, 12 h, 24 h, 36 h and 48 h groups by flow cytometry. B: histogram of the mean percentage of control, 12 h, 24 h, 36 h and 48 h groups apoptosis profiles (*: P < 0.05; **: P < 0.01 vs. control group). |
2.4 NDV F3对c-Myc基因表达的影响
Myc是核糖体形成的主要调节因子,控制整个核糖体的形成步骤,Myc基因表达水平的改变常见于多种恶性肿瘤细胞中[8]。为了验证NDV F3对c-Myc基因表达的影响,用NDV F3分别刺激HeLa细胞12、24、36、48 h后用qRT-PCR评估c-Myc基因表达。结果如图 4所示,与对照组相比,NDV处理组的c-Myc基因表达量随着时间的延长呈逐渐下降趋势,在0–12 h内降低不明显,24–48 h内下降显著(P < 0.01),该结果表明NDV F3诱导核糖体发生应激反应。
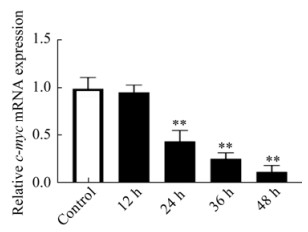
|
| 图 4 NDV F3对HeLa细胞c-Myc基因表达的影响 Figure 4 Effect of NDV F3 on the expression of the c-Myc gene in HeLa cells (*: P < 0.05; **: P < 0.01 vs. control group). |
2.5 NDV F3对HeLa细胞周期的影响
如图 5所示,对照组、12 h、24 h、36 h和48 h处理组G0/G1期细胞百分比分别为(49.67±1.70)%、(51.23±1.66)%、(61.17±1.01)%、(65.45±0.81)%和(70.78±0.64)%。对照组与24、36和48 h处理组之间差异性显著(P < 0.01)。与对照组相比,NDV F3诱导HeLa细胞G0/G1期发生停滞,进入S期和G2期的细胞减少。随着作用时间的延长,HeLa细胞G0/G1期受阻作用越来越强。核糖体发生应激反应的表现之一为细胞周期受阻,该结果进一步验证了NDV F3诱导核糖体发生应激反应。
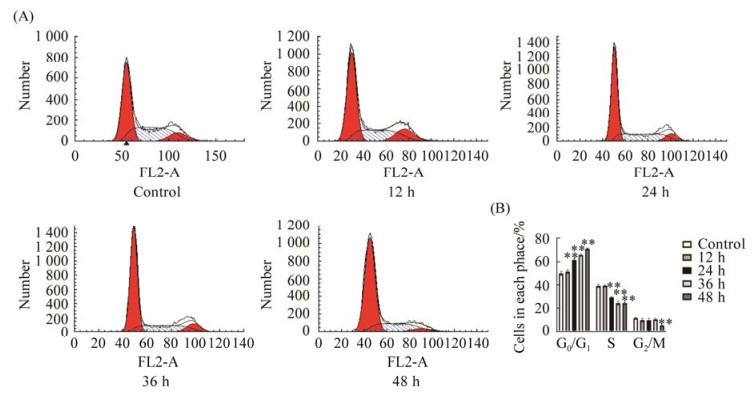
|
| 图 5 NDV F3感染HeLa细胞后细胞周期停滞于G0/G1期 Figure 5 The cell cycle stagnates at G0/G1 after NDV infection with HeLa cells. A: the phase of cell cycle of control, 12 h, 24 h, 36 h, and 48 h groups by flow cytometry. B: histogram of the mean percentage of control, 12 h, 24 h, 36 h, and 48 h groups cell cycle profiles (*: P < 0.05; **: P < 0.01 vs. control group). |
2.6 NDV F3对c-Myc、RPS7、Bcl-2、eIF2α、eIF4E及NP蛋白表达的影响
Bcl-2是最早发现的抑制细胞凋亡的基因,该基因的表达与细胞抵抗力密切相关[9]。Western blotting检测结果如图 6所示,NDV F3组与对照组相比,Bcl-2蛋白表达量随着NDV F3作用时间的延长而逐渐降低,在12 h时无明显差异,在36–48 h内迅速降低(P < 0.01);Myc是核糖体形成的主要调节因子,控制整个核糖体的形成步骤,结果发现c-Myc蛋白表达下降,核糖体小亚基蛋白RPS7也随之降低,该结果表明,宿主细胞核糖体生成受损。在真核翻译起始过程中,限制翻译速度的关键部分是翻译复合体eIF4F,其亚基之一eIF4E能与mRNA 5′帽子结构结合,该环节是翻译起始的核心,eIF2α是真核翻译起始的负调控因子,能够介导eIF4F翻译[10]。Western blotting检测结果如图 6所示,与对照组相比,NDV F3分别作用于HeLa细胞6、12、24、36、48 h后,eIF4E及eIF2α蛋白在0–12 h内逐渐增加,12–48 h内依次降低(P < 0.05);该结果表明NDV F3对细胞翻译起始存在一定的抑制作用。NP蛋白是NDV编码蛋白之一,在翻译时被优先翻译,与NDV的转录、复制、mRNA转移等密切相关[11]。从实验结果中可以看出,NP蛋白在0–12 h内不表达,12–48 h内表达逐渐上升,48 h时明显增加(P < 0.01)。推测NDV F3抑制了eIF4E蛋白表达,从而抑制细胞的翻译速度。
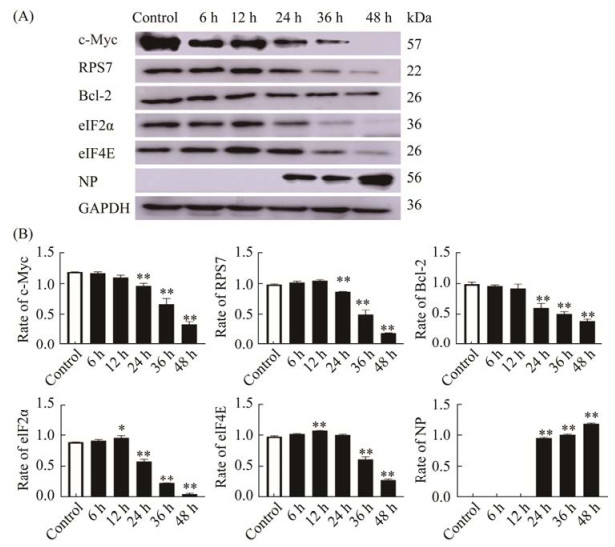
|
| 图 6 HeLa细胞被NDV F3感染不同时间段后对c-Myc、RPS7、Bcl-2、eIF2α、eIF4E及NP蛋白表达的影响 Figure 6 Effect of HeLa cells on c-Myc, RPS7, Bcl-2, eIF2α, eIF4E and NP protein expression after different time periods of NDV F3 infection. A: c-Myc, RPS7, Bcl-2, eIF2α, eIF4E and NP protein expression was assessed by Western blottingting. B: relative ratios of c-Myc, RPS7, Bcl-2, eIF2α, eIF4E and NP proteins to GAPDH (*: P < 0.05; **: P < 0.01 vs. control group). |
2.7 NP蛋白亚细胞定位检测
如图 7所示,经Western blotting技术检测,NDV感染HeLa细胞后,β-actin主要表达在全细胞和细胞质中,ATPase Na+/K+在全细胞和细胞膜中表达,Lamin B在全细胞、细胞质和细胞核中表达,以上结果表明细胞器蛋白提纯效果甚佳。而目的蛋白NP在0和12 h内不表达,在24–48 h内表达在细胞质、细胞膜和线粒体。

|
| 图 7 NDV F3侵染HeLa细胞后NP蛋白的亚细胞定位 Figure 7 Subcellular localization of NP protein after NDV infecting HeLa cells. T: total protein; M: cell membrane protein; C: cytoplasmic protein; N: nuclear protein; Mt: mitochondrial protein. |
2.8 免疫荧光检测NP蛋白定位
如图 8所示,NDV F3感染HeLa细胞24 h后,NP蛋白表达,且主要位于细胞质中。
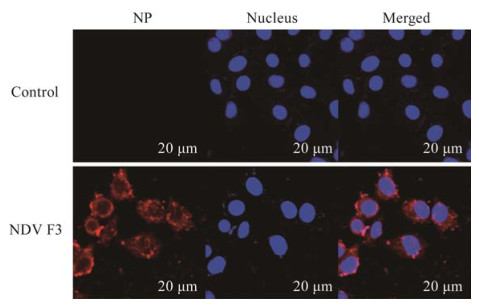
|
| 图 8 NDV F3侵染HeLa细胞后免疫荧光检测NP蛋白定位 Figure 8 Immunofluorescence detection of NP protein localization after NDV F3 infects HeLa cells. |
2.9 NDV F3 NP蛋白与eIF4E蛋白共定位
此前有文献报道发现,痘病毒在感染后能够诱导eIF4E亚细胞定位发生变化,通过将其定位于细胞内的场所从而选择性地促进病毒mRNA的翻译[12]。为了研究NDV F3是否能够引起该现象,我们采用免疫荧光检测NDV F3感染24 h后的HeLa细胞中,NP与eIF4E的定位情况,发现NP与eIF4E在细胞质中共定位(图 9),该结果表明二者可能相互作用,NDV F3激活eIF4E将其转运至病毒mRNA的翻译场所。NDV F3可能利用该机制促进病毒mRNA的复制,另一方面切断eIF4F与宿主mRNA之间的联系,造成宿主翻译的抑制。
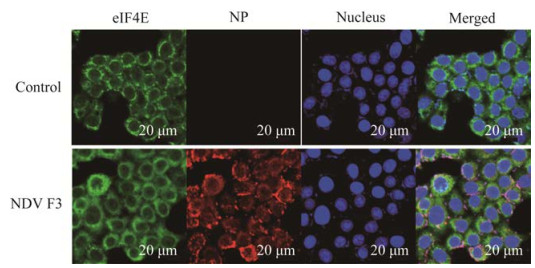
|
| 图 9 NDV F3编码蛋白NP与eIF4E蛋白共定位 Figure 9 Co-localization of NDV F3 encoded protein NP. |
3 讨论
宫颈癌是临床最常见的女性恶性肿瘤之一,除了最常规的放、化疗治疗手段外,溶瘤病毒疗法也是一种相对安全有效的治疗方法,它利用基因工程技术和免疫疗法来进行癌症治疗[13]。NDV是一种有效的溶瘤病毒,一方面,NDV感染肿瘤细胞后可诱导产生多种细胞因子,从而激活宿主细胞的凋亡信号导致溶瘤[14];另一方面,NDV感染细胞后,核转录因子(nuclear factor-κappa B,NF-κB)通路的激活和TNF-α/TRAIL的上调导致caspase 8激活和Bid裂解为tBid,tBid将凋亡信号途径传递到线粒体并介导内源性细胞凋亡[15]。本研究利用细胞增殖检测(CCK-8)和流式细胞术方法发现,用NDV F3处理后的HeLa细胞,其增殖均以时间和浓度依赖性方式受到抑制,同时,Western blotting结果中抗凋亡蛋白Bcl-2在0–48 h内逐渐降低。以上实验结果均证实NDV F3抑制HeLa细胞增殖并诱导细胞发生凋亡。
NDV作为一种具有潜在抗肿瘤应用价值的病毒,感染肿瘤细胞后引发一系列应激反应。据研究报道,NDV侵染肿瘤细胞后,首先引起细胞内质网应激,IRE1的RNase活化,TXNP1表达水平上调,CHOP蛋白表达增加,Ca2+被释放转运到线粒体中,线粒体因此发生应激,膜电位发生变化,线粒体从融合状态转为分离状态,线粒体活性氧(mitochondrial Reactive Oxygen Species,mROS)产生,细胞色素C释放,损伤的线粒体途径PINK/PARKIN介导MFN2泛素化,在伴侣分子P62、NDP52的介导下发生选择性自噬,降解天然免疫中枢MAVS进而抑制Ⅰ型干扰素的表达,促进病毒复制。病毒复制这一过程则由核糖体参与调控,触发核糖体应激[16]。核糖体应激具体表现为:核仁体积变小;RNA聚合酶介导的rRNA合成受到抑制;核糖体应激相关的核仁定位蛋白从核仁转移到核质或胞质;细胞周期受阻[17−18]。Wang等发现NDV能通过PERK-eIF2α-ATF4-CHOP信号通路诱导细胞周期中G0/G1期停滞,促进NDV增殖[19]。本研究通过流式细胞术显示,NDV F3刺激HeLa细胞后,周期的G0/G1期增加,36 h和48 h处理组的G0/G1期细胞百分比从(49.67±1.70)%增加到(65.45±0.81)%和(70.78±0.64)%,表明NDV F3诱导HeLa细胞发生核糖体应激。
Myc基因是一种原癌基因,通过转录激活和抑制众多的靶基因来调节复杂的生物程序,如细胞周期、新陈代谢和核糖体生成[20]。c-Myc能够通过直接调控上游绑定因子(UBF)与核糖体DNA(rDNA)相互作用,以此来增强rDNA的转录[21]。另外,c-Myc可以直接调控前体rRNA的加工,激活RNA聚合酶III的转录增加5S rRNA的合成[22]。qRT-PCR和Western blotting结果表明,NDV F3引起核糖体应激后,显著抑制c-Myc基因及蛋白的表达,说明c-Myc基因参与核糖体应激并可能通过降低rDNA的转录与5S rRNA的合成两种方式来降低核糖体的生成,最终达到杀伤抑制肿瘤的效果。
核糖体基因表达的调节在核糖体生物发生中蛋白质和RNA的平衡合成中起重要作用[23]。NDV F3作用于HeLa细胞后,核糖体小亚基蛋白RPS7含量明显下降,表明NDV F3导致核糖体生成受损。真核翻译起始过程中的翻译起始复合体eIF4F与5′甲基化的帽子结构结合,调控蛋白质的合成。eIF4F由帽结合蛋白(eIF4E)、支架蛋白(eIF4G)、DETD-box RNA解旋酶(eIF4A) 3个部分组成。eIF2α是真核翻译起始的负调控因子,eIF2α在Ser 51的磷酸化会损害三元复合物中GTP交换GDP,导致全局蛋白质合成急剧抑制。我们通过Western blotting对翻译起始因子eIF4E和负调控因子eIF2α的表达研究发现,eIF4E和eIF2α在NDV F3作用于HeLa细胞后0–12 h内表达量未有显著变化,但之后12–48 h内蛋白表达量显著降低;此时,对NDV F3的NP蛋白检测发现其表达量在24 h后逐渐升高。推测NDV mRNA的翻译能够抵抗这种eIF2α磷酸化所造成的翻译抑制作用,促进自身蛋白质的复制,同时抑制宿主蛋白合成,其机制可能与PI3K/Akt/mTOR及p38MAPK/Mnk1通路引起eIF4E及eIF4G的磷酸化并促进eIF4F复合体的形成等方式来开启宿主的帽子依赖性翻译系统,从而实现病毒mRNA的快速复制有关[10]。
许多病毒能通过自身编码蛋白与eIF4F相互作用来招募其进行病毒mRNA的翻译。如杯状病毒的病毒基因末端结合蛋白(viral protein genome-linked,VPg)可以与eIF4E和eIF3相互作用从而促进核糖体与病毒mRNA的结合[24]。流感病毒的NS1蛋白能够通过与eIF4G之间的作用将eIF4F招募至病毒mRNA周围,选择性地促进病毒mRNA翻译[25]。Western blotting与免疫荧光染色结果发现在NDV F3感染后,NP与eIF4E共定位,并且NP表达上升。据此,我们推测NDV F3可能利用自身编码的NP蛋白调控eIF4F,抑制翻译起始环节,从而促进病毒mRNA的翻译。
综上所述,NDV F3诱导HeLa细胞发生核糖体应激反应后,通过NP抑制eIF2α介导的翻译起始复合体eIF4F,NDV F3将eIF4E转运至病毒mRNA翻译场所,并可能利用该机制一方面促进NDV F3 mRNA的翻译,另一方面切断eIF4F与宿主mRNA之间的联系,造成宿主蛋白翻译受到抑制。
| [1] | Walsh RJ, Tan DSP. The role of immunotherapy in the treatment of advanced cervical cancer: current status and future perspectives. Journal of Clinical Medicine, 2021, 10(19): 4523. DOI:10.3390/jcm10194523 |
| [2] | Meng QX, He J, Zhong LP, Zhao YX. Advances in the study of antitumour immunotherapy for Newcastle disease virus. International Journal of Medical Sciences, 2021, 18(11): 2294-2302. DOI:10.7150/ijms.59185 |
| [3] | Xu XH, Zhang D, Ding W, Wang WQ, Jin NY, Ding Z. NDV related exosomes enhance NDV replication through exporting NLRX1 mRNA. Veterinary Microbiology, 2021, 260: 109167. DOI:10.1016/j.vetmic.2021.109167 |
| [4] | Zhao LJ, Niu C, Shi XM, Xu DS, Li M, Cui JW, Li W, Xu JT, Jin HF. Dendritic cells loaded with the lysate of tumor cells infected with Newcastle disease virus trigger potent anti-tumor immunity by promoting the secretion of IFN-γ and IL-2 from T cells. Oncology Letters, 2018, 16(1): 1180-1188. |
| [5] |
Liu KY, Qu JG, Liu JJ, Liu F. Effects of Newcastle disease virus on the mitochondria of human gastric carcinoma BGC-823 cells. Chinese Journal of Experimental and Clinical Virology, 2008, 22(3): 198-200.
(in Chinese) 刘开扬, 屈建国, 刘进军, 刘芳. 新城疫病毒对BGC-823胃癌细胞线粒体的影响. 中华实验和临床病毒学杂志, 2008, 22(3): 198-200. |
| [6] |
Xie XJ, Jin Y, Wang J, Lan JP, Wu CX, Liu Y, Liu KY. Role of microfilament sketeton in NDV inducing apoptosis of human lung cancer cells. Acta Universitatis Medicinalis Anhui, 2020, 55(1): 51-56.
(in Chinese) 谢晓娟, 金燕, 王静, 兰金苹, 武彩霞, 刘宇, 刘开扬. 细胞微丝骨架在NDV诱导肺癌细胞凋亡中的作用. 安徽医科大学学报, 2020, 55(1): 51-56. |
| [7] | James A, Wang YB, Raje H, Rosby R, DiMario P. Nucleolar stress with and without p53. Nucleus, 2014, 5(5): 402-426. DOI:10.4161/nucl.32235 |
| [8] | Stasevich EM, Murashko MM, Zinevich LS, Demin DE, Schwartz AM. The role of non-coding RNAs in the regulation of the proto-oncogene MYC in different types of cancer. Biomedicines, 2021, 9(8): 921. DOI:10.3390/biomedicines9080921 |
| [9] | Timucin AC, Basaga H, Kutuk O. Selective targeting of antiapoptotic BCL-2 proteins in cancer. Medicinal Research Reviews, 2019, 39(1): 146-175. DOI:10.1002/med.21516 |
| [10] | Zhan Y, Yu SQ, Yang S, Qiu XS, Meng CC, Tan L, Song CP, Liao Y, Liu WW, Sun YJ, Ding C. Newcastle disease virus infection activates PI3K/Akt/mTOR and p38 MAPK/Mnk1 pathways to benefit viral mRNA translation via interaction of the viral NP protein and host eIF4E. PLoS Pathogens, 2020, 16(6): e1008610. DOI:10.1371/journal.ppat.1008610 |
| [11] |
Ding C. The structure and function of Newcastle disease virus nucleocapsid protein. Chinese Journal of Preventive Veterinary Medicine, 2011, 33(1): 80-84.
(in Chinese) 丁铲. 新城疫病毒核衣壳蛋白的结构和功能. 中国预防兽医学报, 2011, 33(1): 80-84. |
| [12] | Walsh D, Arias C, Perez C, Halladin D, Escandon M, Ueda T, Watanabe-Fukunaga R, Fukunaga R, Mohr I. Eukaryotic translation initiation factor 4F architectural alterations accompany translation initiation factor redistribution in poxvirus-infected cells. Molecular And Cellular Biology, 2008, 28(8): 2648-2658. DOI:10.1128/MCB.01631-07 |
| [13] | Chiocca EA, Rabkin SD. Oncolytic viruses and their application to cancer immunotherapy. Cancer Immunology Research, 2014, 2(4): 295-300. DOI:10.1158/2326-6066.CIR-14-0015 |
| [14] | Huang Z, Liu M, Huang Y. Oncolytic therapy and gene therapy for cancer: recent advances in antitumor effects of Newcastle disease virus. Discovery Medicine, 2020, 30(159): 39-48. |
| [15] | Liao Y, Wang HX, Mao X, Fang HJ, Wang H, Li YR, Sun YJ, Meng C, Tan L, Song CP, Qiu XS, Ding C. RIP1 is a central signaling protein in regulation of TNF-α/TRAIL mediated apoptosis and necroptosis during Newcastle disease virus infection. Oncotarget, 2017, 8(26): 43201-43217. DOI:10.18632/oncotarget.17970 |
| [16] |
Ding C. Virus infection causes cell organelle stress and selective autophagy. China Poultry, 2019, 41(10): 1-9.
(in Chinese) 丁铲. 病毒感染引起的细胞器应激损伤和选择性自噬. 中国家禽, 2019, 41(10): 1-9. |
| [17] | Lu L, Yi HM, Chen C, Yan SC, Yao H, He GC, Li GF, Jiang YQ, Deng T, Deng XY. Nucleolar stress: is there a reverse version?. Journal of Cancer, 2018, 9(20): 3723-3727. DOI:10.7150/jca.27660 |
| [18] | Ma H, Oederson T. The nucleolus stress response is coupled to an ATR-Chk1-mediated G2 arrest. Molecular Biology of the Cell, 2013, 24(9): 1334-1342. DOI:10.1091/mbc.e12-12-0881 |
| [19] | Wang Y, Wang R, Li YR, Sun YJ, Song CP, Zhan Y, Tan L, Liao Y, Meng CC, Qiu XS, Ding C. Newcastle disease virus induces G0/G1 cell cycle arrest in asynchronously growing cells. Virology, 2018, 520: 67-74. DOI:10.1016/j.virol.2018.05.005 |
| [20] | Pandya N, Khan E, Jain N, Satham L, Singh R, Makde RD, Mishra A, Kumar A. Curcumin analogs exhibit anti-cancer activity by selectively targeting G-quadruplex forming c-Myc promoter sequence. Biochimie, 2020, 180: 205-221. |
| [21] | Dai MS, Lu H. Crosstalk between c-Myc and ribosome in ribosomal biogenesis and cancer. Journal of Cellular Biochemistry, 2008, 105(3): 670-677. DOI:10.1002/jcb.21895 |
| [22] | Gomez-Roman N, Grandori C, Eisenman RN, White RJ. Direct activation of RNA polymerase Ⅲ transcription by c-Myc. Nature, 2003, 421(6920): 290-294. DOI:10.1038/nature01327 |
| [23] | Mikhaylina AO, Nikonova EY, Kostareva OS, Tishchenko SV. Regulation of ribosomal protein synthesis in prokaryotes. Molecular Biology (Mosk), 2021, 55(1): 16-36. DOI:10.1134/S0026893321010118 |
| [24] | Daughenbaugh KF, Fraser CS, Hershey JWB, Hardy ME. The genome-linked protein VPg of the Norwalk virus binds eIF3, suggesting its role in translation initiation complex recruitment. The EMBO Journal, 2003, 22(11): 2852-2859. DOI:10.1093/emboj/cdg251 |
| [25] | Burgui I, Aragón T, Ortín J, Nieto A. PABP1 and eIF4GI associate with influenza virus NS1 protein in viral mRNA translation initiation complexes. The Journal of General Virology, 2003, 84(Pt 12): 3263-3274. |
 2022, Vol. 62
2022, Vol. 62




