中国科学院微生物研究所,中国微生物学会
文章信息
- 郭容, 齐瑜, 李洋洋, 张海洋, 刘鹏选, 王权, 方维焕, 蒋蔚. 2022
- GUO Rong, QI Yu, LI Yangyang, ZHANG Haiyang, LIU Pengxuan, WANG Quan, FANG Weihuan, JIANG Wei.
- 外膜蛋白OmpR对副溶血弧菌致病特性的影响
- Influence of outer membrane protein OmpR on pathogenicity of Vibrio parahaemolyticus
- 微生物学报, 62(9): 3410-3420
- Acta Microbiologica Sinica, 62(9): 3410-3420
-
文章历史
- 收稿日期:2022-01-07
- 修回日期:2022-03-20
- 网络出版日期:2022-04-25
2. 浙江农林大学动物科技学院, 浙江 临安 311300
2. College of Animal Science and Technology, Zhejiang Agriculture & Forestry University, Lin'an 311300, Zhejiang, China
副溶血弧菌(Vibrio parahaemolyticus)是一种具嗜盐性的革兰氏阴性无芽孢菌,主要分布在气候条件温暖的海洋和河口环境中,在鱼、虾贝类等水产品中广泛存在[1]。人食用被该菌污染的,生的或未煮熟的水产品可导致急性胃肠炎,症状包括腹泻、恶心、呕吐、发热、脱水、昏迷甚至死亡[2–3]。此外,副溶血弧菌还可通过开放性伤口感染人类,严重时可引发高死亡率的败血症[4]。副溶血弧菌作为世界范围内重要的食源性致病菌,不仅阻碍了水产品养殖业的发展,对人类健康也构成了严重威胁[5]。副溶血弧菌能够在全球范围内流行,与其黏附因子、溶血性毒素、蛋白酶、侵袭因子、外膜蛋白、摄铁系统、Ⅲ型分泌系统(T3SS)和Ⅵ型分泌系统(T6SS)等毒力因子息息相关[6–7]。
外膜蛋白(outer membrane proteins,OMPs)作为细菌外膜的主要结构之一,位于细胞的最外层,是菌体抵御外界环境的重要屏障。由于其特殊的定位,OMPs在革兰氏阴性菌维持膜的完整性、适应外界环境的变化、对宿主的感染和致病中起着关键作用[8]。此外,OMPs是一种高度免疫原性的细菌成分,被认为是潜在的候选疫苗来源之一[9]。
转录调控因子OmpR是一类外膜蛋白,与EnvZ共同组成了EnvZ/OmpR双组份调控系统[10]。已有研究表明OmpR参与不同病原体的多种生物学过程,如OmpR在大肠杆菌渗透压应激的反应中起关键作用[11];OmpR在沙门氏菌中能够调控多种毒力相关基因的表达[12];OmpR与欧文氏菌多糖的合成、运动以及T3SS基因的表达有关等[13]。目前,OmpR在副溶血弧菌中功能研究未见报道。本试验选取ompR (VP0154)基因作为研究对象,构建了副溶血弧菌SH112株ompR基因缺失株(ΔompR)和互补株(CΔompR),以探究OmpR在副溶血弧菌生物学特性及致病性中发挥的作用。
1 材料与方法 1.1 菌种、质粒、试剂和实验动物副溶血弧菌临床分离株SH112 (tdh+,血清型O3∶K6)、大肠杆菌HB101 (pRK2013)、大肠杆菌CC118λpir、同源重组质粒菌(pYAK1)、互补质粒菌(pMMB207)以及HeLa细胞均由本实验室保存;细菌基因组提取试剂盒购于南京诺唯赞生物科技有限公司;质粒小提试剂盒购于天根生化科技有限公司;CytoTox 96®非放射性细胞毒性检测试剂盒购自Promega公司;限制性内切酶和T4 DNA连接酶购自大连宝生物工程有限公司;DMEM细胞培养基和胎牛血清均购自Gibco公司;高速低温离心机购自Eppendorf公司;ICR (Institute of Cancer Research)小鼠购自上海杰思捷实验动物有限公司。
1.2 引物设计和合成根据GenBank上副溶血弧菌RIMD2210633标准株的ompR (VP0154)基因序列,用Primer Premier5.0软件设计引物(表 1)。其中引物sacB-F/R用于检测位于质粒pYAK1的多克隆酶切位点外侧的sacB基因,以判断同源重组后质粒在细菌中的凋亡情况。
| Primers | Sequences (5′→3′) | Restriction site | Target gene/bp |
| ompR-A | ACCGGATCCTGAAAGCCGTGATTTGTGGT | BamH I BamH I | 619 |
| ompR-B | TGAAACATCCTTTCAGAAGCATCTATT | ||
| ompR-C | TGAAAGGATGTTTCA CTCTTACTCGCTTAAC | 355 | |
| ompR-D | ACCCTGCAGTCACGCCCAACCTTTCTAAT | Pst I | |
| ompR-E | ACCATCGTAGATTACTCACC | Wild type: 2 671 Mutant: 1 951 |
|
| ompR-F | TTTGTTTACAGGCTTTAGAT | ||
| pMMB-F | GGCCTGCAGATGCAGGAAAATCATAAAAT | Pst I Pst I | 738 |
| pMMB-R | ATTGAGCTC TTACGACTCTTTGCCGTCTG | Sac I Sac 1 | |
| sacB-F | ACGGCACTGTCGCAAACTATA | 600 | |
| sacB-R | TTCCGTCACCGTCAAAGAT | ||
| a: restriction enzyme sites are underlined. | |||
1.3 ompR基因缺失株与互补株的构建
缺失株的构建:以副溶血弧菌SH112株为野生株(wild type strain,WT),基因缺失株的构建采用同源重组方法,所用的引物见表 1。分别以ompR-A/ompR-B和ompR-C/ompR-D为引物,以副溶血弧菌SH112基因组DNA为模板进行第一轮PCR扩增,从而产生同源臂AB和CD片段。再以同源臂AB和CD的PCR扩增片段为模板,ompR-A/ompR-D为引物进行第二轮融合PCR,获得缺失目的基因ompR的同源片段ompR-AD。将该片段用BamH I和Pst I进行双酶切后,连接到pYAK1质粒上获得携带同源臂而缺失靶基因的重组质粒。将重组质粒转入到大肠杆菌CC118λpir感受态细胞中,用含10 μg/mL氯霉素的LB平板筛选目标菌株,并提取DNA进行PCR鉴定。再以含有同源重组质粒的CC118λpir为供体菌,副溶血弧菌SH112株为受体菌,pRK2013-HB101为辅助菌进行接合转移。用含10 μg/mL氯霉素的TCBS平板和含20%蔗糖的LB平板筛选结合子。选取在10 µg/mL氯霉素的TCBS平板中未生长,而在含20%蔗糖LB平板中生长的细菌,用引物ompR-E/F和sacB-F/R进行鉴定。将构建成功的缺失株命名为ΔompR,于−80 ℃,25%甘油中冻存。
互补株的构建:以副溶血弧菌SH112株基因组DNA为模板,用引物pMMB-F/R扩增获得ompR整个ORF片段。将该片段与pMMB207质粒同时进行双酶切,经T4连接酶连接后转入CC118λpir感受态细胞中,并用10 μg/mL氯霉素的TCBS平板进行筛选,经PCR和测序鉴定后的阳性互补质粒,称为pMMB-ompR。分别以含互补质粒pMMB-ompR的CC118λpir为供体菌,ΔompR缺失株为受体菌,pRK2013-HB101为辅助菌进行结合转移,利用引物pMMB-F/R进行PCR鉴定,阳性株命名为互补株CΔompR。
1.4 生长曲线的测定将过夜培养的WT、ΔompR及CΔompR转接到3% NaCl-LB液体培养基(pH 7.2)中,37 ℃、180 r/min培养至对数生长期(OD600为0.20±0.02)。取100 μL各菌液于96孔无菌细胞培养板中,将培养板置于37 ℃培养箱中温育,每隔1 h测其OD600值,连续监测12 h,绘制各菌株的生长曲线并进行差异性分析。
1.5 运动性测定泳动运动(swimming):将WT、ΔompR和CΔompR培养至对数生长期,调整各菌液浓度一致,取1 µL的各菌液轻轻垂直点在泳动平板(含0.3%琼脂、3% NaCl的LB培养基)上,于37 ℃温箱内静置培养4 h,测量细菌泳动直径,并对各菌株的泳动能力进行分析。
群集运动(swarming):与泳动试验类似,取1 µL处于对数生长期的各菌液垂直点在群集运动平板上(含1.5%琼脂的HIB培养基),于30 ℃恒温培养箱静置培养16 h,测量细菌圆形运动直径的大小并拍照记录,并对各菌株的群集运动能力进行分析。试验重复3次,取其平均值。
1.6 生物被膜的测定将WT、ΔompR和CΔompR培养至对数生长期。取各菌液200 μL/孔至96孔板中,分别置于30、37 ℃恒温培养箱中静置培养48 h。弃去细菌培养物上清,用200 μL的PBS小心清洗3次并用100%甲醇固定15 min后,用200 μL的1%结晶紫染色15 min,染色结束后用PBS洗涤3次后自然风干。最后加入200 μL 95%酒精溶液作用10 min,并用酶标仪测量OD595。
1.7 细胞黏附试验用10% FBS-DMEM培养基将HeLa细胞培养至24孔细胞培养板中,于37 ℃、5% CO2细胞培养箱中培养至细胞长势良好且大致铺满。以无抗生素的DMEM洗涤细胞3次后待用。将WT、ΔompR和CΔompR培养至对数生长期,用空白DMEM洗涤细菌1次,以感染率(multiplicity of infection,MOI)为100:1 (活菌数: 细胞数)感染HeLa细胞1 h。感染结束后用PBS小心洗涤3次后,每孔加入100 μL 0.5% Triton X-100作用20 min以裂解细胞。最后用无菌的PBS倍比稀释裂解液后涂布于3% NaCl-LB平板上,计算各菌株相对于野生株的黏附率。
1.8 细胞毒性检测将培养至对数生长期的WT、ΔompR和CΔompR调至菌含量一致,以MOI=100:1感染HeLa细胞1.5 h,并设置相应的对照孔。按照CytoTox96试剂盒说明书操作,检测各菌株对HeLa细胞的毒性作用。
1.9 小鼠毒力实验参照李洋洋等的方法[14],将3–4周龄的ICR雌鼠按体重均匀分成4组,即WT组、ΔompR组、CΔompR组和空白组,每组8只。将各菌株培养至生长对数期,用无菌生理盐水洗涤3次,调节其浓度至3×108 CFU/mL。酒精棉球擦拭小鼠腹部,将100 μL菌液注射到相应试验组的小鼠腹腔内,空白组注射相同剂量的无菌生理盐水。每小时观察1次,记录每组ICR小鼠的存活率,连续观察7 d,以时间作为横坐标,以各组小鼠存活率为纵坐标绘制各菌株感染ICR小鼠的存活率图。
1.10 组织载量测定将5周龄的小鼠按体重均匀分成4组,即WT组、ΔompR组、CΔompR组和空白组,每组10只小鼠。取对数生长期的细菌(5×107 CFU/mL)和无菌生理盐水各100 μL注射到相应小鼠的腹腔内。感染10 h后,从每组随机选取5只存活的小鼠进行无菌解剖,观察各组小鼠内脏的病理变化。制备各组小鼠心脏、肝脏、脾脏、肾脏的组织研磨液,用PBS倍比稀释后涂布于TCBS琼脂平板上,并计算各菌株在ICR小鼠各脏器组织中的细菌定殖数。
1.11 组织病理切片制备各菌株以每只5×106 CFU的剂量感染5周龄的小鼠10 h后,取各组存活小鼠的心脏、肝脏、脾脏和肾脏送往武汉赛维尔生物科技有限公司制作组织病理切片。
1.12 数据分析试验数据采用GraphPad Prism8软件进行单因素方差分析(one-way ANOVA),用平均数±标准差(x±SD)表示,P < 0.05认为是变化显著。
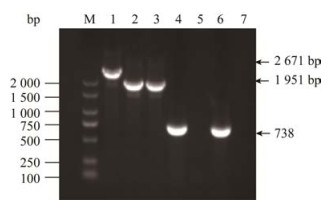
2 结果与分析 2.1 基因缺失株ΔompR和互补株CΔompR的鉴定以疑似阳性单菌落的基因组DNA为模板进行PCR鉴定,结果见图 1。用引物ompR-E/F扩增副溶血弧菌野生株基因组DNA获得的条带大小为2 671 bp (图 1,泳道1),而扩增缺失株ΔompR和互补株CΔompR基因组DNA获得1 951 bp的片段(图 1,泳道2,3)。用引物ompR-pMMB-F/R扩增副溶血弧菌野生株和互补株CΔompR因组DNA获得738 bp完整片段(图 1,泳道4,6),而缺失株ΔompR扩增不出目的条带(图 1,泳道5)。缺失株ΔompR基因组DNA用sacB-F/R引物扩增不出目的条带(图 1,泳道7)。证明缺失株ΔompR与互补株CΔompR构建成功。
|
| 图 1 ompR缺失株及互补株鉴定结果 Figure 1 PCR identification results of the ΔompR and CΔompR. M: DL2000; lane 1–7: primers of WT-E/F, ΔompR-E/F, CΔompR-E/F, WT-pMMB-F/R, ΔompR-pMMB-F/R, CΔompR-pMMB-F/R, sacB-F/R. |
2.2 ompR基因缺失不影响副溶血弧菌的生长能力
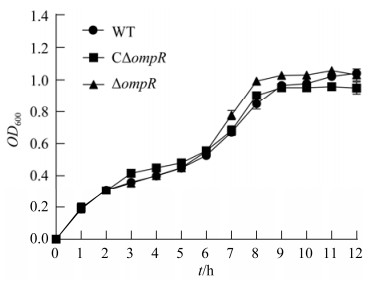
如图 2所示,缺失株ΔompR的生长速度和野生株WT相比差异不显著,表明ompR基因的缺失对副溶血弧菌的生长并无影响。
|
| 图 2 副溶血弧菌野生株(WT)、缺失株(ΔompR)及互补株(CΔompR)的生长曲线 Figure 2 The growth curve of the wild-type (WT), mutant strain (ΔompR) and complement strain (CΔompR). |
2.3 OmpR不参与副溶血弧菌的泳动及群集运动过程
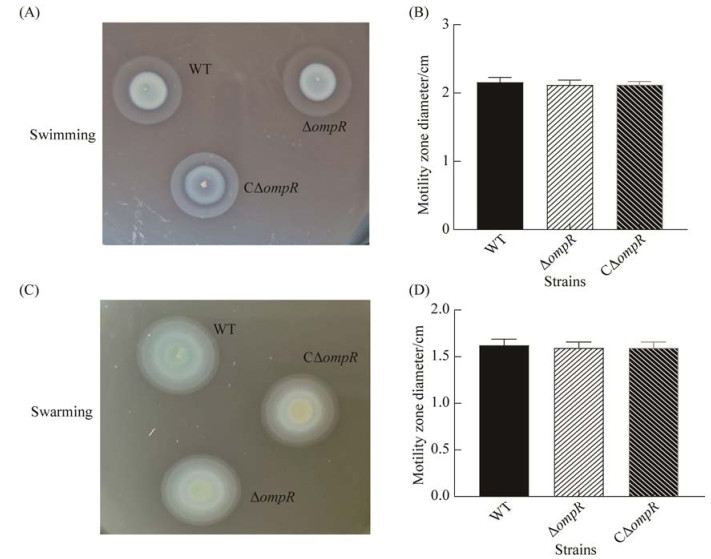
在泳动平板上培养4 h时,各菌株在灯光下出现半透明的圆形运动轨迹(图 3A)。泳动直径测量统计结果显示(图 3B),缺失株ΔompR的泳动能力与野生株WT和互补株CΔompR相比没有显著差异。各菌株在群集平板上均表现出明显的运动性(图 3C)。对各菌株的运动直径进行分析,结果显示(图 3D),缺失株ΔompR的群集运动能力与野生株WT和互补株CΔompR相比没有显著差异。提示ompR基因缺失不影响副溶血弧菌泳动及群集运动能力。
|
| 图 3 各菌株在泳动平板(A, B)和群集运动平板(C, D)上的运动轨迹和运动直径 Figure 3 The swimming pattern (A) and motility zone diameter (B) of the strains and the swarming pattern (C) and motility zone diameter (D) of the strains. P > 0.05. |
2.4 OmpR与副溶血弧菌生物被膜形成能力相关
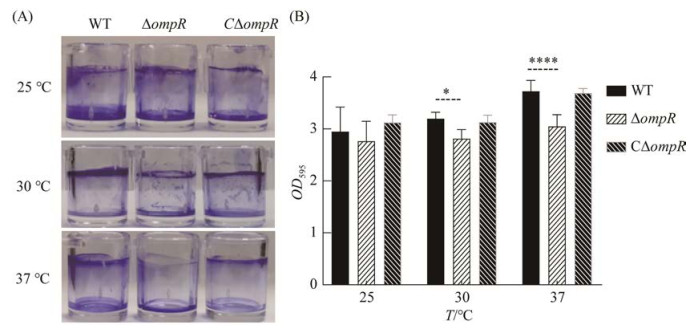
经48 h温箱孵育,用结晶法比较WT、ΔompR与CΔompR在不同培养温度下生物被膜形成能力的差异。结果显示(图 4),各菌株在25 ℃培养时,缺失株ΔompR生物被膜的形成能力与野生株WT以及互补株CΔompR相比,没有显著差异。在30、37 ℃的培养条件下,与野生株WT相比,缺失株ΔompR生物被膜形成能力显著降低,互补株CΔompR生物被膜形成能力均恢复至野生株水平。以上结果表明:在25 ℃的条件中生长时,ompR基因的缺失不影响副溶血弧菌生物被膜的形成;但随着环境温度的升高,与WT相比,缺失株ΔompR生物被膜形成能力下降得越明显,表明OmpR对副溶血弧菌在温暖环境中生物被膜的形成能力起重要作用。
|
| 图 4 各菌株培育48 h后结晶紫染色情况(A)及生物被膜形成能力(B) Figure 4 Biofilm formation of the strains by crystal violet staining with visual signs (A) and measured data (B) at 48 h. *: P≤0.1; ****: P≤0.000 1. |
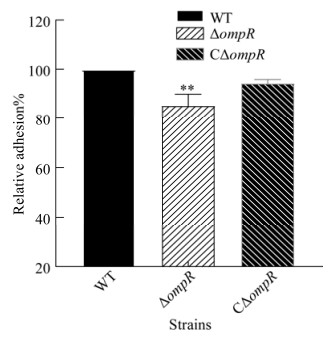
2.5 OmpR参与副溶血弧菌对细胞的黏附过程
以MOI=100:1感染HeLa细胞1 h,各菌株的细胞黏附结果(图 5)显示,缺失株ΔompR的黏附率与野生株WT相比显著降低,互补株CΔompR的细胞黏附能力恢复到野生株水平。表明OmpR参与副溶血弧菌对HeLa细胞的黏附过程。
|
| 图 5 黏附试验 Figure 5 Adhesion experiment. **: P≤0.01. |
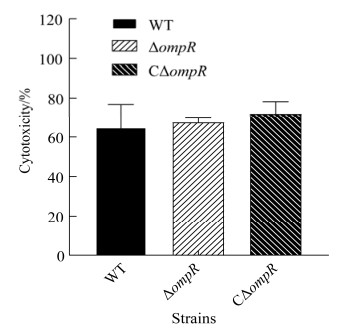
2.6 ompR基因缺失不影响副溶血弧菌对细胞的毒性作用
各菌株以MOI=100:1感染HeLa细胞1.5 h,结果显示,缺失株ΔompR对HeLa细胞的毒性作用与野生株相比差异不显著,表明OmpR与副溶血弧菌对HeLa细胞的毒性作用无关(图 6)。
|
| 图 6 细胞毒性试验 Figure 6 Cytotoxicity test. |
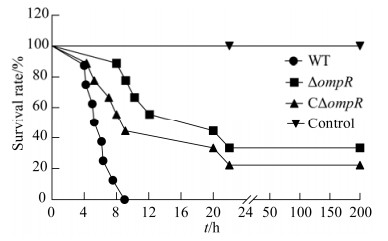
2.7 OmpR参与副溶血弧菌对小鼠的毒力作用
毒力试验结果显示,小鼠感染副溶血弧菌野生株2 h后开始出现精神委顿、呼吸急促、眼球充血、粪便稀薄等临床症状,并很快全部死亡,存活率为0;缺失株ΔompR组临床症状与野生株相比有所减弱,且开始死亡时间较野生株组延后,存活率为25%;CΔompR互补株组小鼠症状与野生株组相类似,存活率为12.5%。空白对照组小鼠未见以上临床症状,存活率为100% (图 7)。以上结果表明,ompR基因缺失使副溶血弧菌对小鼠的毒力有所降低,提示OmpR参与了副溶血弧菌对小鼠的致病过程。
|
| 图 7 OmpR与小鼠的致死率有关 Figure 7 OmpR is responsible for mouse lethality. |
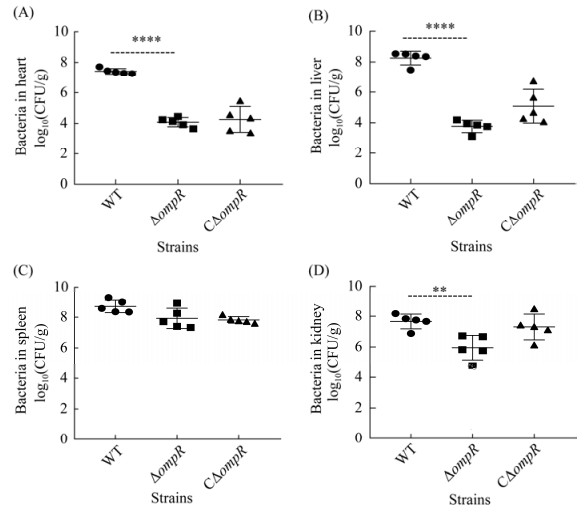
2.8 OmpR参与副溶血弧菌在小鼠组织的定殖过程
如图 8所示,ΔompR缺失株在脾脏的细菌定殖数与野生株相比没有显著差异(图 8C),在心脏、肝脏和肾脏(图 8A、8B、8D)的细菌定殖数均显著低于野生株。提示OmpR与副溶血弧菌的致病性相关。
|
| 图 8 各菌株在小鼠心(A)、肝(B)、脾(C)、肾组织(D)的细菌载量 Figure 8 Bacterial loads in heart (A), liver (B), spleen (C) and kidney (D) of infected mice. **: P≤0.01; ****: P≤0.000 1. |
2.9 病理切片观察分析
将各菌株以5.0×106 CFU的细菌量感染小鼠10 h后,取存活小鼠的心脏、肝脏、脾脏、肾脏制作病理切片,结果如图 9所示。心脏:各组小鼠心脏均无明显的病理变化;肝脏:WT组小鼠病理切片可见大量的血管充满淤血,ΔompR和CΔompR组小鼠肝脏内少量的血管充满淤血;脾脏:WT组可见少量的髓窦重度扩张,大量的白髓内可见中等量的凋亡小体,红髓内可见少量的粒细胞浸润。ΔompR组脾脏少量的髓窦轻度淤血扩张,红髓大面积淤血,可见大量的粒细胞浸润;肾脏:WT组小鼠病理切片可见皮质少量的肾小管与髓质大量的集合管轻度扩张,上皮扁平化,大量的血管可见淤血。ΔompR组脾脏皮髓质分界清晰,皮质中肾小球分布均匀,髓质集合管排列规则,多量的血管可见淤血。CΔompR组多量的血管可见淤血。整体综合考虑病变情况WT组严重于ΔompR和CΔompR组。
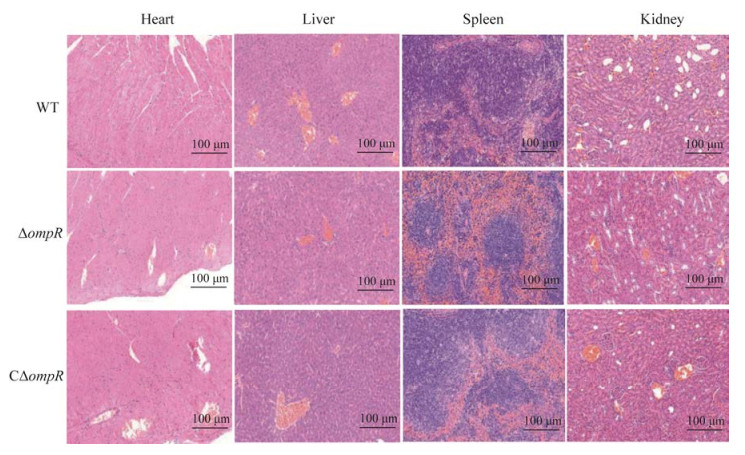
|
| 图 9 不同感染组的组织切片 Figure 9 Different tissue sections from mice in different groups. |
3 讨论
细菌通过分泌系统分泌蛋白和毒素进入外界环境,以提高其环境适应性和致病力[15]。T6SS与副溶血弧菌的环境适应性和致病性密切相关,其生物学活性主要通过效应因子来实现[16]。我们实验室前期通过差异蛋白质组学筛选到了副溶血弧菌T6SS1潜在的效应因子OmpR (VP0154基因编码),本试验拟对其功能进行深入研究。
外膜蛋白OmpR是EnvZ/OmpR双组份调控系统中的调节蛋白,磷酸化的OmpR参与多种信号转导[10]。已有研究表明,OmpR对病原菌的渗透压、酸应激、细胞侵袭能力等有重大意义[17]。本研究构建了ompR基因缺失株和互补株,发现缺失ompR基因不影响副溶血弧菌的生长特性。运动性参与病原菌最初的侵袭和定殖,是许多病原菌重要的毒力因子[18]。Tipton等[19]研究表明OmpR参与调控E. coli中鞭毛的合成和细菌的运动能力,并且OmpR可以调控鲍曼不动杆菌在0.3%琼脂平板上的运动能力。冯寒霜[20]研究发现ompR基因缺失使禽致病性大肠杆菌的运动性极显著降低。但本研究发现OmpR不参与与副溶血弧菌泳动及群集运动,提示OmpR在不同病原菌中发挥的作用不尽相同。
副溶血弧菌能通过分泌不同类型的黏附因子,定殖宿主表面并形成生物膜,提高副溶血弧菌的生存能力。Tipton等[19]研究表明,OmpR对鲍曼不动杆菌的生物膜没有显著性影响。而宋雪迎等[21]发现OmpR参与大肠杆菌生物被膜的形成过程。副溶血弧菌在不同的环境温度中生物被膜的形成能力不同[22]。为研究ompR基因对副溶血弧菌生物被膜形成能力的影响,本研究分别比较了各组菌株在不同温度中生物被膜形成能力的差异,发现在30 ℃和37 ℃中培养时:与野生株相比,缺失株ΔompR生物被膜的形成能力均显著降低,且在37 ℃条件下ΔompR生物被膜形成能力下降得更明显,表明ompR基因参与副溶血弧菌生物被膜的形成过程,且与温度相关。
黏附是细菌攻击宿主细胞的第一步,细菌对宿主细胞的作用与副溶血弧菌在宿主体内的定殖和侵袭有关[23]。董洪艳等[24]研究表明OmpR不参与肠炎沙门氏菌对上皮细胞的吸附和侵入过程。而林立萍等[25]研究发现OmpR可增强伤寒沙门菌对HeLa细胞的侵袭能力。本研究发现ompR基因缺失后能显著降低副溶血弧菌对HeLa细胞的黏附能力,但不影响副溶血弧菌对HeLa细胞的毒性作用。已有研究报道表明OmpR参与对动物的致病性过程,如冯寒霜[20]发现ompR基因缺失使禽致病性大肠杆菌对鸡的致病力下降74.98倍。董洪艳等[23]研究发现伤寒沙门氏菌缺失ompR基因后对小鼠的毒力减弱了106倍。本研究通过动物实验也发现,与感染野生株相比,感染ΔompR的小鼠存活率升高了25%,且小鼠的组织病变程度更低。体内攻毒试验进一步发现在攻毒10 h后,缺失株ΔompR在脾脏的细菌定殖数与野生株相比没有显著差异,但在心脏、肝脏和肾脏的细菌定殖数均显著低于野生株。以上结果提示OmpR与副溶血弧菌的致病性密切相关。
综上所述,本研究通过对ompR缺失株进行生物学特性和致病性分析,发现ompR基因缺失对副溶血弧菌的生长特性、运动性特性和细胞毒性无显著影响,但OmpR参与副溶血弧菌生物被膜的形成、对HeLa细胞的黏附作用以及对小鼠的毒性作用,提示OmpR是副溶血弧菌重要的毒力因子,其作用机理和分子机制还需要进一步探明。
| [1] | De Silva RS, Kovacikova G, Lin W, Taylor RK, Skorupski K, Kull F. Crystal structure of the virulence gene activator AphA from Vibrio cholerae reveals it is a novel member of the winged helix transcription factor superfamily. Journal of Biological Chemistry, 2005, 280: 13779-13783. DOI:10.1074/jbc.M413781200 |
| [2] | Shimohata T, Takahashi A. Diarrhea induced by infection of Vibrio parahaemolyticus. The Journal of Medical Investigation, 2010, 57(3, 4): 179-182. |
| [3] | Daniels NA, MacKinnon L, Bishop R, Altekruse S, Ray B, Hammond RM, Thompson S, Wilson S, Bean NH, Griffin PM, Slutsker L. Vibrio parahaemolyticus infections in the United States, 1973-1998. The Journal of Infectious Diseases, 2000, 181(5): 1661-1666. DOI:10.1086/315459 |
| [4] | Strom MS, Paranjpye RN. Epidemiology and pathogenesis of Vibrio vulnificus. Microbes and Infection, 2000, 2(2): 177-188. DOI:10.1016/S1286-4579(00)00270-7 |
| [5] |
Wang FQ, Sun YZ, Ren LH, Jiang XY, Jiang F, Cui YM, Liu LJ. Research progress on the main pathogenic Vibrio affecting aquatic animals in mariculture. Chinese Fishery Quality and Standards, 2018, 8(2): 49-56.
(in Chinese) 王凤青, 孙玉增, 任利华, 姜向阳, 姜芳, 崔艳梅, 刘丽娟. 海水养殖中水产动物主要致病弧菌研究进展. 中国渔业质量与标准, 2018, 8(2): 49-56. DOI:10.3969/j.issn.2095-1833.2018.02.007 |
| [6] | Broberg CA, Calder TJ, Orth K. Vibrio parahaemolyticus cell biology and pathogenicity determinants. Microbes and Infection, 2011, 13(12/13): 992-1001. |
| [7] | Zhang LL, Orth K. Virulence determinants for Vibrio parahaemolyticus infection. Current Opinion in Microbiology, 2013, 16(1): 70-77. DOI:10.1016/j.mib.2013.02.002 |
| [8] | Rollauer SE, Sooreshjani MA, Noinaj N, Buchanan SK. Outer membrane protein biogenesis in Gram-negative bacteria. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2015, 370(1679): 20150023. DOI:10.1098/rstb.2015.0023 |
| [9] | Yang Q, Pan YL, Wang KY, Wang J, He Y, Wang EL, Liu T, Yi Geng, Chen DF, Huang XL. OmpN, outer membrane proteins of Edwardsiella ictaluri are potential vaccine candidates for channel catfish (Ictalurus punctatus). Molecular Immunology, 2016, 78: 1-8. DOI:10.1016/j.molimm.2016.08.011 |
| [10] | Chakraborty S, Winardhi RS, Morgan LK, Yan J, Kenney LJ. Non-canonical activation of OmpR drives acid and osmotic stress responses in single bacterial cells. Nature Communications, 2017, 8: 1587. DOI:10.1038/s41467-017-02030-0 |
| [11] | Skerker JM, Prasol MS, Perchuk BS, Biondi EG, Laub MT. Two-component signal transduction pathways regulating growth and cell cycle progression in a bacterium: a system-level analysis. PLoS Biology, 2005, 3(10): e334. DOI:10.1371/journal.pbio.0030334 |
| [12] | Bang IS, Kim BH, Foster JW, Park YK. OmpR regulates the stationary-phase acid tolerance response of Salmonella enterica serovar typhimurium. Journal of Bacteriology, 2000, 182(8): 2245-2252. DOI:10.1128/JB.182.8.2245-2252.2000 |
| [13] | Li WT, Ancona V, Zhao YF. Co-regulation of polysaccharide production, motility, and expression of type Ⅲ secretion genes by EnvZ/OmpR and GrrS/GrrA systems in Erwinia amylovora. Molecular Genetics and Genomics: MGG, 2014, 289(1): 63-75. DOI:10.1007/s00438-013-0790-4 |
| [14] |
Li YY, Wang Q, Guo R, Zhang HY, Liu PX, Qi Y, Fang WH, Sun WD, Jiang A. Study on biological characteristics and pathogenicity of VPA1500 gene knock-out mutant of Vibrio parahaemolyticus. Acta Microbiologica Sinica, 2021, 61(12): 3937-3951.
(in Chinese) 李洋洋, 王权, 郭容, 张海洋, 刘鹏选, 齐瑜, 方维焕, 孙卫东, 蒋蔚. VPA1500基因缺失对副溶血弧菌生物学特性和致病性的影响. 微生物学报, 2021, 61(12): 3937-3951. |
| [15] | Bönemann G, Pietrosiuk A, Mogk A. Tubules and donuts: a type Ⅵ secretion story. Molecular Microbiology, 2010, 76(4): 815-821. DOI:10.1111/j.1365-2958.2010.07171.x |
| [16] | Lien YW, Lai EM. Type Ⅵ secretion effectors: methodologies and biology. Frontiers in Cellular and Infection Microbiology, 2017, 7: 254. DOI:10.3389/fcimb.2017.00254 |
| [17] | 林立萍. OmpR调控伤寒沙门菌毒力分子机制的初步研究. 江苏大学硕士学位论文, 2019. |
| [18] | Sun E, Liu SJ, Hancock REW. Surfing motility: a conserved yet diverse adaptation among motile bacteria. Journal of Bacteriology, 2018, 200(23): e00394-18. |
| [19] | Tipton KA, Rather PN. An ompR-envZ two-component system ortholog regulates phase variation, osmotic tolerance, motility, and virulence in Acinetobacter baumannii strain AB5075. Journal of Bacteriology, 2017, 199(3): e00705-16. |
| [20] | 冯寒霜. 二元调控系统ompR/envZ对APEC致病性的影响. 安徽农业大学硕士学位论文, 2020. |
| [21] |
Song XY, Fu JJ, Pan YJ, Zhao Y. The developmental process of biofilm by pathogenic and non-pathogenic Vibrio parahaemolyticus at different temperatures. Beijing China, 2016, 2.
(in Chinese) 宋雪迎, 付娇娇, 潘迎捷, 赵勇. 致病性与非致病性副溶血弧菌在不同温度条件下生物被膜形成过程研究. 中国北京, 2016, 2. |
| [22] | 张同超. 猪肠外致病性大肠杆菌双组份系统对(p)ppGpp的调控研究. 华中农业大学硕士学位论文, 2019. |
| [23] | Navarre WW, Schneewind O. Surface proteins of Gram-positive bacteria and mechanisms of their targeting to the cell wall envelope. Microbiology and Molecular Biology Reviews: MMBR, 1999, 63(1): 174-229. DOI:10.1128/MMBR.63.1.174-229.1999 |
| [24] |
Dong HY, Peng DX, Jiao XA, Zhang XR, Chen SJ, Lu Y, Geng SZ, Liu XF. Construction and characterization of an ompR gene deletion mutant from Salmonella enteritidis. Acta Microbiologica Sinica, 2011, 51(9): 1256-1262.
(in Chinese) 董洪燕, 彭大新, 焦新安, 张小荣, 陈素娟, 卢艳, 耿士忠, 刘秀梵. 肠炎沙门氏菌鸡源株ompR基因缺失株的构建及生物学特性与亲本株的比较. 微生物学报, 2011, 51(9): 1256-1262. |
| [25] |
Lin LP, Zhang LL, Yi ZY, Zhao YW, Li X, Tang H, Huang XX, Zhang Y. Effect of OmpR on the invasion of Salmonella enterica serovar typhi. Journal of Jiangsu University: Medicine Edition, 2019, 29(2): 128-132.
(in Chinese) 林立萍, 张连璐, 易周易, 赵雅闻, 李雪, 唐浩, 黄新祥, 张盈. OmpR对伤寒沙门菌侵袭上皮细胞能力的影响. 江苏大学学报: 医学版, 2019, 29(2): 128-132. |
 2022, Vol. 62
2022, Vol. 62




