中国科学院微生物研究所,中国微生物学会
文章信息
- 王润博, 王泽铭, 王红越, 于景丽. 2022
- WANG Runbo, WANG Zeming, WANG Hongyue, YU Jingli.
- 土壤稳定性有机碳组分与优势细菌门类陆向分布及相关性
- Landward distribution and association of the soil stable organic carbon fractions and dominant bacterial phyla
- 微生物学报, 62(6): 2389-2402
- Acta Microbiologica Sinica, 62(6): 2389-2402
-
文章历史
- 收稿日期:2022-02-15
- 修回日期:2022-03-24
- 网络出版日期:2022-04-17
2. 内蒙古自治区环境污染控制与废物资源化重点实验室, 内蒙古 呼和浩特 010021;
3. 内蒙古大学生态与环境学院, 内蒙古 呼和浩特 010021
2. Inner Mongolia Key Laboratory of Environmental Pollution Control & Waste Resource Reuse, Hohhot 010021, Inner Mongolia, China;
3. School of Ecology and Environment, Inner Mongolia University, Hohhot 010021, Inner Mongolia, China
土壤圈有机碳是地球表层系统最大的碳库(约1 550 Gt),高于生物圈碳库(560 Gt)和大气圈碳库(760 Gt)的总和[1]。腐殖物质(humic substances)被认为是表征稳定性有机碳(stable organic carbon,SOC)的重要功能指标[2],依据耐酸碱性可区分为最稳定的胡敏素(humin,HM)、较稳定的胡敏酸(humic acid,HA)和次稳定的富里酸(fulvic acid,FA)等组分[2]。腐殖物质组分及含量差异与土壤类型、植被类型及水分变化等有关[2–4],并随着土地利用变化、耕作方式、施肥措施的变化表现出时空分布的异质性特征[3–4]。Mielnik等用高敏感性荧光光谱检测技术证明,腐殖物质组成在30年内未发生变化,但弃耕后土壤湿度降低会影响土壤有机质腐殖化的方向[5]。大量的研究证明,腐殖物质广泛分布在水体[6–7]、湿地[8]、旱地[9–11]土壤中。但关于腐殖物质在由水及陆这一环境梯度下如何分布的研究极为匮乏。这给局域、区域、全球尺度下准确评估土壤稳定性有机碳的陆向分布动态及碳达峰水平带来不便。
微生物群落在维持土壤圈FA、HA、HM与大气圈CH4、CO2平衡及驱动稳定性碳库与活性碳库转化等方面发挥杠杆作用[3,12]。其中变形菌门是腐殖物质的主要降解菌,而变形菌门、放线菌门、拟杆菌门和厚壁菌门是HA的主要降解菌[13]。湖泊沉积物中变形菌门等优势门类能促进HA逐级转化为FA、芳香族化合物和溶解性有机物[14]。Trap等研究山毛榉4个林龄时间序列下形态未变化、碎片化、完全变化的枯落物和土壤微生物群落的关系,发现枯落物的形态与细菌群落功能多样性存在显著相关性[15]。可见,细菌群落组成功能变化与土壤腐殖物质组分的转化有关。
锡林河流域是蒙古高原半干旱区最具代表性的生态系统类型,集水生、湿生、旱生环境于一体[16],是研究陆向分布的“天然实验室”。研究文选择长期性水流、季节性水流、长期性无水流代表陆向梯度,选择FA、HA、HM代表稳定性有机碳组分,研究局域尺度下土壤稳定性有机碳组分及主要细菌门类的陆向分布特征及其相关性,为解析区域及全球尺度下土壤稳定性有机碳转化及其与微生物功能群的关系提供科学思路,亦可为土壤圈碳封存能力和大气圈含碳温室气体减排提供科学导向。
1 材料与方法 1.1 研究区概况与样品的采集研究区位于中国科学院内蒙古草原生态系统定位研究站附近的锡林河湿地及羊草(Leymus chinensis)和大针茅(Stipa grandis)典型草原旱地(表 1),锡林河湿地植被主要包括长期性水流区水莎草(Juncellus serotinus)、季节性水流区灯芯草(Juncus effusus)和鹅绒委陵菜(Potentilla anserina)[16]。该区气候为中温带半干旱大陆性季风气候,四季分明,年平均降雨量296.3 mm,近60年的年均温2.6 °C,最高月份(7月)均温22.4 °C,最低月份(1月)均温–21 °C[16]。
| Soil code | Vegetation type | Hydrographic features | Habitat features | Soil texture | Latitude (N) | Longitude (E) | Altitude/(m) |
| Np | No plant | Long-term flow | Wetland | Sand | 43°36′36″ 43°45′32″ |
116°41′08″ 116°41′19″ |
1 164 1 167 |
| Js | Juncellus serotinus | Silt loam | 43°37′33〞 43°37′37″ |
116°41′08″ 116°41′19″ |
1 163 1 166 |
||
| Je | Juncus effusus | Seasonal flow | Wetland | Sand | 43°36′36″ 43°37′31″ |
116°41′06″ 116°41′07″ |
1 169 1 174 |
| Pa | Potentilla anserina | Silt loam | 43°36′35″ 43°37′40″ |
116°39′25″ 116°41′12″ |
1 178 1 185 |
||
| Lc | Leymus chinensis | Long-term no-flow | Dryland | Loam | 43°33′4″ 43°37′41″ |
116°40′22″ 116°41′22″ |
1 186 1 188 |
| Sg | Stipa grandis | Silt loam | 43°32′33″ 43°35′56″ |
116°33′30″ 116°44′20″ |
1 195 1 201 |
采样时间为2020年7月5日,沿着由水及陆的方向依次采集长期性水流区无植被带(Np)和水莎草样带(Js)湿地土壤,季节性水流区灯芯草样带(Je)和鹅绒委陵菜样带(Pa)湿地土壤,长期性无水流区羊草样带(Lc)和大针茅样带(Sg)旱地土壤(表1)。每个植被带沿河流流向分别采集3份0–10 cm表层土壤样品,6个植被带共18份土样。样品装入无菌塑封袋冰上保存运回实验室。样品的保存及预处理过程参考文献[14]的方法,部分样品室温风干后用于SOC组分的检测,部分样品–80 °C冷冻后用于微生物的分子生物学分析。
1.2 稳定性有机碳组分的提取及检测本文选择腐殖物质中富里酸FA、胡敏酸HA、胡敏素HM 3种代表SOC组分,其提取检测参考国际腐殖物质协会(International Humic Substances Society,IHSS)推荐的方法,具体操作步骤如下。
1.2.1 土壤SOC的预处理称取5.00 g过0.25 mm筛的土样于100 mL塑料离心管中,加入30 mL蒸馏水(水土比为6:1),在70 °C恒温水浴振荡器上振荡1 h,再以3 500 r/min离心15 min后弃去上清液,保留沉淀。
1.2.2 三种SOC组分的提取向上述沉淀中加入30 mL 0.1 mol/L NaOH与0.1 mol/L Na4P2O7混合液,在70 °C恒温水浴振荡器上振荡1 h,以3 500 r/min离心15 min,将上清液用中速定量滤纸过滤到50 mL容量瓶中,用10 mL 0.1 mol/L NaOH与0.1 mol/L Na4P2O7混合液清洗残渣2次,将清洗液合并到50 mL容量瓶中,用蒸馏水定容。此溶液即为FA和HA共存的腐殖酸,残渣即为HM。吸取上述腐殖酸30 mL,用0.5 mol/L H2SO4溶液调节pH至1.0–1.5,65 °C下保温1.5 h,室温静置过夜确保HA完全沉淀,用中速定量滤纸过滤获得滤液FA。用0.025 mol/L H2SO4溶液洗涤沉淀3次获得沉淀HA,用0.050 mol/L NaOH溶液溶解并定容至50 mL容量瓶中。
1.2.3 三种SOC组分的测定使用总有机碳/总氮分析仪(multi N/C 3 100,Analytik Jena AG)测定FA、HA溶液的含 碳量;使用重铬酸钾外加热法测定HM的含 碳量。
1.3 土壤细菌门类的检测及生物信息学分析按照FastDNA Spin Kit for Soil (MP Biomedicals)说明书提取土壤样品中微生物总DNA。细菌16S rRNA基因PCR扩增引物为细菌V3–V4区的338F (5′-ACTCCTACGGGAGGC AGCA-3′)和806R (5′-GGACTACHVGGGTWTC TAAT-3′)[14]。具体扩增反应体系和工作条件见文献[14]。依托北京百迈客生物科技有限公 司Illumina MiSeq PE300测序平台进行高通量测序。
使用Trimmomatic软件删除测序接头、非特异性扩增片段、模糊碱基、单碱基高重复区及长度过短的序列以获得高质量序列;使用Flash软件将双端测序的基因序列进行拼接。运用UPARSE软件在97%相似度的水平上对可操作分类单元(operational taxonomic unit,OTU)进行聚类分析,同时剔除嵌合体。使用RDP classifier对每个OTU中的序列进行分类学注释,总共获得36个细菌门类。运用SILVA数据库将全部样品获取的36个细菌门类在每份样品中分配的门类及其对应的序列数进行组成的划分和相对丰度的计算。最后基于单个门类在所有样品中的最高相对丰度(≥4.96%)抽选出最优势的8个细菌门类进行分析。所有测序数据已上传至NCBI数据库,序列号为SRR8835404– 8835405、8835408、8835410、8835412–8835413、8835419、8835421–8835425、8835427–8835429、8835432、8835434–8835435。
1.4 数据的统计与分析使用Excel 2010进行基本数据的处理和表格制作,使用Origin 2021进行柱状图的绘制。使用SPSS 26.0进行单因素方差分析(analysis of variance,ANOVA)以及SOC组分与单一细菌门类的Pearson相关性分析。使用CANOCO 5.0 (Biometris-Plant Research International,Wageningen)对不同植被带SOC组分与优势细菌门类进行多重相关的冗余分析(redundancy analysis,RDA),通过CANOCO 5.0的变异权重分析(variation partitioning analysis,VPA)计算影响不同植被带SOC组分陆向分布的单个细菌门类的解释度。基于R语言ggcor程序包和corrplot程序包[17]生成Pearson相关性矩阵,同步利用dplyr程序包进行Mantel检验;利用lavaan程序包[18]构建结构方程模型(structural equation modeling,SEM)。
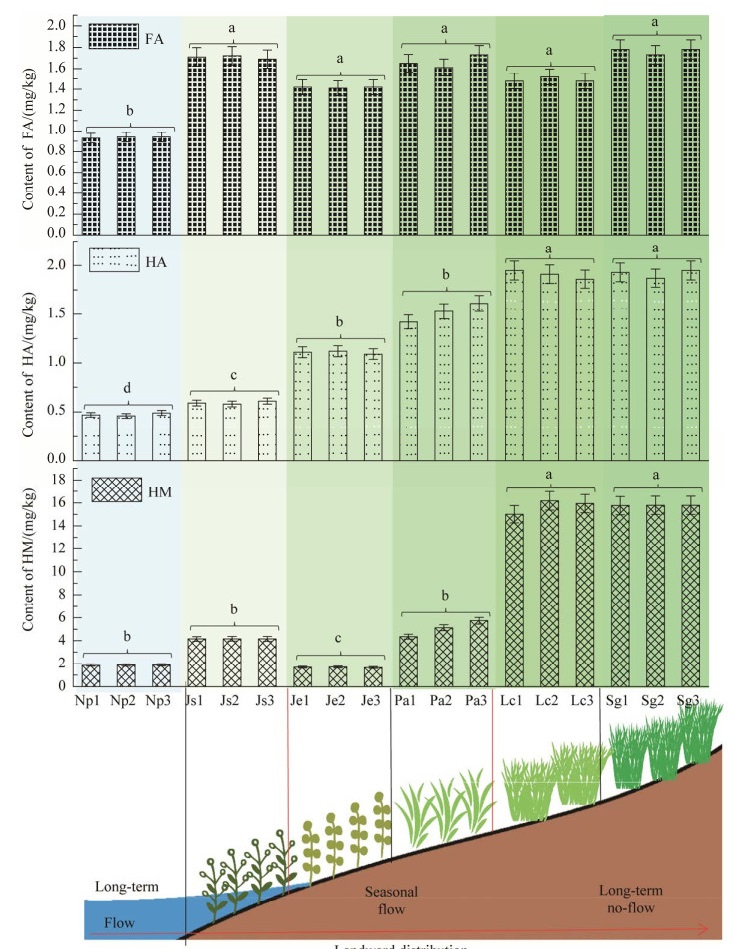
2 结果与分析 2.1 锡林河流域不同植被带土壤稳定性有机碳组分的陆向分布特征沿着长期性水流、季节性水流、长期性无水流的陆向梯度,SOC组分FA的含量呈现大致升高的波状分布趋势,在长期性水流的无植被样带Np湿地土壤中分布的含量 [(0.93±0.01) mg/kg]显著(P<0.05)低于其他5个植被带土壤[(1.41±0.01)–(1.75±0.03) mg/kg],但在5个植被带湿地或旱地土壤间FA含量差异不显著(P>0.05)(图 1)。
|
| 图 1 锡林河流域不同植被带土壤稳定性有机碳组分的陆向分布特征 Figure 1 The landward distribution characteristics of the soil stable organic carbon (SOC) fractions from different vegetation zones in Xilin River Basin. The same and different lowercase letters respectively indicated insignificant (P>0.05) and significant (P<0.05) differences of samples which were determined by one-way analysis of variance (ANOVA) followed by Games-Howell’s test. |
SOC组分HA的含量沿着长期性水流、季节性水流、长期性无水流的陆向梯度呈现逐渐升高的分布趋势,且在长期性水流区[(0.47±0.02)–(0.59±0.02) mg/kg]、季节性水流区[(1.11±0.02)–(1.52±0.10) mg/kg]、长期性无水流区[(1.90±0.05)–(1.92±0.04) mg/kg]三者间存在显著性差异(P<0.05),但长期性水流区无植被带Np与水莎草样带Js间、季节性水流区灯芯草样带Je和鹅绒委陵菜样带Pa间,长期性无水流区羊草样带Lc和大针茅样带Sg间HA含量差异不显著(P>0.05)(图 1)。
SOC组分HM的含量沿着长期性水流、季节性水流、长期性无水流的陆向梯度呈现先升高后降低再逐渐升高的分布趋势,在长期性无水流区羊草样带Lc和大针茅样带Sg旱地土壤中HM的含量[(15.71±0.08) mg/kg和(15.77±0.02) mg/kg]显著(P<0.05)高于其他4个样带湿地土壤中HM的含量[(1.69±0.02)–(5.07±0.70) mg/kg],且季节性水流的灯芯草样带Je湿地土壤中HM的含量[(1.69±0.02) mg/kg]显著(P<0.05)低于长期或季节性水流的其他3个植被带湿地中HM的含量[(1.88±0.01)–(5.07±0.70) mg/kg] (图 1)。
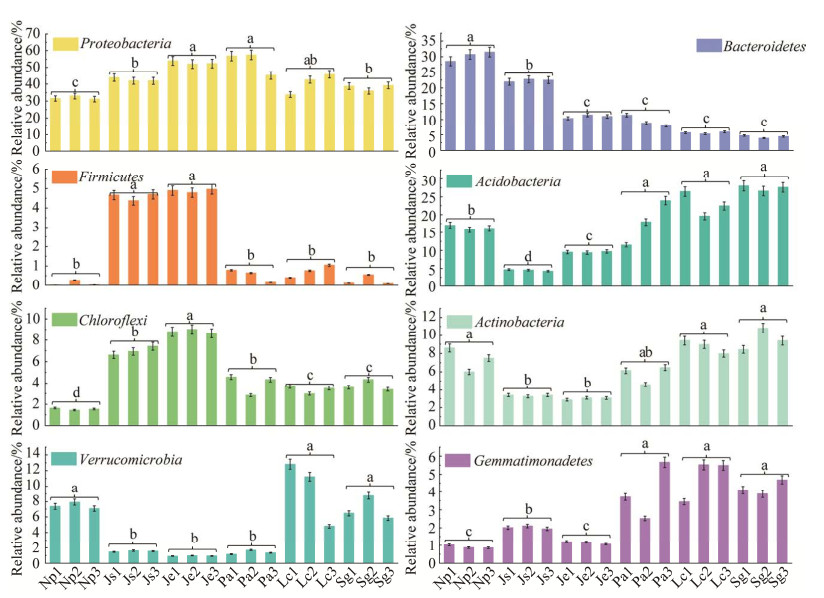
2.2 锡林河流域不同植被带土壤优势细菌门类的陆向分布特征沿着长期性水流、季节性水流、长期性无水流的陆向梯度,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)的相对丰度呈现先升高后降低的分布趋势;拟杆菌门的相对丰度呈现逐渐降低的分布趋势;酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)和疣微菌门(Verrucomicrobia)的相对丰度大致呈现先降低后升高的分布趋势;芽单胞菌门(Gemmatimonadetes)的相对丰度呈现大致升高的分布趋势(图 2)。其中,变形菌门的相对丰度在季节性水流区鹅绒委陵菜样带Pa湿地土壤中达到峰值(51.27%±6.20%),且显著(P<0.05)高于长期性水流区Np与Js和无水流区大针茅样带Sg;厚壁菌门和绿弯菌门的相对丰度均在季节性水流区灯芯草样带Je湿地土壤中达到峰值(4.87%±0.09%和8.81%±0.19%),且显著(P<0.05)高于长期性水流区Np和无水流区羊草样带Lc与大针茅样带Sg;拟杆菌门的相对丰度在长期性水流区无植被样带Np湿地土壤中达到峰值(30.00%±1.48%),且显著(P<0.05)高于其他5个植被带;芽单胞菌门和疣微菌门的相对丰度均在长期性无水流区羊草样带Lc旱地土壤中达到峰值(4.48%±1.03%和8.82%±4.00%),且显著(P<0.05)高于季节性水流区灯芯草Je和鹅绒委陵菜Pa样带;放线菌门和酸杆菌门的相对丰度均在长期性无水流区大针茅样带Sg旱地土壤中达到峰值(9.63%±1.18%和27.30%±0.80%),且显著(P<0.05)高于季节性水流区灯芯草Je和鹅绒委陵菜Pa样带(图 2)。
|
| 图 2 锡林河流域不同植被带土壤优势细菌门类的陆向分布特征 Figure 2 The landward distribution characteristics of the soil dominant bacterial phyla from different vegetation zones in Xilin River Basin. The same and different lowercase letters respectively indicated insignificant (P>0.05) and significant (P<0.05) differences of samples which were determined by one-way analysis of variance (ANOVA) followed by Dunnett’s test. |
2.3 锡林河流域不同植被带土壤稳定性有机碳组分与优势细菌门类的相关性
Pearson相关性分析结果(表 2)显示,稳定性有机碳SOC组分中FA含量与芽单胞菌门和拟杆菌门的相对丰度分别存在极显著(P<0.01)正相关和负相关关系;SOC组分中HA及HM含量与酸杆菌门(P<0.01及P<0.01)、放线菌门(P<0.05及P<0.01)、芽单胞菌门(P<0.01及P<0.01)、疣微菌门(P>0.05及P<0.01)的相对丰度均存在正相关关系;与拟杆菌门(P<0.01及P<0.01)、厚壁菌门(P>0.05及P<0.05)、绿弯菌门(P>0.05及P>0.05)的相对丰度存在负相关关系;三类SOC组分的含量与芽单胞菌门的相对丰度均呈极显著(P<0.01)正相关关系;SOC组分的含量与变形菌门的相对丰度呈现不显著(P>0.05)的正相关关系(FA及HA)及负相关关系(HM)。
| Biotic factors | Stable organic carbon (SOC) | ||
| Fulvic acid (FA) | Humic acid (HA) | Humin (HM) | |
| Proteobacteria | 0.396 | 0.170 | –0.259 |
| Bacteroidetes | –0.663** | –0.945** | –0.702** |
| Firmicutes | 0.188 | –0.427 | –0.484* |
| Chloroflexi | 0.379 | –0.157 | –0.340 |
| Acidobacteria | 0.100 | 0.761** | 0.762** |
| Actinobacteria | –0.041 | 0.578* | 0.757** |
| Gemmatimonadetes | 0.591** | 0.825** | 0.806** |
| Verrucomicrobia | –0.294 | 0.338 | 0.611** |
| *: correlation was significant at the 0.05 level (2-tailed); **: correlation was significant at the 0.01 level (2-tailed). | |||
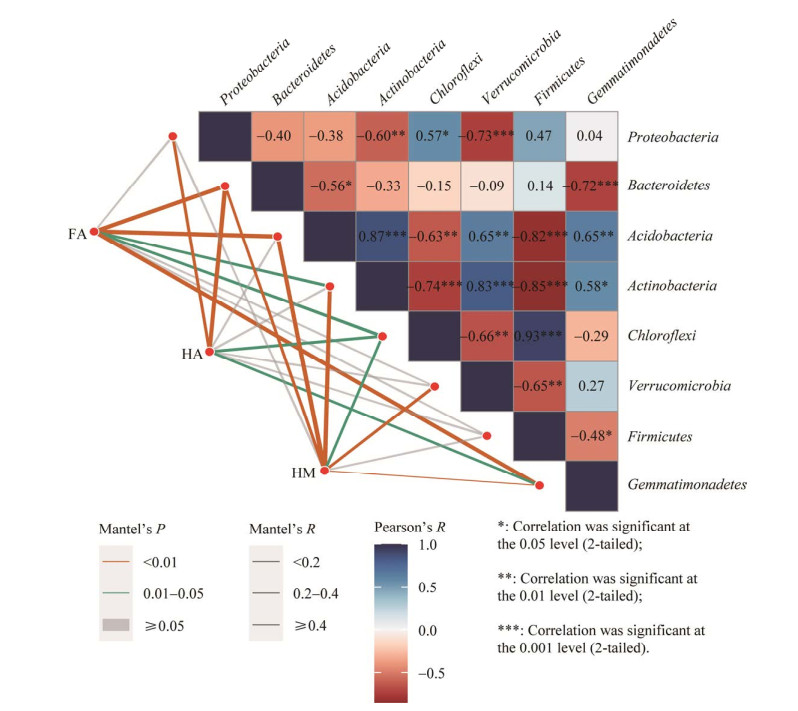
SOC组分与优势细菌门类的RDA结果(图 3A)显示,第一排序轴的解释度高达92.17%。VPA结果(图 3B)显示,芽单胞菌门、拟杆菌门、酸杆菌门、放线菌门对3类SOC陆向变异的绝对解释度分别为71.8%、54.0%、50.3%、45.9%。SOC组分与优势细菌门类的Mantel检验结果(图 4)与Pearson相关性分析结果一致,例如3类SOC组分含量与拟杆菌门的相对丰度存在极显著(P<0.01)相关性。综上,芽单 胞菌门、拟杆菌门、酸杆菌门、放线菌门是 影响3类SOC组分陆向分布的重要细菌门类(图 3B)。

|
| 图 3 土壤稳定性有机碳组分与优势细菌门类的冗余分析(A)和变异权重分析(B) Figure 3 Redundancy analysis (RDA) (A) and variation partitioning analysis (VPA) (B) between the soil stable organic carbon (SOC) fractions and dominant bacterial phyla. |
|
| 图 4 土壤稳定性有机碳组分与优势细菌门类的Mantel检验及优势细菌门类间的Pearson相关性分析 Figure 4 Mantel test between the soil stable organic carbon (SOC) fractions and dominant bacterial phyla as well as Pearson correlation analysis between dominant bacterial phyla. |
基于图 3B VPA结果抽选出最重要的4个细菌门类进行SEM拟合分析(箭头的直接和间接指向分别定义为直接和间接作用、路径系数的大小定义为重要值、箭头的绿色和红色分别代表正相关性和负相关性),发现芽单胞菌门对3类SOC组分的陆向分布异质性发挥正向(绿色线条)的直接作用,路径系数分别为FA=0.58、HA=0.12、HM=0.27;拟杆菌门对3类SOC组分的陆向分布异质性发挥负向(红色线条)的直接作用,路径系数分别为FA=–0.52、HA=–0.72、HM=–0.41;放线菌门对SOC组分HA和HM的陆向分布异质性发挥正向(绿色线条)的直接作用,路径系数分别为HA=0.12和HM=0.65,对SOC组分FA的陆向分布异质性发挥负向(红色线条)的直接作用,路径系数为FA=–0.21;酸杆菌门对3类SOC组分的陆向分布异质性也发挥直接作用(图 5)。芽单胞菌门、拟杆菌门、酸杆菌门、放线菌门还可通过细菌与细菌的相互作用对3类SOC组分陆向分布异质性发挥间接作用。
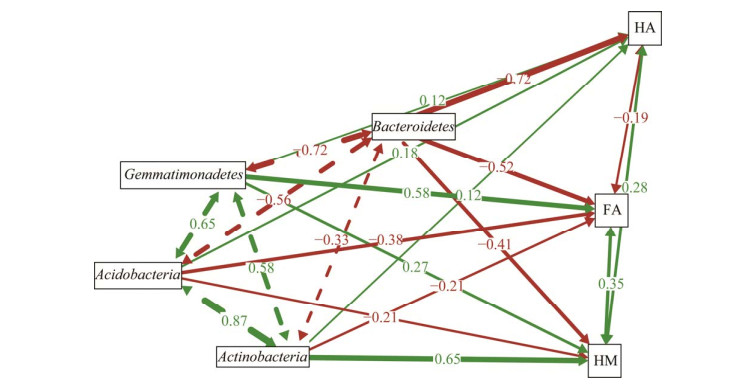
|
| 图 5 土壤稳定性有机碳组分与优势细菌门类的结构方程模型 Figure 5 Structural equation modeling (SEM) between the soil stable organic carbon (SOC) fractions and dominant bacterial phyla. |
3 讨论 3.1 锡林河流域不同植被带土壤稳定性有机碳组分的陆向分布特征
托坎廷斯(Tocantins)南部不同植被类型土壤SOC组分的分布存在空间异质性,FA、HA和HM的分布特征为森林区>牧草区>农田区[19];阿根廷草地种植大豆后土壤FA和HA组分明显低于对照草地土壤[20]。这些研究结果为本文FA、HA和HM随着植被带变化产生波动的陆向分布趋势提供了科学依据。迄今为止,关于土壤SOC组分FA、HA和HM的陆向分布规律尚无定论。本研究首次发现沿着长期性水流、季节性水流、长期性无水流的陆向梯度,FA、HA和HM分别呈现大致升高、逐渐升高、先升后降再升高的分布趋势。推测锡林河流域内FA、HA和HM的陆向分布和生态水文特征有关,长期性水流和季节性水流的湿地土壤环境不利于SOC组分的储存,长期性无水流的旱地土壤环境有利于SOC组分的储存。
锡林河流域土壤SOC组分中,HM明显高于HA或FA的含量,这和文献[21]报道的HM是土壤SOC主要组分的研究结果是一致的,说明HM是锡林河流域湿地及旱地土壤SOC的主要组分。阿根廷天然草地种植大豆对土壤最稳定HM组分的影响不大,但对较稳定HA和次稳定FA组分的影响较大[20],证明HM自身作为SOC中结构最复杂、最稳定的组分不易被分解[22],而HA或FA因自身结构相对简单、稳定性低则容易被分解[23]。
3.2 锡林河流域不同植被带土壤优势细菌门类的陆向分布特征沿着长期性水流、季节性水流、长期性无水流的陆向梯度,锡林河流域湿地及旱地土壤优势细菌门类具有明显的陆向分布特征。变形菌门是自然界中多样性最为丰富、分布最为广泛的细菌门类之一[24–25],这与本研究中变形菌门的相对丰度明显高于其他细菌门类且广泛分布在锡林河流域各个植被带土壤中的结果一致。Filippidou等[26]和Trivedi等[27]研究证实厚壁菌门微生物形成的芽孢能耐受干湿交替环境,这为本研究变形菌门、厚壁菌门和绿弯菌门是锡林河流域季节性水流区最优势细菌门类的结果提供了直接和间接的科学依据。原因可能与干湿交替环境下这些菌大量繁殖[28–29]及其产生的遗留效应(legacy effect)[30]有关。拟杆菌门是锡林河流域长期性水流区寡营养[16]土壤中最优势的细菌门类,这与拟杆菌门最适于印度洋寡营养地表水生境的研究结果具有相似性[31];放线菌门、酸杆菌门、芽单胞菌门、疣微菌门是锡林河流域长期性无水流区羊草和大针茅旱地土壤中最优势的细菌门类。这与放线菌门最适于智利阿卡塔马沙漠土壤的研究结果相似[32],也与放线菌门、酸杆菌门、芽单胞菌门、疣微菌门主要分布于祁连山草原旱地土壤的研究结果相似[33]。据报道,芽单胞菌门在水分含量较低的环境中更具优势[34],这为锡林河流域芽单胞菌门沿由水及陆的方向呈现出逐渐升高的分布特征提供了科学支撑。
3.3 锡林河流域不同植被带土壤稳定性有机碳组分与优势细菌门类的相关性土壤有机碳组分与细菌群落的相互作用具有重要的生物地球化学意义。Kulikova等研究证实变形菌门是腐殖物质等SOC组分的主要降解菌,而变形菌门、放线菌门、拟杆菌门和厚壁菌门是HA的主要降解菌[13]。内陆河水陆交汇处变形菌门、拟杆菌门、放线菌门、疣微菌门与腐殖物质的降解密切相关[35]。这为本研究FA、HA、HM稳定性有机碳组分均与拟杆菌门呈现极显著(P<0.01)相关性以及HA、HM与放线菌门分别呈显著(P<0.05)、极显著(P<0.01)相关性的结果提供了科学支撑,推测锡林河流域拟杆菌门及放线菌门与土壤SOC的转化密切相关。研究表明,酸杆菌门微生物分泌的胞外多糖是腐殖物质形成的前体物[36],间接说明酸杆菌门与腐殖物质类SOC的转化有关。这为本研究HA、HM稳定性有机碳组分均与酸杆菌门呈现极显著(P<0.01)相关性的结果提供了间接依据。
相比于非腐殖物质中蛋白质和氨基酸等不稳定性有机碳组分,腐殖物质等SOC组分与细菌群落的相互作用关系更为复杂[35]。这为本研究结构方程模型(图 5)拟合的直接作用与间接作用、正相关性(绿色线条)与负相关性(红色线条)及路径系数r值大小提供了科学支撑。例如,芽单胞菌门对FA (r=0.58),拟杆菌门对FA、HA、HM (r=0.52、–0.72、–0.41),放线菌门对HM (r=0.65)等SOC组分的陆向分布异质性均发挥直接作用(图 5)。这和内陆河水陆交汇处微生物代谢与有机碳组分降解有直接联系[35]的研究结果具有相似性。本研究发现芽单胞菌门、拟杆菌门、酸杆菌门、放线菌门还可通过细菌之间的相互作用对3类SOC组分的陆向分布异质性发挥间接作用。关于锡林河流域优势细菌门类的代谢特征与SOC组分之间存在直接或间接作用有待于后续相关研究证实。
干湿交替的土壤环境下,微生物群落结构的变化[37]会促进有机碳的分解及CO2的排放[38]。在内陆河水陆交汇处、河口区及水源地有机碳组分存在差异的情况下,不同细菌的响应和代谢功能存在差异[35]。例如,变形菌门中鞘氨醇单胞菌(Sphingomonas)成员作为内陆河水陆交汇处(干湿交替环境)的指示性细菌直接参与有机碳的降解过程[35]。这为锡林河流域季节性水流区湿地土壤变形菌门为最优势的类群但SOC含量相对低的研究结果提供了间接依据。内陆河水陆交汇处的腐殖物质等SOC组分能诱导激活细菌参与的脂质代谢[35],但优势细菌类群如何参与SOC和非稳定性有机碳的代谢转化尚不明晰,有待于后续研究。
4 结论锡林河流域湿地旱地土壤稳定性有机碳FA、HA和HM沿着长期性水流、季节性水流、长期性无水流的陆向梯度分别呈现大致升高、逐渐升高、先升后降再升高的分布趋势,主要分布在长期性无水流区羊草及大针茅旱地土壤中;变形菌门、厚壁菌门、绿弯菌门呈现先升高后降低的陆向分布趋势;拟杆菌门呈现逐渐降低的陆向分布趋势;酸杆菌门、放线菌门和疣微菌门大致呈现先降低后升高的陆向分布趋势;芽单胞菌门呈大致升高的陆向分布趋势。芽单胞菌门、酸杆菌门和放线菌门与土壤SOC组分存在直接和间接的正相关性;拟杆菌门与土壤SOC组分存在直接和间接的负相关性。优势细菌门类对稳定性碳积累和分解的作用机制尚不明晰,有待后续研究证实。
| [1] | Lal R. Soil carbon sequestration impacts on global climate change and food security. Science, 2004, 304(5677): 1623-1627. DOI:10.1126/science.1097396 |
| [2] | Dou S, Shan J, Song XY, Cao R, Wu M, Li CL, Guan S. Are humic substances soil microbial residues or unique synthesized compounds? A perspective on their distinctiveness. Pedosphere, 2020, 30(2): 159-167. DOI:10.1016/S1002-0160(20)60001-7 |
| [3] | Tang H, Li C, Xu Y, Cheng K, Shi L, Wen L, Li W, Xiao X. Effects of fertilizer practice on fungal and actinobacterial cellulolytic community with different humified particle-size fractions in double-cropping field. Scientific Reports, 2021, 11: 18441. DOI:10.1038/s41598-021-97975-0 |
| [4] | Witzgall K, Vidal A, Schubert DI, Höschen C, Schweizer SA, Buegger F, Pouteau V, Chenu C, Mueller CW. Particulate organic matter as a functional soil component for persistent soil organic carbon. Nature Communications, 2021, 12: 4115. DOI:10.1038/s41467-021-24192-8 |
| [5] | Mielnik L, Hewelke E, Weber J, Oktaba L, Jonczak J, Podlasiński M. Changes in the soil hydrophobicity and structure of humic substances in sandy soil taken out of cultivation. Agriculture, Ecosystems & Environment, 2021, 319: 107554. |
| [6] | Yamashita Y, Nishioka J, Obata H, Ogawa H. Shelf humic substances as carriers for basin-scale iron transport in the North Pacific. Scientific Reports, 2020, 10: 4505. DOI:10.1038/s41598-020-61375-7 |
| [7] | Hertkorn N, Claus H, Schmitt-Kopplin P, Perdue EM, Filip Z. Utilization and transformation of aquatic humic substances by autochthonous microorganisms. Environmental Science & Technology, 2002, 36(20): 4334-4345. |
| [8] | Fan BL, Tang ML, Yao LY, Zhang AB, Yin HQ, Yang WL, Ma ZZ, Xiang W, Bao ZY. Germanium fractions in typical paddy soil and its interaction with humic substances. Environmental Science and Pollution Research International, 2021, 28(8): 9670-9681. DOI:10.1007/s11356-020-11482-9 |
| [9] | Yang F, Sui L, Tang CY, Li JS, Cheng K, Xue Q. Sustainable advances on phosphorus utilization in soil via addition of biochar and humic substances. Science of the Total Environment, 2021, 768: 145106. DOI:10.1016/j.scitotenv.2021.145106 |
| [10] | Meng FD, Huang QX, Yuan GD, Cai YB, Han FX. The beneficial applications of humic substances in agriculture and soil environments. New Trends in Removal of Heavy Metals from Industrial Wastewater. Amsterdam:Elsevier, 2021: 131-160. |
| [11] | Cybulak M, Sokołowska Z, Boguta P. The influence of biochar on the content of carbon and the chemical transformations of fallow and grassland humic acids. Scientific Reports, 2021, 11: 5698. DOI:10.1038/s41598-021-85239-w |
| [12] | Thakur MP, Geisen S. Trophic regulations of the soil microbiome. Trends in Microbiology, 2019, 27(9): 771-780. DOI:10.1016/j.tim.2019.04.008 |
| [13] | Kulikova NA, Perminova IV. Interactions between humic substances and microorganisms and their implications for nature-like bioremediation technologies. Molecules:Basel, Switzerland, 2021, 26(9): 2706. DOI:10.3390/molecules26092706 |
| [14] | Yang CM, Sun JL, Chen YY, Wu J, Wang YL. Linkage between water soluble organic matter and bacterial community in sediment from a shallow, eutrophic lake, Lake Chaohu, China. Journal of Environmental Sciences, 2020, 98: 39-46. DOI:10.1016/j.jes.2020.05.023 |
| [15] | Trap J, Laval K, Akpa-Vinceslas M, Gangneux C, Bureau F, Decaëns T, Aubert M. Humus macro-morphology and soil microbial community changes along a 130-yr-old Fagus sylvatica chronosequence. Soil Biology and Biochemistry, 2011, 43(7): 1553-1562. DOI:10.1016/j.soilbio.2011.04.005 |
| [16] | Yu JL, Xia JJ, Ma QL, Zhang C, Zhao J, Tanggood X, Yang YF. Soil particle and moisture-related factors determine landward distribution of bacterial communities in a lateral riverside continuum of the Xilin River basin. Soil Ecology Letters, 2021, 3(4): 303-312. DOI:10.1007/s42832-021-0106-2 |
| [17] | Murdoch DJ, Chow ED. A graphical display of large correlation matrices. The American Statistician, 1996, 50(2): 178-180. |
| [18] | Rosseel Y. Lavaan: an R package for structural equation modeling. Journal of Statistical Software, 2012, 48(2): 1-36. |
| [19] | Marinho JL, Piscoya VC, Fernandes MM, Gonçalves SB, Holanda FSR, Cunha Filho M, Gomes Filho RR, Pedrotti A, Araújo Filho RN. Carbon dynamics in humic fractions of soil organic matter under different vegetation cover in southern Tocantins. Floresta e Ambiente, 2021, 28(2): e20220002. |
| [20] | Conti ME, González MG, Gómez E, Holtz EF, Moreno G. Soil organic carbon fractions as influenced by soybean cropping in the humid Pampa of Argentina. Terra Latinoamericana, 2014, 32(3): 195-200. |
| [21] | Hayes MHB, Mylotte R, Swift RS. Humin: its composition and importance in soil organic matter. Advances in Agronomy, 2017, 143: 47-138. |
| [22] | Parsons JW. Humus chemistry—genesis, composition, reactions. Soil Science, 1983, 135(2): 129-130. |
| [23] | Vázquez C, Iriarte AG, Merlo C, Abril A, Kowaljow E, Meriles JM. Land use impact on chemical and spectroscopical characteristics of soil organic matter in an arid ecosystem. Environmental Earth Sciences, 2016, 75(10): 1-13. |
| [24] | Spain AM, Krumholz LR, Elshahed MS. Abundance, composition, diversity and novelty of soil Proteobacteria. The ISME Journal, 2009, 3(8): 992-1000. DOI:10.1038/ismej.2009.43 |
| [25] | Delmont TO, Quince C, Shaiber A, Esen ÖC, Lee ST, Rappé MS, McLellan SL, Lücker S, Eren AM. Nitrogen-fixing populations of Planctomycetes and Proteobacteria are abundant in surface ocean metagenomes. Nature Microbiology, 2018, 3(7): 804-813. DOI:10.1038/s41564-018-0176-9 |
| [26] | Filippidou S, Wunderlin T, Junier T, Jeanneret N, Dorador C, Molina V, Johnson DR, Junier P. A combination of extreme environmental conditions favor the prevalence of endospore-forming Firmicutes. Frontiers in Microbiology, 2016, 7: 1707. |
| [27] | Trivedi P, Delgado-Baquerizo M, Jeffries TC, Trivedi C, Anderson IC, Lai KT, McNee M, Flower K, Pal Singh B, Minkey D, Singh BK. Soil aggregation and associated microbial communities modify the impact of agricultural management on carbon content. Environmental Microbiology, 2017, 19(8): 3070-3086. DOI:10.1111/1462-2920.13779 |
| [28] | McHugh TA, Schwartz E. A watering manipulation in a semiarid grassland induced changes in fungal but not bacterial community composition. Pedobiologia, 2016, 59(3): 121-127. DOI:10.1016/j.pedobi.2016.04.003 |
| [29] | Veach AM, Zeglin LH. Historical drought affects microbial population dynamics and activity during soil drying and re-wet. Microbial Ecology, 2020, 79(3): 662-674. DOI:10.1007/s00248-019-01432-5 |
| [30] | Meisner A, Jacquiod S, Snoek BL, Ten Hooven FC, Van Der Putten WH. Drought legacy effects on the composition of soil fungal and prokaryote communities. Frontiers in Microbiology, 2018, 9: 294. DOI:10.3389/fmicb.2018.00294 |
| [31] | Wang YY, Liao SL, Gai YB, Liu GL, Jin T, Liu H, Gram L, Strube ML, Fan GY, Sahu SK, Liu SS, Gan SH, Xie ZX, Kong LF, Zhang PF, Liu X, Wang DZ. Metagenomic analysis reveals microbial community structure and metabolic potential for nitrogen acquisition in the oligotrophic surface water of the Indian Ocean. Frontiers in Microbiology, 2021, 12: 518865. DOI:10.3389/fmicb.2021.518865 |
| [32] | Neilson JW, Quade J, Ortiz M, Nelson WM, Legatzki A, Tian F, LaComb M, Betancourt JL, Wing RA, Soderlund CA, Maier RM. Life at the hyperarid margin: novel bacterial diversity in arid soils of the Atacama Desert, Chile. Extremophiles:Life Under Extreme Conditions, 2012, 16(3): 553-566. DOI:10.1007/s00792-012-0454-z |
| [33] | Kang BT, Bowatte S, Hou FJ. Soil microbial communities and their relationships to soil properties at different depths in an alpine meadow and desert grassland in the Qilian Mountain range of China. Journal of Arid Environments, 2021, 184: 104316. DOI:10.1016/j.jaridenv.2020.104316 |
| [34] | Fawaz NM, Revealing the ecological role of Gemmatimonadetes through cultivation and molecular analysis of agricultural soils. University of Tennessee Masters Theses, 2013. |
| [35] | Li Y, Xu C, Zhang WL, Lin L, Wang LF, Niu LH, Zhang HJ, Wang PF, Wang C. Response of bacterial community in composition and function to the various DOM at river confluences in the urban area. Water Research, 2020, 169: 115293. DOI:10.1016/j.watres.2019.115293 |
| [36] | Kielak AM, Barreto CC, Kowalchuk GA, Van Veen JA, Kuramae EE. The ecology of Acidobacteria: moving beyond genes and genomes. Frontiers in Microbiology, 2016, 7: 744. |
| [37] | Schimel JP. Life in dry soils: effects of drought on soil microbial communities and processes. Annual Review of Ecology, Evolution, and Systematics, 2018, 49: 409-432. DOI:10.1146/annurev-ecolsys-110617-062614 |
| [38] | Weise L, Ulrich A, Moreano M, Gessler A, E Kayler Z, Steger K, Zeller B, Rudolph K, Knezevic-Jaric J, Premke K. Water level changes affect carbon turnover and microbial community composition in lake sediments. FEMS Microbiology Ecology, 2016, 92(5): fiw035. DOI:10.1093/femsec/fiw035 |
 2022, Vol. 62
2022, Vol. 62