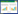中国科学院微生物研究所,中国微生物学会
文章信息
- 刘璐, 刘星, 靖宪月, 黄玲艳, 周顺桂. 2022
- LIU Lu, LIU Xing, JING Xianyue, HUANG Lingyan, ZHOU Shungui.
- 地杆菌:驱动厌氧生物地球化学循环的“多面手”
- Geoabcter: the "generalist" driving anaerobic biogeochemical cycles
- 微生物学报, 62(6): 2277-2288
- Acta Microbiologica Sinica, 62(6): 2277-2288
-
文章历史
- 收稿日期:2021-12-17
- 修回日期:2022-01-25
- 网络出版日期:2022-03-18
地杆菌是革兰氏阴性、严格厌氧杆菌,是能够同步有机物氧化分解与Fe(Ⅲ)氧化物还原的微生物[1]。在系统分类学上地杆菌分布于变形菌门、δ变形菌纲、脱硫单胞菌目、地杆菌科。一般认为地杆菌属为地杆菌科的唯一菌属[2]。2019年,Xu等从日本水稻土中分离出Geomonas oryzae S43T、Geomonas edaphica Red53T、Geomonas ferrireducens S62T以及Geomonas terrae Red111T菌株,并基于16S rRNA基因、平均核苷酸一致性(ANI)和数字DNA-DNA杂交(GGDC)等技术分析结果将这些菌株划分为一个新属,命名为Geomonas,并归为地杆菌科[3]。另外,基于系统发育和基因组分析,将先前划分为地杆菌属的Geobacter bremensis及Geobacter bemidjiensis也同样归为Geomonas属,并重新命名为Geomonas bremensis、Geomonas bemidjiensis[3] (图 1)。
|
| 图 1 地杆菌及本科内的相关菌属neighbor-joining (NJ)系统进化树 Figure 1 Neighbor-joining phylogenetic tree of the genus Geobacter and its related members in the family Geobacteraceae. |
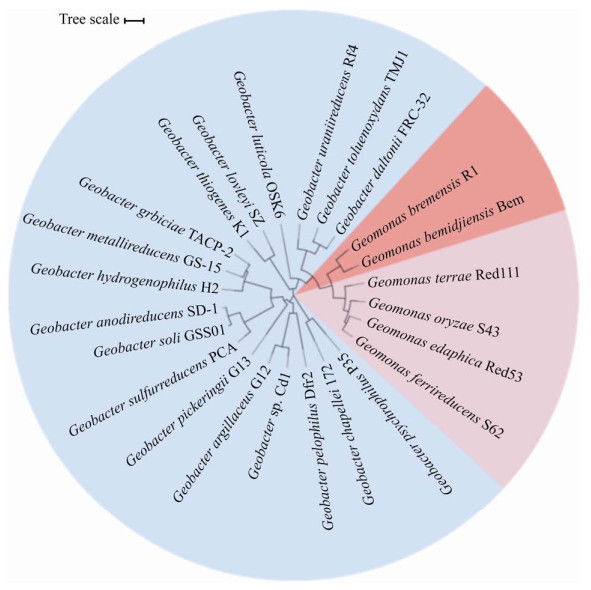
地杆菌的发现揭开了研究厌氧环境中微生物驱动C、N、Fe等元素生物地球化学循环的序幕,并开启了研究微生物胞外呼吸、电活性微生物的篇章(图 2)。1987年,Lovley等从波托马克河沉积物中分离到首株异化铁还原菌GS-15[4]。1993年,Lovley等基于16S rRNA基因测序结果,将GS-15归为δ变形菌纲,并正式命名为Geobacter metallireducens GS-15[1]。1994年,第二种地杆菌G. sulfurreducens成功分离[5]。1996年,Lovley等发现腐殖质可同时作为电子受体及电子穿梭体参与地杆菌还原铁(Ⅲ)氧化物的过程,揭示了腐殖质介导的地杆菌胞外电子传递过程[6]。2003年,G. sulfurreducens全基因组序列的获得及基因操作系统的建立,极大加快了地杆菌的研究进程[7]。2005年,Reguera等发现地杆菌菌毛具有导电性,可长距离传递电子到胞外铁(Ⅲ)氧化物以完成胞外呼吸[8]。导电菌毛的发现颠覆了对生物电子传递的认识,将胞外电子传递研究推向了新的高度。这直接促进了以OmcS、OmcZ为代表的细胞色素C纳米线的发现。地杆菌呼吸形式多样,不但可以利用各种氧化态的电子受体而且可以代谢多种有机物。这使其在厌氧土壤和沉积物等多种环境中广泛存在。同时,地杆菌可通过多种形式参与土壤中C、N、Fe等元素循环从而显著影响着元素生物地球化学循环。本文将主要针对该属所表现的这些“多面手”特性进行描述。
|
| 图 2 地杆菌研究里程碑事件 Figure 2 Time line of important discoveries associated with Geobacter species. |
1 地杆菌的呼吸形式与分布
地杆菌具有多种呼吸形式,不仅可利用硝酸盐、富马酸盐和含氯化合物等可溶性电子受体进行胞内呼吸,还可利用铁(锰)氧化物、电极、腐殖质等不可溶性电子受体实现胞外呼吸。其中,铁(锰)呼吸是地杆菌最典型的胞外呼吸形式。在该过程中,地杆菌氧化有机物释放电子,电子通过胞外电子传递链转移到胞外并最终用于胞外铁氧化物的还原。研究表明,该电子传递链由导电纳米线及细胞色素C组成[9]。此外,在微生物燃料电池(MFC)中,地杆菌可以利用人工电极作为胞外电子受体[10]。其中,G. sulfurreducens产电的最大电流密度高达9.29 A/m2,是迄今报道的产电最高的电活性微生物[14]。然而,目前G. sulfurreducens与电极间电子传递机制尚不清楚。一般认为细胞色素C,如OmcZ[15],介导了该电子传递过程。腐殖质是一类高分子芳香族醌类聚合物,具有可接收电子的醌类基团。1996年,Lovley等利用14C标记乙酸盐,证明G. metallireducens可以利用腐殖质为电子受体耦合乙酸盐氧化[6]。
地杆菌呼吸形式的多样性解释了其分布的广泛性。目前已在土壤、地下水、活性污泥、海洋和河口沉积物等多种环境中发现地杆菌的存在。此外,一些地杆菌因其具有独特的代谢特征,可在特殊环境中生存。例如G. daltonii[16],Geobacter strain OR-1[17]等菌株因具备将重金属还原与有机物氧化耦合的能力,可在受铀、砷、镉污染的厌氧沉积物及土壤环境中生存。G. humireducens[18]、G. toluenoxydans[19]可代谢芳香族化合物,而在富含有机物的环境中生存。
2 碳循环地杆菌通过参与碳分解与固定代谢、甲烷代谢等多个过程,影响全球碳循环。乙酸是微生物发酵过程重要的中间产物,广泛存在于自然环境中。地杆菌拥有高度保守的负责乙酸转运、氧化的酶系统[7]。这使得地杆菌成为厌氧环境中重要的乙酸氧化菌。有报道指出,稻田土壤中高达85%的乙酸氧化菌是地杆菌[20]。
此外,地杆菌可代谢多种芳香族化合物。1989年,Lovley等首次报道G. metallireducens可氧化芳香族化合物[21]。研究发现,G. metallireducens在代谢苯时,苯首先被羟基化为苯酚,并进一步转化为中间产物苯甲酰辅酶A (benzoyl- CoA)[22],之后通过benzoyl-CoA降解途径(脱芳基苯甲酰辅酶A还原酶(BCR)还原脱芳构化、修饰氧化反应和水解环裂解)实现开环,最终在氧化作用下被降解为乙酰辅酶A (acetyl-CoA)和CO2[23]。相比之下G. metallireducens对于苯酸盐的降解相对较易。在苯甲酸酯辅酶A连接酶(BamY)或苯甲酸酯辅酶A转移酶(Bct)的作用下苯酸盐直接转化为benzoyl-CoA,再通过与降解苯、苯酚相同的benzoyl-CoA降解途径生成acetyl-CoA,之后在TCA循环中被同化和/或氧化成CO2[24]。氯酚类化合物作为一种有机毒物,对人体、水生生物、植物以及微生物都具有显著的生态毒性。G. sulfurreducens作为一种弱脱氯呼吸菌,可将五氯苯酚(PCP)还原为低氯化合物。有研究表明生物炭表面氧化还原活性基团及高导电性可促进G. sulfurreducens对PCP的还原降解(较对照组提升24.8倍)[25]。
早期研究认为地杆菌为严格异养菌。2020年,Zhang等借助适应性实验室进化(ALE)手段,以甲酸作为电子供体和碳源培养G. sulfurreducens。在经过连续17次传代后,他们发现G. sulfurreducens获得表达琥珀酰辅酶A合成酶的能力,从而可以利用反向氧化TCA循环(roTCA)实现CO2还原固定[13]。此外,基因组序列信息分析表明G. metallireducens[26]以及G. bemidjiensis[27]可能也具备化能自养的能力。因此,我们有理由重新审视地杆菌在全球碳循环中的贡献。
地杆菌还可以作为电子供体驱动其他微生物碳代谢。例如,G. sulfurreducens氧化乙酸时产生的电子可驱动绿色硫细菌Prosthecochloris aestuarii完成厌氧不产氧光合作用[28]。同时接种时,G. sulfurreducens与P. aestuarii可以紧密结合形成团聚体,而缺失外膜细胞色素复合体(ombB-omaB-omcB-orfS-ombC-omaC-omcC)的G. sulfurreducens突变株与P. aestuarii不能共培养,这表明G. sulfurreducens与P. aestuarii依赖细胞色素C形成种间直接电子互营群落。最近的研究发现,在黑暗、厌氧条件下G. metallireducens可以与Rhodopseudomonas palustris形成电子互营群落,驱动R. palustris电能自养生长[29]。这些研究为理解地杆菌在碳元素生物地球化学循环中的作用提供了新的认识。此外,地杆菌依靠直接种间电子传递将电子传递至产甲烷菌甲烷鬃菌属Methanosaeta[30]和巴氏甲烷八叠球菌Methanosarcina barkeri [31],直接驱动CO2还原产甲烷过程。2014年,Rotaru等发现在乙醇为电子供体、二氧化碳为电子受体的培养体系中,G. metallireducens和M. barkeri无法单独存活,而当两者共存时,可同步乙醇氧化与CO2还原产甲烷[31]。进一步研究发现,在互营体系中,G. metallireducens与M. barkeri以导电团聚体的形态存在,而敲除导电菌毛的G. metallireducens无法与M. barkeri共生[31]。这表明两者依赖直接种间电子传递实现二氧化碳固定产甲烷。基于宏基因组、宏转录组数据分析表明,地杆菌驱动的产甲烷过程可能广泛存在于多种产甲烷环境中[32]。地杆菌与产甲烷菌的互营促进了厌氧环境中甲烷的排放,影响着全球温室效应。
3 氮循环硝酸盐异化还原成氨(DNRA)可将硝酸盐转化为生物有效性较高的氨,同时不会排放气态氮氧化物,避免了生态系统中氮素的流失。研究表明,地杆菌是土壤环境DNRA的重要驱动者[33]。地杆菌属的多种菌株,如G. lovleyi[34]、G. metallireducens[1]、G. soli[35]等均可进行DNRA。其中G. lovleyi作为模式DNRA菌株得到了研究者的广泛关注。在厌氧环境中,G. lovleyi利用内膜结合的硝酸盐还原酶NarGYJI将NO3-还原为NO2-,之后在异二聚体亚硝酸还原酶复合体的周质亚基(NrfA)和膜结合亚基(NrfH)作用下,被进一步还原为NH4+[36]。大部分研究表明,DNRA过程受环境中C/N比的影响,较高的C/N比有助于DNRA的进行[36]。地杆菌因具备将有机物氧化与DNRA耦合的能力,导致环境中C/N比的变化不会对其DNRA过程产生影响,从而保持稳定的DNRA性能。
地杆菌拥有完整的固氮基因簇,可在缺氮环境中通过胞外还原Fe(Ⅲ)获得能量实现自生固氮,从而表现出巨大的固氮潜力。近期研究发现,固氮过程不影响G. sulfurreducens库伦效率,其可通过降低乙酸同化代谢并促进乙酸氧化分解代谢以促进胞外呼吸,为固氮过程提供能量[37]。土壤(尤其是水稻田土壤)环境中地杆菌固氮贡献长期被忽视。近年来,基于宏基因组及宏转录组技术获得的元数据分析结果表明地杆菌是水稻田土壤固氮主力军[38]。在稻田土壤中施加三价铁(水铁矿、磁铁矿及赤铁矿等)可显著提高地杆菌的丰度,并提高水稻产量[39]。此外,在其他低氮环境中,如河川底泥、森林、极地、沙漠及杂草地等,地杆菌同样表现出活跃的固氮活性,参与了系统的氮素固定。同时,利用地杆菌同步胞外呼吸与自生固氮的能力,我们已经实现同步固氮与电能产生及基于生物电化学系统的缺氮废水资源化利用[37]。
此外,地杆菌可通过与反硝化菌建立电子互营关系参与氮循环过程。Thiobacillus denitrificans是土壤中常见的反硝化化能自养菌[40]。2012年,Kato等发现,在Fe3O4存在时,G. sulfurreducens通过种间电子传递驱动Thiobacillus denitrificans异化硝酸盐还原产铵[41]。G. sulfurreducens还可以与Diaphorobacter、Delftia及Shinella等形成聚集体,将硝酸盐还原成氮气[42]。地杆菌通过DNRA、自生固氮以及驱动其他微生物的氮代谢活动,在氮元素的生物地球化学循环中发挥了不容小觑的作用。
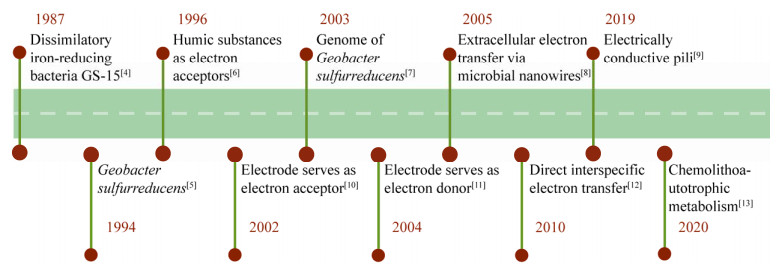
4 铁循环微生物是陆地和水生生态系统中铁循环的重要驱动者。其中,地杆菌作为铁(Ⅲ)还原活跃环境中含量最为丰富的铁(Ⅲ)还原微生物,在铁循环过程中有着重要作用[43]。环境中的铁氧化物至少以15种矿物形式存在,地杆菌主要还原可溶性螯合铁(Ⅲ)以及无定形和弱晶体结构的铁(Ⅲ)氧化物[41]。结晶度、粒径、pH等因素都会影响铁氧化物的氧化还原电位,进而影响微生物可获得的能量[44]。研究发现,G. sulfurreducens利用的受体电位窗宽度超过0.8 V[45],受体从水铁矿(-0.1-0 V)到水钠锰矿(约为+0.55 V)[44]。不同于希瓦氏菌Shewanella oneidensis仅依赖CymA分配电子到不同受体[46],地杆菌通过利用不同的醌脱氢酶传递电子以适应环境中具有不同氧化还原电位的电子受体(图 3)。例如,G. sulfurreducens至少合成3种内膜醌脱氢酶(ImcH、CbcL和CbcAB),用于胞外铁(Ⅲ) 还原[47]。当铁氧化物氧化还原中点电位大于-0.1 V时(相对于标准氢电极),G. sulfurreducens利用内膜醌脱氢酶ImcH传递电子[48]。当中点电位小于-0.1 V时,G. sulfurreducens转而使用CbcL[44]。当中点电位小于-0.21 V (接近呼吸的热力学极限)时,G. sulfurreducens很可能仅依赖于CbcAB传递电子[47]。地杆菌根据电子受体氧化还原电位高低选择不同的醌脱氢酶,暗示地杆菌可能存在类似于S. oneidensis MR-1拥有的厌氧氧化还原(Arc)控制系统[49]。不同电子传递路径的切换确保了地杆菌可利用环境中存在的不同电势铁(Ⅲ)氧化物。但目前对地杆菌选择不同醌脱氢酶的分子机制,还未得到清晰的阐述。

|
| 图 3 氧化还原电位控制地杆菌呼吸链的选择 Figure 3 Redox potential controls the selection of the respiratory chain of Geobacter. |
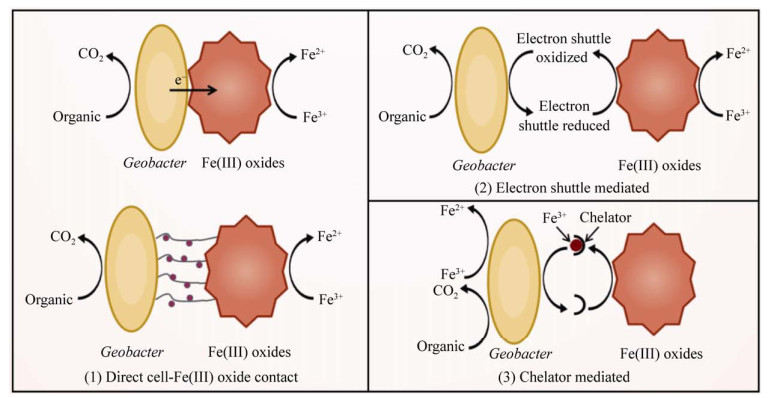
除选择内膜不同醌脱氢酶外,地杆菌选择不同胞外电子传递途径进行胞外铁呼吸。如图 4所示,目前发现的铁(Ⅲ)呼吸机制主要包括:直接接触机制、电子穿梭体介导机制以及螯合物介导机制。
|
| 图 4 地杆菌还原Fe(Ⅲ)氧化物的途径 Figure 4 Pathways of reducing Fe(Ⅲ) oxides by Geobacter. |
(1) 直接接触机制。地杆菌对铁(Ⅲ)氧化物具有趋化性[50],可通过直接接触的方式还原铁(Ⅲ)。目前,铁(Ⅲ)呼吸机制尚不清晰。一般认为G. sulfurreducens内膜醌脱氢酶ImcH、CbcL和CbcBA氧化醌池后,将电子分配到周质空间的细胞色素PpcA-E、GSU0105[51]。随后经PpcA家族蛋白和GSU0105将电子转移到5种外膜跨膜蛋白复合体OmaB/OmbB/OmcB、OmaC/ OmbC/OmcC、extABCD、extEFG或extHIJKL,从而完成跨膜传递[52]。其中OmcB和OmcC可直接还原铁(Ⅲ)氧化物。然而,这些复合体中的大多数细胞色素的电势和特性尚未确定。最近研究发现,地杆菌可分泌富含细胞色素C的膜囊泡,膜囊泡可介导地杆菌及其他非电活性菌胞外铁(Ⅲ)还原[53]。此外,地杆菌可通过表面附着物——纳米线,协助胞外长距离电子传递[8]。纳米线是一类具有导电性的纤维状结构。已发现的地杆菌纳米线包括细胞色素OmcS纳米线、OmcZ纳米线和菌毛。其中OmcS纳米线直接参与Fe(Ⅲ)氧化物还原[54],OmcZ纳米线直接参与阳极呼吸[55],菌毛在Fe(Ⅲ)氧化物及电极呼吸中都发挥重要作用[56]。需要注意的是,菌毛的组成、结构及功能尚存争议。一般认为菌毛是由PilA-N蛋白组成的细胞表面纤维状多聚物[56]。然而最近有研究表明,菌毛可能是由PilA-N和PilA-C蛋白二聚体组成的位于周质空间中的多聚体,仅具有协助细胞色素C分泌的功能[57]。
(2) 电子穿梭体机制。电子穿梭体是一类能够充当电子载体以介导氧化还原反应的物质。电子穿梭体接受地杆菌释放的电子后,通过扩散作用到达铁(Ⅲ)氧化物,释放电子完成铁(Ⅲ)还原,自身被再次氧化,从而往复循环。目前发现的电子穿梭体主要有腐殖质及其类似物、吩嗪以及核黄素等。其中,地杆菌-腐殖质-水铁矿的电子转移速率是地杆菌-水铁矿的7倍[58]。1998年,Lovley等发现人为添加100 μmol/L的腐殖质类似物2, 6-双磺酸蒽醌(AQDS)后,G. metallireducens还原铁(Ⅲ)氧化物速率明显加快[59]。2018年,Huang等发现当通过包埋阻止G. uraniireducens直接接触水铁矿时,G. uraniireducens可以分泌核黄素实现铁呼吸。对地杆菌-穿梭体-矿物的电子传递机制的理解,可为地杆菌在驱动厌氧生物地球化学循环的角色与功能研究提供新的认识[60]。
(3) 螯合促溶机制。溶铁螯合剂是一类能够与铁氧化物反应形成可溶性螯合铁的物质。溶铁螯合剂通过将不溶性铁转化为可溶铁,再通过扩散作用传输至地杆菌表面。螯合剂的加入不仅可以增加铁的生物可利用率,也可以提高铁(Ⅲ)与地杆菌的接触几率,从而提高铁还原效率。自然界存在多种溶铁螯合物,如麦芽糖、邻苯二醇,可与铁(Ⅲ)形成多种铁螯合物。此外,氨基三乙酸(NTA)是常见的铁螯合剂,Fe-NTA存在于污泥或受污染的土壤中[61]。1988年,Arnold等加入与不溶性铁等浓度的NTA后,发现铁矿的溶解速率提高了近20倍[62]。2003年,Luu等发现NTA的加入能够萃取土壤中的腐殖质,从而介导并促进微生物的胞外铁呼吸[63]。
除参与铁还原过程外,最近研究发现,地杆菌也参与厌氧环境中铁氧化腐蚀过程。一般认为地杆菌不能直接利用零价铁,而是通过利用厌氧环境中Fe0+2H+→Fe2++H2反应过程产生的H2参与铁腐蚀过程。2019年,Tang等发现G. sulfurreducens ACL可以利用细胞色素OmcS或OmcZ从零价铁表面直接获得电子[64]。
5 结论和展望地杆菌“多面手”特性使其成为还原性土壤和沉积环境中广泛存在的微生物。地杆菌含有大量编码细胞色素和导电菌毛的基因,使其成为最有效的胞外呼吸菌并驱动着厌氧环境中元素的生物地球化学循环过程。此外,地杆菌可通过种间电子传递与多种微生物实现电子互营,同时具有适应极端环境的能力,在维持生态平衡以及污染治理中起着至关重要的作用。但目前仍然缺少有效的方法对地杆菌在不同环境中的生理状态进行精准的评估,对于地杆菌利用不同电势或不同表面特性电子受体的分子机制也有待进一步的探究,以及地杆菌在不同生境中与其他微生物竞争及互作机制也尚不清晰。尽管近年来在地杆菌胞外电子传递的研究过程中取得了令人振奋的成就,但总体上胞外电子传递机制与效应研究尚处于初级阶段,组学技术的迅速发展将为地杆菌研究提供新的契机:(1) 高通量测序、蛋白质组学等技术为阐明种间电子传递机制提供了新的方法,并为分析参与种间电子传递群落的组成及功能研究提供了新的思路。基于地杆菌与其他微生物间的相互作用的研究,将对设计新型的生物修复策略及开发高效的能源生产方式有着积极的影响;(2) 利用转录组学和代谢组学等技术分析地杆菌对不同电势电子受体的响应,将揭示地杆菌感知与适应不同电势受体的机制,深化对地杆菌驱动的矿物元素循环的认识;(3) 借助宏组学技术,获取环境中地杆菌胞外电子传递作用网络,揭示以地杆菌为核心的生态过程与作用机制,为确立地杆菌在厌氧生物地球化学循环过程的重要作用提供可能。
| [1] | Lovley DR, Giovannoni SJ, White DC, Champine JE, Phillips EJ, Gorby YA, Goodwin S. Geobacter metallireducens gen. nov. sp. nov., a microorganism capable of coupling the complete oxidation of organic compounds to the reduction of iron and other metals. Archives of Microbiology, 1993, 159(4): 336-344. DOI:10.1007/BF00290916 |
| [2] | Nevin KP, Holmes DE, Woodard TL, Covalla SF, Lovley DR. Reclassification of Trichlorobacter thiogenes as Geobacter thiogenes comb. nov.. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(3): 463-466. DOI:10.1099/ijs.0.63408-0 |
| [3] | Xu ZX, Masuda Y, Itoh H, Ushijima N, Shiratori Y, Senoo K. Geomonas oryzae gen. nov., sp. nov., Geomonas edaphica sp. nov., Geomonas ferrireducens sp. nov., Geomonas terrae sp. nov., four ferric-reducing bacteria isolated from paddy soil, and reclassification of three species of the genus Geobacter as members of the genus Geomonas gen. nov.. Frontiers in Microbiology, 2019, 10: 2201. DOI:10.3389/fmicb.2019.02201 |
| [4] | Lovley DR, Stolz JF, Nord GL, Phillips EJP. Anaerobic production of magnetite by a dissimilatory iron-reducing microorganism. Nature, 1987, 330(6145): 252-254. DOI:10.1038/330252a0 |
| [5] | Caccavo F Jr, Lonergan DJ, Lovley DR, Davis M, Stolz JF, Mclnerney MJ. Geobacter sulfurreducens sp. nov., a hydrogen- and acetate-oxidizing dissimilatory metal-reducing microorganism. Applied and Environmental Microbiology, 1994, 60(10): 3752-3759. |
| [6] | Lovley DR, Coates JD, Blunt-Harris EL, Phillips EJP, Woodward JC. Humic substances as electron acceptors for microbial respiration. Nature, 1996, 382(6590): 445-448. DOI:10.1038/382445a0 |
| [7] | Methé BA, Nelson KE, Eisen JA, Paulsen IT, Nelson W, Heidelberg JF, Wu D, Wu M, Ward N, Beanan MJ, Dodson RJ, Madupu R, Brinkac LM, Daugherty SC, DeBoy RT, Durkin AS, Gwinn M, Kolonay JF, Sullivan SA, Haft DH, Selengut J, Davidsen TM, Zafar N, White O, Tran B, Romero C, Forberger HA, Weidman J, Khouri H, Feldblyum TV, Utterback TR, Van Aken SE, Lovley DR, Fraser CM. Genome of Geobacter sulfurreducens: metal reduction in subsurface environments. Science, 2003, 302(5652): 1967-1969. DOI:10.1126/science.1088727 |
| [8] | Reguera G, McCarthy KD, Mehta T, Nicoll JS, Tuominen MT, Lovley DR. Extracellular electron transfer via microbial nanowires. Nature, 2005, 435(7045): 1098-1101. DOI:10.1038/nature03661 |
| [9] | Liu XY, Walker DJF, Nonnenmann SS, Sun DZ, Lovley DR. Direct observation of electrically conductive pili emanating from Geobacter sulfurreducens. mBio, 2021, 12(4): e0220921. DOI:10.1128/mBio.02209-21 |
| [10] | Bond DR, Holmes DE, Tender LM, Lovley DR. Electrode-reducing microorganisms that harvest energy from marine sediments. Science, 2002, 295(5554): 483-485. DOI:10.1126/science.1066771 |
| [11] | Gregory KB, Bond DR, Lovley DR. Graphite electrodes as electron donors for anaerobic respiration. Environmental Microbiology, 2004, 6(6): 596-604. DOI:10.1111/j.1462-2920.2004.00593.x |
| [12] | Summers ZM, Fogarty HE, Leang C, Franks AE, Malvankar NS, Lovley DR. Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria. Science, 2010, 330(6009): 1413-1415. DOI:10.1126/science.1196526 |
| [13] | Zhang T, Shi XC, Ding R, Xu K, Tremblay PL. The hidden chemolithoautotrophic metabolism of Geobacter sulfurreducens uncovered by adaptation to formate. The ISME Journal, 2020, 14(8): 2078-2089. DOI:10.1038/s41396-020-0673-8 |
| [14] | Fujikawa T, Ogura Y, Ishigami K, Kawano Y, Nagamine M, Hayashi T, Inoue K. Unexpected genomic features of high current density-producing Geobacter sulfurreducens strain YM18. FEMS Microbiology Letters, 2021, 368(17): fnab119. DOI:10.1093/femsle/fnab119 |
| [15] | Kai A, Tokuishi T, Fujikawa T, Kawano Y, Ueki T, Nagamine M, Sakakibara Y, Suiko M, Inoue K. Proteolytic maturation of the outer membrane c-type cytochrome OmcZ by a subtilisin-like serine protease is essential for optimal current production by Geobacter sulfurreducens. Applied and Environmental Microbiology, 2021, 87(12): e0261720. DOI:10.1128/AEM.02617-20 |
| [16] | Prakash O, Gihring TM, Dalton DD, Chin KJ, Green SJ, Akob DM, Wanger G, Kostka JE. Geobacter daltonii sp. nov., an Fe(Ⅲ)- and uranium(Ⅵ)-reducing bacterium isolated from a shallow subsurface exposed to mixed heavy metal and hydrocarbon contamination. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(3): 546-553. DOI:10.1099/ijs.0.010843-0 |
| [17] | Ohtsuka T, Yamaguchi N, Makino T, Sakurai K, Kimura K, Kudo K, Homma E, Dong DT, Amachi S. Arsenic dissolution from Japanese paddy soil by a dissimilatory arsenate-reducing bacterium Geobacter spOR-1. . Environmental Science & Technology, 2013, 47(12): 6263-6271. |
| [18] | Coates JD, Ellis DJ, Blunt-Harris EL, Gaw CV, Roden EE, Lovley DR. Recovery of humic-reducing bacteria from a diversity of environments. Applied and Environmental Microbiology, 1998, 64(4): 1504-1509. DOI:10.1128/AEM.64.4.1504-1509.1998 |
| [19] | Kunapuli U, Jahn MK, Lueders T, Geyer R, Heipieper HJ, Meckenstock RU. Desulfitobacterium aromaticivorans sp. nov. and Geobacter toluenoxydans sp. nov., iron-reducing bacteria capable of anaerobic degradation of monoaromatic hydrocarbons. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(3): 686-695. DOI:10.1099/ijs.0.003525-0 |
| [20] | Hori T, Muller A, Igarashi Y, Conrad R, Friedrich MW. Identification of iron-reducing microorganisms in anoxic rice paddy soil by 13C-acetate probing. The ISME Journal, 2010, 4(2): 267-278. DOI:10.1038/ismej.2009.100 |
| [21] | Lovley DR, Baedecker MJ, Lonergan DJ, Cozzarelli IM, Phillips EJP, Siegel DI. Oxidation of aromatic contaminants coupled to microbial iron reduction. Nature, 1989, 339(6222): 297-300. DOI:10.1038/339297a0 |
| [22] | Zhang T, Tremblay PL, Chaurasia AK, Smith JA, Bain TS, Lovley DR. Anaerobic benzene oxidation via phenol in Geobacter metallireducens. Applied and Environmental Microbiology, 2013, 79(24): 7800-7806. DOI:10.1128/AEM.03134-13 |
| [23] | Tomei MC, Mosca Angelucci D, Clagnan E, Brusetti L. Anaerobic biodegradation of phenol in wastewater treatment: achievements and limits. Applied Microbiology and Biotechnology, 2021, 105(6): 2195-2224. DOI:10.1007/s00253-021-11182-5 |
| [24] | Marozava S, Merl-Pham J, Muller H, Meckenstock RU. Adaptation of carbon source utilization patterns of Geobacter metallireducens during sessile growth. Frontiers in Microbiology, 2020, 11: 1271. DOI:10.3389/fmicb.2020.01271 |
| [25] | Yu LP, Yuan Y, Tang J, Wang YQ, Zhou SG. Biochar as an electron shuttle for reductive dechlorination of pentachlorophenol by Geobacter sulfurreducens. Scientific Reports, 2015, 5: 16221. DOI:10.1038/srep16221 |
| [26] | Feist AM, Nagarajan H, Rotaru AE, Tremblay PL, Zhang T, Nevin KP, Lovley DR, Zengler K. Constraint-based modeling of carbon fixation and the energetics of electron transfer in Geobacter metallireducens. PLoS Computational Biology, 2014, 10(4): e1003575. DOI:10.1371/journal.pcbi.1003575 |
| [27] | Aklujkar M, Young ND, Holmes D, Chavan M, Risso C, Kiss HE, Han CS, Land ML, Lovley DR. The genome of Geobacter bemidjiensis, exemplar for the subsurface clade of Geobacter species that predominate in Fe(Ⅲ)-reducing subsurface environments. BMC Genomics, 2010, 11: 490. DOI:10.1186/1471-2164-11-490 |
| [28] | Ha PT, Lindemann SR, Shi L, Dohnalkova AC, Fredrickson JK, Madigan MT, Beyenal H. Syntrophic anaerobic photosynthesis via direct interspecies electron transfer. Nature Communications, 2017, 8: 13924. DOI:10.1038/ncomms13924 |
| [29] | Liu X, Huang LY, Rensing C, Ye J, Nealson KH, Zhou SG. Syntrophic interspecies electron transfer drives carbon fixation and growth by Rhodopseudomonas palustris under dark, anoxic conditions. Science Advances, 2021, 7(27): eabh1852. DOI:10.1126/sciadv.abh1852 |
| [30] | Rotaru AE, Shrestha PM, Liu FH, Shrestha M, Shrestha D, Embree M, Zengler K, Wardman C, Nevin KP, Lovley DR. A new model for electron flow during anaerobic digestion: direct interspecies electron transfer to Methanosaeta for the reduction of carbon dioxide to methane. Energy & Environmental Science, 2014, 7(1): 408-415. |
| [31] | Rotaru AE, Shrestha PM, Liu FH, Markovaite B, Chen S, Nevin KP, Lovley DR. Direct interspecies electron transfer between Geobacter metallireducens and Methanosarcina barkeri. Applied and Environmental Microbiology, 2014, 80(15): 4599-4605. DOI:10.1128/AEM.00895-14 |
| [32] | Mei R, Nobu MK, Narihiro T, Yu J, Sathyagal A, Willman E, Liu WT. Novel Geobacter species and diverse methanogens contribute to enhanced methane production in media-added methanogenic reactors. Water Research, 2018, 147: 403-412. DOI:10.1016/j.watres.2018.10.026 |
| [33] | Reguera G, Kashefi K. The electrifying physiology of Geobacter bacteria, 30 years on. Advances in Microbial Physiology, 2019, 74: 1-96. |
| [34] | Sung Y, Fletcher KF, Ritalaliti KM, Apkarian RP, Ramos-Hernández N, Sanford RA, Mesbah NM, Löffler FE. Geobacter lovleyi sp. nov. strain SZ, a novel metal-reducing and tetrachloroethene- dechlorinating bacterium. Applied and Environmental Microbiology, 2006, 72(4): 2775-2782. DOI:10.1128/AEM.72.4.2775-2782.2006 |
| [35] | Zhou SG, Yang GQ, Lu Q, Wu M. Geobacter soli sp. nov., a dissimilatory Fe(Ⅲ)-reducing bacterium isolated from forest soil. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(11): 3786-3791. |
| [36] | Pandey CB, Kumar U, Kaviraj M, Minick KJ, Mishra AK, Singh JS. DNRA: a short-circuit in biological N-cycling to conserve nitrogen in terrestrial ecosystems. Science of The Total Environment, 2020, 738: 139710. DOI:10.1016/j.scitotenv.2020.139710 |
| [37] | Jing XY, Liu X, Zhang ZS, Wang X, Rensing C, Zhou SG. Anode respiration-dependent biological nitrogen fixation by Geobacter sulfurreducens. Water Research, 2022, 208: 117860. DOI:10.1016/j.watres.2021.117860 |
| [38] | Masuda Y, Itoh H, Shiratori Y, Isobe K, Otsuka S, Senoo K. Predominant but previously-overlooked prokaryotic drivers of reductive nitrogen transformation in paddy soils, revealed by metatranscriptomics. Microbes and Environments, 2017, 32(2): 180-183. DOI:10.1264/jsme2.ME16179 |
| [39] | Masuda Y, Shiratori Y, Ohba H, Ishida T, Takano R, Satoh S, Shen WS, Gao N, Itoh H, Senoo K. Enhancement of the nitrogen-fixing activity of paddy soils owing to iron application. Soil Science and Plant Nutrition, 2021, 67(3): 243-247. DOI:10.1080/00380768.2021.1888629 |
| [40] | Baalsrud K, Baalsrud KS. Studies on Thiobacillus denitrificans. Archiv für Mikrobiologie, 1954, 20(1): 34-62. DOI:10.1007/BF00412265 |
| [41] | Kato S, Hashimoto K, Watanabe K. Methanogenesis facilitated by electric syntrophy via (semi)conductive iron-oxide minerals. Environmental Microbiology, 2012, 14(7): 1646-1654. DOI:10.1111/j.1462-2920.2011.02611.x |
| [42] | Wan YX, Zhou LA, Wang S, Liao CM, Li N, Liu WT, Wang X. Syntrophic growth of Geobacter sulfurreducens accelerates anaerobic denitrification. Frontiers in Microbiology, 2018, 9: 1572. DOI:10.3389/fmicb.2018.01572 |
| [43] | Chen Z, Zhang YX, Luo QL, Wang LY, Liu SR, Peng YJ, Wang HT, Shen L, Li QB, Wang YP. Maghemite (γ-Fe2O3) nanoparticles enhance dissimilatory ferrihydrite reduction by Geobacter sulfurreducens: impacts on iron mineralogical change and bacterial interactions. Journal of Environmental Sciences (China), 2019, 78: 193-203. DOI:10.1016/j.jes.2018.09.021 |
| [44] | Levar CE, Hoffman CL, Dunshee AJ, Toner BM, Bond DR. Redox potential as a master variable controlling pathways of metal reduction by Geobacter sulfurreducens. The ISME Journal, 2017, 11(3): 741-752. DOI:10.1038/ismej.2016.146 |
| [45] | Clarke TA. Plugging into bacterial nanowires: a comparison of model electrogenic organisms. Current Opinion in Microbiology, 2022, 66: 56-62. DOI:10.1016/j.mib.2021.12.003 |
| [46] | Marritt SJ, Lowe TG, Bye J, McMillan DG, Shi L, Fredrickson J, Zachara J, Richardson DJ, Cheesman MR, Jeuken LJ, Butt JN. A functional description of CymA, an electron-transfer hub supporting anaerobic respiratory flexibility in Shewanella. Biochemical Journal, 2012, 444(3): 465-474. DOI:10.1042/BJ20120197 |
| [47] | Joshi K, Chan CH, Bond DR. Geobacter sulfurreducens inner membrane cytochrome CbcBA controls electron transfer and growth yield near the energetic limit of respiration. Molecular Microbiology, 2021, 116(4): 1124-1139. DOI:10.1111/mmi.14801 |
| [48] | Levar CE, Chan CH, Mehta-Kolte MG, Bond DR. An inner membrane cytochrome required only for reduction of high redox potential extracellular electron acceptors. mBio, 2014, 5(6): e02034. |
| [49] | Hirose A, Kasai T, Aoki M, Umemura T, Watanabe K, Kouzuma A. Electrochemically active bacteria sense electrode potentials for regulating catabolic pathways. Nature Communications, 2018, 9(1): 1083. DOI:10.1038/s41467-018-03416-4 |
| [50] | Childers SE, Ciufo S, Lovley DR. Geobacter metallireducens accesses insoluble Fe(Ⅲ) oxide by chemotaxis. Nature, 2002, 416(6882): 767-769. DOI:10.1038/416767a |
| [51] | Fernandes TM, Folgosa F, Teixeira M, Salgueiro CA, Morgado L. Structural and functional insights of GSU0105, a unique multiheme cytochrome from G. sulfurreducens. Biophysical Journal, 2021, 120(23): 5395-5407. DOI:10.1016/j.bpj.2021.10.023 |
| [52] | Chan CH, Levar CE, Jiménez-Otero F, Bond DR. Genome scale mutational analysis of Geobacter sulfurreducens reveals distinct molecular mechanisms for respiration and sensing of poised electrodes versus Fe(Ⅲ) oxides. Journal of Bacteriology, 2017, 199(19): e00340-17. |
| [53] | Liu X, Jing XY, Ye Y, Zhan J, Ye J, Zhou SG. Bacterial vesicles mediate extracellular electron transfer. Environmental Science & Technology Letters, 2020, 7(1): 27-34. |
| [54] | Filman DJ, Marino SF, Ward JE, Yang L, Mester Z, Bullitt E, Lovley DR, Strauss M. Cryo-EM reveals the structural basis of long-range electron transport in a cytochrome-based bacterial nanowire. Communications Biology, 2019, 2: 219. DOI:10.1038/s42003-019-0448-9 |
| [55] | Inoue K, Qian XL, Morgado L, Kim BC, Mester T, Izallalen M, Salgueiro CA, Lovley DR. Purification and characterization of OmcZ, an outer-surface, octaheme c-type cytochrome essential for optimal current production by Geobacter sulfurreducens. Applied and Environmental Microbiology, 2010, 76(12): 3999-4007. DOI:10.1128/AEM.00027-10 |
| [56] | Vargas M, Malvankar NS, Tremblay PL, Leang C, Smith JA, Patel P, Snoeyenbos-West O, Nevin KP, Lovley DR. Aromatic amino acids required for pili conductivity and long-range extracellular electron transport in Geobacter sulfurreducens. mBio, 2013, 4(2): e00105-e00113. |
| [57] | Gu YQ, Srikanth V, Salazar-Morales AI, Jain R, O'Brien JP, Yi SM, Soni RK, Samatey FA, Yalcin SE, Malvankar NS. Structure of Geobacter pili reveals secretory rather than nanowire behaviour. Nature, 2021, 597(7876): 430-434. DOI:10.1038/s41586-021-03857-w |
| [58] | Jiang J, Kappler A. Kinetics of microbial and chemical reduction of humic substances: implications for electron shuttling. Environmental Science & Technology, 2008, 42(10): 3563-3569. |
| [59] | Lovley DR, Fraga JL, Blunt-Harris EL, Hayes LA, Phillips EJP, Coates JD. Humic substances as a mediator for microbially catalyzed metal reduction. Acta hydrochimica et hydrobiologica, 1998, 26(3): 152-157. DOI:10.1002/(SICI)1521-401X(199805)26:3<152::AID-AHEH152>3.0.CO;2-D |
| [60] | Huang LY, Tang JH, Chen M, Liu X, Zhou SG. Two modes of riboflavin-mediated extracellular electron transfer in Geobacter uraniireducens. Frontiers in Microbiology, 2018, 9: 2886. DOI:10.3389/fmicb.2018.02886 |
| [61] | Ferreira MR, Salgueiro CA. Biomolecular interaction studies between cytochrome PpcA from Geobacter sulfurreducens and the electron acceptor ferric nitrilotriacetate (Fe-NTA). Frontiers in Microbiology, 2018, 9: 2741. DOI:10.3389/fmicb.2018.02741 |
| [62] | Arnold RG, DiChristina TJ, Hoffmann MR. Reductive dissolution of Fe(Ⅲ) oxides by Pseudomonas sp. 200. Biotechnology and Bioengineering, 1988, 32(9): 1081-1096. DOI:10.1002/bit.260320902 |
| [63] | Luu Y, Ramsay BA, Ramsay JA. Nitrilotriacetate stimulation of anaerobic Fe(Ⅲ) respiration by mobilization of humic materials in soil. Applied and Environmental Microbiology, 2003, 69(9): 5255-5262. DOI:10.1128/AEM.69.9.5255-5262.2003 |
| [64] | Tang HY, Holmes DE, Ueki T, Palacios PA, Lovley DR. Iron corrosion via direct metal-microbe electron transfer. mBio, 2019, 10(3): e00303-e00319. |
 2022, Vol. 62
2022, Vol. 62