中国科学院微生物研究所,中国微生物学会
文章信息
- 程宽, 李涵, 杜衍红, 董海波, 刘同旭. 2022
- CHENG Kuan, LI Han, DU Yanhong, DONG Haibo, LIU Tongxu.
- 微生物介导铁还原耦合氨氧化过程的研究进展
- Microbes-mediated coupling of Fe(Ⅲ) reduction and ammonium oxidation
- 微生物学报, 62(6): 2249-2264
- Acta Microbiologica Sinica, 62(6): 2249-2264
-
文章历史
- 收稿日期:2022-02-17
- 修回日期:2022-03-31
- 网络出版日期:2022-04-21
2. 广东省科学院生态环境与土壤研究所, 华南土壤污染控制与修复国家地方联合工程研究中心, 广东省农业环境综合治理重点实验室, 广东 广州 510650;
3. 中国科学院大学, 北京 100049
2. Guangdong Key Laboratory of Integrated Agro-environmental Pollution Control and Management, National-Regional Joint Engineering Research Center for Soil Pollution Control and Remediation in South China, Institute of Eco-environmental and Soil Sciences, Guangdong Academy of Sciences, Guangzhou 510650, Guangdong, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
铁是地壳中第四丰富的元素,同时也是生物圈中普遍存在的具有氧化还原活性的金属元素[1]。生态系统中铁循环主要包括Fe(Ⅱ)氧化和Fe(Ⅲ)还原两个过程。铁的循环过程驱动着氮、碳、硫、氧等元素的循环,同时对重金属等污染物的迁移转化具有重要作用[2–3]。氮元素是生命的重要组成部分,也是农业生产的关键元素,除以惰性的N2存在外,还以多种具有氧化还原活性的氮化合物广泛存在于大气、水体、土壤等生境中,并可以通过一系列的生物化学过程进行循环转化[4]。作为环境中的两种关键元素,铁循环和氮循环的相互作用关系一直受到广泛关注。前期的研究主要关注生物和化学作用驱动的亚铁氧化耦合硝酸盐还原过程,近期新发现的厌氧条件下的氨氧化耦合铁还原(铁氨氧化)过程引发了广泛关注。此过程将生态系统中的Fe(Ⅲ)还原和NH4+氧化过程相偶联,促进了铁循环介导的元素转化过程(如重金属固定),降低了环境中温室气体的排放,同时也加剧了氮素的流失,因此为研究铁、氮耦合循环提供了新视角,也为人为调控元素循环过程提供了新思路[5–7]。以Fe(Ⅲ)-NH4+之间的耦合循环为核心的生物地球化学过程也逐渐受到重视。
铁氨氧化现象最初发现于20世纪80年代,李良谟等根据淹水条件下水稻土壤中氨肥异常流失的现象,推测土壤中大量存在的Fe(Ⅲ)氧化物可能作为了氨氧化过程中的电子受体[8]。21世纪初,Clément等以河岸土沉积物为研究对象,也发现了氨氧化耦合铁还原的现象,并以NO2–作为氨氧化的产物,从热力学角度说明铁氨氧化过程可以自发进行[反应式(1)][9]。2006年,Sawayama首次提出了Feammox一词,并被后续的研究所沿用[10]。2009年,Shrestha等发现,铁氨氧化反应体系中Fe(Ⅱ)与NO2–的生成比例与Clément等[9]提出的热力学方程并不匹配,推测铁氨氧化和异化铁还原可能是2个独立的过程,同时通过同位素示踪手段,首次提出N2可能是铁氨氧化过程中的最终产物[11]。前期的这些研究,虽然对铁氨氧化过程有了初步探究,但由于认识水平和分析技术的局限性,对此过程的产物、关键的作用微生物以及铁氨氧化与其他元素循环的关系并没有明确的认识。
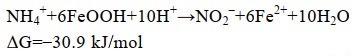
|
公式(1) |
2012年,Yang等通过热力学计算,提出当NO3–、NO2–或N2为氨氧化的直接产物时,铁氨氧化过程均能自发进行[反应式(2-4)],并以森林表层土为研究对象,通过同位素示踪技术和乙炔(C2H2)抑制手段,证明了N2是铁氧化过程的产物并且是主要产物[7]。同时,研究还以N2产生量为基准计算了铁氨氧化过程对氮素损失的贡献[7]。2014年,朱永官团队首次揭示了稻田土壤中的铁氨氧化过程,进一步剖析了铁氨氧化过程中N2的产生途径(由氨氧化直接产生,或首先生成NO3–、NO2–,再由反硝化和厌氧氨氧化过程产生),并发现铁氨氧化过程驱动的氮损失可达氮肥施用量的3.9%–31.0%[12]。上述的研究在铁氨氧化过程的研究与分析方法上取得了突破性的进展,为后续的相关研究奠定了基础。随后,铁氨氧化过程逐渐在淡水湖泊、湿地和海洋等不同的生境被发现,根据计算,在人工生态系统(如稻田土壤)中,铁氨氧化驱动的氮排放量可达7.8–61.0 kg N/(hm2·a),而在自然生态系统(如森林表层土),也可达到1–4 kg N/(hm2·a),因此铁氨氧化过程在氮排放过程中占据着重要地位[13–15]。环境因子,如pH、Fe(Ⅲ)种类和浓度、有机和无机碳源以及锰元素对铁氧化过程具有显著影响。同时,以新发现Acidimicrobiaceae sp. A6 (A6菌)和异化铁还原菌(DIRB)为代表的关键微生物的研究也迅速发展起来[16–18]。铁氨氧化过程的相关研究进入了一个蓬勃的发展阶段。
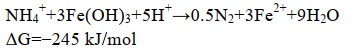
|
公式(2) |
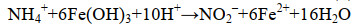
|
公式(3) |
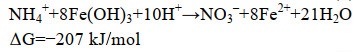
|
公式(4) |
虽然铁氨氧化的相关研究已取得了较大进展,但由于环境介质的复杂性,目前的研究主要集中在探讨铁氨氧化过程的存在生境与对氮素损失的相对贡献,很少将具体的反应过程作为主要科学问题进行探究。鉴于解析铁氨氧化过程对进一步深入认识元素地球化学过程和开展生态保护与治理的重要性,本文从生态系统中元素循环的角度出发,综述了铁氨氧化过程的发生生境、相关微生物、潜在机制与影响因素,并阐述了铁氨氧化过程的环境意义与研究展望。
1 铁氨氧化过程相关微生物虽然铁氨氧化过程的反应机理尚不明确,但研究通过设置灭菌/非灭菌处理,表明微生物是铁氨氧化过程发生的关键驱动力[19]。另外,由于对铁氨氧化相关微生物的分离纯化仍具有一定的障碍,尚未分离到耦合氨氧化与铁还原过程并可以稳定存在的铁氨氧化菌。目前,通过分子生物学手段,推测Acidimicrobiaceae sp. A6 (A6菌),DIRB以及部分其他菌种可能在铁氨氧化过程中扮演者重要的角色。上述相关菌种及发现生境如表 1所示。
| Related microbes | Natural habits | pH | Nitrogen loss | References |
| Exiguobacterium sp. WK6 | Tropical forest soil | 4.30–6.20 | 1–4 kg N/(hm2·a) | [7] |
| Digested sludge | 6.70–7.80 | [10] | ||
| Geobacteraceae spp., Shewanella spp. | Paddy soils | 4.70–5.70 | 7.8–61.0 kg N/(hm2·a) | [12] |
| Intertidal wetland | 8.32–8.75 | 115–180 kg N/(hm2·a) | [13] | |
| Uncultured Acidimicrobiaceae bacterium A6 | Paddy soil | 6.80–7.20 | 0.13–0.48 mg N/(L·d) | [17] |
| Geobacteraceae, Pseudomonas, GOUTA19, Nitrososphaeraceae | Paddy soils | 5.11–7.36 | 1.63 Tg N/a | [18] |
| Geobacter, Desulfovibrio, unclassified Pelobacteraceae | Forested riparian wetland | 3.50–4.50 | [19] | |
| Geobacteraceae spp., Shewanella spp., Acidimicrobiaceae bacterium A6 |
Eutrophic lake sediment | 7.19–7.62 | 10.9–20.1 kg N/(hm2·a) | [20] |
| Bacillus, Geobacteraceae, Clostridium, Pseudomonas, Anaeromyxobacter | Riparian soils | 5.95–7.85 | 0.038 mg N/(kg·d) | [21] |
| Anaeromyxobacter, Pseudomonas, Geobacteraceae | Riparian zones | 7.26–8.06 | 23.7–43.9 kg N/(hm2·a) | [24] |
| Geobacteraceae, Shewanella, Bacillus, Anaeromyxobacter | Wheat-rice rotation area | 5.98–7.86 | 7.3–43.3 kg N/(hm2·a) | [25] |
| Geobacteraceae, Acidimicrobiaceae bacterium A6 | Wetland sediments | 4.00–8.00 | [26] | |
| Geobacteraceae spp., Shewanella spp., Acidimicrobiaceae bacterium A6 |
Freshwater sediment | 7.35–7.96 | 0.14–0.34 mg N/(kg·d) | [27] |
| Geobacter, Anaeromyxobacter, Pseudomonas, Thiobacillus, Bacillus | Farmland soils | 6.34–7.50 | 0.17–0.24 mg N/(kg·d) | [28] |
| Geobacter, Anaeromyxobacter, Acidimicrobiaceae | Farmland soils, riparian soils, river sediments | 7.20–7.95 | 0.02–0.19 mg N/(kg·d) | [29] |
1.1 Acidimicrobiaceae sp. A6 (A6菌)
Acidimicrobiaceae sp. A6是目前发现的唯一1株在厌氧条件下可以驱动氨氧化耦合铁还原的菌种,它的发现为微生物驱动铁氨氧化过程的存在提供了强有力的证据[16]。2015年,Huang和Jaffé以森林湿地土壤为载体,经过长时间的传代培养得到了富含A6菌的混合菌群,并在2018年成功地纯化到了A6菌[19]。随后,A6菌在稻田土壤、河流沉积物等多种生境中被发现[20–22]。这种棒状革兰氏阳性菌属于酸微菌属,偏好酸性的反应条件,固定无机碳进行自养生长,还原Fe(Ⅲ)的同时将NH4+氧化为NO2–[16]。进一步的研究发现,A6菌可以将NH4+氧化产生的电子通过电子穿梭体的介导还原Fe(Ⅲ)或直接传递给电极,表明其驱动的铁还原途径可能是一种胞外电子传递过程[23]。从铁氨氧化过程的发展角度来看,A6菌的发现和前期的理论推测相吻合。根据Yang等在2012年提出的热力学方程,铁还原耦合氨氧化生成NO2– [反应式(3)]只有在pH < 6.5的情况下才可以自发进行,而A6菌在低pH条件下才可以驱动NH4+氧化生成NO2–的现象,正是对上述理论的有力验证[7, 19]。从氮循环的角度上看,目前发现的与NH4+氧化相关的微生物(硝化菌、厌氧氨氧化菌)多为自养型菌,而自养型A6菌的发现,表明在自然系统中可能存在着更多以A6菌为代表的自养型氨氧化菌,驱动着更为广泛的氮循环与其他元素的耦合循环过程[30–31]。虽然A6菌的发现对铁氨氧化过程具有里程碑式的意义,但仍具有一定的局限性。A6菌只能将NH4+氧化为NO2–,这与自然环境中铁氨氧化过程中直接产物以N2为主要产物的现象并不相符[12, 19]。另外,A6菌虽然可以驱动铁氧化过程,但是只能在混合菌群中长期存在,纯培养条件下非常容易失活[19]。这些局限性预示着在自然环境中,驱动铁氨氧化过程的可能并非某一种菌,而是以A6菌为代表的多种微生物构成的群落共同作用的结果,这一共生的现象已经在另一种重要的铁氮耦合过程-微生物驱动的硝酸盐还原耦合亚铁氧化过程中被发现[32–33]。
1.2 异化铁还原菌(DIRB)异化铁还原菌(DIRB)是一类可以在胞内氧化有机物产生电子,同时以胞外的Fe(Ⅲ)为末端电子受体,通过胞外呼吸方式完成电子传递并产生能量用于自身生长的微生物[34]。研究发现,DIRB在铁氨氧化过程发生的生境中具有较高的丰度,推测其可能参与或者影响了铁氨氧化过程。Li等[13]以潮间带湿地为研究对象,发现主要的DIRB种类为地杆菌属(Geobacter)和希瓦氏菌属(Shewanella),并且两种菌属的丰度均与不同位置和不同季节的30N2产生速率呈显著正相关。研究认为可能是由于不同的环境条件影响了DIRB活性,而DIRB活性进一步影响了铁氨氧化速率。Qin等通过研究太湖流域的铁氨氧化过程,发现在20–30 cm的厌氧土壤中,铁氨氧化速率最大,而DIRB的丰度在这一深度范围内达到最高,表明DIRB可能对铁氨氧化过程具有重要作用[21]。从氮转化的角度看,NH4+一般作为无机氮源用于DIRB细胞的同化作用,或者作为异化硝酸盐还原的末端产物,尚未有报道说明此类菌种可以直接氧化NH4+[35–36]。从铁还原的角度看,DIRB在生境中与铁氨氧化菌同时参与铁还原过程并可能相互竞争。根据Ding等的计算,稻田土壤中铁氨氧化过程驱动的铁还原过程仅占铁还原总量的0.81%–4.00%,大部分铁还原过程是由DIRB的异养活动所驱动[12]。理论上,DIRB可能无法参与甚至与铁氨氧化菌竞争Fe(Ⅲ)从而抑制铁氨氧化过程,但是目前铁氨氧化过程发生的生境中其反应速率与DIRB丰度的同步变化预示DIRB可能以某些方式参与或者影响了此过程,因此DIRB在铁氨氧化过程中扮演的角色与作用机制亟须进一步研究。值得注意的是,除了可以还原Fe(Ⅲ)外,DIRB还可以还原铁氨氧化过程的部分产物,如NO2–和NO3–,以它们为电子受体进行反硝化过程[37–38]。纯培养体系表明,相对于Fe(Ⅲ),部分DIRB更易于利用溶解态的NOx–为电子受体进行生长,而DIRB驱动的反硝化过程也可以生成N2,这可能是DIRB参与铁氨氧化过程的方式之一[39]。
1.3 其他潜在作用的菌种除了A6菌和DIRB之外,还有部分菌种在铁氨氧化体系中被发现,它们往往只在某一特定生境中受到关注,但其潜在的作用不应忽视。Sawayama研究了消化污泥中的铁氨氧化过程,通过16S rRNA基因克隆技术对微生物进行多样性分析时,检测到Exiguobacterium spp.,而其他铁还原微生物并未发现,推测Exiguobacterium spp.是研究体系内铁氨氧化过程的重要参与者[10]。Zhou等发现,生物碳添加可以促进稻田土壤中的铁氨氧化过程,在此过程中Geobacteraceae的丰度下降,而Pelobacteraceae、Desulfovibrio和反硝化微生物等其他菌种的丰度显著增高,因此推测这些菌种可能是铁氨氧化过程发生的重要生物证据[17]。利用RNA-SIP技术,通过添加含13C作为标记的底物,Li等对中国南方12种稻田土壤进行了铁氨氧化相关微生物的鉴定,结果发现除了DIRB外,与铁和硫循环相关的GOUTA19细菌和硝化古菌Nitrososphaeraceae丰度也与铁氨氧化反应速率呈显著正相关[18]。Shuai等在研究人工湿地宇宙体系中的铁氨氧化过程时,发现了一定数量硝化菌的存在[26]。对于硝化细菌,一般认为其需要氧气的参与才可以实现氨氧化过程,而最近的研究表明,在厌氧的条件下,部分硝化细菌能够以电极为电子受体驱动NH4+的氧化,而其是否可以耦合NH4+的氧化与Fe(Ⅲ)的还原过程,还需要进一步的验证[40–41]。除了单一菌种外,Bao等从稻田土壤沉积物中富集了一种可以稳定存在的微生物群落HJ-4。在此群落中,Anaerospora hongkongensis占比85%,可以介导硫的循环并驱动Fe(Ⅲ)还原为Fe(Ⅱ);Comamonadaceae占比15%,可以驱动氨的氧化过程,并介导硝酸盐和Fe(Ⅱ)之间的反应,实现反应体系中Fe(Ⅲ)的补充与铁氨氧化过程的持续[42]。
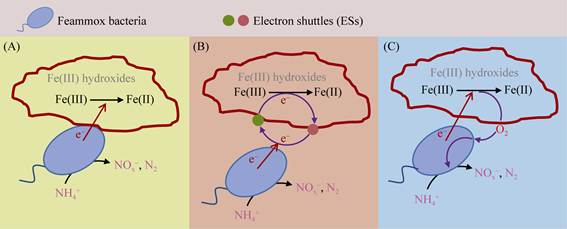
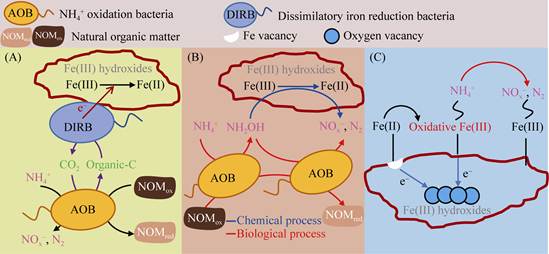
2 铁氨氧化过程机制虽然铁氨氧化过程研究已经取得了一定进展,但相关的反应途径与机制仍不明确。基于表观的反应结果,现有的研究提出了铁氨氧化过程的3种反应机制,如图 1所示,分别为:微生物直接接触驱动的铁氨氧化过程;电子穿梭体介导的铁氨氧化过程;微生物利用氧气介导的铁氨氧化过程。本文基于对铁、氮循环转化过程认识的基础上,对铁氨氧化过程提出了另外3种潜在的反应机制,如图 2所示,分别为:微生物种间相互作用驱动的铁氨氧化过程;生物化学耦合作用驱动的铁氨氧化过程;化学催化作用驱动的铁氨氧化过程。其中,图 1(A–C)和图 2(A–B)中的铁氨氧化过程由生物作用驱动,图 2C中的过程由化学作用驱动。对于微生物驱动的铁氨氧化过程,图 1中的假设微生物可以独立耦合Fe(Ⅲ)还原与NH4+氧化两个过程,而图 2中的假设微生物只能完成NH4+的氧化过程,Fe(Ⅲ)还原过程由其他微生物或化学因子驱动完成。
|
| 图 1 现有研究报道的微生物驱动的铁氨氧化过程反应机制 Figure 1 The mechanism of Feammox driven by bacteria reported by current studies. A: direct contact; B: ESs mediation; C: oxygen used by bacteria. |
|
| 图 2 铁氨氧化过程潜在的反应机制 Figure 2 Potential mechanisms of Feammox. A: interspecies interactions; B: coupled chemical-biological process; C: mineral catalysis. |
2.1 微生物直接接触驱动的铁氨氧化过程
Fe(Ⅲ)还原过程是铁氨氧化过程的重要组成部分,Yang等推测此过程可能是由微生物以直接接触的方式完成的[7],如图 1A所示。这种还原方式可能与现有的微生物胞外呼吸驱动的Fe(Ⅲ)还原过程存在一定的相似性。在胞外呼吸过程中,微生物通过氧化胞内的有机物产生电子,通过一系列的电子传递链最终将电子由细胞外膜传递至Fe(Ⅲ)[34]。在铁氨氧化过程中,可能也存在着类似的电子传递过程,即铁氨氧化相关微生物将胞内NH4+氧化产生的电子传递至与细胞直接接触的Fe(Ⅲ)。不同的胞外呼吸微生物与Fe(Ⅲ)直接接触进行电子传递存在着很大的差异,例如Geobacter和Shewanella都可以通过产生纳米导线直接与胞外Fe(Ⅲ)接触,前者的纳米导线是具有强电子传递能力的纤毛,而后者则更像细胞膜的延伸[43]。因此铁氨氧化菌可能以某种全新的方式完成细胞膜到Fe(Ⅲ)的电子传递过程。
2.2 电子穿梭体介导的铁氨氧化过程电子穿梭体可以通过介导微生物与Fe(Ⅲ)之间的电子传递,实现长距离和广范围内的Fe(Ⅲ)还原过程,从而显著促进环境中的铁循环过程[34]。研究表明,电子穿梭体也可以介导铁氨氧化过程中的Fe(Ⅲ)还原过程,如图 1B所示。与传统的胞外电子传递过程一样,电子穿梭体对铁氨氧化过程的影响具有普遍性和显著性。一方面,目前发现多种电子穿梭体可以参与微生物驱动的铁氨氧化过程。类腐殖质模拟物如AQS、AQDS和类固态腐殖质如生物炭都可以参与铁氨氧化过程[17]。因此在实际的环境中,土壤中具有电子穿梭能力的天然有机物和人工投入的生物碳类物质对铁氨氧化过程的影响作用不容忽视。另一方面,电子穿梭体对铁氨氧化过程具有显著的促进作用。在土壤培养体系中,研究发现电子穿梭体的添加对稻田土壤和红树林体系的铁氨氧化速率均具有显著的提升作用[17, 27]。对于具体微生物来说,电子穿梭体的添加可以显著促进A6菌的铁氨氧化速率,而缺乏则会导致微生物生长停滞[16],这进一步说明了电子穿梭机制在铁氨氧化过程中的重要作用。
2.3 微生物利用氧气介导的铁氨氧化过程近年来,在甲烷氧化耦合亚硝酸盐还原过程中,发现了一种新型的产氧方式。微生物首先将亚硝酸盐分解为氧气与一氧化氮,然后利用氧气耦合甲烷氧化,实现氧气的自产自销过程。Yang等提出,在铁氨氧化过程中可能也存在相似的过程,微生物在还原Fe(Ⅲ)的过程中产生氧气,继而完成NH4+的好氧氧化过程[7],如图 1C所示。然而,氧气产生所用的氧原子是来源于Fe(Ⅲ)氧化物或是其他含氧化合物,产生的具体过程是什么,目前尚没有明确的认识。Tan等指出,乙炔可以显著抑制好氧硝化过程而不会对铁氨氧化过程产生影响,在乙炔添加的铁氨氧化相关实验中也否定了好氧硝化菌驱动的NH4+氧化过程[44],因此铁氨氧化菌如果可以实现氧气的自产自销,可能需要具备更为独特的细胞结构以实现NH4+的好氧氧化过程。
2.4 微生物种间相互作用驱动的铁氨氧化过程目前已经发现了数种与铁氨氧化过程相关的微生物,但这些微生物能否可以独立且持续地进行铁氨氧化过程尚需讨论。A6菌具有铁氨氧化的能力,但电子穿梭体的存在对A6的NH4+氧化过程和生长具有决定性的作用[16]。DIRB丰度与铁氨氧化速率显著相关,但纯培养体系尚未发现DIRB具有NH4+氧化的能力,因此铁氨氧化过程中的NH4+氧化和Fe(Ⅲ)还原过程可能是2个独立的过程,由不同的微生物协同完成。NOM (natural organic matter)广泛分布于不同生境中,其含量丰富的氧化还原功能基团具有良好的电子接受能力。近期的研究证实,NOM可以作为微生物NH4+氧化的直接电子受体从而实现NH4+的氧化过程[45–46]。在A6菌的培养过程中,电子穿梭体能否接受微生物电子可能是氨氧化发生的关键,NOM含有丰富的接受电子基团,可能成为了氨氧化产生电子的良好受体。目前的研究认为,铁氨氧化菌呈自养代谢方式,其可能在氨氧化的同时,将无机碳固定为有机碳被DIRB利用,从而促进完成Fe(Ⅲ)的还原过程。因此,在NOM的参与下,氨氧化微生物可能和Fe(Ⅲ)还原微生物相互作用从而共同完成铁氨氧化过程,如图 2A所示。
2.5 生物化学耦合作用驱动的铁氨氧化过程羟胺是具有高反应活性的含氮化合物,可以与Fe(Ⅲ)反应生成NOx–和N2,此化学反应与铁氨氧化过程产物相一致[47]。在目前反应机制较为清楚的两种微生物驱动的氨氧化过程(硝化、厌氧氨氧化)中,羟胺均是必要的中间产物[4]。因此,羟胺可能是铁氨氧化过程中的关键中间产物,驱动氨氧化和Fe(Ⅲ)还原过程的进行。如图 2B所示,氨氧化微生物首先以NOM作为电子受体,将NH4+氧化为羟胺,羟胺可以被微生物直接生物还原,也可以与Fe(Ⅲ)发生化学反应生成Fe(Ⅱ)、NOx–和N2,从而完成生物化学耦合作用驱动的铁氨氧化过程。
2.6 化学催化作用驱动的铁氨氧化过程Amstaetter等发现,铁矿物中存在的氧空位可以将Fe(Ⅱ)转化为具有高活性Fe(Ⅲ)的物种,从而实现As(Ⅲ)的氧化[48]。在自然条件下,Fe(Ⅲ)与NH4+无法直接发生化学反应,但环境中存在的矿物可能催化Fe元素与NH4+之间的反应,从而实现铁氨氧化过程。如图 2C所示,由于氧空位的存在,Fe(Ⅱ)吸附到矿物表面后发生电子转移,同时生成具有高反应活性Fe(Ⅲ)的物种。当有NH4+存在时,NH4+可能被高活性Fe(Ⅲ)氧化,从而生成NOx–和N2等铁氨氧化产物。
3 铁氨氧化过程的影响因素 3.1 环境pHpH是影响反应物种形态、微生物活性的关键因素[49]。在土壤体系中,对于铁元素,当pH < 4.0时,Fe(Ⅲ)以离子态存在,而在高pH条件下则形成固态矿物从而降低铁离子的移动性和微生物可利用性[50]。对于氮元素,低pH条件下NH4+主要以离子态存在,而高pH则会导致NH4+形成气态NH3挥发损失,这些形态的变化可能会影响铁氨氧化过程是否发生[26]。根据热力学计算结果,pH对铁氨氧化能否自发进行以及生成的产物种类具有决定性的作用。以水铁矿和游离态NH4+作为反应物,N2作为终产物时,铁氨氧化过程可在较大pH范围内自发进行,但在低pH条件下可以产生更多能量。当生成产物为NO2–/NO3–时,需要环境pH < 6.5并且消耗更多的Fe(Ⅲ)[7, 51]。Yang等发现,随着培养时间的延长,铁氨氧化的速率逐渐下降,可能是由于反应体系中pH逐渐升高所致。当把培养体系的初始pH由4.27调至6.12时,铁氨氧化速率显著下降,并且N2生成量在6 h后不再产生明显变化,表明低pH可能更有利于铁氨氧化反应的发生[7]。作为目前发现的唯一1株和铁氨氧化过程直接相关的微生物,A6菌反应活性也显著受到pH的影响。A6菌更易在低pH条件下生存,当pH > 6时,A6菌的铁氨氧化速率受到显著的抑制[16]。部分土壤培育实验也表明,低pH土壤环境时A6呈现更高的丰度[16, 22]。上述研究表明,铁氨氧化过程可能更偏向于在低pH条件发生,然而部分土壤实验表明铁氨氧化过程并不局限于低pH反应条件。如表 1所示,在部分生境中,如潮间带湿地(pH 8.32–8.75)、河岸表层土壤(pH 7.26–8.06)和湖泊沉积物(pH 7.35–7.96)等微碱性的生境中同样发现了铁氨氧化现象,并且造成的氮损失与酸性土壤呈相同的数量级。将微碱性土壤的pH值与铁氨氧化速率进行相关分析时发现,两者之间并没有显著的相关性,这与酸性生境中pH作为关键影响因素的结论并不相同[13, 24, 27]。造成这一结果的原因可能是因为pH并不是决定铁氨氧化过程的唯一影响因子,其他环境条件,如铁矿物的种类、浓度和碳源等环境因素也可能对此过程产生影响,因此对于不同的生境条件,pH的影响作用可能需要分别对待[17, 52]。值得注意的是,目前针对pH作为影响因素的研究,针对同一种生境只探究了较窄范围pH的影响(酸性或者微碱性),而针对较大范围pH的影响则选取了不同的生境(由酸性到微碱性),后续的研究可能需要相似性质的生境探究不同pH下的铁氨氧化过程,从而进一步认识pH对铁氨氧化过程的影响。
3.2 Fe(Ⅲ)浓度与种类Fe(Ⅲ)广泛存在于土壤、湿地和湖泊等自然生境中,是环境中铁元素的重要组成部分,研究表明,Fe(Ⅲ)可以作为NH4+氧化的电子受体,驱动并影响铁氨氧化过程的发生与反应速率[53]。Fe(Ⅲ)主要通过存在形态和浓度对铁氨氧化过程产生影响。例如,当铁氨氧化反应物中的Fe物种为针铁矿时,NH4+氧化生成N2可以在pH < 6.8的情况下自发进行,但生成NO3–在任何条件下都无法自发进行[7, 54]。当Fe(Ⅲ)为水铁矿,pH为7.0时,生成N2和NO3–需要满足环境中Fe(Ⅱ)浓度分别小于10–2.7 mol/L和10–26 mol/L,后者所需的Fe(Ⅲ)浓度显然低于实际环境浓度因而无法在中性条件下自发进行[51]。土壤培养实验表明,铁氨氧化速率与环境中Fe(Ⅲ)浓度密切相关。Ding等探究了不同耕作时间水稻土壤的铁氨氧化过程,发现铁氨氧化速率与Fe(Ⅲ)浓度呈显著的相关性,认为耕作引起的Fe(Ⅲ)含量变化是导致土壤中铁氨氧化速率出现差异的关键因素[12]。在研究一定区域内不同生境(农田、河岸土、河流沉积物)的铁氨氧化过程中,也发现Fe(Ⅲ)浓度和N2产量的显著相关性[29]。除此之外,外源添加Fe(Ⅲ)对N2产生速率的显著促进作用进一步表明了Fe(Ⅲ)浓度对铁氨氧化过程的重要作用[7, 17]。Fe(Ⅲ)浓度对铁氨氧化过程的影响可能是由于更高浓度的Fe(Ⅲ)提供了更多的表面积供微生物利用,因此有利于微生物的反应和铁氨氧化过程的进行[12]。除了浓度,Fe(Ⅲ)种类也是影响铁氨氧化过程的重要因素。在A6菌的培养过程中,不同种类的Fe(Ⅲ),如水铁矿、针铁矿和纤铁矿均可以作为A6的电子受体,但仅在水铁矿和针铁矿添加时观测到NH4+的氧化和微生物的生长[16]。在土壤培养过程中,对于相同种类的矿物,原位水铁矿相比于异位水铁矿对铁氨氧化则具有更高的促进作用[17]。不同种类的Fe(Ⅲ)具有不同的氧化还原电位,而不同的微生物对不同种类Fe(Ⅲ)的利用能力并不相同,因此不同种类的矿物的添加可能影响了微生物的群落分布,从而影响了铁氨氧化过程。
3.3 无机碳源和有机碳源碳化合物是微生物的重要能量来源和机体组成部分,因此碳化合物可能通过影响微生物的代谢过程,从而对铁氨氧化过程产生影响。在铁氨氧化过程研究初期,Sawayama探究了碳源的影响,发现无机碳的添加可以促进铁氨氧化过程的进行[10]。Ding等探究了稻田土壤中铁氮耦合过程时,发现无机碳含量高的土壤具有更高的铁氨氧化效率[12]。A6的培养实验表明,仅在无机碳存在的情况下微生物可以发生NH4+氧化且有机碳(如乙酸钠)的添加并不能对反应速率产生显著的影响[19],因此驱动铁氨氧化过程的微生物可能趋向于自养的代谢方式,而无机碳源是此过程的关键影响因素。除无机碳外,有机碳在铁氨氧化过程中扮演的角色也值得关注,根据其是否直接参与微生物过程,我们将有机碳对铁氨氧化过程的影响分为抑制作用和促进作用。
有机碳是异养微生物重要的碳源和电子供体,DIRB,如Geobacter spp.、Shewanella spp.,是环境中Fe(Ⅲ)还原的主要驱动者,因此有机质驱动的异化铁还原过程可能与自养型铁氨氧化过程产生竞争,从而抑制铁氨氧化过程[3, 34]。Shrestha等根据热力学方程中Fe(Ⅲ)与NH4+的反应摩尔比计算铁氨氧化过程对Fe(Ⅲ)还原的贡献时,发现仅有微量的Fe(Ⅲ)还原来源于铁氧化过程[11]。这一比例在Yang等研究的森林土壤中占0.4%–0.8%,在Ding等研究的稻田土壤中占0.81%–4.00%,在Li等研究的湿地土壤中占1.58%–3.16%,而其他的Fe(Ⅲ)还原过程则是由异化铁还原过程驱动的[7, 12–13]。因此,两种不同方式的Fe(Ⅲ)还原过程同时存在时,有机碳的大量存在可能促使异化铁还原过程利用更多的Fe(Ⅲ),从而抑制铁氨氧化过程。
有机碳除了作为碳源和能源影响微生物参与的铁氨氧化外,还可以通过改变微生物Fe(Ⅲ)还原方式或者土壤中铁的可以利用性从而间接影响铁氨氧化过程。一方面,胡敏素、腐殖质等具有电子穿梭功能的有机质广泛存在于环境中,这些电子穿梭体可以介导并促进一系列微生物的Fe(Ⅲ)还原过程[43]。作为新型的铁还原方式,以有机质方式存在的电子穿梭体可以对铁氨氧化过程产生影响。研究发现,电子穿梭体可以显著加快A6菌的铁氨氧化能力[16]。在土壤培养体系中,电子穿梭体的添加可以将稻田土壤的铁氨氧化速率提高17%−340%,对红树林沉积物提高31%–56%[17, 55]。因此,在有机质丰富的环境中,胡敏素类有机质可以通过电子穿梭功能显著促进铁氨氧化过程。另一方面,环境中的有机碳可以影响土壤中可利用性Fe(Ⅲ)的含量。研究表明,有机碳可以促进黏土矿物释放其包含的Fe(Ⅲ),最终构成铁的氢氧化物从而增加土壤中Fe(Ⅲ)的浓度,促进铁氨氧化过程对Fe(Ⅲ)的利用效率[3, 56]。在以藻类和大型植物作为有机碳源添加的土壤中,发现了微生物可利用Fe(Ⅲ)浓度的提升和铁氨氧化速率的同步提高现象,说明有机碳可能通过影响Fe(Ⅲ)的可利用性从而影响了铁氨氧化过程的速率[27]。
3.4 Mn(Ⅳ)氧化物Mn(Ⅳ)和Fe(Ⅲ)都是环境中重要的电子受体,具有许多相似的性质,因此Mn(Ⅳ)是否可以作为氨氧化的电子受体(即是否存在锰氨氧化)一直受到广泛关注。20世纪90年代,Luther等根据海洋沉积物中锰离子和含氮产物的纵向变化以及实验室模拟实验,推测NH3、NH4+或有机氮可以与MnO2反应直接生成N2,并且从热力学角度证明反应可以自发进行[54]。然而,Thamdrup等采用同位素示踪技术研究海洋沉积物中的锰氨氧化过程时,并未检测到显著的15N标记的N2和NOx–产生,推测虽然MnO2与NH4+可能发生化学反应,但此反应在海洋氮循环过程中的作用可以忽视[57]。后续的研究中,Lin等通过向海洋沉积物中外源添加Mn(Ⅳ)的方式,表明配体态的MnO2可以氧化NH4+生成NO3–,而无定形的MnO2氧化物则不具备催化作用[58]。2018年,Luther等对前期的工作进行了重新计算和分析,其热力学计算表明,在中性条件下,MnO2和NH3的反应可以自发进行,而与NH4+的反应则不能自发进行。同时,推测MnO2和NH3反应快速停止可能是NH3在溶液中逐渐转化为NH4OH的原因[59]。前期的这部分研究主要探讨了锰氨氧化存在的可能性,并未探讨此反应和其他元素(如铁)的相互作用关系。近期,Chen等以太湖流域富锰土壤为研究对象,发现外源添加MnO2可以显著促进NH4+的氧化速率,同时抑制Fe(Ⅲ)的还原速率,提出锰氨氧化和铁氨氧化可能存在着竞争关系[60]。相对于铁氨氧化过程,锰氨氧化的相关微生物、影响因素和在生态系统氮循环中的作用尚不明确,还需要进一步讨论。
4 环境意义铁氨氧化过程是生态系统中新发现的元素循环过程,在铁、氮两种元素的耦合转化过程中扮演重要的角色[44]。从铁元素的角度看,铁氨氧化过程直接促进了Fe(Ⅲ)到Fe(Ⅱ)的循环转化过程,并可以通过NH4+氧化产物间接驱动Fe(Ⅱ)的氧化,完成铁的循环过程,这一过程对于重金属迁移转化具有重要意义[61]。从氮元素的角度看,铁氨氧化过程丰富了生态系统中的氮循环过程,对生态系统中的氮素转化提供了新的途径,并且氧化产物以N2为主,有利于降低环境中温室气体N2O的排放[7]。但对于农田氮素管理来说,铁氨氧化过程造成大量的氮素流失也会引发一系列的负面效应[12]。因此,无论是从生态还是实际应用角度看,铁氨氧化过程均具有重要意义。
铁的氧化还原循环往往影响污染物(如重金属)的迁移转化过程,通过调控Fe(Ⅲ)还原过程和Fe(Ⅱ)氧化过程从而固定重金属是重金属防控的有效手段[61]。在Fe(Ⅲ)还原过程中,铁还原微生物可以促进无定形的铁氧化物发生晶相转化作用从而向结晶态铁氧化物转化,进一步固定易于释放的重金属[62]。土壤实验和相关微生物的培养过程中发现,铁氨氧化过程更趋向于利用无定形的铁氧化物,因此在铁还原的过程中可能有利于促进无定形铁氧化物转化从而起到固定重金属的作用[12]。在Fe(Ⅱ)的氧化过程中,例如硝酸盐还原耦合亚铁氧化(NRFO)过程中,溶解态Fe(Ⅱ)容易生成针铁矿、纤铁矿等结晶态的铁氧化物,同时发生吸附或共沉淀作用从而对重金属起到固定作用[63]。Fe(Ⅱ)和NOx–都是铁氨氧化过程的产物,因此Fe(Ⅱ)可以进一步通过NRFO过程转化为结晶态的铁氧化物对重金属产生固定作用。整体上看,铁氨氧化驱动的直接Fe(Ⅲ)还原过程和间接Fe(Ⅱ)氧化过程有利于环境中的铁元素向结晶态的铁氧化物转化,从而起到对重金属的有效固定,因此后续的研究应该对如何调控铁氨氧化过程以固定重金属给予更多的重视。除此之外,目前发现的铁氨氧化菌Acidimicrobiaceae sp. A6除了以Fe(Ⅲ)为电子受体外,还可以通过自养方式还原放射性元素铀从而降低其移动性,这也为调控重金属提供了新思路[64]。
氮循环是生物地球化学循环的重要组成部分,与生态系统健康、人类生产活动息息相关[4]。对于NH4+的转化过程,前期的研究认为好氧条件下的硝化作用和厌氧条件下的厌氧氨氧化作用是NH4+氧化的必要途径。铁氨氧化过程的发现,为微生物驱动的NH4+氧化提供了新的反应途径,丰富了全球的氮循环过程[9]。除此之外,相比于厌氧氨氧化过程,铁氨氧化过程以环境中普遍存在的Fe(Ⅲ)为电子受体,摆脱了NO2–含量不足的限制,因此厌氧条件下铁氨氧化相关微生物相比于厌氧氨氧化微生物可能占据更宽的生态位[44]。对于人工生态系统,农田土壤的氮素转化过程中会释放大量的温室气体N2O。目前的研究发现,在铁氨氧化的培养体系中只检测到N2,并未有N2O的生成,只有在抑制剂乙炔添加时,才可以检测到由副产物NOx-还原生成的微量N2O[7],说明铁氨氧化过程驱动的氮素循环过程有利于减少NH4+氧化过程中的温室气体排放。从农业生产的角度看,铁氨氧化过程也造成了氮素的直接流失。例如,根据不同土壤的施肥标准,铁氨氧化造成的氮素损失在江西鹰潭稻田土壤中占施肥总量的3.9%–31.0%、在江苏无锡太湖流域的稻麦轮作区土壤中占1.35%−29.26%[12, 25]。大量氮素的损失可以导致土壤养分的流失,对农业生产造成不利影响,同时也会进一步增加氮素的投入成本。因此,除了推动自然生态系统中的氮循环过程外,如何调控铁氨氧化过程从而促进氮素充分利用,对于解决农业生产中的土壤和环境问题也具有重要的实际意义。
5 展望微生物驱动的铁氨氧化过程,是当今元素地球化学循环的热点科学问题。进一步深入解析铁氨氧化过程的反应机制与生态意义,具有重要的科学价值。虽然目前对铁氨氧化过程的发生广度和影响因素等方面的研究取得了一定的进展,但由于土壤环境介质的复杂性和相关微生物纯化具有一定困难,目前对于铁氨氧化过程的微观反应机制、相关微生物和实际应用等方面仍处于起步阶段,未来的研究可着眼于以下几个方面:
(1) 目前虽然可以证实铁氨氧化的发生和终产物的种类,但此过程的微观反应机制仍不明晰。Fe(Ⅲ)还原和NH4+氧化过程如何发生,两种元素如何互相耦合转化,这些问题亟须解决。分离获得活性稳定的相关微生物,并采用分子生物学技术对微生物的微观反应机制进行解析是解决这些问题的关键。因此后续的研究中应继续开展不同生境的铁氨氧化微生物的纯化工作。
(2) 在铁氨氧化过程的相关研究中,同位素示踪技术是主要的研究手段。在复杂的环境体系中,有限的研究手段限制了对反应微观过程和功能微生物的进一步探究。稳定同位素核酸探针(DNA/RNA-SIP)技术可以脱离纯培养的限制,在原位水平,以微生物群落为研究目标分析复杂环境中微生物驱动元素循环的分子调控机制,为铁氨氧化过程研究提供更多的研究思路。
(3) 目前铁氨氧化过程的存在与速率主要通过同位素示踪实验实现。同位素实验需要严格的培养条件与较高的成本,同时仅能以含氮气体作为检测目标,限制了进一步深入研究铁氨氧化过程。动力学数学模型可以将复杂的转化过程简化并对无法直接检测的反应过程进行量化。在环境中,NH4+主要有矿化、吸附、挥发、同化与氧化(铁氨氧化)几种途径,除了氧化过程之外,其他几种氨转化过程已经有了较多的研究,因此后续的研究中,将动力学建模手段引入铁氨氧化过程的反应体系,可能是获得铁氨氧化反应常数与氮物种转化过程的有效手段。
| [1] | Kappler A. Geomicrobiological cycling of iron. Reviews in Mineralogy and Geochemistry, 2005, 59(1): 85-108. DOI:10.2138/rmg.2005.59.5 |
| [2] | Peiffer S, Kappler A, Haderlein SB, Schmidt C, Byrne JM, Kleindienst S, Vogt C, Richnow HH, Obst M, Angenent LT, Bryce C, McCammon C, Planer-Friedrich B. A biogeochemical-hydrological framework for the role of redox-active compounds in aquatic systems. Nature Geoscience, 2021, 14(5): 264-272. DOI:10.1038/s41561-021-00742-z |
| [3] | Melton ED, Swanner ED, Behrens S, Schmidt C, Kappler A. The interplay of microbially mediated and abiotic reactions in the biogeochemical Fe cycle. Nature Reviews Microbiology, 2014, 12(12): 797-808. DOI:10.1038/nrmicro3347 |
| [4] | Kuypers MMM, Marchant HK, Kartal B. The microbial nitrogen-cycling network. Nature Reviews Microbiology, 2018, 16(5): 263-276. DOI:10.1038/nrmicro.2018.9 |
| [5] | Liu TX, Chen DD, Li XM, Li FB. Microbially mediated coupling of nitrate reduction and Fe(Ⅱ) oxidation under anoxic conditions. FEMS Microbiology Ecology, 2019, 95(4): fiz030. |
| [6] | Picardal F. Abiotic and microbial interactions during anaerobic transformations of Fe(Ⅱ) and NOx–. Frontiers in Microbiology, 2012, 3: 112. |
| [7] | Yang WH, Weber KA, Silver WL. Nitrogen loss from soil through anaerobic ammonium oxidation coupled to iron reduction. Nature Geoscience, 2012, 5(8): 538-541. DOI:10.1038/ngeo1530 |
| [8] |
Li LM, Pan YH, Wu QT, Zhou XR, Li ZG. Investigation on amorphous ferric oxide acting as an electron acceptor in the oxidation of NH4+ under anaerobic condition. Acta Pedologica Sinica, 1988, 25(2): 184-190.
(in Chinese) 李良谟, 潘映华, 伍期途, 周秀如, 李振高. 无定形氧化铁作为嫌气下NH4+氧化时电子受体的研究. 土壤学报, 1988, 25(2): 184-190. |
| [9] | Clément JC, Shrestha J, Ehrenfeld JG, Jaffé PR. Ammonium oxidation coupled to dissimilatory reduction of iron under anaerobic conditions in wetland soils. Soil Biology and Biochemistry, 2005, 37(12): 2323-2328. DOI:10.1016/j.soilbio.2005.03.027 |
| [10] | Sawayama S. Possibility of anoxic ferric ammonium oxidation. Journal of Bioscience and Bioengineering, 2006, 101(1): 70-72. DOI:10.1263/jbb.101.70 |
| [11] | Shrestha J, Rich JJ, Ehrenfeld JG, Jaffe PR. Oxidation of ammonium to nitrite under iron-reducing conditions in wetland soils. Soil Science, 2009, 174(3): 156-164. DOI:10.1097/SS.0b013e3181988fbf |
| [12] | Ding LJ, An XL, Li S, Zhang GL, Zhu YG. Nitrogen loss through anaerobic ammonium oxidation coupled to iron reduction from paddy soils in a chronosequence. Environmental Science & Technology, 2014, 48(18): 10641-10647. |
| [13] | Li XF, Hou LJ, Liu M, Zheng YL, Yin GY, Lin XB, Cheng L, Li Y, Hu XT. Evidence of nitrogen loss from anaerobic ammonium oxidation coupled with ferric iron reduction in an intertidal wetland. Environmental Science & Technology, 2015, 49(19): 11560-11568. |
| [14] | Guan QS, Cao WZ, Wang M, Wu GJ, Wang FF, Jiang C, Tao YR, Gao Y. Nitrogen loss through anaerobic ammonium oxidation coupled with iron reduction in a mangrove wetland. European Journal of Soil Science, 2018, 69(4): 732-741. DOI:10.1111/ejss.12552 |
| [15] | Rios-Del Toro EE, Valenzuela EI, López-Lozano NE, Cortés-Martínez MG, Sánchez-Rodríguez MA, Calvario-Martínez O, Sánchez-Carrillo S, Cervantes FJ. Anaerobic ammonium oxidation linked to sulfate and ferric iron reduction fuels nitrogen loss in marine sediments. Biodegradation, 2018, 29(5): 429-442. DOI:10.1007/s10532-018-9839-8 |
| [16] | Huang S, Jaffé PR. Isolation and characterization of an ammonium-oxidizing iron reducer: Acidimicrobiaceae sp. A6. PLoS One, 2018, 13(4): e0194007. DOI:10.1371/journal.pone.0194007 |
| [17] | Zhou GW, Yang XR, Li H, Marshall CW, Zheng BX, Yan Y, Su JQ, Zhu YG. Electron shuttles enhance anaerobic ammonium oxidation coupled to iron(Ⅲ) reduction. Environmental Science & Technology, 2016, 50(17): 9298-9307. |
| [18] | Li H, Su JQ, Yang XR, Zhou GW, Lassen SB, Zhu YG. RNA stable isotope probing of potential feammox population in paddy soil. Environmental Science & Technology, 2019, 53(9): 4841-4849. |
| [19] | Huang S, Jaffé PR. Characterization of incubation experiments and development of an enrichment culture capable of ammonium oxidation under iron-reducing conditions. Biogeosciences, 2015, 12(3): 769-779. DOI:10.5194/bg-12-769-2015 |
| [20] | Yao ZB, Wang F, Wang CL, Xu HC, Jiang HL. Anaerobic ammonium oxidation coupled to ferric iron reduction in the sediment of a eutrophic lake. Environmental Science and Pollution Research International, 2019, 26(15): 15084-15094. DOI:10.1007/s11356-019-04907-7 |
| [21] | Qin YB, Chen ZH, Ding BJ, Li ZK. Impact of sand mining on the carbon sequestration and nitrogen removal ability of soil in the riparian area of Lijiang River, China. Environmental Pollution, 2020, 261: 114220. DOI:10.1016/j.envpol.2020.114220 |
| [22] | Huang S, Chen C, Peng XC, Jaffé PR. Environmental factors affecting the presence of Acidimicrobiaceae and ammonium removal under iron-reducing conditions in soil environments. Soil Biology and Biochemistry, 2016, 98: 148-158. DOI:10.1016/j.soilbio.2016.04.012 |
| [23] | Ruiz-Urigüen M, Shuai WT, Jaffé PR. Electrode colonization by the Feammox bacterium Acidimicrobiaceae sp. strain A6. Applied and Environmental Microbiology, 2018, 84(24): 1-18. |
| [24] | Ding BJ, Li ZK, Qin YB. Nitrogen loss from anaerobic ammonium oxidation coupled to iron(Ⅲ) reduction in a riparian zone. Environmental Pollution, 2017, 231: 379-386. DOI:10.1016/j.envpol.2017.08.027 |
| [25] | Qin YB, Ding BJ, Li ZK, Chen S. Variation of Feammox following ammonium fertilizer migration in a wheat-rice rotation area, Taihu Lake, China. Environmental Pollution, 2019, 252: 119-127. DOI:10.1016/j.envpol.2019.05.055 |
| [26] | Shuai WT, Jaffé PR. Anaerobic ammonium oxidation coupled to iron reduction in constructed wetland mesocosms. Science of the Total Environment, 2019, 648: 984-992. DOI:10.1016/j.scitotenv.2018.08.189 |
| [27] | Yao ZB, Yang L, Song N, Wang CH, Jiang HL. Effect of organic matter derived from algae and macrophyte on anaerobic ammonium oxidation coupled to ferric iron reduction in the sediment of a shallow freshwater lake. Environmental Science and Pollution Research International, 2020, 27(21): 25899-25907. DOI:10.1007/s11356-019-06793-5 |
| [28] | Ding BJ, Luo WQ, Qin YB, Li ZK. Effects of the addition of nitrogen and phosphorus on anaerobic ammonium oxidation coupled with iron reduction (Feammox) in the farmland soils. Science of the Total Environment, 2020, 737: 139849. DOI:10.1016/j.scitotenv.2020.139849 |
| [29] | Ding BJ, Qin YB, Luo WQ, Li ZK. Spatial and seasonal distributions of Feammox from ecosystem habitats in the Wanshan region of the Taihu watershed, China. Chemosphere, 2020, 239: 124742. DOI:10.1016/j.chemosphere.2019.124742 |
| [30] | Van De Graaf AA, De Bruijn P, Robertson LA, Jetten MSM, Kuenen JG. Autotrophic growth of anaerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor. Microbiology, 1996, 142(8): 2187-2196. DOI:10.1099/13500872-142-8-2187 |
| [31] | Burton SA, Prosser JI. Autotrophic ammonia oxidation at low pH through urea hydrolysis. Applied and Environmental Microbiology, 2001, 67(7): 2952-2957. DOI:10.1128/AEM.67.7.2952-2957.2001 |
| [32] | Tominski C, Lösekann-Behrens T, Ruecker A, Hagemann N, Kleindienst S, Mueller CW, Höschen C, Kögel-Knabner I, Kappler A, Behrens S. Insights into carbon metabolism provided by fluorescence in situ hybridization-secondary ion mass spectrometry imaging of an autotrophic, nitrate-reducing, Fe(Ⅱ)-oxidizing enrichment culture. Applied and Environmental Microbiology, 2018, 84(9): e02166-e02117. |
| [33] | He SM, Tominski C, Kappler A, Behrens S, Roden EE. Metagenomic analyses of the autotrophic Fe(Ⅱ)-oxidizing, nitrate-reducing enrichment culture KS. Applied and Environmental Microbiology, 2016, 82(9): 2656-2668. DOI:10.1128/AEM.03493-15 |
| [34] | Shi L, Dong H, Reguera G, Beyenal H, Lu A, Liu J, Yu HQ, Fredrickson JK. Extracellular electron transfer mechanisms between microorganisms and minerals. Nature Reviews Microbiology, 2016, 14(10): 651-662. DOI:10.1038/nrmicro.2016.93 |
| [35] | Cooper DC, Picardal FW, Schimmelmann A, Coby AJ. Chemical and biological interactions during nitrate and goethite reduction by Shewanella putrefaciens 200. Applied and Environmental Microbiology, 2003, 69(6): 3517-3525. DOI:10.1128/AEM.69.6.3517-3525.2003 |
| [36] | Liu TX, Li XM, Zhang W, Hu M, Li FB. Fe(Ⅲ) oxides accelerate microbial nitrate reduction and electricity generation by Klebsiella pneumoniae L17. Journal of Colloid and Interface Science, 2014, 423: 25-32. DOI:10.1016/j.jcis.2014.02.026 |
| [37] | Jiang M, Zheng X, Liu H, Chen YG. Shewanella oneidensis MR-1 improving denitrification performance via influencing electron competition and distribution. Bioresource Technology Reports, 2020, 10: 100381. DOI:10.1016/j.biteb.2020.100381 |
| [38] | Yoon S, Cruz-García C, Sanford R, Ritalahti KM, Löffler FE. Denitrification versus respiratory ammonification: environmental controls of two competing dissimilatory NO3−/NO2− reduction pathways in Shewanella loihica strain PV-4. The ISME Journal, 2015, 9(5): 1093-1104. DOI:10.1038/ismej.2014.201 |
| [39] | Wang GW, Chen TH, Yue ZB, Zhou YF, Wang J. Isolation and characterization of Pseudomonas stutzeri capable of reducing Fe(Ⅲ) and nitrate from skarn-type copper mine tailings. Geomicrobiology Journal, 2014, 31(6): 509-518. DOI:10.1080/01490451.2013.847992 |
| [40] | Qu B, Fan B, Zhu SK, Zheng YL. Anaerobic ammonium oxidation with an anode as the electron acceptor. Environmental Microbiology Reports, 2014, 6(1): 100-105. DOI:10.1111/1758-2229.12113 |
| [41] | Zhan GQ, Zhang LX, Tao Y, Wang YJ, Zhu XY, Li DP. Anodic ammonia oxidation to nitrogen gas catalyzed by mixed biofilms in bioelectrochemical systems. Electrochimica Acta, 2014, 135: 345-350. DOI:10.1016/j.electacta.2014.05.037 |
| [42] | Bao P, Li GX. Sulfur-driven iron reduction coupled to anaerobic ammonium oxidation. Environmental Science & Technology, 2017, 51(12): 6691-6698. |
| [43] |
Wu YD, Li FB, Liu TX. Mechanism of extracellular electron transfer among microbe-humus-mineral in soil: a review. Acta Pedologica Sinica, 2016, 53(2): 277-291.
(in Chinese) 吴云当, 李芳柏, 刘同旭. 土壤微生物—腐殖质—矿物间的胞外电子传递机制研究进展. 土壤学报, 2016, 53(2): 277-291. |
| [44] | Tan X, Xie GJ, Nie WB, Xing DF, Liu BF, Ding J, Ren NQ. Fe(Ⅲ)-mediated anaerobic ammonium oxidation: a novel microbial nitrogen cycle pathway and potential applications. Critical Reviews in Environmental Science and Technology, 2021: 1-33. |
| [45] | Rios-Del Toro EE, Valenzuela EI, Ramírez JE, López-Lozano NE, Cervantes FJ. Anaerobic ammonium oxidation linked to microbial reduction of natural organic matter in marine sediments. Environmental Science & Technology Letters, 2018, 5(9): 571-577. |
| [46] | Li S, Kappler A, Zhu YG, Haderlein SB. Mediated electrochemical analysis as emerging tool to unravel links between microbial redox cycling of natural organic matter and anoxic nitrogen cycling. Earth-Science Reviews, 2020, 208: 103281. DOI:10.1016/j.earscirev.2020.103281 |
| [47] | Rue K, Rusevova K, Biles CL, Huling SG. Abiotic hydroxylamine nitrification involving manganese- and iron-bearing minerals. Science of the Total Environment, 2018, 644: 567-575. DOI:10.1016/j.scitotenv.2018.06.397 |
| [48] | Amstaetter K, Borch T, Larese-Casanova P, Kappler A. Redox transformation of arsenic by Fe(Ⅱ)-activated goethite (α-FeOOH). Environmental Science & Technology, 2010, 44(1): 102-108. |
| [49] | Bird LJ, Bonnefoy V, Newman DK. Bioenergetic challenges of microbial iron metabolisms. Trends in Microbiology, 2011, 19(7): 330-340. DOI:10.1016/j.tim.2011.05.001 |
| [50] | Weber KA, Achenbach LA, Coates JD. Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction. Nature Reviews Microbiology, 2006, 4(10): 752-764. DOI:10.1038/nrmicro1490 |
| [51] | Wang XN, Sun GX, Zhu YG. Thermodynamic energy of anaerobic microbial redox reactions couples elemental biogeochemical cycles. Journal of Soils and Sediments, 2017, 17(12): 2831-2846. DOI:10.1007/s11368-017-1767-4 |
| [52] | Yi B, Wang HH, Zhang QC, Jin H, Abbas T, Li Y, Liu YM, Di HJ. Alteration of gaseous nitrogen losses via anaerobic ammonium oxidation coupled with ferric reduction from paddy soils in Southern China. Science of the Total Environment, 2019, 652: 1139-1147. DOI:10.1016/j.scitotenv.2018.10.195 |
| [53] | Kappler A, Bryce C, Mansor M, Lueder U, Byrne JM, Swanner ED. An evolving view on biogeochemical cycling of iron. Nature Reviews Microbiology, 2021, 19(6): 360-374. DOI:10.1038/s41579-020-00502-7 |
| [54] | Luther GW Ⅲ, Sundby B, Lewis BL, Brendel PJ, Silverberg N. Interactions of manganese with the nitrogen cycle: alternative pathways to dinitrogen. Geochimica et Cosmochimica Acta, 1997, 61(19): 4043-4052. DOI:10.1016/S0016-7037(97)00239-1 |
| [55] | Guan QS, Zhang YL, Tao YR, Chang CT, Cao WZ. Graphene functions as a conductive bridge to promote anaerobic ammonium oxidation coupled with iron reduction in mangrove sediment slurries. Geoderma, 2019, 352: 181-184. DOI:10.1016/j.geoderma.2019.05.044 |
| [56] | Jia R, Li LN, Qu D, Mi NN. Enhanced iron(Ⅲ) reduction following amendment of paddy soils with biochar and glucose modified biochar. Environmental Science and Pollution Research International, 2018, 25(1): 91-103. DOI:10.1007/s11356-016-8081-3 |
| [57] | Thamdrup B, Dalsgaard T. The fate of ammonium in anoxic manganese oxide-rich marine sediment. Geochimica et Cosmochimica Acta, 2000, 64(24): 4157-4164. DOI:10.1016/S0016-7037(00)00496-8 |
| [58] | Lin H, Taillefert M. Key geochemical factors regulating Mn(Ⅳ)-catalyzed anaerobic nitrification in coastal marine sediments. Geochimica et Cosmochimica Acta, 2014, 133: 17-33. DOI:10.1016/j.gca.2014.01.025 |
| [59] | Luther GW, Thibault De Chanvalon A, Oldham VE, Estes ER, Tebo BM, Madison AS. Reduction of manganese oxides: thermodynamic, kinetic and mechanistic considerations for one- versus two-electron transfer steps. Aquatic Geochemistry, 2018, 24(4): 257-277. DOI:10.1007/s10498-018-9342-1 |
| [60] | Chen S, Ding BJ, Qin YB, Chen ZH, Li ZK. Nitrogen loss through anaerobic ammonium oxidation mediated by Mn(Ⅳ)-oxide reduction from agricultural drainage ditches into Jiuli River, Taihu Lake Basin. Science of the Total Environment, 2020, 700: 134512. DOI:10.1016/j.scitotenv.2019.134512 |
| [61] | Yu HY, Li FB, Liu CS, Huang W, Liu TX, Yu WM. Iron redox cycling coupled to transformation and immobilization of heavy metals: implications for paddy rice safety in the red soil of South China. Advances in Agronomy, 2016, 137: 279-317. |
| [62] | Islam FS, Pederick RL, Gault AG, Adams LK, Polya DA, Charnock JM, Lloyd JR. Interactions between the Fe(Ⅲ)-reducing bacterium Geobacter sulfurreducens and arsenate, and capture of the metalloid by biogenic Fe(Ⅱ). Applied and Environmental Microbiology, 2005, 71(12): 8642-8648. DOI:10.1128/AEM.71.12.8642-8648.2005 |
| [63] | Xiu W, Guo HM, Shen JX, Liu S, Ding SS, Hou WG, Ma J, Dong HL. Stimulation of Fe(Ⅱ) oxidation, biogenic lepidocrocite formation, and arsenic immobilization by Pseudogulbenkiania sp. strain 2002. Environmental Science & Technology, 2016, 50(12): 6449-6458. |
| [64] | Gilson ER, Huang S, Jaffé PR. Biological reduction of uranium coupled with oxidation of ammonium by Acidimicrobiaceae bacterium A6 under iron reducing conditions. Biodegradation, 2015, 26(6): 475-482. DOI:10.1007/s10532-015-9749-y |
 2022, Vol. 62
2022, Vol. 62