中国科学院微生物研究所,中国微生物学会
文章信息
- 汪文强, 赵长明, 张新芳, 陈玉莹, 刘勇勤. 2022
- WANG Wenqiang, ZHAO Changming, ZHANG Xinfang, CHEN Yuying, LIU Yongqin.
- 三极冰川冰尘微生物及其介导的碳氮生物地球化学循环研究进展
- Research progress of cryoconite microorganisms and biogeochemical cycling of carbon and nitrogen driven by cryoconite in tripolar glaciers
- 微生物学报, 62(6): 2136-2149
- Acta Microbiologica Sinica, 62(6): 2136-2149
-
文章历史
- 收稿日期:2021-06-29
- 修回日期:2021-10-08
- 网络出版日期:2021-11-22
2. 兰州大学生命科学学院, 甘肃 兰州 730000;
3. 兰州大学生命科学学院, 草地农业生态系统国家重点实验室, 甘肃 兰州 730000;
4. 中国科学院青藏高原研究所, 青藏高原地球系统与资源环境国家重点实验室, 北京 100101
2. School of Life Sciences, Lanzhou University, Lanzhou 730000, Gansu, China;
3. State Key Laboratory of Grassland Agro-ecosystem, School of Life Sciences, Lanzhou University, Lanzhou 730000, Gansu, China;
4. State Key Laboratory of Tibetan Plateau Earth System, Resources and Environment (TPESRE), Institute of Tibetan Plateau Research, Chinese Academy of Sciences, Beijing 100101, China
冰川约占地球面积的10%,是地表重要的淡水资源[1]。随着全球气候变暖,南北极以及以青藏高原为主的第三极地区的冰川正在加速消融。冰川消融主要以冰面消融为主,影响冰面消融的主要因素是冰面反照率,冰尘作为冰川表面的主要吸光物质,能有效降低冰川表面反照率[2]。
冰尘是散落在冰川表面的由矿物质、有机质和微生物组成的聚合体,既包括远源输送来的细粉尘和气溶胶组分,也有局地源的粗冰碛物及来自周围生态系统的土壤和植物碎屑等[3–5]。冰尘分为2类,分布于冰川表面的冰面冰尘(图 1A)和位于冰尘穴中的沉积冰尘(图 1B)。冰尘穴是冰面冰尘吸收更多的太阳辐射融化于冰川冰中,经长时间积累形成深度可达几十厘米的圆柱型孔穴[6–8]。

|
| 图 1 冰面冰尘(A)及冰尘穴中的沉积冰尘(B) Figure 1 Cryoconite on the surface of glacier (A) and in the cryoconite hole (B). |
19世纪以来冰尘及冰尘穴一直是冰川学和生物学研究的重要点之一[9],也是冰川表面生物多样性和微生物活动的“热点”[10]。冰尘中由有机物质和微生物组成的有机部分能有效影响冰川表面反照率,并进一步影响冰川的物质平衡[2]。冰尘中的微生物可通过光合作用、硝化和反硝化作用等参与到地球化学循环过程中[9, 11],因此研究冰尘的物理化学及其微生物特征具有重要意义。
基于冰尘的重要性,本文综述了南极(Antarctic)、北极(Arctic)及以青藏高原为主的第三极(the Third Pole,TP)冰尘的物理和化学特征及其影响因素、冰尘微生物群落组成及其介导的碳氮生物地球化学循环过程。对目前冰尘研究中可能存在的问题和不足进行了陈述,并对今后冰尘研究方向提出了展望。
1 冰尘的物理化学特征及其影响因素冰尘主要由有机物和无机物组成,有机物包括活的和死的微生物、微生物的分泌物和分解产物、以及一些外来的生物物质[8, 12–13]。三极冰川冰尘中有机物的丰度为1.9%–18.3%,且在不同冰川之间存在明显的差异,其中南极最低,为3%[14];第三极冰川冰尘中有机物平均丰度为8.4%,冰川之间丰度差异相对较小(5%–13.2%),位居第二[15–17];北极冰川冰尘中有机物丰度最高,平均丰度为8.5%,冰川之间丰度差异较大(1.9%–18.3%)[18–20]。
冰尘中的无机物主要由矿物碎片组成,通常以层状硅酸盐、网状硅酸盐和石英为主[12, 18–22]。三极冰川冰尘中无机物的组成及其浓度也存在差异,南极冰川冰尘中含有高浓度的角闪石、辉石、金/黑云母、滑石和绿泥石[14, 23–24];第三极冰川冰尘中的无机物以矿物颗粒为主,其中硅酸盐成分最多,主要是石英、钾长石、斜长石和一些黏土矿物,如绿泥石、伊利石和高岭石[25]。北极冰川冰尘中无机物主要包括石英、钠长石、斜长石、蒙皂石、云母、角闪石和绿泥石[26]。
冰尘外观类似球形,其中第三极冰川中有的冰尘呈现不规则的形状和锐利的边缘,也有一些呈现规则形状且光滑边缘,除此之外还发现了一些呈现絮状结构的冰尘[27];而北极冰川冰尘大多数呈现多边形,并具有锐利的边缘[28]。
冰尘颗粒直径在三极冰川之间差别较大。三极冰川冰尘的平均颗粒直径为8.80 mm[15, 27, 29–31],其中第三极冰川冰尘平均颗粒直径为1.84 mm,粒度在冰川之间差异相对较小(0.55–2.93 mm)[15, 27];北极冰川冰尘平均颗粒直径为20.4 mm,远大于第三极冰川冰尘颗粒,而且冰川之间粒度差异较大(0.33–110.00 mm)[29–31]。目前已发表的冰尘颗粒直径大小如表 1和表 2所示。
| Glacier/region | Granule size/mm | References |
| Meikuang, China | 0.55±0.26 | [15] |
| Gohza, China | 0.55±0.28 | |
| Xiao Dongkemadi, China | 0.80±0.35 | |
| Urumqi No.1, China | 1.10±0.39 | |
| Austre Brøggerbreen, Svalbard | 0.49±0.29 | |
| Penny Ice Cap, Canada | 0.33±0.11 | |
| Devon Ice Cap, Canada | 0.33±0.13 | |
| Longyearbreen, Svalbard | 8.59±6.67 | [29] |
| Aldegondabreen, Svalbard | 110.00±35.00 | [30] |
| Leverett, Greenland | 2.59±1.54 | [31] |
| Glacier/region | Granule size/mm | Reference | |
| Long range | Local range | ||
| Laohugou No.12, China | 1.28±1.12 | 4.55±3.05 | [27] |
| Shiyi, China | 1.25±0.84 | 4.83±3.54 | |
| Dongkemadi, China | 1.23±1.02 | 4.63±3.20 | |
| Zhadang, China | 1.24±1.06 | 4.01±2.85 | |
| Urumqi No.1, China | 1.15±0.93 | 3.98±2.61 | |
| Baishui, China | 1.36±1.25 | – | |
| –: none. | |||
组成冰尘的颗粒,一般以含2个亚颗粒的最多,冰尘颗粒越大其包含的亚颗粒也越多。冰尘中多数颗粒具有同心层结构,以3层结构最为常见,层级越多颗粒越大;也有些冰尘颗粒并无特殊的内部结构,也无分层结构[32]。按照冰尘内部颗粒结构,有学者将冰尘分为4种类型,分别是具有同心层结构的冰尘、带有亚颗粒的冰尘、内部无明显结构的冰尘和中心位置处具有较大无机颗粒的冰尘[2]。
引起冰尘物理化学特征差异的主要原因有:(1) 空间异质性。如:冰尘组成成分来源的空间异质性。有研究发现冰尘粒子直径存在0.57–20.00 µm和20–100 µm两个峰,这说明本地和异地输送物质与冰尘形成有关。在大型冰川和冰盖的内部区域,由外源性输送的大气悬浮物沉积的细尘为重要来源,而在较小的冰川和冰盖边缘,有着含量更高的矿物质[33–34],除上述来源以外,这些物质还源于冰内物质的消融释放[35]和一些微量陨石的沉积[33]。(2) 冰尘中有机物的数量和类别。冰尘颗粒的大小与冰尘中有机物的含量(外源性有机质以及更多腐殖化形式的碳)呈负相关,但与冰尘中碳水化合物的含量呈正相关。有机物的性质影响冰尘的聚合过程进而影响冰尘颗粒的大小和形态[36]。(3) 冰尘中微生物的群落组成。冰尘颗粒的大小还与其中丝状自养生物的数量和丝状长度相关,并且冰尘粒径与有机质含量有很强的相关性,这些有机物的含量很大程度归因于微生物的生化过程,这表明冰尘中的微生物群落对冰尘颗粒的大小有着重要作用[12, 37]。(4) 人类活动。微生物群落对环境变化高度敏感,对变化的环境条件或人为胁迫反应迅速[38]。人类对冰川的频繁访问可能会增加引入人类来源微生物的机会,进而影响冰尘微生物群落结构[10]。此外,冰尘成分的来源之一是大气输送,而大气中会携带一部分由人类活动产生的物质。如:在冰川中发现与人类活动相关的重金属Pb、Cd以及其他金属元素Cu、Zn、Fe、Mn、As、Se、Sb、Hg[3, 10, 39],以及137Cs、239+240Pu、90Sr[40]。因此,人类活动影响冰尘微生物群落组成和冰尘的地球化学循环,进而可能影响冰尘的物理化学特征。
2 冰尘的微生物特征 2.1 冰尘微生物多样性特征及其影响因素冰尘是冰川表面生物多样性最高的生物栖息地,生活着多种微生物,如细菌、古菌和真核生物[14, 41–42]。冰尘微生物的研究主要集中在南北极,而且多数研究以细菌为主,藻类和真核等的研究较少。冰尘中微生物群落构建同时受到扩散、环境过滤和生物过滤的作用,群落组成存在距离衰减模式[43];且冰尘中微生物群落组成在不同粒径大小的冰尘颗粒中表现不同,如在较大颗粒冰尘中丝状蓝细菌Phormidesmis priestleyi是主要的细菌种类[41];此外冰尘微生物群落多样性与冰尘穴的地理位置、大小、及冰尘穴上覆水中硝酸盐浓度显著相关,表明冰尘穴结构及其上覆水营养条件等环境因子对冰尘微生物多样性的影响[44]。Cameron等对北极和南极地区沉积冰尘中的细菌群落结构和多样性的研究发现南北极群落结构存在显著差异[42]。Liu等首次对青藏高原3个气候区的3条冰川冰尘微生物群落进行了研究,发现冰尘细菌群落组成在3条冰川存在显著差异[43],表明冰尘微生物多样性受空间尺度大小的影响。通过对三极地区已有冰尘细菌微生物的数据整合[41, 43, 45–48],我们进一步分析了冰尘细菌alpha多样性以及群落组成结构(图 2),分析得出三极冰川冰尘中细菌丰富度和物种多样性存在显著差异,其中南极冰尘细菌丰富度(Richness:454.27)和物种多样性(Shannon:6.72)最高,且变化范围较大(Richness:155–721;Shannon:4.31–7.97);其次是第三极冰川冰尘细菌(Richness:426.07,变化范围为212–737;Shannon:5.23,变化范围为2.20–7.47);北极地区冰尘细菌丰富度(205.2)和物种多样性(4.98)最低,且变化范围较小(Richness:98–579;Shannon:1.91–7.32)。三极冰川冰尘中共有的主要优势物种分别是Proteobacteria (45.86%),Bacteroidetes (18.73%),Cyanobacteria (27.6%),Actinobacteria (8.9%)和Firmicutes (3.63%)等(表 3),这些优势物种在各个分布区域丰度各异,南极冰川冰尘中含有更高的Bacteroidetes (32.3%),其次是北极冰川冰尘(16.4%),第三极冰川冰尘丰度最低(7.5%);北极冰川冰尘中含有更高的Cyanobacteria (13.2%),南极次之(12.1%),第三极最低(2.3%);第三极冰尘中含有更高的Proteobacteria (71.8%),北极次之(40.1%),南极最低(25.7%)。

|
| 图 2 三极冰川冰尘中细菌丰富度(A)和多样性(B)比较 Figure 2 Comparisons of Richness (A) and Shannon (B) of cryoconite bacteria in the tripolar glaciers. **: P < 0.01, ***: P < 0.001; ns: no significant difference. TP: the Third Pole. |
| Phylum | Antarctic | Arctic | TP |
| Acidobacteria | 5.0 | 3.2 | 0.3 |
| Actinobacteria | 5.1 | 6.5 | 6.2 |
| Bacteroidetes | 32.3 | 16.4 | 7.5 |
| Chloroflexi | 0.5 | 0.8 | 1.1 |
| Cyanobacteria | 12.1 | 13.2 | 2.3 |
| Deinococcus.Thermus | 0.2 | 0.4 | 0.4 |
| Firmicutes | 1.7 | 3.7 | 5.5 |
| Gemmatimonadetes | 3.5 | 0.7 | 1.6 |
| Planctomycetes | 2.8 | 0.2 | 0.0 |
| Proteobacteria | 25.7 | 40.1 | 71.8 |
| Verrucomicrobia | 5.0 | 1.9 | 0.2 |
| Others | 6.1 | 13.0 | 3.2 |
南北极和第三极冰尘微生物群落结构具有明显的地理分布差异,其可能的原因是:首先三极冰尘中有机物浓度存在明显差异,这可能是由有机物种类不同引起的[14–17]。其次3个地区有机物的来源不同,有机物的来源分为外源和内源,其中内源有机物主要以Cyanobacteria及Haptophyta、Heterokonta和Cryptophyceae等真核藻类为代表的一类初级生产者通过光合作用提供,Cyanobacteria丰度越高,可能提供的有机物越多[18, 30],而外源碳源主要通过干湿大气沉降、冰面消融的径流带入[15, 33–34]。研究发现第三极冰川消融速率高于南北极[46],并且大气传输带来的气溶胶更复杂[49]。第3个可能的因素是冰川环境不同,冰尘所处环境的pH对群落组成具有重要意义[50],第三极冰尘穴中的pH (8.80,未发表数据)高于北极(6.47)和南极(8.30)[45, 51–52]。
2.2 冰尘微生物的适应性特征冰尘中的细菌、真菌及酵母等能产生胞外聚合物(EPS),EPS通过促进生物絮凝作用促进冰尘颗粒的聚集,并可以作为黏合剂将无机颗粒、微生物和其他有机物黏合在一起,还可以降解自身颗粒内和周围异养生物中的有机物[31, 53]。如丝状蓝细菌Phormidesmis priestleyi以EPS的形式将化合物释放到环境中,这些物质包括蛋白质、脂质、多糖和其他次级代谢产物,其中多糖成分还可以与蓝细菌菌丝结合以形成保护性的鞘或胶囊。EPS和胞外多糖被认为是冷冻保护剂,可防止细胞膜破裂,还可以作为储存紫外线保护物的场所,并可能协助生物体对金属离子和其他营养物的吸收[54]。
冰尘中蓝细菌为其他微生物提供了丰富的碳源。据报道,冰尘中75%–93%的可用碳来源于蓝细菌的光合作用,在温暖条件下它固定碳的速率比通常在周围环境存在的生物更高[11]。一些可培养的冰尘微生物可以水解利用有机物且偏好单糖,如甘露糖、鼠李糖和木糖[55]。除此之外冰尘中的微生物还可以利用葡萄糖以及一些有机碳化合物,这些化合物主要以氨基酸(糖原、左旋糖、纤维二糖和异赤藓糖醇等)为主,其次是碳水化合物(D-甘露醇、D-丝氨酸、L-丙氨酰甘氨酸和L-苯丙氨酸等)和羧酸类(甲酸、丁二酸、尿氨酸和甘油-谷氨酸等)化合物[14]。
冰尘微生物具有低温酶活性及耐盐性[55]。冰尘微生物常见的活性酶有多种,包括淀粉酶、纤维素酶、脂肪酶、脲酶、蛋白酶、过氧化氢酶和Beta-半乳糖苷酶等[54, 56]。研究发现在南极东部Anuchin冰川冰尘穴中分离培养的Mrakia sp.菌株在4 ℃和10 ℃下不仅具有胞外果胶酶活性而且耐盐性较高;Rhodotorula sp.在10 ℃和15 ℃环境下具有较好的淀粉酶活性,耐盐性中等;Phialophora alba具有胞外纤维素酶活性,且盐度耐受性较低;所有的酵母菌株在10 ℃环境下均表现出过氧化氢酶活性,所有的丝状真菌在20 ℃环境以下都可以生长[51]。冰尘微生物产生的酶在低温下仍有较高活性,对维持冰尘微生物在寒冷条件下的生命代谢活动具有重要作用。
冰尘微生物中的某些氨基酸通过改变蛋白结构并调控相关基因的表达来适应低温环境。如:精氨酸在蛋白质二级结构中形成H键,低温环境下这种过程能抑制蛋白质的柔韧性,并妨碍蛋白质的最佳功能,因此在低温环境下冷适应性生物可以用赖氨酸代替精氨酸的残基,以降低结构稳定性,同样脯氨酸含量的降低也可以增加蛋白质二级结构的柔韧性。此外微生物还可以通过作用于热应激和冷应激相关的基因来降温或升温,而且一些蛋白不仅有冷应激作用,同时也能作为热应激蛋白[57]。有些微生物还具有抗冻蛋白(AFPs)活性,AFPs是一组结构多样的冰结合蛋白,通过降低溶液的冰点或通过抑制冰粒的重结晶来抑制冰的生长,它是生物体在经历有规律的低温和冷冻过程中进化而来的。通过AFPs的生理过程,一些冷适应细菌的细胞膜仍然受到保护,免受冷冻造成的损害,从而提高了受到冷冻的微生物的生存能力。在冰尘微生物中发现的AFPs属于AFP家族IBP-1,该蛋白在寒冷环境中具有重要的生理作用[58]。除以上适应性策略外,还包括在低温下较多的色素或多不饱和脂肪酸的产生,这些物质提供了微生物在低温环境下的适应性策略[59]。
3 冰尘微生物参与的碳氮循环过程 3.1 碳循环微生物介导的碳循环主要分为对无机碳的固定作用以及通过呼吸和发酵对有机物的分解作用[4, 57, 60–62]。冰川生态系统参与碳循环过程的微生物主要包括细菌和真核藻类,细菌主要包括Actinobacteria、Cyanobacteria和Proteobacteria,而真核藻类主要包括Haptophyta、Heterokonta和Cryptophyceae[63]。陈玉莹等综述了冰尘微生物驱动的碳循环过程[63]。冰川微生物参与的碳循环过程见图 3。
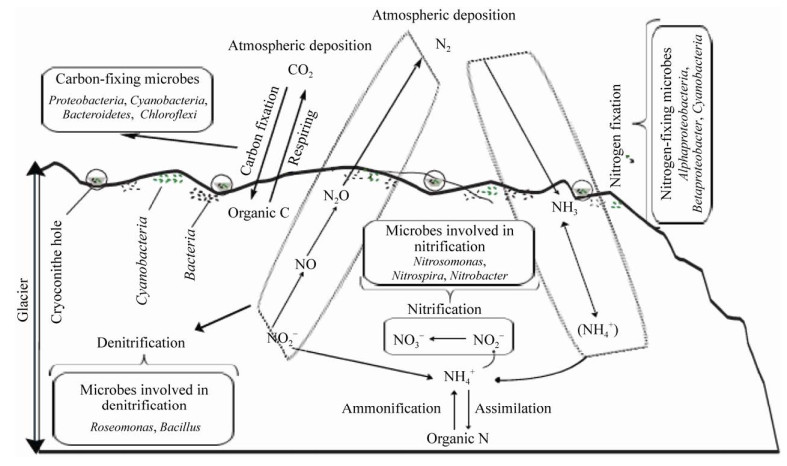
|
| 图 3 冰尘微生物及其驱动的碳、氮循环过程示意图 Figure 3 Diagram of the carbon and nitrogen cycle processes driven by the cryoconite microbes. |
冰尘中的自养型细菌和自养型真核微生物可将环境中的无机碳固定成生物可利用的有机碳[11],如冰尘中蓝细菌利用光能和无机碳合成可供其他微生物生长繁殖的活性有机碳(labile dissolved organic matter,LDOC)。冰尘中的异养型细菌通过呼吸作用消耗有机物,如冰尘中复杂的异养细菌群落代谢转化LDOC为惰性的有机碳[64]。冰尘微生物的净自养过程发生在夏季,由于光照条件较好且存在大气气体交换,该时期冰尘穴具有较高的自养效率,以有机碳的积累过程为主;而净异养过程很可能发生在秋、冬季的冰冻期,由于降雪及水体冻结过程等导致冰尘穴透光性下降,气体交换较差,该时期主要以有机物分解过程为主。溶解性有机碳(DOC)在冰川融化过程中再生,导致DOC的量每年增加[64]。冰尘中参与碳循环过程的外源性有机碳类型包括木质素、脂质、蛋白质和不饱和烃,其中脂质和蛋白质可能来自原位生物的活动产生,木质素和不饱和烃可能来自冰川外源输入[65],包括来自本源和远源的植物区系、有机矿物尘埃、微生物和人为污染物碎片[37]。冰尘中碳存在形式及其含量具有空间差异性,总结见表 4,TOC代表冰尘中总溶解性有机碳,DOC代表冰尘穴上覆水中可溶性有机碳。
| Glacier/region | TOC | DOC | References |
| Midtre Lovenbreen, Svalbard | 20.10 mg/g | [66] | |
| Vestre Brøggerbreen, Svalbard | 33.90 mg/g | ||
| Austre Brøggerbreen, Svalbard | 17.30 mg/g | ||
| Midtre Lovenbreen, Svalbard | 22.96 mg/g | [67] | |
| Vestre Brøggerbreen, Svalbard | 28.10 mg/g | ||
| Austre Brøggerbreen, Svalbard | 15.60 mg/g | ||
| Laohugou No. 12, China | 1.60% dry wt | 0.20% dry wt | [45] |
| Tanggula Dongkemadi Glacier, China | 2.84% dry wt | 0.32% dry wt | |
| Yulong Baishui Glaciers, China | 9.70% dry wt | 0.60% dry wt | |
| Laohugou No. 12, China | 1.51 mg/g | 0.17 mg/g | [65] |
| Dongkemadi Glacier, China | 0.89 mg/g | 0.16 mg/g | |
| Nyainqentanglha Glacier, China | 0.25 mg/g | ||
| Karola Glacier, China | 0.39 mg/g | ||
| East Antarctic ice sheet, Antarctic | 0.20 mg/g | ||
| Kronprins Christian Land, Greenland | 1.48% | [12] | |
| Kangerlussuaq, Greenland | 1.30% | ||
| Midtre Lovenbreen, Svalbard | 3.27% | ||
| Longyearbreen, Svalbard | 2.76% | ||
| Vestfonna, Svalbard | 6.07% | ||
| Dronning Maud Land, Antarctic | 0.50 mg/L | [59] | |
| Larseman Hills, Antarctic | 0.06 mg/L | ||
| Amery Ice shelf, Antarctic | 0.58 mg/L | ||
| Himalaya, Sutri Dhaka | 5.20 mg/L |
3.2 氮循环
微生物介导的氮循环过程主要包括对外来输入氮素营养的固定,以及维持冰尘环境物质平衡所进行的氮素转化过程,包括硝化、反硝化和氨化作用等[68–71]。冰尘环境接受大气沉降带来的氮是微生物固氮合成有机物、满足自身新陈代谢需要的重要养分来源;而冰尘特殊的物理结构,即颗粒、碎片等形式,为氮素聚集、滞留创造了条件,促进了微生物彼此的共生作用,使得其在这种极端低温、寡营养环境中进行不同价态氮素的转化[68]。
对冰川生态系统的研究发现可能与氮循环相关的微生物门类主要有:Cyanobacteria、Thaumarchaeota、Proteobacteria、Bacteroidetes、Firmicutes、Gemmatimonadetes、Verrucomicrobia[69–70]。其中,与固氮相关的微生物有Alphaproteobacteria、Betaproteobacteria、Cyanobacteria等[68],与硝化作用相关的微生物主要有Nitrosomonas、Nitrospira和Nitrobacter等,与反硝化作用相关的微生物有Roseomonas和Bacillus等[71]。冰川微生物参与的氮循环过程见图 3。
分析冰尘样品N、O同位素发现,沉积冰尘和表面冰尘中存在不同价态的氮(NO3–、NH4+、NO2–)浓度差异,冰尘中NO3–浓度高,NO2–浓度低,表面冰尘中NH4+高于沉积冰尘[68]。这些氮素离子只有少部分来自冰、雪融化、有机再矿化的氮输入[68],这无法满足微生物的生长需求,表明外源沉降对微生物固氮养分获取的重要性[68, 72]。大气干、湿沉降以及人类活动带来的沉降都可作为外源输入,尤其是位于雪中的冰尘,影响微生物固氮[73]。大多数北极冰川通过间歇性大气氮富集过程从低纬度获得相当比例的氮源,如硝酸盐沉积,其主要发生在干沉降季节(9月至次年6月),铵沉积在干沉降和湿沉降季节都有发生[74]。另外,氧气含量和氮有效性也是氮固定的重要影响因素[68],研究发现,冰尘物理环境的分层导致氧气含量的变化,进而导致在功能通路和物种类群的划分[72]。冰川冰尘中无机氮的可利用率显著影响氮固定的发生,与可溶性无机氮、总无机氮等有关[72]。当总无机氮浓度低于1.3 µg N/g,并且可溶性无机氮浓度很低时固氮作用才会更强,这说明可溶性有机氮不足以满足冰尘穴中微生物的同化需求,需要无机氮的供给[73]。
微生物参与氮循环由自身的机制驱动,这与碳循环相关。当冰尘环境中氮源有限时,微生物自身可以通过基因调控功能代谢,分解一些含碳有机底物为自身供能,并摄取稀缺的氮素,达到固氮目的。固定的氮通过不同微生物类群,在需氧或厌氧条件下,进行氮素价态的转化,主要是硝化和反硝化过程。另外,有机氮的存在给冰尘中的微生物提供了额外的氮循环途径,例如微生物可合成自身有机氮进行同化作用、氧化还原作用,也可以分解环境中的有机氮进行氨化作用等[71]。这些作用都可以通过测定冰尘中不同形式氮的浓度表征,达到对微生物参与冰尘氮循环过程的了解。
冰川冰尘中氮的存在形式及其浓度具有空间差异性,总结见表 5。TN是冰尘中总氮的含量,NH4+和NO3–是冰尘穴上覆水中铵根离子和硝酸根离子的含量。
4 讨论与展望
综上所述,冰尘主要由有机物和无机物组成,其中有机物以微生物、微生物的分泌物、分解产物为主;无机物主要以层状硅酸盐、网状硅酸盐和石英为主。冰尘中生物群落较复杂,包括细菌、藻类和真核等。冰尘微生物具有多种酶活性和盐度耐受性,从而应对冰川寒冷环境的胁迫。冰尘微生物广泛参与冰川表面的碳、氮等物质循环,对冰川生态系统具有重要影响。冰尘微生物群落受到地域环境、海拔、营养物质以及人类活动影响。
冰尘形状和大小主要取决于分布在冰尘表面蓝细菌的菌丝对颗粒物的物理附着、胞外聚合物对颗粒的粘附以及颗粒内和周围异养生物降解有机物的相互作用,同时也受融雪、风、重力、冰川坡度等影响,且具有空间分布差异性。它们对冷环境的适应机制是由EPS通过促进生物絮凝作用促进冰尘颗粒的聚集,EPS不仅可防止细胞膜破裂,还可以作为储存紫外线保护物的场所,并可能协助生物体对金属离子和其他营养物的吸收。
从目前对冰尘的研究可以看出大多数集中于南北极,而对第三极冰尘的研究多数关注其物理化学特性,对微生物相关的研究很少。虽有研究阐述了第三极不同地理区域中冰尘微生物多样性及其结构的组成,以及冰尘的可能性来源,但所研究仍然存在以下不足:(1) 未阐明第三极冰川冰尘(穴)的分布特征及基本物理和化学特征;(2) 所研究冰川仅是第三极的极少部分,对于空间和地理分布差异性研究不足,难以全面揭示冰尘的微生物多样性;(3) 就人类活动对冰尘微生物结构的影响目前没有任何报道;(4) 冰尘结构和微生物多样性的年际变化、季节变化未能做出揭示;(5) 影响冰尘微生物多样性及其结构的可能因素揭示不足;(6) 冰尘微生物如何适应极端环境条件并进行地球化学循环等过程缺乏系统研究;(7) 冰尘作为冰面主要的吸光物质,能有效降低冰川表面反照率,然而关于反照率与冰尘微生物的关系却不明确,也尚未见任何报道。
青藏高原平均海拔4 000多m,是我国最大、也是世界海拔最高的高原,被称为“世界屋脊”;青藏高原也是除南北极以外地球上冰川分布最广的地区,拥有3万多条现代冰川,面积达到49 873.44 km2,冰储量为4 561 km3。青藏高原还是世界上最大的分水岭之一,长江、黄河、澜沧江、怒江、雅鲁藏布江等世界著名大河均发源于此,是亚洲众多大江大河的发源地,因此具有“亚洲水塔”之称,高海拔和低纬度造就了其独特的地理位置。由于其环境的特殊性以及对周边国家的贡献,研究其表面冰尘微生物意义重大。未来我们可以进一步开展以下几个方面的研究:(1) 系统开展青藏高原冰川冰尘微生物多样性研究;(2) 建立冰尘微生物群落、色素含量与反照率的关系模型;(3) 通过多组学技术(宏基因组、宏转录组、基因组)定量、定性分析冰尘微生物在冰川环境中的适应性机制及其对环境变化的响应;(4) 探究冰尘微生物对青藏高原冰川生态系统生物地球化学循环的影响及其贡献。
| [1] |
Shi YF, Ren BH. A short history on glaciological research in China. Journal of Glaciology and Geocryology, 1983, 5(1): 21-31.
(in Chinese) 施雅风, 任炳辉. 中国冰川研究发展简史. 冰川冻土, 1983, 5(1): 21-31. |
| [2] | Xu H, Li ZQ, Nozomu T, Zhang XY, Zhang GF. Characteristics and formation analysis of cryoconite granules: take the Urumqi Glacier No. 1 as an example. Journal of Glaciology and Geocryology, 2013, 35(5): 1118-1125. |
| [3] | Łokas E, Zaborska A, Kolicka M, Różycki M, Zawierucha K. Accumulation of atmospheric radionuclides and heavy metals in cryoconite holes on an Arctic glacier. Chemosphere, 2016, 160: 162-172. DOI:10.1016/j.chemosphere.2016.06.051 |
| [4] | Anesio AM, Hodson AJ, Fritz A, Psenner R, Sattler B. High microbial activity on glaciers: importance to the global carbon cycle. Global Change Biology, 2009, 15(4): 955-960. DOI:10.1111/j.1365-2486.2008.01758.x |
| [5] | Li QL, Kang SC, Wang NL, Li Y, Li XF, Dong ZW, Chen PF. Composition and sources of polycyclic aromatic hydrocarbons in cryoconites of the Tibetan Plateau glaciers. Science of the Total Environment, 2017, 574: 991-999. DOI:10.1016/j.scitotenv.2016.09.159 |
| [6] | McIntyre NF. Cryoconite hole thermodynamics. Canadian Journal of Earth Sciences, 1984, 21(2): 152-156. DOI:10.1139/e84-016 |
| [7] | Wharton RA Jr, McKay CP, Simmons GM Jr, Parker BC. Cryoconite holes on glaciers. BioScience, 1985, 35(8): 499-503. DOI:10.2307/1309818 |
| [8] | New E, To I, Ecology IN. Glacial Ecosystems. 2008. |
| [9] | Porazinska DL, Fountain AG, Nylen TH, Tranter M, Virginia RA, Wall DH. The biodiversity and biogeochemistry of cryoconite holes from McMurdo dry valley glaciers, Antarctica. Arctic, Antarctic, and Alpine Research, 2004, 36(1): 84-91. DOI:10.1657/1523-0430(2004)036[0084:TBABOC]2.0.CO;2 |
| [10] | Edwards A, Douglas B, Anesio AM, Rassner SM, Irvine-Fynn TDL, Sattler B, Griffith GW. A distinctive fungal community inhabiting cryoconite holes on glaciers in Svalbard. Fungal Ecology, 2013, 6(2): 168-176. DOI:10.1016/j.funeco.2012.11.001 |
| [11] | Stibal M, Tranter M. Laboratory investigation of inorganic carbon uptake by cryoconite debris from Werenskioldbreen, Svalbard. Journal of Geophysical Research: Biogeosciences, 2007, 112(G4): G04S33. |
| [12] | Langford H, Hodson A, Banwart S, Bøggild C. The microstructure and biogeochemistry of Arctic cryoconite granules. Annals of Glaciology, 2010, 51(56): 87-94. DOI:10.3189/172756411795932083 |
| [13] | Takeuchi N, Nishiyama H, Li ZQ. Structure and formation process of cryoconite granules on Ürümqi Glacier No. 1, Tien Shan, China. Annals of Glaciology, 2010, 51(56): 9-14. DOI:10.3189/172756411795932010 |
| [14] | Foreman CM, Sattler B, Mikucki JA, Porazinska DL, Priscu JC. Metabolic activity and diversity of cryoconites in the Taylor Valley, Antarctica. Journal of Geophysical Research: Biogeosciences, 2007, 112(G4): G04S32. |
| [15] | Takeuchi N. Optical characteristics of cryoconite (surface dust) on glaciers: the relationship between light absorbency and the property of organic matter contained in the cryoconite. Annals of Glaciology, 2002, 34: 409-414. DOI:10.3189/172756402781817743 |
| [16] | Takeuchi N, Matsuda Y, Sakai A, Fujita K. A large amount of biogenic surface dust (cryoconite) on a glacier in the Qilian Mountains, China. Bulletin of Glaciological Research, 2005, 22: 1-8. |
| [17] | Takeuchi N, Li ZQ. Characteristics of surface dust on Ürümqi Glacier No. 1 in the Tien Shan mountains, China. Arctic, Antarctic, and Alpine Research, 2008, 40(4): 744-750. DOI:10.1657/1523-0430(07-094)[TAKEUCHI]2.0.CO;2 |
| [18] | Hodson A, Bøggild C, Hanna E, Huybrechts P, Langford H, Cameron K, Houldsworth A. The cryoconite ecosystem on the Greenland ice sheet. Annals of Glaciology, 2010, 51(56): 123-129. DOI:10.3189/172756411795931985 |
| [19] | Takeuchi N, Nagatsuka N, Uetake J, Shimada R. Spatial variations in impurities (cryoconite) on glaciers in northwest Greenland. Bulletin of Glaciological Research, 2014, 32: 85-94. DOI:10.5331/bgr.32.85 |
| [20] | Edwards A, Anesio AM, Rassner SM, Sattler B, Hubbard B, Perkins WT, Young M, Griffith GW. Possible interactions between bacterial diversity, microbial activity and supraglacial hydrology of cryoconite holes in Svalbard. The ISME Journal, 2011, 5(1): 150-160. DOI:10.1038/ismej.2010.100 |
| [21] | Stibal M, Tranter M, Benning LG, Řehák J. Microbial primary production on an Arctic glacier is insignificant in comparison with allochthonous organic carbon input. Environmental Microbiology, 2008, 10(8): 2172-2178. DOI:10.1111/j.1462-2920.2008.01620.x |
| [22] | Stibal M, Tranter M, Telling J, Benning LG. Speciation, phase association and potential bioavailability of phosphorus on a Svalbard glacier. Biogeochemistry, 2008, 90(1): 1-13. DOI:10.1007/s10533-008-9226-3 |
| [23] | Bory A, Wolff E, Mulvaney R, Jagoutz E, Wegner A, Ruth U, Elderfield H. Multiple sources supply eolian mineral dust to the Atlantic sector of coastal Antarctica: evidence from recent snow layers at the top of Berkner Island ice sheet. Earth and Planetary Science Letters, 2010, 291(1/2/3/4): 138-148. |
| [24] | Lutz S, Anesio AM, Jorge Villar SE, Benning LG. Variations of algal communities cause darkening of a Greenland glacier. FEMS Microbiology Ecology, 2014, 89(2): 402-414. DOI:10.1111/1574-6941.12351 |
| [25] | Nagatsuka N, Takeuchi N, Nakano T, Shin K, Kokado E. Geographical variations in Sr and Nd isotopic ratios of cryoconite on Asian glaciers. Environmental Research Letters, 2014, 9(4): 045007. DOI:10.1088/1748-9326/9/4/045007 |
| [26] | Tedesco M, Foreman CM, Anton J, Steiner N, Schwartzman T. Comparative analysis of morphological, mineralogical and spectral properties of cryoconite in Jakobshavn Isbræ, Greenland, and Canada Glacier, Antarctica. Annals of Glaciology, 2013, 54(63): 147-157. DOI:10.3189/2013AoG63A417 |
| [27] | Dong Z, Kang S, Qin D et al. Provenance of cryoconite deposited on the glaciers of the Tibetan Plateau: new insights from Nd-Sr isotopic composition and size distribution. AGU Fall Meeting Abstracts, 2016. |
| [28] | Wientjes IGM, Van De Wal RSW, Reichart GJ, Sluijs A, Oerlemans J. Dust from the dark region in the western ablation zone of the Greenland ice sheet. The Cryosphere, 2011, 5(3): 589-601. DOI:10.5194/tc-5-589-2011 |
| [29] | Irvine-Fynn TDL, Bridge JW, Hodson AJ. Rapid quantification of cryoconite: granule geometry and in situ supraglacial extents, using examples from Svalbard and Greenland. Journal of Glaciology, 2010, 56(196): 297-308. DOI:10.3189/002214310791968421 |
| [30] | Zarsky JD, Stibal M, Hodson A, Sattler B, Schostag M, Hansen LH, Jacobsen CS, Psenner R. Large cryoconite aggregates on a Svalbard glacier support a diverse microbial community including ammonia-oxidizing archaea. Environmental Research Letters, 2013, 8(3): 035044. DOI:10.1088/1748-9326/8/3/035044 |
| [31] | Cook JM, Hodson AJ, Anesio AM, Hanna E, Yallop M, Stibal M, Telling J, Huybrechts P. An improved estimate of microbially mediated carbon fluxes from the Greenland ice sheet. Journal of Glaciology, 2012, 58(212): 1098-1108. DOI:10.3189/2012JoG12J001 |
| [32] | Takeuchi N, Kohshima S, Seko K. Structure, formation, and darkening process of albedo-reducing material (cryoconite) on a Himalayan glacier: a granular algal mat growing on the glacier. Arctic, Antarctic, and Alpine Research, 2001, 33(2): 115-122. DOI:10.1080/15230430.2001.12003413 |
| [33] | Stibal M, Šabacká M, Žárský J. Biological processes on glacier and ice sheet surfaces. Nature Geoscience, 2012, 5(11): 771-774. DOI:10.1038/ngeo1611 |
| [34] | Bullard JE. Contemporary glacigenic inputs to the dust cycle. Earth Surface Processes and Landforms, 2013, 38(1): 71-89. DOI:10.1002/esp.3315 |
| [35] | MacDonell S, Fitzsimons S. The formation and hydrological significance of cryoconite holes. Progress in Physical Geography: Earth and Environment, 2008, 32(6): 595-610. DOI:10.1177/0309133308101382 |
| [36] | Langford HJ, Irvine-Fynn TDL, Edwards A, Banwart SA, Hodson AJ. A spatial investigation of the environmental controls over cryoconite aggregation on Longyearbreen glacier, Svalbard. Biogeosciences, 2014, 11(19): 5365-5380. DOI:10.5194/bg-11-5365-2014 |
| [37] | Stibal M, Lawson EC, Lis GP, Mak KM, Wadham JL, Anesio AM. Organic matter content and quality in supraglacial debris across the ablation zone of the Greenland ice sheet. Annals of Glaciology, 2010, 51(56): 1-8. DOI:10.3189/172756411795931958 |
| [38] | Lee YM, Kim SY, Jung J, Kim EH, Cho KH, Schinner F, Margesin R, Hong SG, Lee HK. Cultured bacterial diversity and human impact on alpine glacier cryoconite. The Journal of Microbiology, 2011, 49(3): 355-362. DOI:10.1007/s12275-011-0232-0 |
| [39] | Baccolo G, Di Mauro B, Massabò D, Clemenza M, Nastasi M, Delmonte B, Prata M, Prati P, Previtali E, Maggi V. Cryoconite as a temporary sink for anthropogenic species stored in glaciers. Scientific Reports, 2017, 7: 9623. DOI:10.1038/s41598-017-10220-5 |
| [40] | Baccolo G, Łokas E, Gaca P, Massabò D, Ambrosini R, Azzoni RS, Clason C, di Mauro B, Franzetti A, Nastasi M, Prata M, Prati P, Previtali E, Delmonte B, Maggi V. Cryoconite: an efficient accumulator of radioactive fallout in glacial environments. The Cryosphere, 2020, 14(2): 657-672. DOI:10.5194/tc-14-657-2020 |
| [41] | Zawierucha K, Buda J, Pietryka M, Richter D, Łokas E, Lehmann-Konera S, Makowska N, Bogdziewicz M. Snapshot of micro-animals and associated biotic and abiotic environmental variables on the edge of the south-west Greenland ice sheet. Limnology, 2018, 19(1): 141-150. DOI:10.1007/s10201-017-0528-9 |
| [42] | Cameron KA, Hodson AJ, Osborn AM. Structure and diversity of bacterial, eukaryotic and archaeal communities in glacial cryoconite holes from the Arctic and the Antarctic. FEMS Microbiology Ecology, 2012, 82(2): 254-267. DOI:10.1111/j.1574-6941.2011.01277.x |
| [43] | Liu YQ, Vick-Majors TJ, Priscu JC, Yao TD, Kang SC, Liu KS, Cong Z, Xiong JB, Li Y. Biogeography of cryoconite bacterial communities on glaciers of the Tibetan Plateau. FEMS Microbiology Ecology, 2017, 93(6). DOI:10.1093/femsec/fix072 |
| [44] | Gokul JK, Hodson AJ, Saetnan ER, Irvine-Fynn TDL, Westall PJ, Detheridge AP, Takeuchi N, Bussell J, Mur LAJ, Edwards A. Taxon interactions control the distributions of cryoconite bacteria colonizing a high Arctic ice cap. Molecular Ecology, 2016, 25(15): 3752-3767. DOI:10.1111/mec.13715 |
| [45] | Uetake J, Tanaka S, Segawa T, Takeuchi N, Nagatsuka N, Motoyama H, Aoki T. Microbial community variation in cryoconite granules on Qaanaaq Glacier, NW Greenland. FEMS Microbiology Ecology, 2016, 92(9): fiw127. DOI:10.1093/femsec/fiw127 |
| [46] | Sommers P, Darcy JL, Gendron EMS, Stanish LF, Bagshaw EA, Porazinska DL, Schmidt SK. Diversity patterns of microbial eukaryotes mirror those of bacteria in Antarctic cryoconite holes. FEMS Microbiology Ecology, 2018, 94(1). DOI:10.1093/femsec/fix167 |
| [47] | Stibal M, Šabacká M, Kaštovská K. Microbial communities on glacier surfaces in svalbard: impact of physical and chemical properties on abundance and structure of cyanobacteria and algae. Microbial Ecology, 2006, 52(4): 644-654. DOI:10.1007/s00248-006-9083-3 |
| [48] | Stanish LF, Bagshaw EA, McKnight DM, Fountain AG, Tranter M. Environmental factors influencing diatom communities in Antarctic cryoconite holes. Environmental Research Letters, 2013, 8(4): 045006. DOI:10.1088/1748-9326/8/4/045006 |
| [49] | Li CL, Chen PF, Kang SC, Yan FP, Li XF, Qu B, Sillanpää M. Carbonaceous matter deposition in the high glacial regions of the Tibetan Plateau. Atmospheric Environment, 2016, 141: 203-208. DOI:10.1016/j.atmosenv.2016.06.064 |
| [50] | Ambrosini R, Musitelli F, Navarra F, Tagliaferri I, Gandolfi I, Bestetti G, Mayer C, Minora U, Azzoni RS, Diolaiuti G, Smiraglia C, Franzetti A. Diversity and assembling processes of bacterial communities in cryoconite holes of a karakoram glacier. Microbial Ecology, 2017, 73(4): 827-837. DOI:10.1007/s00248-016-0914-6 |
| [51] | Weisleitner K, Perras AK, Unterberger SH, Moissl-Eichinger C, Andersen DT, Sattler B. Cryoconite hole location in east-Antarctic untersee oasis shapes physical and biological diversity. Frontiers in Microbiology, 2020, 11: 1165. DOI:10.3389/fmicb.2020.01165 |
| [52] | Webster-Brown JG, Hawes I, Jungblut AD, Wood SA, Christenson HK. The effects of entombment on water chemistry and bacterial assemblages in closed cryoconite holes on Antarctic glaciers. FEMS Microbiology Ecology, 2015, 91(12): 144. DOI:10.1093/femsec/fiv144 |
| [53] | Colica G, Li H, Rossi F, Li DH, Liu YD, De Philippis R. Microbial secreted exopolysaccharides affect the hydrological behavior of induced biological soil crusts in desert sandy soils. Soil Biology and Biochemistry, 2014, 68: 62-70. DOI:10.1016/j.soilbio.2013.09.017 |
| [54] | Pereira S, Zille A, Micheletti E, Moradas-Ferreira P, De Philippis R, Tamagnini P. Complexity of cyanobacterial exopolysaccharides: composition, structures, inducing factors and putative genes involved in their biosynthesis and assembly. FEMS Microbiology Reviews, 2009, 33(5): 917-941. DOI:10.1111/j.1574-6976.2009.00183.x |
| [55] | Singh P, Singh SM, Dhakephalkar P. Diversity, cold active enzymes and adaptation strategies of bacteria inhabiting glacier cryoconite holes of high Arctic. Extremophiles, 2014, 18(2): 229-242. DOI:10.1007/s00792-013-0609-6 |
| [56] | Cook J, Edwards A, Takeuchi N, Irvine-Fynn T. Cryoconite. Progress in Physical Geography: Earth and Environment, 2016, 40(1): 66-111. DOI:10.1177/0309133315616574 |
| [57] | Chrismas NAM, Barker G, Anesio AM, Sánchez-Baracaldo P. Genomic mechanisms for cold tolerance and production of exopolysaccharides in the Arctic cyanobacterium Phormidesmis priestleyi BC1401. BMC Genomics, 2016, 17: 533. DOI:10.1186/s12864-016-2846-4 |
| [58] | Singh P, Hanada Y, Singh SM, Tsuda S. Antifreeze protein activity in Arctic cryoconite bacteria. FEMS Microbiology Letters, 2014, 351(1): 14-22. DOI:10.1111/1574-6968.12345 |
| [59] | Sanyal A, Antony R, Samui G, Thamban M. Microbial communities and their potential for degradation of dissolved organic carbon in cryoconite hole environments of Himalaya and Antarctica. Microbiological Research, 2018, 208: 32-42. DOI:10.1016/j.micres.2018.01.004 |
| [60] | Smith HJ, Foster RA, McKnight DM, Lisle JT, Littmann S, Kuypers MMM, Foreman CM. Microbial formation of labile organic carbon in Antarctic glacial environments. Nature Geoscience, 2017, 10(5): 356-359. DOI:10.1038/ngeo2925 |
| [61] | Boyd ES, Skidmore M, Mitchell AC, Bakermans C, Peters JW. Methanogenesis in subglacial sediments. Environmental Microbiology Reports, 2010, 2(5): 685-692. DOI:10.1111/j.1758-2229.2010.00162.x |
| [62] | Säwström C, Mumford P, Marshall W, Hodson A, Laybourn-Parry J. The microbial communities and primary productivity of cryoconite holes in an Arctic glacier (Svalbard 79°N). Polar Biology, 2002, 25(8): 591-596. DOI:10.1007/s00300-002-0388-5 |
| [63] |
Chen YY, Zhang ZH, Liu YQ. Research progress of carbon fixation microorganisms in glaciers. Acta Microbiologica Sinica, 2020, 60(9): 2012-2029.
(in Chinese) 陈玉莹, 张志好, 刘勇勤. 冰川生态系统固碳微生物研究进展. 微生物学报, 2020, 60(9): 2012-2029. |
| [64] | Bagshaw EA, Tranter M, Fountain AG, Welch KA, Basagic H, Lyons WB. Biogeochemical evolution of cryoconite holes on Canada Glacier, Taylor Valley, Antarctica. Journal of Geophysical Research: Biogeosciences, 2007, 112(G4): G04S35. |
| [65] | Feng L, Xu JZ, Kang SC, Li XF, Li Y, Jiang B, Shi Q. Chemical composition of microbe-derived dissolved organic matter in cryoconite in Tibetan Plateau glaciers: insights from Fourier transform ion cyclotron resonance mass spectrometry analysis. Environmental Science & Technology, 2016, 50(24): 13215-13223. |
| [66] | Telling J, Anesio AM, Tranter M, Stibal M, Hawkings J, Irvine-Fynn T, Hodson A, Butler C, Yallop M, Wadham J. Controls on the autochthonous production and respiration of organic matter in cryoconite holes on high Arctic glaciers. Journal of Geophysical Research: Biogeosciences, 2012, 117(G1): G01017. |
| [67] | Telling J, Anesio AM, Hawkings J, Tranter M, Wadham JL, Hodson AJ, Irvine-Fynn T, Yallop ML. Measuring rates of gross photosynthesis and net community production in cryoconite holes: a comparison of field methods. Annals of Glaciology, 2010, 51(56): 153-162. DOI:10.3189/172756411795932056 |
| [68] | Segawa T, Ishii S, Ohte N, Akiyoshi A, Yamada A, Maruyama F, Li ZQ, Hongoh Y, Takeuchi N. The nitrogen cycle in cryoconites: naturally occurring nitrification-denitrification granules on a glacier. Environmental Microbiology, 2014, 16(10): 3250-3262. DOI:10.1111/1462-2920.12543 |
| [69] | Boyd ES, Lange RK, Mitchell AC, Havig JR, Hamilton TL, Lafrenière MJ, Shock EL, Peters JW, Skidmore M. Diversity, abundance, and potential activity of nitrifying and nitrate-reducing microbial assemblages in a subglacial ecosystem. Applied and Environmental Microbiology, 2011, 77(14): 4778-4787. DOI:10.1128/AEM.00376-11 |
| [70] | Cameron KA, Hodson AJ, Osborn AM. Carbon and nitrogen biogeochemical cycling potentials of supraglacial cryoconite communities. Polar Biology, 2012, 35(9): 1375-1393. DOI:10.1007/s00300-012-1178-3 |
| [71] | Larose C, Dommergue A, Vogel TM. Microbial nitrogen cycling in Arctic snowpacks. Environmental Research Letters, 2013, 8(3): 035004. DOI:10.1088/1748-9326/8/3/035004 |
| [72] | Telling J, Stibal M, Anesio AM, Tranter M, Nias I, Cook J, Bellas C, Lis G, Wadham JL, Sole A, Nienow P, Hodson A. Microbial nitrogen cycling on the Greenland Ice Sheet. Biogeosciences, 2012, 9(7): 2431-2442. DOI:10.5194/bg-9-2431-2012 |
| [73] | Bagshaw EA, Tranter M, Fountain AG, Welch K, Basagic HJ, Lyons WB. Do cryoconite holes have the potential to be significant sources of C, N, and P to downstream depauperate ecosystems of Taylor valley, Antarctica?. Arctic, Antarctic, and Alpine Research, 2013, 45(4): 440-454. DOI:10.1657/1938-4246-45.4.440 |
| [74] | Kühnel R, Roberts TJ, Björkman MP, Isaksson E, Aas W, Holmén K, Ström J. 20-year climatology of NO3– and NH4+ wet deposition at Ny-ålesund, Svalbard. Advances in Meteorology, 2011, 2011: 1-10. |
 2022, Vol. 62
2022, Vol. 62