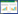中国科学院微生物研究所,中国微生物学会
文章信息
- 朱録媛, 崔国兵, 孙文达, 尹凯, 毕新萍, 邓懿祯. 2022
- ZHU Luyuan, CUI Guobing, SUN Wenda, YIN Kai, BI Xinping, DENG Yizhen.
- 甘蔗内生解淀粉芽孢杆菌CGB15的分离、鉴定及生防活性
- Isolation, identification, and biocontrol activity of an endophytic strain Bacillus amyloliquefaciens CGB15 from sugarcane
- 微生物学报, 62(5): 1698-1710
- Acta Microbiologica Sinica, 62(5): 1698-1710
-
文章历史
- 收稿日期:2021-08-17
- 修回日期:2021-11-17
- 网络出版日期:2022-02-17
内生菌在植物组织中通过寄生、共生等方式与宿主共存,可以很好定殖在宿主内部。同时,内生菌可以分泌具有抑菌活性的次生代谢产物[1–3],因而具有开发应用于植物病害生物防治的巨大潜力。在农作物和经济作物中的内生细菌已被报道超过129个种、54个属,主要为芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、克雷伯氏菌属(Klebsiella)、肠杆菌属(Enterobacter)等属[4]。分离自甘蔗组织(茎、叶)的内生细菌,目前已报道约21个属,包括芽孢杆菌属、伯克氏菌属、肠杆菌属和泛菌属[5–6],其中研究与应用较多的为芽孢杆菌(Bacillus spp.)、放线菌(Agrobacterium radiobacter)、假单胞杆菌(Pseudomonas spp.)等[7]。其中,芽孢杆菌属细菌BGMRC03005对甘蔗鞭孢堆黑粉菌(Sporisorium scitamineum)的3种形态:单倍体酵母样担孢子、双核菌丝和二倍体冬孢子的生长发育均有抑制作用[8]。因此,通过分离甘蔗内生菌从而获得高效且稳定存在甘蔗体内的生防菌,理论上是可行的。
芽孢杆菌由于具有高效低毒且环境分布广、易获得的特点,一直是生防菌研究的热点之一。芽孢杆菌的生防机制主要有以下几点:(1) 与病原菌竞争环境资源和营养;(2) 分泌抗菌物质(抗生素、抗菌蛋白等);(3) 产生融菌作用;(4) 诱导植物抗病性[9–10]。解淀粉芽孢杆菌抑制真菌活性物质的分离,在过去几年中一直有报道。王奕文等从甜瓜表面分离得到1株解淀粉芽孢杆菌,对灰葡萄孢、链格孢、尖孢镰刀、黑曲霉和粉红单端孢等8种果蔬采后病原真菌具有广谱的拮抗作用[11];陈士云等从土壤中分离到1株解淀粉芽孢杆菌CH22,对油菜核盘菌具有强烈的抑制作用[12];欧雄常等从红树内生细菌中分离得到1株能够拮抗辣椒疫霉病的解淀粉芽孢杆菌[13]。然而上述解淀粉芽孢杆菌通常分离自土壤,并不能较好地定殖在植物体内;目前也还没有关于植物内生解淀粉芽孢杆菌用于甘蔗鞭黑穗病生物防治的相关报道。
本研究从甘蔗叶片分离一株编号为CGB15的内生细菌,经鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。CGB15对多种病原真菌菌丝生长具有显著的抑制作用;并能特异性抑制甘蔗鞭孢堆黑粉菌有性配合后的双核菌丝形成、冬孢子萌发,在田间条件下能降低甘蔗鞭黑穗病发病率。CGB15发酵上清液也能抑制稻梨孢菌附着胞形成与叶片病斑的形成,因此CGB15具有应用于甘蔗鞭黑穗病与水稻稻瘟病生物防治的潜能。
1 材料与方法 1.1 材料本研究用于平板对峙培养的丝状真菌有:甘蔗鞭孢堆黑粉菌(Sporisorium scitamineum)的两个交配型担孢子菌株WT17和WT18 (本课题组)、稻梨孢菌(Pyricularia oryzae) Guy11菌株(本课题组)、荔枝霜疫霉菌(Peronophythora litchii) SHS3菌株(华南农业大学姜子德教授课题组)、胶孢刺盘孢菌(Colletotrichum gloeosporioides) 16GDYJ1菌株(华南农业大学徐大高课题组)和引起香蕉枯萎病的尖孢镰刀菌(Fusarium oxysporum f. sp. cubense) XJZ2菌株(华南农业大学姜子德教授课题组)。
上述6种病原真菌培养温度均为28 ℃,其中甘蔗鞭孢堆黑粉菌所用培养基为YEPS,稻梨孢菌为PA,荔枝霜疫霉菌为胡萝卜培养基,其余所用培养基皆为PDA。具体配置如下:YEPS培养基:酵母提取物10 g/L,蛋白胨10 g/L,蔗糖40 g/L,固体平板含1.5% agar;PA固体培养基:乳糖2.5 g/L,蔗糖2.5 g/g,西梅汁40 mL/L,酵母提取物1 g/L,琼脂糖10 g/L,调pH为6.5;胡萝卜培养基:去皮胡萝卜250–300 g榨汁,加水至1 L (固体平板含1.5% agar);PDA固体培养基:海博生物PDA干粉46 g/L。
1.2 内生菌的分离、筛选叶片采集:甘蔗(品种:新台糖22)叶片采自华南农业大学农学院沈万宽研究员的甘蔗种田(113.34°E,23.15°N)。
叶片消毒:用灭菌的超纯水洗3次,用3%过氧化氢浸泡1 min,100 mL乙醇浸泡1 min,6.15%含有吐温-20的次氯酸浸泡5 min,3%过氧化氢浸泡1 min,灭菌的超纯水洗5–6次,收集最后1次洗涤叶片的水。
消毒检测:最后1次洗涤的水,涂在无抗生素的LB平板上,吹干封口,37 ℃保存3 d,观察是否有菌落产生,如果有说明消毒不完全,需要重新采集叶片进行消毒。
叶片研磨:取消毒成功的叶片2–3块,研磨完全,加1 mL灭菌的超纯水,转移到2 mL无菌的离心管中,低速离心,取上清稀释,稀释倍数分别为:101、102、103、104、105。
菌落纯化及鉴定:稀释后的叶片提取液,每个梯度涂3个LB平板,吹干,封口,28 ℃培养3–5 d。根据菌落形态挑选不同形态的菌,用LB液体培养基37 ℃过夜摇菌后在LB固体培养基上划线。挑取单菌落,用LB液体培养基37 ℃摇菌过夜。菌株鉴定方法详见下文。
拮抗菌株挑选:将真菌菌块接种于固体培养基,距离菌块1–2 cm处均匀接种3 μL待测细菌菌液(OD600=1.0),同样位置点3 μL LB培养基为空白对照组;吹干后封口于28 ℃培养约3 d,所有试验设置3个生物学重复,每次包含2个技术重复。由于待测真菌为丝状真菌,因此首选以菌落形态作为筛选依据。培养3 d后,挑选与对照组有明显差异的平板拍照记录。

|
将分离纯化后的内生细菌直接以菌落为模板进行PCR扩增,使用16S rRNA基因通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT-3′)[14],扩增体系为:2× Phanta Max Buffer 25 μL,10 mmol/L dNTPs 1 μL,Forward primers (10 μmol/L) 1.5 μL,Reverse primers (10 μmol/L) 1.5 μL,DNA template 1 μL,2× Taq PCR StarMix with Loading Dye 1 μL,再加ddH2O至50 μL。扩增条件为:95 ℃ 3 min;95 ℃ 15 s,58 ℃ 15 s,72 ℃ 30 s,30个循环;72 ℃ 5 min。
将扩增的基因片段进行1%浓度琼脂糖凝胶电泳,检测扩增得到的基因片段的质量及浓度,并设置无菌水模板作负对照。合格的扩增片段送往公司进行测序。登录NCBI网站,通过BLAST在16S ribosomal RNA sequences (bacteria and archaea)数据库中比对测序获得的16S rRNA序列,找出相似度大于96%的序列,从而分析菌株种属关系。
1.4 甘蔗鞭孢堆黑粉菌、CGB15及大肠杆菌发酵液的制备甘蔗鞭孢堆黑粉菌:用接种环挑取活化后的单菌落接入YEPS液体培养基中,于28 ℃、200 r/min摇床中培养12 h,即可得到菌悬液;将获得的菌悬液添加到装有YEPS培养基的50 mL离心管中,置于28 ℃、200 r/min摇床中培养12 h,即得所需发酵液。
CGB15、大肠杆菌:用接种环挑取活化后的单菌落分别接入LB液体培养基中,于37 ℃、200 r/min摇床中培养12 h,即可得到菌悬液;将获得的菌悬液添加到装有LB培养基的50 mL离心管中,置于37 ℃、200 r/min摇床中培养12 h,即得所需发酵液。
1.5 真菌孢子萌发甘蔗鞭孢堆黑粉菌冬孢子萌发实验:从甘蔗鞭黑穗病病圃(每年定期用WT17与WT18担孢子混合后接种至甘蔗宿根/幼苗)采集发病的甘蔗黑穗鞭,取少量冬孢子用于经PCR验证(使用bE4和bE8基因扩增引物[15])。验证后,在超净台中刮取病鞭冬孢子约1 mg重悬于1 mL无菌水中,并进行梯度稀释,稀释倍数分别为:101、102、103、104、105。上述稀释后的悬液各取200 μL,分别涂布于含有CGB15上清液、大肠杆菌上清液(培养至OD600约1.0以后离心,仅取上清液)的PDA平板上,吹干后封口并且放置于28 ℃培养箱中培养3 d,观察并记录冬孢子萌发情况。每组试验重复3次,每次包含2个技术重复。
稻梨孢菌附着胞形成抑制率测定:稻梨孢菌于PA平板上培养1周,用无菌水收集分生孢子并离心,弃上清。CGB15在液体LB培养基培养至OD600约1.0,离心取上清液,重悬稻梨孢菌分生孢子;无菌水重悬的分生孢子设置为对照组。分生孢子浓度均调节为约105个/mL。取20 μL孢子悬液于干燥的疏水玻片上室温避光培养约8 h,观察孢子萌发形成附着胞的情况并记录。每组试验重复3次,每次包含2个技术重复。

|
CGB15于37 ℃、200 r/min摇床中摇至OD600约1.0后取20 μL点于酶活性检测培养平板[Pel培养基(果胶酸盐裂解酶检测)、Peh培养基(聚半乳糖醛酸酶检测)、Cel培养基(纤维素酶检测,培养基配方见Lv等文章[16])]中预先打好的孔内,待全部加好后放置平板于37 ℃培养箱中培养12 h,同时设置玉米迪克氏菌(Dickeya zeae) MS2菌株[17]为正对照,观察结果并拍照记录。每组试验重复3次,每次包含2个技术重复。
1.7 田间防效试验在华南农业大学增城教学科研基地的水旱轮作田,我们从2018年新植了约5亩甘蔗(新台糖22),至2021年为第3年宿根蔗。我们选取其中占地500 m2、包括约370丛宿根的面积用于本次田间测试。试验分为对照组(仅浇灌甘蔗鞭孢堆黑粉菌发酵液)和CGB15施用组(浇灌甘蔗鞭孢堆黑粉菌发酵液约3 d后向宿根根部土壤和叶片部位喷施CGB15发酵液),每组包括3个重复。2021年3月初对甘蔗宿根进行处理,6月初统计甘蔗黑穗病发病情况。使用如下公式分别计算对照组、处理组的甘蔗鞭黑穗病发病率(%),并计算CGB15处理对甘蔗鞭黑穗病田间相对防效(%):

|
水稻叶片离体接种实验:培育水稻(CO39) 14–16 d,取嫩叶并裁剪至合适长度,等距离固定各叶片,用双面胶将叶片两端粘贴在90 mm×90 mm的方形培养基内。处理组为CGB15上清液重悬的稻梨孢菌分生孢子,对照组为无菌水重悬的稻梨孢菌分生孢子,孢子密度均为105个/mL,取20 μL对应液体等距滴在水稻叶片上,于28 ℃培养箱内黑暗培养12–24 h,再转至光暗交替(12 h: 12 h)培养3–4 d,观察结果并拍照。每组试验重复3次,每次每种处理包含2–3片水稻叶片。
盆栽接种实验:稻梨孢菌分生孢子悬液(浓度为105个/mL,以清水和CGB15上清液分别悬浮)中加入0.25%的吐温-20,混匀后均匀的喷洒在生长2周的水稻(CO39)苗上。喷雾接种后的水稻苗于28 ℃黑暗保湿培养36 h,后转移至28 ℃光暗交替(12 h: 12 h)培养3–4 d,观察并拍照记录水稻叶片的发病情况,并根据国际水稻所发布的“叶瘟评估标准”[18]对叶瘟进行分级。每组试验重复2次,每次每种处理包含4–5株水稻苗。
2 结果与分析 2.1 甘蔗内生菌分离及抑制病原真菌菌丝生长的活性检测我们从甘蔗叶片中分离到若干内生细菌,通过16S rRNA基因序列扩增与比对,鉴定到它们的种属如表 1所示。
| Number | Identification (genus) |
| s1 | Micrococcus yunnanensis |
| s3 | Staphylococcus hominis |
| s5 | Staphylococcus sp. |
| s6 | Moraxella sp. |
| s9 | Dermacoccus nishinomiyaensis |
| s10 | Agrococcus terreus |
| s11 | Staphylococcus sp. |
| s12 | Pseudomonas oryzihabitans |
| s13 | Pseudomonas sp. |
| s14 | Staphylococcus sp. |
| s15 | Moraxella osloensis |
| s16 | Uncultured bacterium clone ncd2145h01c1 |
| s17 | Bacillus circulans |
| z1 | Exiguobacterium profundum |
| z2 | Rummeliibacillus stabekisii |
| z3 | Micrococcus sp. |
| z4 | Micrococcus luteus strain |
| z5 | Brevibacterium casei |
| z6 | Staphylococcus epidermidis |
| z7 | Dermacoccus sp. |
| z8 | Bacillus aerophilus |
| z9 | Bacillus sp. |
| x4 | Bacillus velezensis |
| CGB15 | Bacillus amyloliquefaciens |
| CGB10 | Burkholderia sp. |
| Sequence identity > 96%. | |
基于植物真菌病害主要通过菌丝在植物体内产生危害[19],因此我们筛选具有生物防治潜力的内生菌的依据为能否有效抑制真菌菌丝生长。我们选用稻梨孢菌、荔枝霜疫霉菌、荔枝炭疽菌和尖孢镰刀菌与CGB15进行平板对峙实验,发现一株编号为CGB15的内生菌能显著抑制多种华南地区常见植物病原真菌菌丝生长,甚至使某些病原真菌的菌丝完全无法生长(图 1)。
|
| 图 1 平板对峙结果 Figure 1 Results of plant confrontation. Bacterial colony of a same strain appeared differently when grown on different culture medium used for different fungi. The confrontation cultures were allowed to grown for 3–5 d, before photographing. |
CGB15菌落在LB平板上表面以及边缘粗糙,单菌落较大不透明(图 2A);结合16S rRNA基因检测与序列比对,CGB15菌株为解淀粉芽孢杆菌(Bacillus amyloliquefaciens) (图 2B)。

|
| 图 2 CGB15菌落以及种属鉴定 Figure 2 Bacterial colony and molecular identification of CGB15. A: the colony morphology of CGB15, cultured on solid LB medium; B: the phylogenetic analysis of CGB15 based on 16S rRNA gene sequence and BLAST search, using BLAST Tree View tool (neighbor-joining method, threshold for maximum sequence difference was set as 0.75, and all the other setting remained as default) of NCBI (ExtJS version: 7.1.0.46). Accession numbers for the sequences used for the comparison were labeled following the respective species, and CGB15 is highlighted in red font. The 0.01 scale bar represents 1% change of amino acid residues. |
2.2 CGB15抑制甘蔗鞭黑穗病
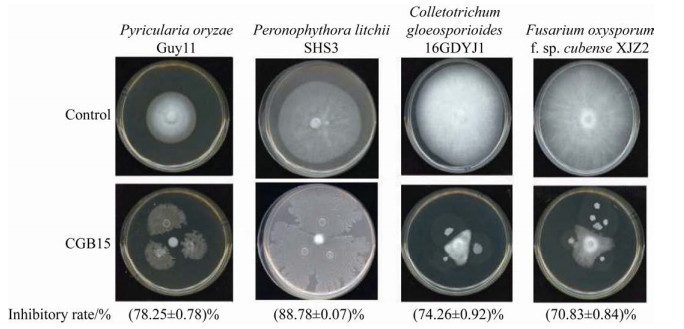
甘蔗鞭黑穗病的病原物为甘蔗鞭孢堆黑粉菌,其两个交配型WT17与WT18担孢子混合后培养于PDA培养基,经有性配合会形成双核菌丝,因此产生绒毛状的菌丝菌落;而酵母状担孢子形成的菌落光滑、与菌丝菌落明显不同[20]。我们发现与CGB15菌株对峙的甘蔗鞭孢堆黑粉菌WT17与WT18菌落呈现光滑(图 3A),提示有性配合与双核菌丝形成受到CGB15菌株的抑制。
|
| 图 3 CGB15抑制甘蔗鞭孢堆黑粉菌有性配合/双核菌丝生长(A)与冬孢子萌发(B) Figure 3 CGB15 inhibited sexual mating/dikaryotic hyphae growth (A) and teliospores germination (B) of S. scitamineum. Arrows denote promycelia from the germinating teliospore colonies. Scale bar=1 mm. |
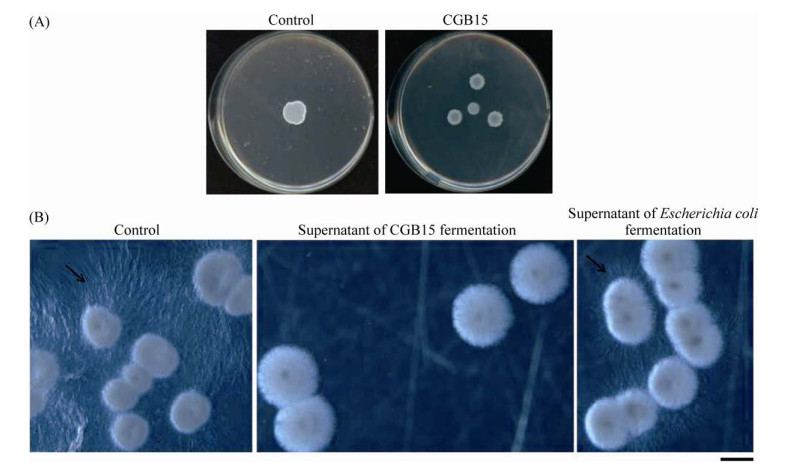
另一方面,甘蔗鞭黑穗病为土传病害,其病原物通过冬孢子在土壤中越冬,环境适宜时冬孢子萌发进而形成担孢子。因此我们进一步检测CGB15菌株对于甘蔗鞭孢堆黑粉菌冬孢子萌发是否具有抑制效果。结果表明,在培养基中添加CGB15发酵上清液,能有效抑制甘蔗鞭孢堆黑粉菌冬孢子萌发(图 3B),抑制率达到(89.01±0.12)%。另一方面,无菌水或大肠杆菌发酵上清液均不影响甘蔗鞭孢堆黑粉菌冬孢子形成健康的先菌丝(图 3B),进一步证实CGB15能形成并分泌抑制甘蔗鞭孢堆黑粉菌冬孢子萌发的活性物质。综上,CGB15既能抑制甘蔗鞭孢堆黑粉菌有性配合/双核菌丝形成,也能抑制其冬孢子萌发,而这两个步骤是甘蔗鞭孢堆黑粉菌侵染宿主甘蔗的关键步骤,因此CGB15可能具有防止甘蔗鞭孢堆黑粉菌侵染宿主的潜力。
因此我们进一步测试田间条件下CGB15菌株是否能抑制甘蔗鞭黑穗病的发生。我们选取甘蔗鞭黑穗病圃中约500 m2、包括约370丛宿根的面积,分为6个小区,用于本次田间测试。对照组仅浇灌甘蔗鞭孢堆黑粉菌发酵液,CGB15施用组在浇灌甘蔗鞭孢堆黑粉菌发酵液约3 d后向宿根根部土壤和叶片部位喷施CGB15发酵液,每种处理包含3个随机分布的小区。2021年3月初对甘蔗宿根进行上述处理,6月初统计甘蔗鞭黑穗病发病情况。结果显示,对照组与CGB15处理组小区均有发病植株,表现为整丛多株发病,发病丛平均每丛含1.6–2.8株病株,对照组与CGB15处理组的发病丛所含发病株数量上无显著差异;但CGB15处理显著降低了宿根蔗发病丛数,对照组3个小区共计发病37丛,总丛369株,整体发病率为10.03%,CGB15处理组发病19丛,总丛369株,整体发病率为5.15% (图 4)。综上,我们的田间测试初步显示CGB15具有抑制甘蔗鞭黑穗病的作用,田间相对防效为48.65%。

|
| 图 4 CGB15田间防效试验 Figure 4 Field test of CGB15 against sugarcane smut. |
2.3 CGB15抑制水稻稻瘟病
稻瘟病为水稻的三大病害之首[21],其病原菌稻梨孢菌成功侵染水稻的关键在于分生孢子萌发形成附着孢和侵入钉,进而产生侵染菌丝为害水稻[22]。据此,抑制稻梨孢菌分生孢子形成附着胞,可以有效抑制该病害的发生。我们的试验结果显示,CGB15发酵上清液处理稻梨孢菌分生孢子,不影响分生孢子萌发形成芽管,但能显著抑制附着胞的形成(图 5),抑制率为(93.55±1.11)%。
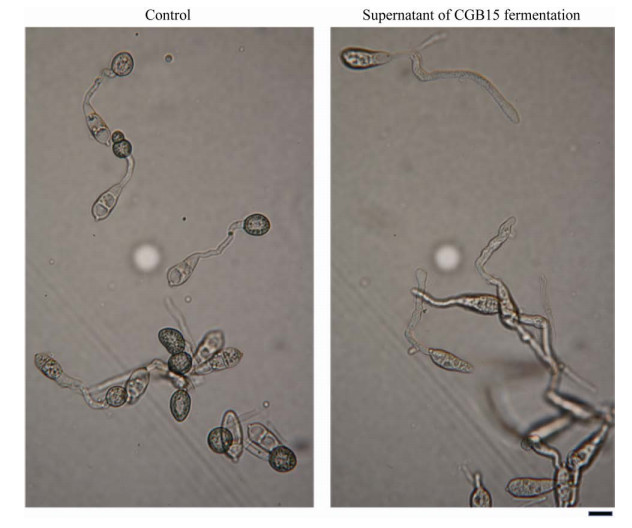
|
| 图 5 CGB15液体培养的上清液显著抑制稻瘟菌附着胞的形成 Figure 5 The supernatant of liquid-cultured CGB15 significantly inhibited appressorium formation of P. oryzae. Scale bar=5 μm. |
我们进而检测CGB15对水稻稻瘟病的防控效果。结果显示,稻梨孢菌接种的水稻离体叶片均产生典型的叶片病斑,但是以CGB15菌株液体培养的上清液处理过的孢子悬浮液,接种水稻离体叶片后几乎不产生病斑(图 6A),病斑抑制率达到100%。另一方面,稻梨孢菌分生孢子悬液喷雾接种的盆栽水稻苗,对照组共计处理4株水稻幼苗,共15片叶片,接种5–7 d后其中出现0–3级病斑的叶片7片,4–6级病斑的叶片6片,7–9级病斑的叶片2片。而液体培养的CGB15菌株上清液处理的稻梨孢菌分生孢子,接种水稻苗后病斑等级全为0–3级,大部分无病斑出现,仅少数极小病斑(图 6B),这一结果显示CGB15上清液对稻瘟病叶片病斑形成具有显著的防治效果。综上,CGB15菌株能分泌活性物质,显著抑制稻梨孢菌附着胞的形成以及水稻叶片病斑的形成。

|
| 图 6 CGB15抑制稻梨孢菌引起的叶片病斑 Figure 6 CGB15 inhibited the formation of lesion of P. oryzae on rice leaves in vitro. A: infection assay on rice leaf explants; B: infection assay on rice seedlings. |
2.4 CGB15菌株的毒力检测
具有生防应用潜力的微生物,本身不能对宿主具有毒力或者致病性。常见的细菌毒力表现为多种降解宿主细胞壁的酶活性,如纤维素酶、果胶酶以及半乳糖醛酸酶等[16]。因此我们检测CGB15菌株是否具有上述酶活性。结果显示,CGB15菌株不能有效地分解培养基中的纤维素以及果胶等物质,说明其不具有对植物细胞壁起降解作用的纤维素酶、果胶酶等酶活性(图 7)。这一试验结果初步排除CGB15菌株对植物潜在的毒力,也为其应用于作物病害生物防治奠定了基础。
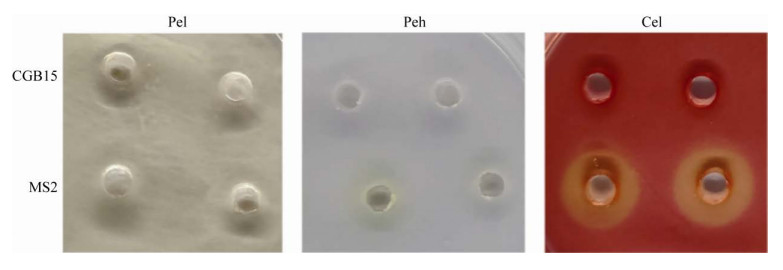
|
| 图 7 CGB15菌株的毒力检测 Figure 7 The virulence test of CGB15. Dickeya zeae MS2 strain was used as a positive control. |
3 讨论
甘蔗鞭黑穗病是为害甘蔗的重要病害,也是影响甘蔗产量的主要病害之一。在过去的报道中,解淀粉芽孢杆菌具有显著的抗真菌作用[23],可用于真菌病害的生物防治。但目前尚未有解淀粉芽孢杆菌用于甘蔗鞭黑穗病防治的报道。本研究成功获得一株具有显著抑制甘蔗鞭孢堆黑粉菌有性配合及冬孢子萌发的解淀粉芽孢杆菌。鉴于甘蔗鞭孢堆黑粉菌经过土壤传播的特点,以及糖蔗在田间多年种植是通过保留宿根来实现的,我们认为解决甘蔗鞭孢堆黑粉菌在田间初侵染、再侵染的关键问题在于抑制其冬孢子的萌发。因此CGB15菌株有效抑制冬孢子萌发、抑制冬孢子萌发后形成的担孢子有性配合产生双核侵染菌丝,这2个关键步骤,预期能有效防控甘蔗鞭黑穗病的发生与传播。受限于甘蔗鞭黑穗病潜伏潜育期比较长,约为3–6个月[24],本研究目前仅取得了一次CGB15田间防控试验的结果,初步显示CGB15施用于宿根蔗根部土壤能降低甘蔗鞭黑穗病的发病率。我们将重复田间测试以确认这一结果,并尝试多种发酵方法和/或施放方法以优化CGB15对甘蔗鞭黑穗病的防治效果。另一方面,CGB15发酵上清液对水稻稻梨孢菌菌丝生长与附着胞形成也具有显著抑制作用,我们也证实其在离体叶片接种与盆栽水稻苗喷雾接种条件下均能有效抑制水稻叶片病斑的形成。因此CGB15也可应用于水稻稻瘟病的生物防治。常见病原细菌胞外酶活性检测试验的结果显示,CGB15并不具有对植物细胞壁起降解作用的纤维素酶、果胶酶等酶活性,这既排除了CGB15菌株对植物潜在的毒力,也进一步说明其抗真菌机制不是基于对真菌细胞壁的分解,而是可能通过合成与分泌其他抗真菌活性物质。这一假设得到我们试验结果的初步验证:CGB15发酵上清液具有抑制上述病原真菌生长、分化与致病力的作用,提示CGB15菌株能合成与分泌抗真菌活性物质。目前已报道的来源于解淀粉芽孢杆菌的抗真菌物质包括抗菌脂肽类,如表面活性素(surfactin)、芬荠素(fengycin)、伊枯草菌素(iturin)等[25]。将来的研究,我们将进一步分离和鉴定CGB15的抗真菌物质,明确其作用机制,为创制作物病害生防菌剂奠定基础。
| [1] | Kloepper JW, Rodríguez-Kábana R, Zehnder GW, Murphy JF, Sikora E, Fernández C. Plant root-bacterial interactions in biological control of soilborne diseases and potential extension to systemic and foliar diseases. Australasian Plant Pathology, 1999, 28(1): 21-26. DOI:10.1071/AP99003 |
| [2] | Ryan RP, Germaine K, Franks A, Ryan DJ, Dowling DN. Bacterial endophytes: recent developments and applications. FEMS Microbiology Letters, 2008, 278(1): 1-9. DOI:10.1111/j.1574-6968.2007.00918.x |
| [3] | Strobel G, Daisy B, Castillo U, Harper J. Natural products from endophytic microorganisms. Journal of Natural Products, 2004, 67(2): 257-268. DOI:10.1021/np030397v |
| [4] |
Fang ZJ, Zhang XX, Ma L. Research progress of endophytes. Journal of Yangtze University (Natural Science Edition), 2018, 15(10): 41-45.
(in Chinese) 方珍娟, 张晓霞, 马立安. 植物内生菌研究进展. 长江大学学报: 自科版, 2018, 15(10): 41-45. DOI:10.3969/j.issn.1673-1409.2018.10.012 |
| [5] |
Liu LF, Cun HC, He PF, Di YN, Wu YX, He LL, Li FS, He YQ. Isolation, identification and multiple function analyses of sugarcane endophytes. Chinese Journal of Tropical Crops, 2019, 40(6): 1144-1152.
(in Chinese) 刘鲁峰, 寸海春, 何鹏飞, 狄义宁, 吴毅歆, 何丽莲, 李富生, 何月秋. 甘蔗内生菌分离鉴定及功能多样性研究. 热带作物学报, 2019, 40(6): 1144-1152. DOI:10.3969/j.issn.1000-2561.2019.06.016 |
| [6] |
Wang L, Zhang JL, Wang JH, Zheng JR, Li ZJ, Han FG, Cao G. Isolation and molecular identification of endophytic bacteria in sugarcane stem. Chinese Journal of Tropical Crops, 2013, 34(11): 2227-2232.
(in Chinese) 王丽, 张剑亮, 王继华, 郑锦荣, 李智军, 韩福光, 曹干. 甘蔗茎部内生细菌的分离及分子鉴定. 热带作物学报, 2013, 34(11): 2227-2232. DOI:10.3969/j.issn.1000-2561.2013.11.026 |
| [7] |
Huang X, Xu LL, Huang RS, Huang SS. Research advance in controlling plant diseases by Bacillus subtilis. Biotechnology Bulletin, 2010(1): 24-29.
(in Chinese) 黄曦, 许兰兰, 黄荣韶, 黄庶识. 枯草芽孢杆菌在抑制植物病原菌中的研究进展. 生物技术通报, 2010(1): 24-29. |
| [8] |
Jiang L, Li F, Li Z, Yi XX, Deng JG, Zhou G, Gao CH. Diversity of symbiotic bacteria isolated from Pseudocnus echinatus and its antifungal activity against Sporisorium scitamineum. Journal of Southern Agriculture, 2018, 49(3): 488-494.
(in Chinese) 江蕾, 李菲, 李智, 易湘茜, 邓家刚, 周桂, 高程海. 海黄瓜共附生细菌多样性及其对甘蔗鞭黑粉菌的抑制作用. 南方农业学报, 2018, 49(3): 488-494. DOI:10.3969/j.issn.2095-1191.2018.03.12 |
| [9] | Adeniji AA, Loots DT, Babalola OO. Bacillus velezensis: phylogeny, useful applications, and avenues for exploitation. Applied Microbiology and Biotechnology, 2019, 103(9): 3669-3682. DOI:10.1007/s00253-019-09710-5 |
| [10] |
Chen ZY, Liu YF, Liu YZ, Zhang RS. Research progress in biocontrol of Bacillus spp. against plant diseases. Jiangsu Journal of Agricultural Sciences, 2012, 28(5): 999-1006.
(in Chinese) 陈志谊, 刘永峰, 刘邮洲, 张荣胜. 植物病害生防芽孢杆菌研究进展. 江苏农业学报, 2012, 28(5): 999-1006. |
| [11] |
Wang YW, Hu WB, Xu L. Identification of the antagonistic Bacillus strains on melon fruit surface. Acta Phytopathologica Sinica, 2008, 38(3): 317-324.
(in Chinese) 王奕文, 胡文兵, 许玲. 甜瓜果实表面生防芽孢杆菌的类群与鉴别. 植物病理学报, 2008, 38(3): 317-324. DOI:10.3321/j.issn:0412-0914.2008.03.015 |
| [12] |
Chen SY, Yang BY, Gao MY, Dai SY. Inhibition of Sclerotia formation of Sclerotinia sclerotiorum by Bacillus amyloliquefaciens. Chinese Journal of Applied and Environmental Biology, 2005, 11(3): 373-376.
(in Chinese) 陈士云, 杨宝玉, 高梅影, 戴顺英. 一株抑制油菜核盘菌菌核形成的解淀粉芽孢杆菌. 应用与环境生物学报, 2005, 11(3): 373-376. DOI:10.3321/j.issn:1006-687X.2005.03.027 |
| [13] |
Ou XC, Liu F, Zhan RL, Hu HQ, He H, Li XS, Zhang XY, Zhao YL. Screen of mangrove endophytic bacteria antagonists against Phytophthora capsici and identification of strain RS261. Microbiology, 2009, 36(2): 175-180.
(in Chinese) 欧雄常, 柳凤, 詹儒林, 胡汉桥, 何红, 李信申, 张小媛, 赵艳龙. 拮抗辣椒疫病菌的红树内生细菌筛选及RS261菌株鉴定. 微生物学通报, 2009, 36(2): 175-180. |
| [14] |
Huang TL, Zhang LN, Zhang HH, Su JF, Guo L, Zhao JY, Zhang K. Screening and nitrogen removal characteristics of a heterotrophic nitrification-aerobic denitrification strain. Ecology and Environmental Sciences, 2015, 24(1): 113-120.
(in Chinese) 黄廷林, 张丽娜, 张海涵, 苏俊峰, 郭琳, 赵金亚, 张凯. 一株贫营养异养硝化-好氧反硝化菌的筛选及脱氮特性. 生态环境学报, 2015, 24(1): 113-120. |
| [15] | Benevenuto J, Longatto DP, Reis GV, Mielnichuk N, Palhares AC, Carvalho G, Saito S, Quecine MC, Sanguino A, Vieira MLC, Camargo LEA, Creste S, Monteiro-Vitorello CB. Molecular variability and genetic relationship among Brazilian strains of the sugarcane smut fungus. FEMS Microbiology Letters, 2016, 363(24): fnw277. DOI:10.1093/femsle/fnw277 |
| [16] | Lv MF, Hu M, Li P, Jiang ZD, Zhang LH, Zhou JN. A two-component regulatory system VfmIH modulates multiple virulence traits in Dickeya zeae. Molecular Microbiology, 2019, 111(6): 1493-1509. DOI:10.1111/mmi.14233 |
| [17] | Feng LW, Schaefer AL, Hu M, Chen RY, Greenberg EP, Zhou JN. Virulence factor identification in the banana pathogen Dickeya zeae MS2. Applied and Environmental Microbiology, 2019, 85(23): e01611-e01619. |
| [18] | International Rice Research Institute (IRRI). Standard Evaluation System for Rice. International Network for Genetic Evaluation of Rice, 2002. |
| [19] |
Zhou AD, Xu XM, Wang L, Huang B. Research progress on pathogenic genes of plant pathogenic fungi. Journal of Green Science and Technology, 2017(3): 113-115.
(in Chinese) 周爱东, 徐小明, 王岚, 黄冰. 植物病原真菌致病基因研究进展. 绿色科技, 2017(3): 113-115. |
| [20] | 刘诗胤. 抑制甘蔗鞭黑粉菌有性配合生防菌ST4的筛选及其作用机制研究. 华南农业大学博士学位论文, 2017. |
| [21] | 高臣. 纳米SiO2增强水稻瘟病抗性机制的研究. 吉林农业大学硕士学位论文, 2011. |
| [22] | Fernandez J, Orth K. Rise of a cereal killer: the biology of Magnaporthe oryzae biotrophic growth. Trends in Microbiology, 2018, 26(7): 582-597. DOI:10.1016/j.tim.2017.12.007 |
| [23] | Lopes R, Tsui S, Gonçalves PJRO, Queiroz MV. A look into a multifunctional toolbox: endophytic Bacillus species provide broad and underexploited benefits for plants. World Journal of Microbiology and Biotechnology, 2018, 34(7): 1-10. |
| [24] | Sundar AR, Barnabas EL, Malathi P, Viswanathan R. A mini-review on smut disease of sugarcane caused by Sporisorium scitamineum, Croatia: InTech, 2012. |
| [25] | Zhao H, Shao D, Jiang C, Shi J, Li Q, Huang Q, Rajoka MSR, Yang H, Jin M. Biological activity of lipopeptides from Bacillus. Applied Microbiology and Biotechnology, 2017, 101(15): 5951-5960. DOI:10.1007/s00253-017-8396-0 |
 2022, Vol. 62
2022, Vol. 62