中国科学院微生物研究所,中国微生物学会
文章信息
- 管景强, 许忠顺, 刘京, 芶剑渝, 邹晓. 2022
- GUAN Jingqiang, XU Zhongshun, LIU Jing, GOU Jianyu, ZOU Xiao.
- 环链虫草Cordyceps cateniannulata对番茄生长和抗氧化酶活性的影响
- Effect of Cordyceps cateniannulata on the growth and antioxidant enzyme activity of Solanum lycopersicum
- 微生物学报, 62(3): 1119-1130
- Acta Microbiologica Sinica, 62(3): 1119-1130
-
文章历史
- 收稿日期:2021-07-08
- 修回日期:2021-09-22
- 网络出版日期:2021-09-29
2. 贵州省烟草公司遵义市公司, 贵州 遵义 563000
2. Zunyi Branch, Guizhou Tobacco Company, Zunyi 563000, Guizhou, China
番茄(Solanum lycopersicum)是茄科(Solanaceae)重要经济作物,其脂肪含量低,具有较高的膳食纤维、矿物质、维生素和抗氧化物质,是全世界种植最多的蔬菜之一[1–2]。统计显示,我国番茄种植面积和番茄酱生产量已跃居世界第二,总种植面积已接近20万公顷[3]。
截止2015年,我国化肥投入总量已超过世界平均水平的3倍,化肥的大量施用已使得土壤盐碱化、板结等现象日趋严重。尤其是对于化肥需求量大、病虫害严重的番茄而言,寻找并开发高效、绿色的新型生态植保技术成为产业可持续发展的重要任务。植物内生真菌是指在植物生活史中的某一个或多个阶段能够栖息于根、茎和叶等组织且不会对植物造成伤害的一类真菌,其在植物保护中发挥的作用越来越受到关注,同时也为生态共生理念在植物保护中的应用提供了基础[4]。自然条件下某些虫生真菌可以存在于植物组织内,并且具有抑制植物病原菌的功能[5]。虫生真菌也能够通过叶面喷施、茎干注射、灌根、浸种和拌土等人工接种的方式定殖于豆类[6]、玉米[7]和咖啡[8]等各种栽培植物,对宿主植物的生长可以产生一些积极作用。例如,人工接种虫生真菌可提高玉米幼苗生长势、地上部分生物量、叶片数及种子发芽率[9],影响大豆植株的株高和干鲜重[10],促进柳枝稷的根毛发育[11];此外,人工接种虫生真菌还能够控制昆虫、螨类等节肢动物的种群数量及生长发育[12]。
环链虫草Cordyceps cateniannulata (Z.Q. Liang) Kepler,B. Shrestha & Spatafora,其同物异名为环链棒束孢Isaria cateniannulata (Liang) Samson & Hywel-Jones、环链拟青霉Paecilomyces cateniannulatus (Z.Q. Liang) Samson & Hywel- Jones[13]。该菌是一类广谱性的虫生真菌,能够对鳞翅目、半翅目、鞘翅目和蜱螨目节肢动物害虫有较强的致死性[14]。作为生防真菌,环链虫草可直接用于农、林业害虫防治且对生态环境影响小,拥有较为广阔的发展前景。白僵菌、绿僵菌和轮枝菌等广谱性虫生真菌具备定殖于植物体的能力,其对植物促生、植物病虫害的相关研究也被广泛报道。迄今,关于接种环链虫草影响番茄生长和抗逆性的研究鲜有报道。基于浸种法简便、易推广、可接受性强的特点,本研究通过真菌孢子悬浮液浸种的方法将该菌接种于番茄植株,以组织分离法评价其对番茄植株的定殖能力,借助番茄形态指标及抗逆性酶活变化情况分析其对番茄促生及抗逆性能力的影响,旨在为种子包衣技术的开发提供实践基础。
1 材料与方法 1.1 环链虫草孢子悬浮液的制备供试菌株:Cordyceps cateniannulata GZUIFR04XS8,菌株登录号为MZ452634,由贵州大学真菌资源研究所(Institute of Fungus Resources,Guizhou University,GZUIFR)保存。真菌孢子悬浮液的制备:在含有20 mL的沙氏葡萄糖琼脂培养皿中接种环链虫草,随后将真菌置于(25±2) ℃、60%–70%湿度、光照L: D=12:12培养10–14 d。通过无菌刀刮取培养基表面的分生孢子,将所得的分生孢子悬浮于0.05%的无菌Tween-80溶液中。用无菌擦镜纸过滤孢子悬浮液,调整悬浮液浓度至2×108孢子/mL和1×103孢子/mL备用。参照Oliveira等[15]的方法将浓度为1×103孢子/mL的孢悬液涂布至PDA培养基培养,24 h后通过光学显微镜检查孢子活力,检测标准为孢子萌发率≥95%。
1.2 环链虫草真菌孢子悬浮液浸种供试番茄种子(贵妃樱桃番茄)由华煜公司生产。参照Akutse等[16]的方法对种子表面消毒:首先将大小相近的番茄种子置于75%乙醇溶液浸泡40 s,再使用5%次氯酸钠溶液浸泡40 s,最后利用无菌水冲洗种子4次。依照Schulz等[17]的方法将最后一次冲洗种子用的液体(100 μL)涂布至新的PDA培养基中,以此检测种子表面灭菌效果。
实验组按一定的方法将表面灭菌的种子与20 mL浓度为2×108孢子/mL的分生孢子悬浮液混合。本实验设置2个对照组,对照组1和对照组2的浸种溶液分别为0.05%无菌Tween-80溶液和无菌水。实验组和对照组的种子均置于26 ℃、110 r/min摇床中光照培养48 h。利用干燥的无菌纸擦拭浸种后的种子,随后将其置于无菌操作台中自然风干10 min。种植所用的泥炭土经121 ℃高温灭菌,灭菌时长1 h,每次灭菌间隔24 h,共2次灭菌。冷却后的泥炭土被分装于育苗盘(50穴,每穴大小为5 cm×5 cm×5 cm)。将处理后的种子点播于育苗盘中,随后将其置于温度为26 ℃、相对湿度70%、光照L: D=12:12的生长室中。
1.3 环链虫草在番茄植株内定殖动态变化 1.3.1 定殖检测基于环链虫草对含Cu2+培养基的耐受性,本研究利用CuSO4·5H2O粉末制备了选择性培养基[18]:葡萄糖40 g,蛋白胨10 g,水1 000 mL,CuSO4·5H2O粉末1 g,双抗(硫酸链霉素和青霉素钾各0.1 g),pH 6–7。在接种后第10、20、30、60和90天,随机从各处理中挑选8株番茄苗。用流动的自来水冲洗附着在植物表面的土壤,参考Jaber描述的方法[19]对植物体表面进行消毒:将清洗后的植株用75%的酒精浸泡2 min,5%次氯酸钠溶液浸泡2 min,无菌水冲洗3次。为检测植物表面消毒效果,将最后一次冲洗用的无菌水(100 μL)涂布于PDA平板。在无菌操作台中将每株番茄的不同部位(根、茎、叶)切分为块状,根和茎长度为1 cm,叶片面积为1 cm2。随机选取根、茎和叶各7段分别涂布于含Cu2+的培养基中(图 1),每处理重复8株番茄苗。将培养皿置于26 ℃下暗培养2–3周,每天观察并记录真菌的生长情况。当真菌菌丝从根、茎或叶的切口边缘长出时,统计符合环链虫草菌株的定殖数量,计算该真菌在植物体内的定殖率。定殖率(%)计算公式为:(显示真菌生长的植物片数/所涂植物片数)×100。
|
| 图 1 定殖检测示意图 Figure 1 Schematic diagram of the detection of endophytic strain. A: sectioned root parts were plated on PDA medium; B: sectioned stem parts were plated on PDA medium; C: segmented leave parts were placed on PDA medium. |
1.3.2 真菌形态学及分子生物学鉴定
为确定从番茄组织中分离的真菌与原有菌株的一致性,通过点接法将诱导出的真菌菌株转接于PDA培养基中,在25±2 ℃、光照L: D=12:12、RH=60%–70%的条件下培养内生真菌,2周后于光学显微镜下观察并描述内生真菌的生长特点。内生真菌rDNA-ITS序列的扩增与测序:刮取PDA平板内的菌丝,利用植物和真菌基因组试剂盒(Aidlab生物科技有限公司)提取内生真菌DNA。采用真菌通用引物ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4 (5′-TC CTCCGCTTATTGATATGC-3′)进行DNA扩增。所用PCR扩增体系(25 μL)为:ITS1(10 μmol/L) 1 μL,ITS4 (10 μmol/L) 1 μL,2×A8 PCR Master Mix 12.5 μL,模板DNA 2 μL,加8.5 μL的ddH2O至25 μL。PCR扩增条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,30个循环;最后,72 ℃延伸5 min。扩增后的产物经1%琼脂糖凝胶(含溴化乙锭)检测,随后将其送至昆明擎科生物有限公司测序。从植物根、茎和叶组织内获取的内生真菌序列皆上传至GenBank数据库(http://www.ncbi.nih.gov/genbank/)。
1.3.3 定殖环链虫草对番茄生长的影响为测量环链虫草对番茄种子发芽率的影响,本研究设置3个处理组(2×108孢子/mL孢子悬浮液浸种、0.05% Tween-80溶液浸种、无菌水浸种),每处理设6个重复,每重复有10颗种子。自播种后的第7天,统计种子的萌发率。为确定环链虫草菌株对植株生长的影响,在接种菌株后的第30天、60天,随机从实验组和对照组中各抽取10株番茄苗用于测量生长参数。生长参数指标主要有:株高(植株基部到最上部叶片的距离)、根长(根着生最高处与根须最顶端的距离)、地上部分干鲜重和根干鲜重。番茄株高、根长的测量利用游标卡尺完成,地上部分鲜重和根鲜重的称量利用电子分析天平(上海菁海FA2004N)完成。
1.4 接种环链虫草对番茄叶片酶活及丙二醛含量的影响在出苗后的第30天对相同位置的最新展开叶进行取样,每处理5个重复。参照Solarbio公司提供的试剂盒使用说明对番茄叶片中的过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)及丙二醛(MDA)含量进行检测。
1.5 数据分析实验数据均由Excel 2010和SPSS 18.0软件处理,采用ANOVA的LSD方法进行显著性差异分析,实验绘图由OriginPro 2018C制作。
2 结果与分析 2.1 环链虫草在番茄体内的定殖 2.1.1 真菌形态学描述从番茄组织内(根、茎、叶)回收出3株内生真菌,各内生真菌菌丝隆起、蓬松、棉絮状。在培育后的第7天,菌落正面开始产孢且菌丝之间较为紧密,菌落背面则呈现为淡黄色(图 2)。显微结构下(图 3),各内生真菌分生孢子梗轮生,瓶梗基部膨大呈卵圆形,瓶梗上方1/2处突向上变细;分生孢子呈椭圆形、覆瓦状排列成环状,这与王定锋等[20]描述一致。
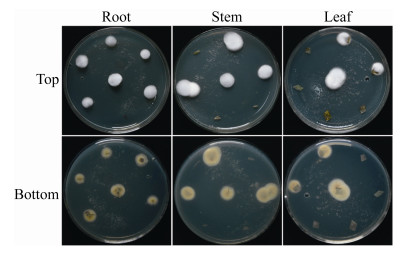
|
| 图 2 检测环链虫草对番茄的内生定殖情况(接种后第30天) Figure 2 Detection of C. cateniannulata isolated from S. lycopersicum at 30 days post-inoculation (dpi). Culture plates showed the top and bottom of the colony which were isolated from root, stem and leave tissues. |

|
| 图 3 环链虫草显微形态图(40×) Figure 3 The microscopic morphology of C. cateniannulata strain isolated from S. lycopersicum (40×). Bar=10 μm. |
2.1.2 真菌rDNA-ITS序列比对
从番茄根、茎和叶组织中获得的内生菌菌株名称分别命名为GZUIFR20.85、GZUIFR20.86、GZUIFR20.87,菌株登录号分别为MW819934、MW819935和MW819936。PCR扩增后的各菌株序列长度分别为527、562和563 bp。在NCBI数据库上将GZUIFR20.85、GZUIFR20.86、GZUIFR20.87菌株与原有菌株GZUIFR04XS8进行BLAST比对,初步比对后的基因相似性分别为99.81%、100%和99.81%。参照Brownbridge等[21]的比对方法将分离所得的3株菌株与接种所用的菌株进行序列再比对并绘制序列比对图谱。综合各序列比对及系统发育树分析结果,从番茄根、茎和叶组织内分离的菌株与接种所用的C. cateniannulata GZUIFR04XS8菌株一致。
2.2 环链虫草在番茄内的定殖变化涂布于PDA培养基的冲洗水并未导致培养基表面产生任何杂菌,这表明种子消毒和植物表面灭菌的方法是有效的。定殖检测结果表明环链虫草能够在番茄植株的根、茎、叶组织内系统定殖(图 2,图 4)。整体而言,环链虫草在番茄植株内的定殖率会受到时间和不同植物组织的影响。从接种后第10天起,环链虫草在植物中的定殖率一直呈现下降趋势,至接种后第90天菌株在根(8.93%)、茎(5.36%)和叶组织(0%)内的定殖率达最低状态。在接种后第10天、20天、30天,根和茎组织的菌株定殖率皆显著高于叶组织(P < 0.05);在接种后第60天和90天,根、茎和叶组织的菌株定殖率无显著性差异(P > 0.05)。综合5个检测时期的定殖率结果可知,环链虫草在番茄组织中存在一定的定殖偏好性,即根部 > 茎部 > 叶片。
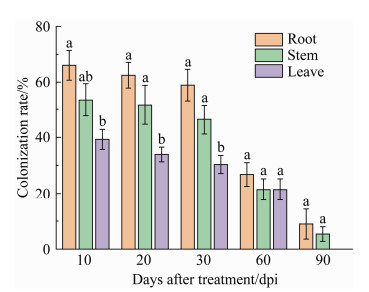
|
| 图 4 环链虫草在番茄不同部位的定殖率 Figure 4 Mean percentage colonization of different plant parts by C. cateniannulata. Means (±SE) capped with different letters differ significantly among different plant tissues within each sampling dates (LSD test, P < 0.05). |
2.3 环链虫草对番茄生长发育的影响
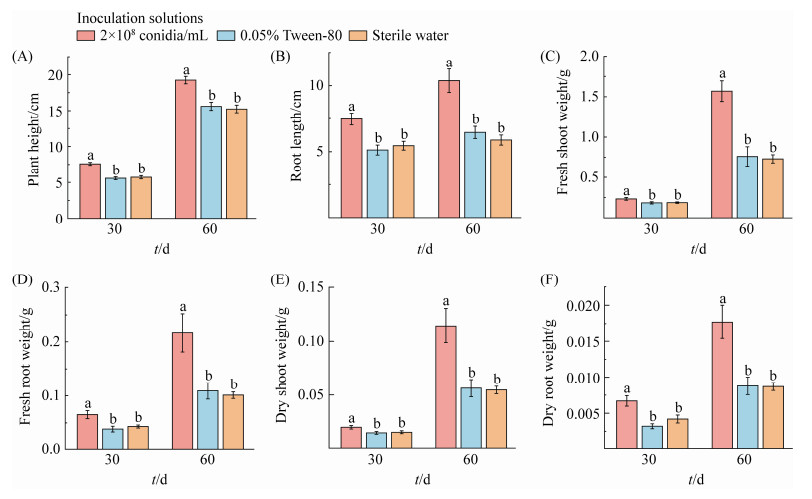
实验结果表明,在播种后的第7天,分生孢子悬浮液浸种处理后的种子发芽率显著高于对照组的发芽率(F=6.904 0;df=2,15;P=0.007 5) (图 5)。从植物形态变化可以初步判断,在接种环链虫草的第60天,实验组和对照组在植株高度及根长方面都优于对照处理组(图 6)。
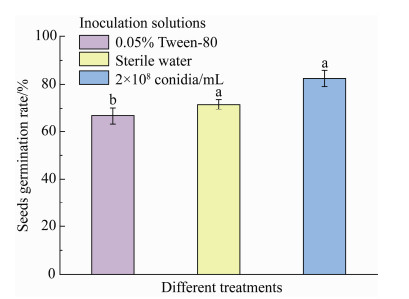
|
| 图 5 番茄种子在第7天的发芽率 Figure 5 The seeds germination rate of tomato at 7 days post-inoculatiuon (dpi). Means (±SE) capped with the different letters indicate significant among different treatments (LSD test, P < 0.05). |

|
| 图 6 环链虫草对番茄的促生作用(接种后第60天) Figure 6 Effect of C. cateniannulata on growth promotion of S. lycopersicum at 60 days post-inoculation (dpi). Macroscopic pictures of tomato plants after inoculations of fungal (2×108 conidia/mL) or control suspensions. A: 0.05% Tween-80 (control); B: C. cateniannulata. Bar=8 cm. |
通过对实验组和对照组的生长参数分析(图 7),接种环链虫草能够显著促进番茄植株的生长。在接种后的第30天,定殖于番茄内的环链虫草显著地影响了植株株高(F=28.71;df=2,27;P < 0.000 1)、根长(F=10.674;df=2,27;P=0.004)、地上部分鲜重(F=4.071;df=2,27;P=0.004)、根鲜重(F=4.071;df=2,27;P=0.028 5)、地上部分干重(F=3.812;df=2,27;P=0.034 8)和根干重(F=9.983;df=2,27;P=0.000 6);同样,在接种后的第60天,实验组和对照组中的植株高度(F=16.702;df=2,27;P < 0.000 1)、根长(F=16.702;df=2,27;P < 0.000 1)、地上部分鲜重(F=20.452;df=2,27;P < 0.000 1)、地下部分鲜重(F=8.24;df=2,27;P < 0.001 6)、地上部分干重(F=10.608;df=2,27;P=0.000 4)和根干重(F=11.302;df=2,27;P=0.000 3)也有较为明显的差异。
|
| 图 7 环链虫草对番茄株高、根长、地上部分干鲜重和地下部分干鲜重的影响(接种后第30天和60天) Figure 7 The effects of seed inoculation with entomopathogenic fungus C. cateniannulata on mean (±SE) plant height (A), root length (B), fresh shoot (C) and fresh root weight (D), dry shoot (E) and dry root weight (F) of S. lycopersicum at 30 and 60 days post-inoculatiuon (dpi). Means (±SE) capped with different lowercase letters differ significantly among different treatments within each sampling dates (LSD test, P < 0.05). |
2.4 环链虫草对番茄叶片酶活及丙二醛含量的影响
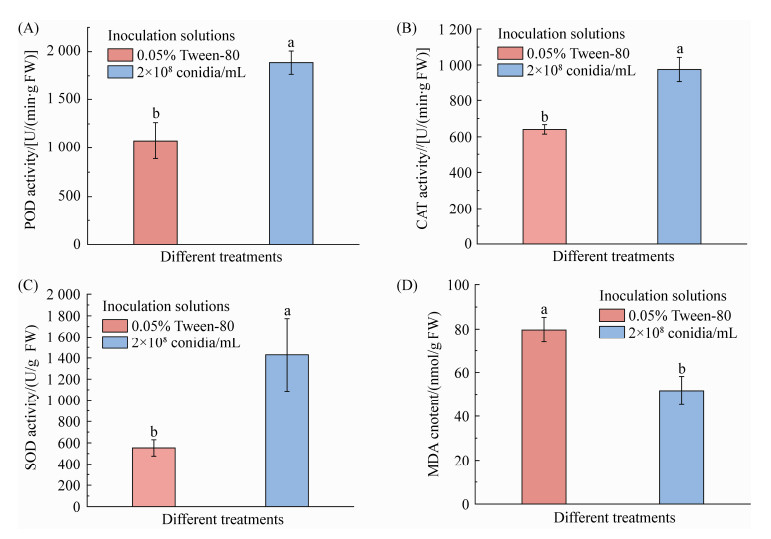
本次实验结果显示,接种环链虫草可有效提高番茄各类抗性相关酶活力。相比于对照组而言,菌株处理组的叶片POD、CAT和SOD活性分别增加了52.21% (图 8A)、75.31% (图 8B)和158.59% (图 8C)。其中,以SOD抗氧化活性酶增长率最高,接种环链虫草对番茄叶片中SOD酶活性影响最大。从图 8D可知,环链虫草处理组的番茄叶片MDA含量比对照组降低了35.15%,两者之间差异显著(F=10.573 0;df=1,8;P=0.011 7)。
|
| 图 8 环链虫草对番茄叶片抗氧化酶活性的影响 Figure 8 The effect of seed inoculation by C. cateniannulata on antioxidant enzyme activity in the leaves of S. lycopersicum at 30 days post-inoculatiuon (dpi). A: POD enzyme activity; B: CAT enzyme activity; C: SOD enzyme activity; D: MDA content. Bars with different letters across treatments differ significantly at P < 0.05 (LSD test). |
3 讨论与结论 3.1 番茄幼苗形态对环链虫草的响应
虫生真菌促进植物生长的现象已有大量研究[22–23]。Qayyum等[24]测定了3株白僵菌对番茄生长的影响,其研究结果表明2株白僵菌都显现出促进番茄生长的功效,仅有一株白僵菌表现出减少地上部分干重和果实重量的副作用;Dash等[25]通过浸种法将白僵菌、玫烟色棒束孢(现学名为Cordyceps fumosorosea)、轮枝菌属真菌定殖至大豆植株,结果显示这些虫生真菌均提高了大豆植株的株高和地上、地下部分的干鲜重;Qin等[26]通过浸种的方式发现定殖白僵菌能够对烟草幼苗的株高、光合速率、气孔大小及表面腺毛产生显著性的影响。目前,虫生真菌促进植物生长的机制仍缺乏一致的定论,Qin等[26]认为虫生真菌在植物体内定殖后可能会影响生长素、吲哚乙酸、赤霉素等其它生物活性物质的产生,这些物质对于提升植物株高、叶绿素含量和生物量的积累有重要作用。观点相同的研究有,Liao等[27]首次发现绿僵菌能够通过产生吲哚乙酸(3-indoleacetic acid,IAA)来促进植物生长。Tall等[28]提出,除了生长激素的影响因素外,虫生真菌促进植物生长的生态功能可能为促进土壤中N、P、Fe等营养元素的可溶性,从而提高植物对N、P、Fe等元素的吸收。本研究与García等[29]的研究结果很相似,即人工接种绿僵菌显著提高番茄幼苗的发芽率、株高、根长、地上部分干鲜重、地下部分干鲜重。环链虫草促进番茄生长的结果说明,在长期的进化过程中,Cordyceps属的某些菌株可能还保留了与植物内共生的特性[30],目前从番茄外观形态来看植物在与环链虫草互作的过程中是获利的。
3.2 环链虫草在番茄内的定殖变化实验结果表明,环链虫草能够在番茄的根、茎和叶组织内系统定殖,且随着时间的推移,该菌株在植物体内的宿存动态呈现出下降的趋势,这与Sánchez-Rodríguez等[31]的研究结果相一致。Vega等[12]曾对此做出推测,虫生真菌定殖率下降的原因可能与植物营养条件、pH、光周期、植物自身的应激反应有关。除了促进植物的生长外,虫生真菌定殖后可通过调控植物代谢产物或虫体取食的方式影响节肢动物害虫的生理及发育[32]。因此,研究虫生真菌在植物体内的宿存动态可能对于虫生真菌与植物的互作机制有重要的作用,但真菌的宿存能力强弱与真菌-植物-害虫之间的相互作用机制了解还不够深入,该过程似乎由植物控制。
环链虫草对番茄不同组织存在一定的定殖差异,即根组织定殖率 > 茎组织定殖率 > 叶组织定殖率。费泓强等[9]研究结果显示,白僵菌更偏向于定殖于玉米的茎部组织和叶组织,而根组织中却未检测到白僵菌。同一菌株对相同植株的不同组织部位存在一定的定殖差异性,Bernstein等[33]针对此类现象提出了内生真菌对寄主组织存在专一性的假说,该假设至今没有明确的定论,但研究虫生真菌-植物之间的协同进化与选择适应机制是非常有价值的工作[34]。这种现象的原因可能在于,不同组织部位的周围环境是有差异的,在环境条件的作用下植物各组织部位形成了特有的生理生态环境,这进一步导致真菌在植物组织中的适应性出现了差异。此外,生防真菌在不同组织部位的定殖率可能还受到接种部位的影响。
3.3 番茄防御性酶活对环链虫草的响应植物体在各种环境因素的作用下会产生大量的活性氧簇(reactive oxygen species),如若不及时清除过量活性氧,这些物质就会导致植物膜脂过氧化和脱脂作用,进而造成植物不可修复的代谢和结构功能障碍[35]。研究显示,为抵御体内所产生的O2·–、·OH、H2O2等活性氧物质,植物会产生一套抗氧化防御机制,即通过SOD、POD、CAT等防御性酶消除自身体内过量的活性氧[36]。但植物对膜脂过氧化程度的缓解能力是有限的,因此为提升植物对不利环境的系统抗性,接种微生物能在一定程度上增强植物对生物胁迫(植物病原菌)和非生物胁迫(盐碱化)的抗性[37]。本研究发现,在接种环链虫草后番茄叶片中的SOD、POD和CAT抗性酶活出现显著性地增加,其中SOD抗氧化活性酶增长率最高(158.59%),这与费泓强等[9]的研究结果相似。SOD和CAT是活性氧代谢动态平衡的主要调节酶,POD可通过合成木质素增强植物对病原菌的抗性,因此抗氧化防御性酶活的变化常常被用作指示植物抗逆性能力强弱;丙二醛MDA是一种膜脂过氧化物,其含量过高则会影响细胞的正常代谢[38]。实验组和对照组的结果显示,接种环链虫草能够显著降低番茄叶片中的MDA含量,这可能与SOD、POD和CAT抗性防御酶的提升有关。我们推测,叶片中定殖的环链虫草是导致番茄抗逆性酶活变化的原因,Rodriguez等认为定殖于植物体的内生真菌会赋予宿主植物更强的抗逆性,这种抗逆性能力的提升可能是宿主植物与内生真菌之间协同作用的结果[39]。
| [1] | Erdinc C, Ekincialp A, Gundogdu M, Eser F, Sensoy S. Bioactive components and antioxidant capacities of different miniature tomato cultivars grown by altered fertilizer applications. Journal of Food Measurement and Characterization, 2018, 12(3): 1519-1529. DOI:10.1007/s11694-018-9767-7 |
| [2] | 林兴军. 不同水肥对日光温室番茄品质和抗氧化系统及土壤环境的影响. 中国科学院研究生院(教育部水土保持与生态环境研究中心)学位论文, 2011. |
| [3] |
Liu H, Yao T, Li JH, Liu T, Zhang ZJ, Ma CY. Effect of various arbuscular mycorrhizal fungi on growth of tomato. Journal of Gansu Agricultural University, 2017, 52(4): 75-81, 89.
(in Chinese) 刘欢, 姚拓, 李建宏, 刘婷, 张仲娟, 马骢毓. 丛枝菌根真菌对番茄生长的影响. 甘肃农业大学学报, 2017, 52(4): 75-81, 89. |
| [4] | Card S, Johnson L, Teasdale S, Caradus J. Deciphering endophyte behaviour: the link between endophyte biology and efficacious biological control agents. FEMS Microbiology Ecology, 2016, 92(8): fiw114. DOI:10.1093/femsec/fiw114 |
| [5] | Ownley BH, Gwinn KD, Vega FE. Endophytic fungal entomopathogens with activity against plant pathogens: ecology and evolution. BioControl, 2010, 55(1): 113-128. DOI:10.1007/s10526-009-9241-x |
| [6] | Gathage JW, Lagat ZO, Fiaboe KKM, Akutse KS, Ekesi S, Maniania NK. Prospects of fungal endophytes in the control of Liriomyza leafminer flies in common bean Phaseolus vulgaris under field conditions. BioControl, 2016, 61(6): 741-753. DOI:10.1007/s10526-016-9761-0 |
| [7] | Russo ML, Scorsetti AC, Vianna MF, Cabello M, Ferreri N, Pelizza S. Endophytic effects of Beauveria bassiana on corn (Zea mays) and its herbivore, Rachiplusia nu (Lepidoptera: Noctuidae). Insects, 2019, 10(4): 110. DOI:10.3390/insects10040110 |
| [8] | Posada F, Aime MC, Peterson SW, Rehner SA, Vega FE. Inoculation of coffee plants with the fungal entomopathogen Beauveria bassiana (Ascomycota: Hypocreales). Mycological Research, 2007, 111(6): 748-757. DOI:10.1016/j.mycres.2007.03.006 |
| [9] |
Fei HQ, Sui L, Zhu H, Xu WJ, Chen RZ, Wang YZ, Li QY, Wang DL. Colonization of Beauveria bassiana in maize seedlings and its effect on their physiological-biochemical characteristics. Chinese Journal of Biological Control, 2016, 32(6): 721-727.
(in Chinese) 费泓强, 隋丽, 朱慧, 徐文静, 陈日曌, 汪洋洲, 李启云, 王德利. 球孢白僵菌在玉米苗期的定殖及其对玉米生理生化特性的影响. 中国生物防治学报, 2016, 32(6): 721-727. |
| [10] | Jaber LR, Enkerli J. Fungal entomopathogens as endophytes: can they promote plant growth?. Biocontrol Science and Technology, 2017, 27(1): 28-41. DOI:10.1080/09583157.2016.1243227 |
| [11] | Sasan RK, Bidochka MJ. The insect-pathogenic fungus Metarhizium robertsii (Clavicipitaceae) is also an endophyte that stimulates plant root development. American Journal of Botany, 2012, 99(1): 101-107. DOI:10.3732/ajb.1100136 |
| [12] | Vega FE. The use of fungal entomopathogens as endophytes in biological control: a review. Mycologia, 2018, 110(1): 4-30. DOI:10.1080/00275514.2017.1418578 |
| [13] | Kepler RM, Luangsa-Ard JJ, Hywel-Jones NL, Quandt CA, Sung GH, Rehner SA, Aime MC, Henkel TW, Sanjuan T, Zare R, Chen MJ, Li ZZ, Rossman AY, Spatafora JW, Shrestha B. A phylogenetically-based nomenclature for Cordycipitaceae (Hypocreales). IMA Fungus, 2017, 8(2): 335-353. DOI:10.5598/imafungus.2017.08.02.08 |
| [14] |
Xu ZS, Xue Y, Zhang L, Wang ZD, Zeng ZY, Yang MF, Zou X. Screening of Isaria isolates for controlling the pupae and second-instar larvae of Spodoptera litura. Plant Protection, 2020, 46(5): 93-101.
(in Chinese) 许忠顺, 薛原, 张丽, 王真娣, 曾召英, 杨茂发, 邹晓. 防治斜纹夜蛾蛹和2龄幼虫的棒束孢菌株筛选. 植物保护, 2020, 46(5): 93-101. |
| [15] | Oliveira DGP, Pauli G, Mascarin GM, Delalibera I. A protocol for determination of conidial viability of the fungal entomopathogens Beauveria bassiana and Metarhizium anisopliae from commercial products. Journal of Microbiological Methods, 2015, 119: 44-52. DOI:10.1016/j.mimet.2015.09.021 |
| [16] | Akutse KS, Maniania NK, Fiaboe KKM, Van Den Berg J, Ekesi S. Endophytic colonization of Vicia faba and Phaseolus vulgaris (Fabaceae) by fungal pathogens and their effects on the life-history parameters of Liriomyza huidobrensis (Diptera: Agromyzidae). Fungal Ecology, 2013, 6(4): 293-301. DOI:10.1016/j.funeco.2013.01.003 |
| [17] | Schulz B, Guske S, Dammann U, Christine B. Endophyte-host interactions II defining symbiosis of the endophyte-host interaction. Symbiosis, 1998, 25(1): 213-227. |
| [18] | 许忠顺. 烟田表层土壤环境对环链棒束孢防控斜纹夜蛾的影响. 贵州大学硕士学位论文, 2020. |
| [19] | Jaber LR, Enkerli J. Effect of seed treatment duration on growth and colonization of Vicia faba by endophytic Beauveria bassiana and Metarhizium brunneum. Biological Control, 2016, 103: 187-195. DOI:10.1016/j.biocontrol.2016.09.008 |
| [20] |
Wang DF, Yang G, Wang QS, Zeng MS, Wu GY. Identification of two Isaria isolates and bioassay of their pathogenicity against tea Tortrix Homona coffearia and smaller tea Tortrix Adoxophyes honmai. Acta Phytophylacica Sinica, 2014, 41(5): 531-539.
(in Chinese) 王定锋, 杨广, 王庆森, 曾明森, 吴光远. 两株棒束孢菌的鉴定及其对茶卷叶蛾和茶小卷叶蛾的致病力. 植物保护学报, 2014, 41(5): 531-539. |
| [21] | Brownbridge M, Reay SD, Nelson TL, Glare TR. Persistence of Beauveria bassiana (Ascomycota: Hypocreales) as an endophyte following inoculation of radiata pine seed and seedlings. Biological Control, 2012, 61(3): 194-200. DOI:10.1016/j.biocontrol.2012.01.002 |
| [22] | Kabaluk JT, Ericsson JD. Metarhizium anisopliae seed treatment increases yield of field corn when applied for wireworm control. Agronomy Journal, 2007, 99(5): 1377-1381. DOI:10.2134/agronj2007.0017N |
| [23] | Liao XG, O'Brien TR, Fang WG, St Leger RJ. The plant beneficial effects of Metarhizium species correlate with their association with roots. Applied Microbiology and Biotechnology, 2014, 98(16): 7089-7096. DOI:10.1007/s00253-014-5788-2 |
| [24] | Qayyum MA, Wakil W, Arif MJ, Sahi ST, Dunlap CA. Infection of Helicoverpa armigera by endophytic Beauveria bassiana colonizing tomato plants. Biological Control, 2015, 90: 200-207. DOI:10.1016/j.biocontrol.2015.04.005 |
| [25] | Dash CK, Bamisile BS, Keppanan R, Qasim M, Lin YW, Islam SU, Hussain M, Wang LD. Endophytic entomopathogenic fungi enhance the growth of Phaseolus vulgaris L. (Fabaceae) and negatively affect the development and reproduction of Tetranychus urticae Koch (Acari: Tetranychidae). Microbial Pathogenesis, 2018, 125: 385-392. |
| [26] | Qin X, Zhao X, Huang SS, Deng J, Li XB, Luo ZB, Zhang YJ. Pest management via endophytic colonization of tobacco seedlings by the insect fungal pathogen Beauveria bassiana. Pest Management Science, 2021, 77(4): 2007-2018. DOI:10.1002/ps.6229 |
| [27] | Liao XG, Lovett B, Fang WG, St Leger RJ. Metarhizium robertsii produces indole-3-acetic acid, which promotes root growth in Arabidopsis and enhances virulence to insects. Microbiology: Reading, England, 2017, 163(7): 980-991. DOI:10.1099/mic.0.000494 |
| [28] | Tall S, Meyling NV. Probiotics for plants? growth promotion by the entomopathogenic fungus Beauveria bassiana depends on nutrient availability. Microbial Ecology, 2018, 76(4): 1002-1008. DOI:10.1007/s00248-018-1180-6 |
| [29] | García JE, Posadas BJ, Perticari A, Lecuona RE. Metarhizium anisopliae (Metschnikoff) Sorokin promotes growth and has endophytic activity in tomato plants. Advances in Biological Research, 2011, 5(1): 22-27. |
| [30] | Zheng P, Xia YL, Zhang SW, Wang CS. Genetics of Cordyceps and related fungi. Applied Microbiology and Biotechnology, 2013, 97(7): 2797-2804. DOI:10.1007/s00253-013-4771-7 |
| [31] | Sánchez-Rodríguez AR, Del-Campillo MC, Quesada- Moraga E. Beauveria bassiana: an entomopathogenic fungus alleviates Fe chlorosis symptoms in plants grown on calcareous substrates. Scientia Horticulturae, 2015, 197: 193-202. DOI:10.1016/j.scienta.2015.09.029 |
| [32] | Ahmad I, Jiménez-Gasco MDM, Luthe DS, Shakeel SN, Barbercheck ME. Endophytic Metarhizium robertsii promotes maize growth, suppresses insect growth, and alters plant defense gene expression. Biological Control, 2020, 144: 104167. DOI:10.1016/j.biocontrol.2019.104167 |
| [33] | Bernstein ME, Carroll GC. Internal fungi in old-growth Douglas fir foliage. Canadian Journal of Botany, 1977, 55(6): 644-653. DOI:10.1139/b77-079 |
| [34] | Vega FE, Goettel MS, Blackwell M, Chandler D, Jackson MA, Keller S, Koike M, Maniania NK, Monzón A, Ownley BH, Pell JK, Rangel DEN, Roy HE. Fungal entomopathogens: new insights on their ecology. Fungal Ecology, 2009, 2(4): 149-159. DOI:10.1016/j.funeco.2009.05.001 |
| [35] |
Kong YL, Zhu CQ, Cao XC, Zhu LF, Jin QY, Hong XZ, Zhang JH. Research progress of soil microbial mechanisms in mediating plant salt resistance. Scientia Agricultura Sinica, 2021, 54(10): 2073-2083.
(in Chinese) 孔亚丽, 朱春权, 曹小闯, 朱练峰, 金千瑜, 洪小智, 张均华. 土壤微生物介导植物抗盐性机理的研究进展. 中国农业科学, 2021, 54(10): 2073-2083. DOI:10.3864/j.issn.0578-1752.2021.10.004 |
| [36] | Tang J, Wang SQ, Hu KD, Huang ZQ, Li YH, Han Z, Chen XY, Hu LY, Yao GF, Zhang H. Antioxidative capacity is highly associated with the storage property of tuberous roots in different sweetpotato cultivars. Scientific Reports, 2019, 9: 11141. DOI:10.1038/s41598-019-47604-8 |
| [37] |
Zhang XM, Tian YQ, Pan XM, Li JJ, Shi XL, Zhang JQ, Wu KL. Antifungal effect and plant growth promoting mechanism of two Trichoderma strains. Journal of Southern Agriculture, 2020, 51(11): 2713-2721.
(in Chinese) 张晓梦, 田永强, 潘晓梅, 李佳佳, 石晓玲, 张建强, 吴康莉. 2株木霉抑菌效果及其促植物生长机制. 南方农业学报, 2020, 51(11): 2713-2721. DOI:10.3969/j.issn.2095-1191.2020.11.014 |
| [38] |
Tai LM, Gao JF, Zuo YH, Jin XH, Zhang YL, Li HY. Induction of defense enzymes activities in soyben and control effect of Phytophthora root rot in flowerpot by Trichoderma longibrachiaum T115D. Chinese Journal of Biological Control, 2018, 34(6): 897-905.
(in Chinese) 台莲梅, 高俊峰, 左豫虎, 靳学慧, 张亚玲, 李海燕. 长枝木霉菌T115D诱导大豆叶片防御酶活性及疫病盆栽防治效果. 中国生物防治学报, 2018, 34(6): 897-905. |
| [39] | Rodriguez RJ, White Jr JF, Arnold AE, Redman RS. Fungal endophytes: diversity and functional roles. New Phytologist, 2009, 182(2): 314-330. DOI:10.1111/j.1469-8137.2009.02773.x |
 2022, Vol. 62
2022, Vol. 62




