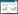中国科学院微生物研究所,中国微生物学会
文章信息
- 黄家锐, 杜鹏强, 李文均, 陶航天, 郑晓珂, 何海荣. 2022
- HUANG Jiarui, DU Pengqiang, LI Wenjun, TAO Hangtian, ZHENG Xiaoke, HE Hairong.
- 地黄内生放线菌的分离及地黄轮纹病拮抗菌Streptomyces folium leaf-16的新种鉴定
- Isolation of endophytic actinomycetes from Rehmannia glutinosa and identification of a new species Streptomyces folium leaf-16 resistant to Phoma herbarum
- 微生物学报, 62(12): 4953-4963
- Acta Microbiologica Sinica, 62(12): 4953-4963
-
文章历史
- 收稿日期:2022-03-31
- 修回日期:2022-05-20
- 网络出版日期:2022-06-21
2. 河南农业大学植物保护学院, 河南 郑州 450046;
3. 中山大学生命科学学院, 广东 广州 510275
2. College of Plant Protection, Henan Agricultural University, Zhengzhou 450046, Henan, China;
3. School of Life Sciences, Sun Yat-Sen University, Guangzhou 510275, Guangdong, China
放线菌能够产生丰富的次级代谢产物,是开发新型药物先导化合物的重要来源[1]。临床应用的大部分抗生素都是由链霉菌产生的,如免疫抑制剂(雷帕霉素和他克莫司)、抗肿瘤药物(阿霉素和放线菌素D)、抗菌类药物(四环素和卡那霉素)及杀虫药物(米尔贝霉素和阿维菌素)等。随着细菌性病原体耐药性的出现及真菌感染数量的增加,急需寻找新的活性化合物以制备新型抗生素,从而抑制新的病原菌。半个世纪以来,随着对常见链霉菌菌株的大量筛选,导致出现了已知活性化合物重复分离、新的活性化合物筛选困难的现象[2]。因此,挖掘新菌种、寻找新基因、新产物是解决以上困难的重要途径[2–4]。
植物内生放线菌即生活在健康植株的根、茎、叶、花、种子和果实等组织中的放线菌,这些放线菌与植物进行化学物质交换,进而促进植物的生长,并抵御病原菌的侵害。药用植物能够产生多种活性化合物,药用植物内生菌与宿主之间长期共存,并与宿主植物形成“协同进化”的关系,进而使植物内生菌能够产生与宿主相同或者相似的代谢产物[5]。因此,从药用植物内生放线菌筛选活性化合物具有极大的可能。
地黄(Rehmannia glutinosa)是我国传统的大宗中药材,具有滋阴补肾、生精补髓、清热生津、防癌、降血糖、抗炎免疫和抗肝损害等功效,在国内多个省份均有种植。其中以旧称“怀庆府”的河南焦作地区产出的地黄被冠以“怀地黄”之称,是我国著名的“四大怀药”之一[6]。地黄不仅是我国重要的药物资源,而且是中国重要的创汇产品之一,远销东南亚及日本等国家。因此,地黄具有重要的药用价值和经济价值。地黄轮纹病是一种重要的叶部病害,发病时叶缘上卷、叶片焦枯,严重时叶片穿孔造成死亡[7]。在河南,地黄产区100%的地块均有轮纹病发生,严重影响地黄的产量和品质[7]。目前,主要通过化学农药进行地黄轮纹病的防治。然而,化学农药防治地黄轮纹病不仅防治效果较差,还会引发农药残留问题。随着人们食品安全意识的提高,中药材农药残留问题引起了广泛关注。因此,为了开发和利用地黄内生放线菌资源,挖掘抗地黄轮纹病病原真菌的生防菌,本研究分离了药用植物地黄内生放线菌,通过平板对峙方法寻找具有抗地黄轮纹病病原真菌拮抗活性的生防菌,并对其进行分类学鉴定,为寻找新型的抗地黄轮纹病的活性化合物奠定基础。
1 材料与方法 1.1 材料和菌株本研究所用的地黄植株采集地点为河南中医药大学药用植物园。链霉菌leaf-16分离自地黄的叶部,并保存于河南中医药大学药学院生物化学实验室。大肠杆菌DH5α感受态细胞购自全式金生物科技有限公司,菌株Streptomyces mayteni YIM 60475T和Streptomyces hainanensis YIM47672T来自中山大学李文均课题组,地黄轮纹病原真菌草茎点霉(Phoma herbarum)来自河南省农科院。
1.2 主要培养基、试剂和仪器 1.2.1 培养基放线菌分离培养基。高氏一号培养基(g/L):可溶性淀粉20.0,K2HPO4·3H2O 0.5,NaCl 0.5,KNO3 1.0,MgSO4·7H2O 0.5,FeSO4·7H2O 0.01,琼脂20.0,pH 7.2–7.4。腐殖酸培养基(HV,g/L):KCl 1.7,腐殖酸1.0,FeSO4·7H2O 0.1,复合维生素100 μL/L,MgSO4·7H2O 0.5,Na2HPO4 0.5,CaCO3 0.02,琼脂20,pH 7.2–7.4。复合维生素(g/L):硫胺素(B1) 0.5,核黄素(B2) 0.5,肌醇0.5,泛酸(B5) 0.5,对氨基苯甲酸0.5,生物素(B7) 0.25,维生素(B6) 0.5,烟酸(B3) 0.5。
放线菌培养基。ISP 3培养基(g/L):燕麦2,MgSO4 0.02,KNO3 0.02,K2HPO4·3H2O 0.05,琼脂2,燕麦煮30 min后取滤液,溶解无机盐,定容至100 mL
细菌培养基。LB培养基(g/L):酵母膏5,胰蛋白胨10,NaCl 5。
病原真菌活性检测培养基。PDA培养基(g/L):马铃薯200,葡萄糖20,琼脂20。V8培养基(g/L):V8蔬菜汁100 mL/L,CaCO3 1.5,琼脂20。
1.2.2 试剂细菌基因组DNA提取试剂盒购自天根生化(北京)生物科技有限公司;PCR及载体构建等试剂购自赛默飞世尔科技(中国)有限公司(Thermo Fisher Scientific)。
1.2.3 仪器PCR仪购自Applied Biosystems公司;Eppendorf mini spin离心机购自Eppendorf公司;Tanon 2500R全自动数码凝胶成像分析系统购自上海天能科技有限公司;生物显微镜(ML11-II)购自广州市明美电技术有限公司;二元高压液相色谱仪和(G+C)%含量测定仪购自苏州岛津仪器设备有限责任公司;DNA杂交仪购自上海百傲科技有限公司。
1.3 微生物分离和纯化采集到的地黄样品经五步消毒法进行消毒,分别为:(1) 5% NaClO溶液浸洗5 min;(2) 2.5% Na2S2O3溶液浸洗10 min;(3) 75%乙醇溶液浸洗5 min;(4) 无菌水冲洗3遍;(5) 10% NaHCO3浸洗10 min;处理后,将其分为根部、茎部和叶部,分别进行研磨,取200 µL研磨液涂布到含放线菌酮(50 mg/L)和萘啶酮酸(20 mg/L)的高氏一号和HV分离培养基上,28 ℃培养1–5周,挑取长出的单菌落并转接到纯化培养基ISP 3上进行纯化培养。
1.4 抗病原真菌活性测试采用平板对峙法测定待测菌株对地黄纶纹病原真菌(Phoma herbarum)的拮抗作用,把待测菌株点接到培养皿中距离原点1/2半径处,待菌落长出后,将真菌的菌饼倒置在原点另一侧对称的位置,于28 ℃培养箱培养7–14 d,观察抑菌效果。
1.5 微生物培养和形态比较形态特征的鉴定在ISP 2-7培养基[8]和察氏培养基[9]上28 ℃培养14 d,并进行颜色统计。菌株孢子丝的电子显微形态是通过革兰氏染色观察的。首先,将放线菌菌落(带培养基切下)倒置于载玻片的中央,轻轻按压后移除菌落。经火焰固定后制片,具体方法为:(1) 结晶紫染色30 s,用无菌水冲洗染液;(2) 加碘液染色30 s,无菌水冲洗;(3) 95%乙醇溶液脱色至无紫色脱落,无菌水冲洗;(4) 沙黄染色液复染30 s,无菌水冲洗;(5) 载玻片晾干后镜检。
1.6 生理生化特征生长温度测定将菌株接种到ISP 3培养基上,并在相应温度(4、10、18、22、28、32、35、37 ℃)下培养14 d后统计结果;将菌株接种到液体ISP 2培养基中进行pH (pH 5–12)和氯化钠(0–12%, W/V)耐受实验,菌株在温度28 ℃、转速220 r/min的条件下培养7 d后统计结果;将菌株接种到基础培养基上进行碳氮源利用实验,28 ℃培养14 d后统计结果;牛奶凝固与胨化、纤维素水解、硝酸盐还原、明胶液化、淀粉水解、氧化酶、过氧化氢酶、脲酶、酯酶、H2S产生等测试参照文献[10]进行。
1.7 化学分类分析化学分类实验中所需的菌丝体通过ISP 2液体培养基于28 ℃、转速250 r/min的条件下培养7 d后离心并冷冻干燥获得。细胞壁中氨基酸、水解糖、磷酸类脂、甲基萘醌等化学组分分析实验步骤参照文献[10]。
1.8 分子生物学分析菌株基因组提取纯化[11]后利用通用引物对16S-F (5'-AGAGTTTGATCCTGGCTCAG-3')和16S-R (5'-AAGGAGGTGATCCAGCCGCA-3')扩增菌株16S rRNA基因,PCR扩增体系为50 μL,包含10× KOD Buffer 5 μL,dNTPs (2.5 mmol/L each) 4 μL,DMSO 3 μL,引物16S-F和16S-R (均为10 μmol/L)各2 μL,MgSO4 2 μL,DNA模板1 μL,KOD DNA聚合酶0.5 μL,无菌蒸馏水30.5 μL。PCR反应扩增程序为94 ℃ 4 min;94 ℃ 1 min,58 ℃ 30 s,68 ℃ 1.5 min,31个循环;68 ℃ 10 min。PCR产物纯化后连接到pMD-19T载体上,送到生工生物工程(上海) 股份有限公司进行一代测序,将测序结果在EzBioCloud (https://www.ezbiocloud.net/identify)网站上进行相似性比对,选取其相似性较高的典型菌株利用MEGA 7.0软件进行系统进化发育树的构建。
(G+C)%含量通过热变性的方法进行测定,并以大肠杆菌JM 109做对照菌株;DNA-DNA杂交实验采用复性率方法进行测定,其公式如下:
DNA同源性(%)=[4Vm–(VA+VB)]/[2×(VA×VB)1/2]× 100
其中,VA、VB分别为2个样品的复性速率,Vm为2个样品混合液的复性速率,计算样品间的DNA同源性。
2 结果与分析 2.1 地黄内生放线菌的分离对地黄样品的内生放线菌进行分离,共获得菌株65株,其中根部分离31株、茎部18株、叶部16株。首先,根据形态对65株放线菌进行分类,其中25株菌株具有典型的链霉菌特征,并归类为链霉菌菌属(Streptomyces),其余40株根据形态可认定为稀有放线菌属。对剩余的40株菌株进行16S rRNA基因测序,测序结果在EzBioCloud上分析,结果表明这40株菌株分布于9个放线菌属,分别为原小单孢菌属(Promicromonospora) 2株、野野村菌属(Nonomuraea) 6株、小单孢菌属(Micromonospora) 13株、游动放线菌菌属(Actinoplanes) 4株、诺卡氏菌属(Nocardia) 5株、放线孢菌属(Actinomycetospora) 3株、链孢囊菌属(Streptosporangium) 5株和马杜拉菌属(Actinomadura) 2株,其数量统计及分离位置如表 1所示。从表 1可以看出,地黄的根、茎和叶部的内生放线菌在种类上没有明显差异,但根部的放线菌数量明显多于茎部和叶部,这可能是因为根部与根系土壤相互接触,促进了微生物在根内的定殖[12]。
| Genus/origin | Root | Stem | Leaf | Total |
| Streptomyces | 13 | 7 | 5 | 25 |
| Promicromonospora | 1 | 0 | 1 | 2 |
| Nonomuraea | 4 | 1 | 1 | 6 |
| Micromonospora | 4 | 4 | 5 | 13 |
| Actinoplanes | 2 | 1 | 1 | 4 |
| Nocardia | 4 | 1 | 0 | 5 |
| Actinomycetospora | 1 | 2 | 0 | 3 |
| Streptosporangium | 2 | 1 | 2 | 5 |
| Actinomadura | 0 | 1 | 1 | 2 |
| Total | 31 | 18 | 16 | 65 |
2.2 地黄内生放线菌的抗地黄纶纹病病原真菌活性
对所分离的65株地黄内生放线菌进行抗地黄轮纹病病原Phoma herbarum的活性测试,结果发现8株菌株具有拮抗活性,如图 1所示。
|
| 图 1 抗草茎点霉活性菌株 Figure 1 The active strains against Phoma herbarum. |
2.3 Streptomyces folium leaf-16的鉴定
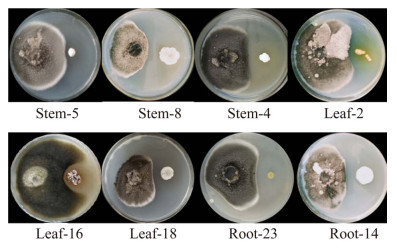
对具有抗地黄轮纹病的拮抗菌株进行16S rRNA基因测序,其在NCBI上的GenBank序列编号为MK809368。将菌株leaf-16的16S rRNA基因序列在EzTaxon-e (https://www.ezbiocloud.net/)上进行比对,发现菌株leaf-16的最高相似性菌株为Streptomyces mayteni YIM 60475T (99.49%)[13],其他相似性较高的菌株分别为Streptomyces hainanensis YIM47672T (98.82%)[14]、Streptomyces manganisoli MK44T (97.29%)[15]、Streptomyces specialis GW41-154T (97.03%)[16]和Streptomyces hoynatensis KCTC 29097T (97.03%)[17]。对菌株leaf-16进行系统发育分析(图 2),发现菌株leaf-16与其相似性较高的菌株S. mayteni YIM 60475T和S. hainanensis YIM47672T在同一个分支上,说明菌株leaf-16为链霉菌属,且与菌株S. mayteni YIM 60475T和S. hainanensis YIM47672T亲缘关系比较近。
|
| 图 2 菌株leaf-16的系统进化发育树 Figure 2 Neighbour-joining tree showing the phylogenetic position of strain leaf-16 and related taxa based on 16S rRNA gene sequences. Bootstrap values > 50% (based on 1 000 replications) are shown at branch points. Bar: 0.005 substitutions per nucleotide position. |
2.3.1 Streptomyces folium leaf-16的形态分析
将菌株leaf-16在ISP系列培养基和察氏培养基上进行培养,观察其形态,菌株颜色范围从白色到橘红色,在ISP 2、ISP 3、ISP 7和察氏培养基上生长良好;但是在ISP 4、ISP 5、ISP 6培养基上生长状态较差,其中在ISP 3培养基上可以产生可溶性色素(表 2)。
| Agar medium | Growth | Aerial mycelium | Substrate mycelium | Diffusible pigment |
| Yeast extract/malt extract (ISP2) | Good | White | White | Dark green |
| Oatmeal (ISP3) | Good | White | White | Light green |
| Inorganic salts/starch (ISP4) | Good | Reddish orange | Yellow | None |
| Glycerol/asparagine (ISP5) | Good | Yellowish white | Yellow | None |
| Peptone/yeast extract/iron (ISP6) | Poor | None | Translucent white | None |
| Tyrosine (ISP7) | Poor | white | White | None |
| Czapek’s | Good | None | Yellowish white | None |
将菌株leaf-16与其同源关系较近的2株菌株S. mayteni YIM 60475T和S. hainanensis YIM47672T进行形态学比较,结果表明菌株leaf-16在形态上与S. mayteni YIM 60475T和S. hainanensis YIM47672T有明显差异,在ISP 2、ISP 3、ISP 4、ISP 5上差异最为显著,如图 3所示。

|
| 图 3 菌株leaf-16、S. mayteni YIM 60475T和S. hainanensis YIM 47672T在ISP 2–5上的形态差异 Figure 3 Pictures showing the different morphology of strain leaf-16, S. mayteni YIM 60475T and S. hainanensis YIM 47672T on ISP 2–5 at 28 oC for 14 d. |
将菌株leaf-16在ISP 3培养基上培养10 d后,在电子显微镜下观察菌株leaf-16的孢子丝和孢子形态,结果发现,菌株leaf-16的气生菌丝分化形成直线或者弯曲的孢子链,孢子呈圆柱形,如图 4所示。
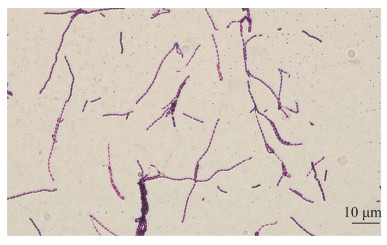
|
| 图 4 菌株leaf-16的孢子链及孢子形态 Figure 4 Spore chain and spore morphology of strain leaf-16 on ISP 3 at 28 ℃ for 10 d. |
2.3.2 Streptomyces folium leaf-16的生理生化特征
将菌株leaf-16接种到ISP 3培养基上,并在4、10、18、22、28、32、35、37 ℃温度下培养14 d,结果菌株leaf-16在4、10、18、37 ℃温度下不生长,在22、28、32、35 ℃温度下可生长,其中最适生长温度为28 ℃;将菌株leaf-16接种到ISP 2液体培养基中,调节pH值为5–12 (pH值梯度为1)以及添加NaCl浓度为0–10% (W/V),浓度梯度为1%,28 ℃、220 r/min培养1周后发现,pH在7–9间菌株生长,且pH为7时状态最好;最大NaCl耐受浓度为9%。
菌株leaf-16在淀粉水解、七叶苷分解、脲酶产生和硝酸盐还原实验中呈阳性,而在纤维素分解、明胶液化、硫化氢产生、牛奶凝固与液化、过氧化氢产生以及脂酶产生实验中呈阴性,具体实验方法及结果判定参考文献[10]。
菌株leaf-16的碳氮源利用实验在基础培养基中加入0.2%的碳源和0.5%的氮源(设阴性对照)后接种菌株leaf-16,28 ℃培养14 d后统计结果,发现菌株leaf-16可以利用的碳源为葡萄糖、半乳糖、甘露糖、麦芽糖、山梨醇、鼠李糖、甘露醇、阿拉伯糖、肌醇和蔗糖,不能利用的碳源为棉子糖、木糖、果糖和核糖;可以利用的氮源为精氨酸、谷氨酰胺、脯氨酸、苏氨酸、丙氨酸、丝氨酸、酪氨酸、天冬酰胺和肌酸,不能利用的氮源为甘氨酸和谷氨酸。
对菌株leaf-16与菌株S. mayteni YIM 60475T和S. hainanensis YIM 47672T进行生理生化比较,结果表明,菌株leaf-16的pH生长范围、NaCl耐受以及碳、氮源利用与其相似性最高且进化树在同一分支的2株放线菌有明显差异,菌株leaf-16与其最高相似性的2株菌的生理生化实验结果如表 3所示。
| Characteristic | 1 | 2 | 3 |
| Diffusible pigment (on ISP 2 medium) | Dark green | – | – |
| NaCl tolerance | 9 | 3 | 10 |
| Decomposition of cellulose | – | – | + |
| H2S production | – | + | + |
| Utilization of: | |||
| Sorbitol | + | – | – |
| D-ribose | – | + | – |
| D-fructose | – | + | – |
| Inositol | – | – | + |
| L-asparagine | + | – | – |
| Whole-cell hydrolysates | Glucose, ribose | Galactose, glucose, xylose | Galactose, xylose. |
| Phospholipid | DPG, PE, PI, PL, GL | DPG, PG, PE, PI | DPG, PE |
| Strains: 1: leaf-16; 2: S. mayteni YIM 60475T; 3: S. hainanensis YIM 47672T; Physiology and biochemistry data for S. mayteni YIM 60475T and S. hainanensis YIM 47672T are from this study, chemotaxonomy data are from study 13 and 14. +: positive; –: negative. | |||
2.3.3 Streptomyces folium leaf-16的化学分类特征
菌株leaf-16细胞壁氨基酸成分和琨组成分通过HPLC分析得到,结果显示菌株leaf-16的细胞壁含有甘氨酸和2, 6-二氨基庚二酸;琨组成分为MK-9(H4) (16.7%)、MK-9(H6) (29.3%)、MK-9(H8) (43.4%)和MK-10(H6) (10.6%)。水解糖和磷酸类脂成分的分析通过薄板层析得到,结果分析表明菌株leaf-16的全细胞糖为葡萄糖和核糖;磷酸类脂主要为双磷脂酰甘油(diphosphatidyl glycerol, DPG)、磷脂酰乙醇胺(phosphatidyl ethanolamine, PE)、磷脂酰肌醇(phosphatidyl inositol, PI)、3个未知磷脂(phospholipids, PLs)和3个未知糖脂(glycolipids, GLs) (图 5)。

|
| 图 5 菌株leaf-16的磷酸类脂成分 Figure 5 Phospholipid compositions of strain leaf-16. A: using molybdophosphoric acid reagent; B: using molybdenum blue reagent; C: ninhydrin reagent; D: using anisaldehyde reagent. Abbreviations: DPG: diphosphatidylglycerol; PE: phosphatidylethanolamine; PI: phosphatidylinositol; PL: unidentified phospholipid; GL: glycolipid. |
2.3.4 Streptomyces folium leaf-16的分子生物学特征
经热变性法测定,菌株leaf-16的(G+C)%含量为73.32%。菌株与其相似性最高且在同一个分支上的2株菌S. mayteni YIM 60475T和S. hainanensis YIM47672T的杂交结果分别为50.06%和45.59%。
3 讨论与结论本研究从中药材地黄中分离得到65株放线菌,其中8株菌株对地黄轮纹病原真菌有较好的抑菌活性,16S rRNA基因测序发现菌株leaf-16为潜在的新菌种。经系统进化发育树分析,该菌株与相似性最高的2株菌S. mayteni YIM 60475T和S. hainanensis YIM47672T在同一个分支上,其亲缘关系比较近(图 2)。首先,从形态上比较,菌株leaf-16与S. mayteni YIM 60475T和S. hainanensis YIM47672T在ISP 2–5培养基上具有完全不同的形态,表明菌株leaf-16与这2株菌不同(图 3)。其次,菌株leaf-16在生理生化性质和细胞壁成分上与其相似性最高,且亲缘关系较近的2株菌具有显著差异(表 3)。此外,菌株leaf-16的细胞壁含有甘氨酸和2, 6-二氨基庚二酸,磷酸类脂属于Ⅱ型,主要琨组成分为MK-9(H4)、MK-9(H6)、MK-9(H8)和MK-10(H6)以及其DNA的(G+C)%为73.32%,以上特征均属于链霉菌分类特征[18]。最后,在分子水平上分析发现,菌株leaf-16与S. mayteni YIM 60475T和S. hainanensis YIM 47672T的DNA-DNA杂交结果分别为50.06%和45.59%,均小于基因组种属鉴定的阈值70%[19]。综上实验结果表明菌株leaf-16为链霉菌的新种,并将菌株命名为Streptomyces folium,其典型菌株为leaf-16。
植物内生菌能够产生多种促进植物生长的因子并且能够抑制多种植物病原菌生长,达到“以菌促生长” “以菌治菌”的效果,大大降低了农药化肥的使用率,减少了化学物质对环境造成的影响。植物内生放线菌可产生多种多样的次生代谢产物,如蛇藤内生放线菌Streptomyces sp. NRRL 30562中筛选获得munumbicin A–E, 这类抗生素可以抗革兰氏阳性菌如炭疽杆菌Bacillus anthracis和结核分枝杆菌Mycobacterium tuberculosis[20]。Igarashi等从美丽相思子内生放线菌Micromonospora sp. GMKU326中分离得到一个新的4-羟乙酸乙酰内脂类多聚酮类化合物maklamicin,该抗生素可以在浓度为0.2、1.7、6.5、13.0 µg/mL时抑制黄体微球菌、枯草芽孢杆菌、黑头芽孢杆菌和金黄色葡萄球菌等革兰氏阳性菌的生长[21]。药用植物蕨菜重的类链霉菌属菌株K12-0794中分离得到2个新型抗生素hamuramicins A和B[22]。
链霉菌(Streptomyces)具有十分复杂的形态发育过程,并在形态发育过程中伴随着初级和次级代谢产物的产生[23]。研究表明,链霉菌能够产生比迄今报道的所有链霉菌次级代谢物多约15万种生物活性化合物,是挖掘生物活性天然产物、药用化学用品和新型药物先导物的重要来源[24]。链霉菌菌株leaf-16表现出对地黄轮纹病原真菌的抑菌活性,表明其具有特异性的抗地黄轮纹病原真菌的代谢产物。因此,在后续的实验中,将进行菌株leaf-16的全基因组测序以及新型活性化合物分离和鉴定,以挖掘能够特异性抑制地黄轮纹病原真菌的天然活性产物,为寻找高效低毒的新型抗轮纹病的抗生素奠定物质基础。
| [1] | Kim JH, Lee N, Hwang S, Kim W, Lee Y, Cho S, Palsson BO, Cho BK. Discovery of novel secondary metabolites encoded in actinomycete genomes through coculture. Journal of Industrial Microbiology and Biotechnology, 2021, 48(3/4): kuaa001. |
| [2] | Li JW, Vederas JC. Drug discovery and natural products: end of an era or an endless frontier?. Science, 2009, 325(3/5937): 161-165. |
| [3] | Fischbach MA, Walsh CT. Antibiotics for emerging pathogens. Science, 2009, 325(5944): 1089-1093. DOI:10.1126/science.1176667 |
| [4] | Ramadhar TR, Beemelmanns C, Currie CR, Clardy J. Bacterial symbionts in agricultural systems provide a strategic source for antibiotic discovery. The Journal of Antibiotics, 2014, 67(1): 53-58. DOI:10.1038/ja.2013.77 |
| [5] |
Wei BY, Cao L, Li SX, Huang D, Zhou J, Guo XY. The role of endophytes in medical plants and the effect of endophytes on secondary metabolites. Chinese Agricultural Science Bulletin, 2011, 27(19): 83-88.
(in Chinese) 魏宝阳, 曹亮, 李顺祥, 黄丹, 周晋, 虢小翊. 内生菌与药用植物的关系及对次生代谢产物的影响. 中国农学通报, 2011, 27(19): 83-88. |
| [6] |
Du Q, Xie XL, Tian MP, Ma MY, Wu TJ, Feng WS. 17 parts of ground yellow germinated resource rotor-based field resistance evaluation. Journal of Chinese Medicinal Materials, 2021, 44(8): 1818-1820.
(in Chinese) 杜权, 谢小龙, 田梦平, 马梦雨, 吴廷娟, 冯卫生. 17份地黄种质资源轮纹病的田间抗性评价. 中药材, 2021, 44(8): 1818-1820. DOI:10.13863/j.issn1001-4454.2021.08.004 |
| [7] | 王飞. 地黄轮纹病病原学及防治研究. 华中农业大学硕士学位论文, 2012. |
| [8] | Shirling EB, Gottlieb D. Methods for characterization of Streptomyces species. International Journal of Systematic Bacteriology, 1966, 16(3): 313-340. DOI:10.1099/00207713-16-3-313 |
| [9] | Waksman SA. The Actinomycetes. A summary of current knowledge. American Scientist, 1967, 55(4): 535A-536A. |
| [10] | 徐丽华, 李文均, 刘志恒. 放线菌系统学: 原理、方法及实践. 北京: 科学出版社, 2007. |
| [11] | Kieser T, Bibb MJ, Chater KF, Butter MJ, Hopwood DA, Bittner M.. Practical Streptomyces Genetics: A Laboratory Manual. Britain: John Innes Foundation, 2000. |
| [12] | Sokol NW, Slessarev E, Marschmann GL, Nicolas A, Blazewicz SJ, Brodie EL, Firestone MK, Foley MM, Hestrin R, Hungate BA, Koch BJ, Stone BW, Sullivan MB, Zablocki O, Trubl G, McFarlane K, Stuart R, Nuccio E, Weber P, Jiao Y, Zavarin M, Kimbrel J, Morrison K, Adhikari D, Bhattacharaya A, Nico P, Tang J, Didonato N, Paša-Tolić L, Greenlon A, Sieradzki ET, Dijkstra P, Schwartz E, Sachdeva R, Banfield J, Pett-Ridge J, Consortium LSM. Life and death in the soil microbiome: how ecological processes influence biogeochemistry. Nature Reviews Microbiology, 2022. DOI:10.1038/s41579-022-00695-z |
| [13] | Chen HH, Qin S, Lee JC, Kim CJ, Xu LH, Li WJ. Streptomyces mayteni sp. nov., a novel actinomycete isolated from a Chinese medicinal plant. Antonie Van Leeuwenhoek, 2009, 95(1): 47-53. DOI:10.1007/s10482-008-9286-3 |
| [14] | Jiang Y, Tang SK, Wiese J, Xu LH, Imhoff JF, Jiang CL. Streptomyces hainanensis sp. nov., a novel member of the genus Streptomyces. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(pt 11): 2694-2698. |
| [15] | Mo P, Zhao J, Li K, Tang X, Gao J. Streptomyces manganisoli sp. nov., a novel actinomycete isolated from manganese-contaminated soil. International Journal of Systematic and Evolutionary Microbiology, 2018, 68(6): 1890-1895. DOI:10.1099/ijsem.0.002762 |
| [16] | Kämpfer P, Huber B, Buczolits S, Thummes K, Grün-Wollny I, Busse HJ. Streptomyces specialis sp. nov. International Journal of Systematic and Evolutionary Microbiology, 2008, 11(58): 2602-2606. |
| [17] | Veyisoglu A, Sahin N. Streptomyces hoynatensis sp. nov., isolated from deep marine sediment. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(pt 3): 819-826. |
| [18] | Lechevalier MP, Bievre CD, Lechevalier H. Chemotaxonomy of aerobic Actinomycetes: phospholipid composition. Biochemical Systematics and Ecology, 1977, 5(4): 249-260. DOI:10.1016/0305-1978(77)90021-7 |
| [19] | Wayne LG. International Committee on systematic bacteriology: announcement of the report of the ad hoc Committee on Reconciliation of Approaches to bacterial systematics. Zentralblatt Fur Bakteriologie, Mikrobiologie, Und Hygiene Series A, Medical Microbiology, Infectious Diseases, Virology, Parasitology, 1988, 268(4): 433-434. DOI:10.1016/S0176-6724(88)80120-2 |
| [20] | Castillo UF, Strobel GA, Ford EJ, Hess WM, Porter H, Jensen JB, Albert H, Robison R, Condron MAM, Teplow DB, Stevens D, Yaver D. Munumbicins, wide-spectrum antibiotics produced by Streptomyces NRRL 30562, endophytic on Kennedia nigriscans. Microbiology: Reading, England, 2002, 148(pt 9): 2675-2685. |
| [21] | Igarashi Y, Ogura H, Furihata K, Oku N, Indananda C, Thamchaipenet A. Maklamicin, an antibacterial polyketide from an endophytic Micromonospora sp. Journal of Natural Products, 2011, 74(4): 670-674. |
| [22] | Suga T, Kimura T, Inahashi Y, Iwatsuki M, Nonaka K, Také A, Matsumoto A, Takahashi Y, Ōmura S, Nakashima T. Hamuramicins A and B, 22-membered macrolides, produced by an endophytic actinomycete Allostreptomyces sp. K12-0794. The Journal of Antibiotics, 2018, 71(7): 619-625. |
| [23] | Boruta T. A bioprocess perspective on the production of secondary metabolites by Streptomyces in submerged co-cultures. World Journal of Microbiology and Biotechnology, 2021, 37(10): 1-15. |
| [24] | Lacey HJ, Rutledge PJ. Recently discovered secondary metabolites from Streptomyces species. Molecules: Basel, Switzerland, 2022, 27(3): 887. |
 2022, Vol. 62
2022, Vol. 62