中国科学院微生物研究所,中国微生物学会
文章信息
- 刘冰冰, 王双雨, 申亚淇, 赵栩, 程爽, 王来友, 郭书贤, 李文均. 2022
- LIU Bingbing, WANG Shuangyu, SHEN Yaqi, ZHAO Xu, CHENG Shuang, WANG Laiyou, GUO Shuxian, LI Wenjun.
- 乌勇布拉克盐湖嗜盐古菌絮凝效果筛选及活性检测
- Flocculation effect and activity of halophilic archaea isolated from Uyong Brac salt lake
- 微生物学报, 62(11): 4095-4107
- Acta Microbiologica Sinica, 62(11): 4095-4107
-
文章历史
- 收稿日期:2022-04-03
- 修回日期:2022-07-23
- 网络出版日期:2022-08-12
2. 中山大学生命科学学院, 广东 广州 510275
2. School of Life Sciences, Sun Yat-Sen University, Guangzhou 510275, Guangdong, China
微生物絮凝剂(microbial flocculants,MBF)是由微生物或其分泌物质组成,是天然的高分子絮凝剂,微生物絮凝剂的絮凝活性高,对污水中的菌体细胞、细小颗粒或悬浮物具有吸附、凝聚、沉积和分解功能,可广泛应用于工业污水处理、饮用水处理以及工业污水下游工艺中[1−2]。微生物絮凝剂具备生物可降解和安全的特点,无毒无害、无二次污染[3]。除微生物本身可以作为絮凝剂外,微生物所产生的胞外聚合物(extracellular polymeric substances,EPS),如胞外多糖、功能蛋白和糖蛋白也具有较好的絮凝效果[3−6]。研究表明,能够产生生物絮凝剂的菌株有Bacillus sp. AEMREG7[7]、Serratia ficaria[8]、Bacillus licheniformis[9]、Rhodococcus erythropolis[10]、Chryseobacterium daeguense[11]和Bacillus subtilis IFO3335[12]等。
高盐废水主要来自于渔业以及工业污水处理过程中。高盐废水之所以难以处理,主要在于常规污水功能微生物无法抵御高盐渗透压。随着后期污水处理,污水中的盐浓度会达到5%甚至10%以上,可杀死或抑制更多活性污泥中的功能微生物,加剧后期处理难度。在处理高盐废水时,采用生物的方法相较于物理、化学的方法更加经济,但对于普通非盐生微生物,高盐严重抑制了菌株的生长[13−14]。而且高盐度或剧烈的盐度变化一般对常规生物处理工艺构成挑战,盐度对悬浮物的物理化学性质有显著影响,导致其表面电荷、疏水性、可滤性、沉降和絮凝性发生变化[15]。相比之下盐生微生物更适合用来处理高盐废水,从盐环境中筛选具有絮凝效果的微生物是解决高盐污水絮凝困扰的有效途径之一[16−17]。目前,耐盐碱微生物Bacillus sp. I-471和耐盐微生物Halomonas sp. V3a,均已被应用于高盐废水的处理工艺中,而且菌株产生的EPS被证明具有较好的絮凝作用[18−19]。在盐生微生物中,能够耐受更高盐浓度的嗜盐古菌对于处理高盐污水中的污染物具有重要的作用[20]。嗜盐古菌普遍能够产生EPS,这些聚合物具有较好的重金属吸附、苯酚清除及絮凝效果,在工业污水,尤其是高盐工业污水的处理中发挥重要作用[21−23]。
本研究从高盐微生物中筛选具有良好絮凝效果的生物材料,对其絮凝率进行检测,结合生物产量,筛选絮凝效果好的絮凝剂,进行盐度及pH稳定性检测,为工业化应用提供优质的生物絮凝剂材料。
1 材料与方法 1.1 试验材料新疆乌勇布拉克干盐湖沉积物(42°686'816" N,89°330'891" E)作为本研究的分离样品。
1.2 主要试剂和仪器本研究使用的化学试剂均为国产AR级,购自阿拉丁试剂(上海)有限公司。数显恒温摇床,苏州威尔实验用品有限公司;高速冷冻离心机,Eppendorf公司;PCR仪,Bio-Rad公司;原位冷冻干燥仪,LABCONCO公司;六联恒温磁力搅拌器,金坛区西城新瑞仪器厂;全波长紫外扫描仪,上海美普达仪器有限公司;红外光谱仪,热电公司;透射电子显微镜,日本电子株式会社。
1.3 分离培养基发酵培养基G1:可溶性淀粉20 g/L,MgSO4·7H2O 0.5 g/L,KNO3 1 g/L,K2HPO4 0.5 g/L,NaCl 150 g/L,蒸馏水1 000 mL,pH 7.2。
1.4 菌株分离沉积物经自然风干,采用稀释涂布法,选择10−3稀释浓度进行样品分离。平板倒置于37 ℃培养4−6周。选择G1固体培养基对分离菌株进行纯化。转接纯化后的菌体细胞于甘油管(30%甘油,15% NaCl),−80 ℃超低温冰箱进行保藏。
1.5 具有絮凝潜力的嗜盐古菌初筛及16S rRNA基因序列鉴定向发酵瓶中添加15 mL发酵液体培养基G1,用15%的NaCl溶液配置菌悬液(OD600=0.8−1.0),接种500 μL于发酵瓶中,37 ℃、120 r/min培养14 d。菌株发酵完成后,挑选发酵液静置3 d以上依然浑浊且摇晃之后产生较多细腻泡沫现象的菌株作为具有絮凝潜力的候选菌株。
取少许菌体加入50 μL pH 7.0 10%的Chelex-100 (默克试剂公司)溶液中。PCR仪选用程序:99 ℃,10 min;16 ℃,10 min。样品12 000 r/min离心10 min,取上清液进行PCR扩增。选用古菌通用引物20F/1452R[26]进行嗜盐古菌16S rRNA基因扩增。扩增体系:25 μL PCR Mix (2×Premix)[宝日医生物技术(北京)有限公司], 1 μL 20F引物(0.55 nmol),1 μL 1452R引物(0.50 nmol),1.5 μL DNA (10−20 ng/μL)模板,无菌水21.5 μL。PCR扩增条件为:94 ℃ 4 min;94 ℃ 1 min,56 ℃ 30 s,72 ℃ 45 s,32个循环;72 ℃ 10 min。PCR产物送生工生物工程(上海)股份有限公司进行16S rRNA基因测序。根据16S rRNA基因序列,通过EzBioCloud (http://www.ezbiocloud.net/)[27]数据库进行序列比对,对于16S rRNA基因相似性小于98.65%[28]的菌株,初步判断为潜在新物种。从NCBI数据库下载相近序列,利用MEGA 7.0[29]构建NJ (neighbour-joining)[30]、MP (maximum-parsimony)[31]、ML (maximum-likelihood)[32]系统发生树,综合分析初步判断菌株的分类地位。
1.6 菌株及生物材料絮凝效果检测因考虑工业应用及后期废水处理工艺改进等环节的便捷性,本研究采用菌株发酵液(包含菌体、菌体发酵产物等)、上清液(发酵液经5 000 r/min离心5 min后弃菌体)、菌悬液(发酵液经5 000 r/min离心5 min后弃上清液留菌体,加入同弃置上清液相同体积的15% NaCl溶液,混合均匀)、EPS(提取方法如1.7.1所示)进行相关絮凝效果检测。菌体产量选用干重法进行计算。絮凝率测定[33−34]方法修改如下。
(1) 配置5 g/L的高岭土悬液(15% NaCl):称取5 g高龄土和150 g NaCl,溶解于1 000 mL水中,磁力搅拌器上25 ℃、100 r/min充分搅拌均匀,溶液现配现用;
(2) 实验样品准备:发酵液直接从发酵摇瓶中进行取样2 mL;发酵上清液的制备:发酵液经4 ℃、5 000 r/min离心5 min,取上清液2 mL;菌悬液的制备:取2 mL发酵液于离心管中,4 ℃、5 000 r/min离心5 min,弃上清,添加2 mL的NaCl溶液,混和均匀。EPS溶液稀释浓度为2 mg/mL;
(3) 烧杯中加入93 mL配置的高岭土悬浮液、5 mL CaCl2 (1%)溶液,分别加入2 mL发酵液、上清液、菌悬液及EPS溶液;
(4) 磁力搅拌器250 r/min搅拌5 min,静置20 min;取烧杯中层液体5 mL,于550 nm处测定吸收值;
计算公式:E (%)=(A−B)/B
其中,E为絮凝率,A为空白对照,B为实验组。
1.7 菌株EPS的提取及不同盐浓度、不同pH条件下絮凝作用检测 1.7.1 EPS提取及产量计算综合上述结果,筛选菌悬液及上清液絮凝效果较好的菌株采用G1培养基进行发酵,待发酵14 d后采用透析+冷冻抽干的方法进行EPS提取。方法如下:发酵液于4 ℃、7 000 r/min条件下离心10 min,去除菌体;上清液装于透析袋(截留分子量为8 kDa,Spectra/Por®6,SPECTRUM,TX)中,置于蒸馏水体系中室温透析24 h,重复5次,去除离子、短肽等杂质。−80 ℃冷冻,−4 ℃冷冻抽干收集液,称量计算EPS发酵含量,常温保藏备用。结合全波长紫外扫描、红外光谱(FTIR)及透射电镜方法初步检测EPS的特性及形态特征。
1.7.2 EPS絮凝率计算采用1.4.3方法进行检测。
1.7.3 EPS稳定性检测结合絮凝率及产量指标,挑选最优菌株所产EPS设置不同浓度(3、2、1 mg/L)、盐度(0%、3%、5%、8%、10%、13%、15%、18%、20% NaCl) (之所以选择 < 5%的盐浓度是为了探究EPS在低盐环境中的絮凝效果,为其盐度的广谱适应性提供数据支撑)、pH (pH 3.0、5.0、6.0、7.0、8.0、9.0、11.0,15% NaCl)梯度进行相关絮凝率检测,判断EPS的稳定性。上述实验同等条件下,选用聚合氯化铝(polyaluminium chloride,PAC)作为对照实验组。
2 结果与讨论 2.1 嗜盐古菌纯培养分离及絮凝特性初筛从乌勇布拉克干盐湖沉积物中共分离到28株嗜盐古菌。分离到的嗜盐古菌发酵21 d后,筛选到16株静置3 d后发酵液依然浑浊,且上下振荡具有细腻泡沫产生的菌株,初步判断这些菌株具有一定絮凝特性,并将其作为后续絮凝效果检测的实验菌株。菌株发酵液静置形态如图 1所示,与空白对照及其他静置后澄清的发酵液相比,16株菌的发酵液依然浑浊。结合16S rRNA基因比对结果,发现这16株菌主要分布于碱线菌属(Natrinema)、盐缓长菌属(Halopiger)和盐土生菌属(Haloterrigena)。菌株16S rRNA基因测序对比信息如表 1所示,GenBank登录号为:ON394489−ON394504。

|
| 图 1 絮凝效果初筛 Figure 1 Initial screening of potential ability of flocculation. C: the blank control group of fermentation liquid; A978: the negative control group of flocculation properties of fermentation liquid by strain A978; RM-149, AT-11, A714, A699, A133, A266-1, A774, RM-2, RM-152, A829, RP-56, RP-33, A279-1, NGA0064, A389, RM-13: the positive group of flocculation properties of fermentation liquid by strains RM-149, AT-11, A714, A699, A133, A266-1, A774, RM-2, RM-152, A829, RP-56, RP-33, A279-1, NGA0064, A389 and RM-13. |
| Strain No. | GenBank accession number of the isolated strains | Closest homolog | GenBank accession number of the closest strain | Similarity/% |
| A279-1 | ON394502 | Natrinema altunense CGMCC 1.3731T | AB663460 | 97.11 |
| A389 | ON394504 | Natrinema altunense CGMCC 1.3731T | AB663460 | 97.83 |
| A774 | ON394496 | Natrinema salaciae CECT 8172T | AB935413 | 97.80 |
| A266-1 | ON394494 | Natrinema soli LMG 29247T | KY381123 | 98.09 |
| RP56 | ON394490 | Natrinema soli LMG 29247T | KY381123 | 98.51 |
| RP-33 | ON394501 | Haloterrigena salifodinae CGMCC 1.12284T | AB935410 | 98.02 |
| RM-149 | ON394499 | Haloterrigena salifodinae CGMCC 1.12284T | AB935410 | 97.88 |
| RM-152 | ON394500 | Haloterrigena salifodinae CGMCC 1.12284T | AB935410 | 97.95 |
| RM-13 | ON394492 | Haloterrigena salina CGMCC 1.6203T | AB663448 | 97.91 |
| AT-11 | ON394498 | Haloterrigena salina CGMCC 1.6203T | AB663448 | 97.97 |
| NGA0064 | ON394503 | Haloterrigena salina CGMCC 1.6203T | AB663448 | 95.77 |
| A829 | ON394489 | Haloterrigena turkmenica DSM 5511T | AB004878 | 98.86 |
| A714 | ON394495 | Haloterrigena turkmenica DSM 5511T | AB004878 | 98.66 |
| RM-2 | ON394497 | Haloterrigena turkmenica DSM 5511T | AB004878 | 99.16 |
| A699 | ON394491 | Haloterrigena turkmenica DSM 5511T | AB004878 | 98.94 |
| A133 | ON394493 | Halopiger xanaduensis CGMCC 1.6379T | AB477974 | 98.58 |
2.2 絮凝特性初筛菌株16S rRNA基因系统发生树分析
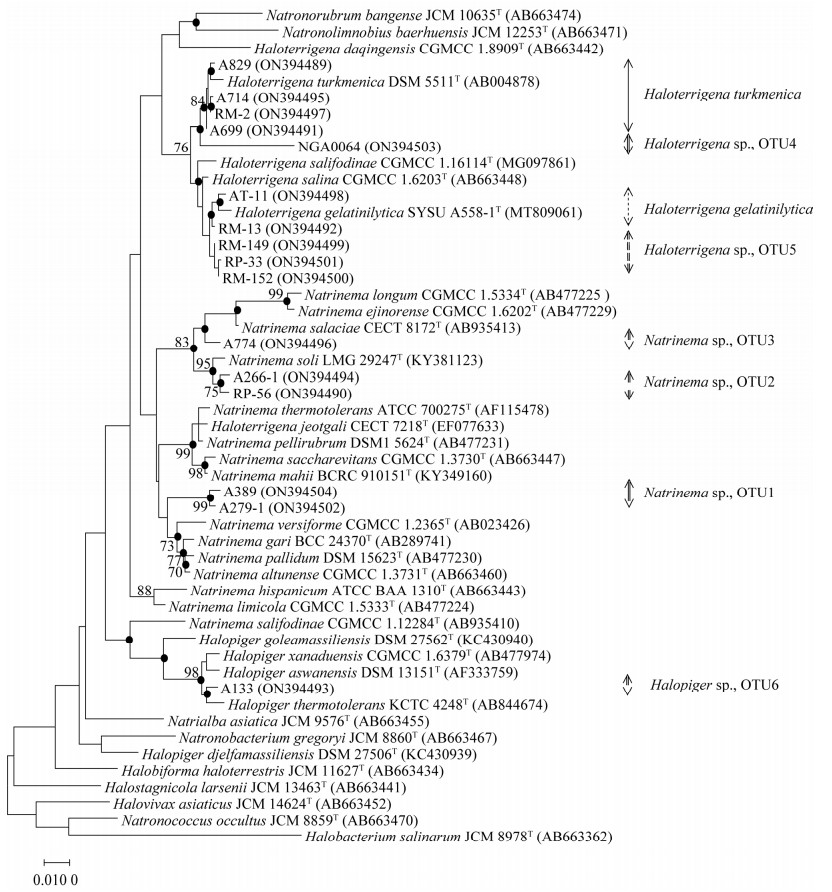
16株具有絮凝特性的初筛菌株的系统发生树如图 2所示。结合基于16S rRNA基因相似性对于新物种的判断依据[28],菌株A266-1和RP-56与最相似菌株Natrinema soli LMG 29247T的16S rRNA基因相似性为98.09%−98.51%,在16S rRNA基因系统发生树中,菌株A266-1和RP-56共同聚在一个分支上,两者的16S rRNA基因相似性为99.21%,组成Natrinema属的一个潜在新种分类单元(Natrinema sp.,OTU1)。菌株A389和A279-1与最相似菌株Natrinema altunense CGMCC 1.3731T的16S rRNA基因相似性为97.11%−97.83%,两者的16S rRNA基因相似性为99.21%,共同组成Natrinema属的一个潜在新种分类单元(Natrinema sp.,OTU2)。菌株A774与最相似菌株Natrinema salaciae CECT 8172T的16S rRNA基因相似性为97.80%,推断其为Natrinema属的潜在新种分类单元(Nnm. sp.,OTU3)。菌株NGA 0064与最相似菌株Haloterrigena salina CGMCC 1.6203T的16S rRNA基因相似性为95.77%,在系统发生树中的Haloterrigena属内单独成支,推断其为Haloterrigena属的潜在新种分类单元(Haloterrigena sp.,OTU4)。菌株RP-33、RM-149、RM-152与最相似菌株Haloterrigena salifodinae的16S rRNA基因相似性为97.88%−98.02%,三者在系统生发树中聚在一个分支上,推测可能代表Haloterrigena属的潜在新种分类单元(Haloterrigena sp.,OTU5)。菌株A133与Halopiger xanaduensis CGMCC 1.6379T的16S rRNA基因相似性为98.58%,推测其为Halopiger属的潜在新种分类单元(Halopiger sp.,OTU6)。菌株A829、A714、RM-2和A699为Haloterrigena turkmenica DSM 5511T种内的不同菌株。菌株AT-11和RM-13为Haloterrigena gelatinilytica SYSU A558-1T种内的不同菌株。
|
| 图 2 具有潜在絮凝效果的嗜盐古菌16S rRNA基因系统发生ML树 Figure 2 Maximum-likelihood phylogenetic tree based on 16S rRNA gene sequences of halophilic archaea with potential flocculation effect. Numbers at nodes indicate levels of bootstrap support based on a maximum-likelihood analysis of 1 000 resampled datasets, only values > 70% were given. Full circles indicate branches that also were recovered in the neighbour-joining, maximum-parsimony and maximum-likelihood trees. Bars: 1 substitution per 1 000 nucleotide positions; OTU: operational taxonomic unit. |
2.3 不同生物材料絮凝效果分析
待测嗜盐古菌发酵液、发酵上清液、菌悬液及EPS的絮凝率如表 2所示。由于菌株及分泌特性的不同,导致不同生物样品的絮凝率有一定差异。本研究中絮凝率较好的生物材料多集中于Haloterrigena属和Natrinema属,尤其是Natrinema sp. (OTU1)和Haloterrigena sp. (OTU5) 2个潜在新种分类单元。
| Strain No. | Species | Genus | Flocculation rate of fermentation liquid/% | Flocculation rate of supernatant/% | Flocculation rate of cell supernatant/% | Flocculation rate of EPS/% | |
| 0% NaCl | 15% NaCl | ||||||
| AT-11 | Haloterrigena gelatinilytica | Haloterrigena | 40.92±11.17 | 45.65±11.51 | 81.25±3.07 | 79.58±0.44 | NT |
| RM-13 | 47.34±1.60 | 55.68±0.23 | 88.22±0.55 | 80.34±0.50 | 74.38±0.97 | ||
| RM-149 | Haloterrigena sp., OTU5 | 41.39±7.26 | 53.96±6.67 | 85.66±1.90 | 87.64±0.69 | NT | |
| RP-33 | 61.06±2.31 | 67.92±0.54 | 88.64±0.60 | 74.32±1.03 | 31.85±3.74 | ||
| RM-152 | 59.81±1.45 | 62.45±0.69 | 83.30±0.36 | 88.27±0.98 | 89.86±0.70 | ||
| NGA0064 | Haloterrigena sp., OTU4 | 54.95±0.29 | 53.91±1.05 | 85.83±0.17 | 87.44±0.38 | NT | |
| A829 | Haloterrigena turkmenica | 49.87±1.39 | 60.90±0.49 | 80.81±0.25 | 72.01±0.32 | 62.04±0.72 | |
| A714 | 17.05±0.89 | 12.49±4.59 | 82.22±0.89 | 59.35±2.34 | NT | ||
| RM-2 | 32.56±1.17 | 11.45±1.07 | 81.04±0.61 | 78.59±1.19 | NT | ||
| A699 | 28.75±6.42 | 27.94±5.14 | 81.70±1.51 | 81.45±0.82 | NT | ||
| A774 | Natrinema sp., OTU3 | Natrinema | 58.01±4.34 | 48.51±3.12 | 83.51±0.76 | 74.76±1.30 | NT |
| A266-1 | Natrinema sp., OTU2 | 32.13±3.41 | 34.42±1.17 | 88.15±0.24 | 83.10±2.44 | NT | |
| RP-56 | 30.04±0.98 | 30.98±2.67 | 88.47±0.33 | 86.23±0.15 | NT | ||
| A389 | Natrinema sp., OTU1 | 66.19±3.15 | 59.04±1.57 | 80.26±0.60 | 89.44±0.29 | 81.53±0.39 | |
| A279-1 | 57.82±3.06 | 65.70±2.98 | 72.69±0.52 | 84.92±1.06 | 66.58±2.14 | ||
| A133 | Halopiger sp., OTU6 | Halopiger | 56.66±0.48 | 60.22±2.35 | 78.62±0.78 | 82.50±0.73 | 47.61±2.59 |
| NT: not test. | |||||||
2.3.1 嗜盐古菌发酵液絮凝效果
16株待测菌株的发酵液的絮凝率为17.05%−66.19%,其中菌株A279-1、A133、A829、RP33、NGA0064、RM-152、A774、A389发酵液的絮凝率接近50%或达到50%以上,分别为57.82%、56.66%、49.87%、61.06%、54.95%、59.81%、58.01%、66.19%。菌株A389的发酵液的絮凝率最高(66.19%),其次是A133菌株发酵液(61.06%),两者絮凝率菌均达60%以上。发酵液中包含了菌体细胞及上清液,但是其絮凝率并没有比发酵上清液或者菌悬液高,主要原因在于培养基中的一些成分可能已经形成了絮凝团,因此对于絮凝检测造成影响,使得絮凝剂的絮凝率降低。
2.3.2 嗜盐古菌发酵上清液絮凝效果16株待测菌株的上清液絮凝率范围为11.45%−67.92%,其中菌株RM-149、A279-1、A133、A829、RP33、RM-13、NGA0064、RM-152、A389发酵液的絮凝率达到50%以上,分别为53.96%、65.70%、60.22%、60.90%、67.92%、55.68%、53.91%、62.45%、59.04%。菌株RP-33发酵上清液的絮凝率最高(67.92%),其次是菌株A279-1的发酵上清液(65.70%)。发酵上清液中包含有细胞分泌到胞外的一些成分可能与培养基的成分形成絮凝团,对后续絮凝检测造成影响。所以与后续的EPS的絮凝效果进行比较,发酵上清液的絮凝率较低;也可能是由于相同体积的待测样品,发酵上清液的胞外分泌物浓度太低引起的。
2.3.3 嗜盐古菌菌悬液絮凝效果考虑到嗜盐古菌的高渗适应性,在低渗溶液中菌体会发生自溶现象。在菌体絮凝检测中,分别选用了在0% NaCl和15% NaCl的盐水配制菌悬液,研究其絮凝效果。
(1) 0% NaCl溶液下菌株形态
大多数嗜盐古菌在0% NaCl条件下细胞会自溶,但是部分菌属能够耐受一定的低渗环境,表现出菌体不发生自溶的特性。待测菌株悬浮于0% NaCl溶液中,12、24、48 h显微观察,发现待测菌株RP-33、RP-56、RM-13、A266-1会有一定程度的自溶现象,但不明显。其他菌株均表现出低渗(0% NaCl)条件下的稳定性。若胞内内含物溢出,会在一定程度上增加絮凝效果。
(2) 0%、15% NaCl的菌悬液絮凝结果
0% NaCl溶液菌悬液的絮凝率除A279-1最小,为72.69%;其次是A133,为78.62%;其他均达到80%以上。其中菌株RP-33、RP-56、RM-13、A266-1菌悬液较高,絮凝率分别为88.64%、88.47%、88.22%、88.15%。对于0% NaCl条件下有自溶特性的菌株(RP-33、RP-56、RM-13、A266-1),其15% NaCl溶液菌悬液相较于0% NaCl的菌悬液,絮凝率有一定程度降低;其中菌株RM-13的菌悬液絮凝率达80.34%;其次是RM-2 (78.59%)。对于0% NaCl条件下破裂现象不明显的菌株(A699、RM-149、RM-152、A774),除A699差异不大之外,其他菌株的15% NaCl菌悬液的絮凝效果均优于0% NaCl菌悬液。其中菌株RM-152的絮凝率最高,为88.27%;其次是RM-149 (87.64%)。15% NaCl菌悬液絮凝效果明显提升的菌株,可能是菌体表面结合的EPS在低渗条件下帮助细胞免受低渗影响,且在高渗情况下,其功能作用能够更好发挥。综合比较,相较于发酵液及发酵上清液的絮凝率,菌悬液的絮凝效果更好,主要原因在于除菌体细胞具有絮凝吸附作用之外,菌体周边包裹的EPS增强了絮凝效果。在后续研究中,我们将结合微生物絮凝剂产量及作用效果,综合筛选优质的微生物絮凝剂材料。
2.3.4 嗜盐古菌EPS絮凝效果挑选发酵液、发酵上清液絮凝效果较好的菌株A279-1、A133、A829、RP-33、RM-13、RM152、A389进行EPS絮凝效果检测。经全波长紫外扫描检测发现在260−280 nm处有吸收峰,说明EPS中含有蛋白类物质。FTIR分析(图 3)初步判断,7株菌的EPS在3 400− 3 740 cm−1处的宽缓峰以及1 640 cm−1附近的吸收峰分别为-OH的伸缩振动峰及弯曲峰。综合全波长紫外扫描结果,初步判断7株菌的EPS是胞外糖蛋白类物质。部分菌株产胞外聚合物透射电镜形态如图 4所示,细胞表面及周边分泌有大量的颗粒状或团絮状分泌物。7株菌所产EPS (2 mg/mL)的絮凝率分别为66.58%、47.61%、62.04%、31.85%、74.38%、89.86%、81.53%,其中RM152、A389菌株所产的EPS的絮凝效果最佳,分别达到89.86%和81.53%。

|
| 图 3 嗜盐古菌菌株所产EPS的FTIR图谱 Figure 3 FTIR spectra of EPS produced by halophilic archaea strains. |

|
| 图 4 菌株及所产EPS透射电镜形态 Figure 4 Transmission electron microscopy morphology of strains and their EPS. |
2.3.5 嗜盐古菌EPS絮凝稳定特性
(1) EPS发酵产量
干重法称量EPS,菌株A279-1、A133、A829、RP-33、RM-13、RM152、A389的EPS发酵产量分别为1.92、10.66、3.23、2.18、2.29、2.51、12.28 g/L。同时测定了相对应的菌体的发酵产量,分别为4.45、6.867、4.55、6.68、4.51、4.01、6.09 g/L。对比菌体发酵产量,以及考虑到代谢产物在后期应用开发中相较于菌体其稳定性及可操作性方面具有优势;同时比较7株菌的EPS的絮凝率及发酵产量,选用菌株A389的EPS进行后续的絮凝稳定性检测。
(2) EPS盐度稳定性
由于在高盐废水中,盐度是最关键的限制性因子,且不同类型高盐废水及处理不同工艺阶段会有盐浓度波动的现象,本研究分别检测了0%−20% NaCl梯度下菌株A389所产EPS的絮凝效果。菌株A389所产EPS在15% NaCl溶液中,1、2、3 mg/mL三个浓度的絮凝率分别为80.57%、81.53%、79.07%,其中2 mg/mL浓度的絮凝效果最好。后续采用2 mg/mL浓度的EPS进行0%、3%、5%、8%、10%、13%、15%、18%、20% NaCl溶液中的絮凝效果检测,其絮凝率分别为83.95%、83.19%、85.26%、85.27%、85.95%、80.91%、81.79%、81.11%、80.64%,具有极显著差异(P < 0.001)。菌株A389所产EPS的絮凝作用具有广谱的盐度适应性,在0%−20%的NaCl盐度范围内其絮凝率均能达到80%以上。PAC化学絮凝剂在高盐条件下其絮凝效果明显下降,在10% NaCl条件下,PAC的絮凝率下降到20.82%,且在15%以上NaCl溶液中其絮凝率下降至11%以下。
(3) EPS的pH稳定性
菌株A389所产EPS在pH 3.0、5.0、6.0、7.0、8.0、9.0、11.0条件下的絮凝率分别为69.87%、76.82%、75.68%、79.39%、73.80%、68.02%、36.89%,具有极显著差异(P < 0.001)。嗜盐古菌A389所产EPS在酸性、中性及碱性条件下具有絮凝效果,能够维持在68%−80%的絮凝率,酸性及中性条件下絮凝效果优于PAC,但是在碱性条件下絮凝效果弱于PAC。对照组PAC在中性、碱性条件下具有絮凝效果,且絮凝率维持在41%−93%之间,碱性条件下其絮凝率明显增加,但是在酸性条件下,其絮凝效果下降明显,pH 3.0时几乎为0,pH 5.0时只有4.56%。
据报道,嗜盐古菌菌株Halogeometricum borinquense菌株A52所产生的一种新型杂多糖蛋白,在较广的盐浓度范围内仍然维持较高的絮凝率,最高达93%;能够在pH 3.0−10.0条件下维持80%−90%的絮凝率[35]。结合本研究结果,我们推断嗜盐古菌部分菌株所产生的EPS具有较好的絮凝效果,且普遍具有广泛的盐度和pH适应性。综合分析,菌株A389所产EPS的絮凝效果稳定,与化学絮凝剂PAC相比具有广谱的盐度及pH的适应性,更适用于处理高盐工业废水的工艺。对于后期工业应用具有重要的发展前景。高盐废水的盐度范围多集中在5% NaCl以上,pH范围在3.0−9.0之间。在工业废水处理的不同阶段,盐度可能有较大的变化,也会伴随pH的波动,对于絮凝剂稳定性的要求极为苛刻。尤其是能够处理10%以上的盐浓度的生物材料的研发,成为制约高盐工业废水处理的最大瓶颈。盐生微生物虽然能够耐受较高的盐浓度,但是对于低渗条件,菌体的稳定性及成活率会受到影响,所以寻找稳定且高效絮凝作用的微生物絮凝剂,是高盐工业废水处理非常好的选择。本研究筛选到菌株A389所产生的EPS具有较好的絮凝效果,且具有广谱的盐度及pH的适应范围,为后续高盐工业废水处理提供良好的研究材料。
3 结论本研究从乌勇布拉克盐湖中筛选到能够产生絮凝作用的嗜盐古菌资源。菌株的发酵液、发酵上清液、菌悬液以及EPS的絮凝效果的检测结果表明,嗜盐古菌具有较好的絮凝开发潜力,尤其在高盐条件下维持较好絮凝效果方面具有优势。菌株不仅在高盐条件下絮凝效果较好,而且在一定程度上能够耐受一定的低渗环境,甚至在低渗条件下其絮凝效果有所增加。这对于突破高盐对菌株的限制以及在处理不同浓度的高盐废水应用方面提供了良好的菌种资源。同时结合工业应用后期工艺改进的需要,选用菌株代谢产物会更有利于材料的回收及改造,菌株A389所产的EPS在产量及絮凝效果方面具有优势,且其对于盐度、pH具有广谱稳定性。在工业应用上,EPS常温保存,既可直接作为生物絮凝剂,也可包埋化处理从而进行相关固定化工艺处理。结合菌体及菌株产EPS的絮凝效果,后续采用底盘细胞改造将会是更好的开发思路,可以利用菌体细胞分解代谢污水中的有机物产生EPS,再进一步进行絮凝处理。因此,嗜盐古菌及其EPS具有良好的絮凝效果,在高盐废水的处理过程中具有巨大作用潜力;本研究为攻克高盐废水处理瓶颈问题提供新的研究思路。
| [1] | Menkhaus TJ, Anderson J, Lane S, Waddell E. Polyelectrolyte flocculation of grain stillage for improved clarification and water recovery within bioethanol production facilities. Bioresource Technology, 2010, 101(7): 2280-2286. DOI:10.1016/j.biortech.2009.11.017 |
| [2] | Qiu ZM, Jiang WT, He ZJ. Post-treatment of banknote printing wastewater using polysilicate ferro-aluminum sulfate (PSFA). Journal of Hazardous Materials, 2009, 166(2/3): 740-745. |
| [3] | Kurniawan SB, Abdullah SRS, Imron MF, Said NSM, Ismail N, Hasan HA, Othman AR, Purwanti IF. Challenges and opportunities of biocoagulant/bioflocculant application for drinking water and wastewater treatment and its potential for sludge recovery. International Journal of Environmental Research and Public Health, 2020, 17(24): 9312. DOI:10.3390/ijerph17249312 |
| [4] | Tian XM, Shen ZQ, Han ZF, Zhou YX. The effect of extracellular polymeric substances on exogenous highly toxic compounds in biological wastewater treatment: an overview. Bioresource Technology Reports, 2019, 5: 28-42. DOI:10.1016/j.biteb.2018.11.009 |
| [5] | Sam S, Kucukasik F, Yenigun O, Nicolaus B, Oner ET, Yukselen MA. Flocculating performances of exopolysaccharides produced by a halophilic bacterial strain cultivated on agro-industrial waste. Bioresource Technology, 2011, 102(2): 1788-1794. DOI:10.1016/j.biortech.2010.09.020 |
| [6] | Al-Wasify RS, Al-Sayed AA, Saleh SM, Aboelwafa AM. Bacterial exopolysaccharides as new natural coagulants for surface water treatment. International Journal PharmTech Research, 2015, 8(9): 198-207. |
| [7] | Okaiyeto K, Nwodo UU, Mabinya LV, Okoli AS, Okoh AI. Characterization of a bioflocculant (MBF-UFH) produced by Bacillus sp. AEMREG7. International Journal of Molecular Sciences, 2015, 16(6): 12986-13003. |
| [8] | Gong WX, Wang SG, Sun XF, Liu XW, Yue QY, Gao BY. Bioflocculant production by culture of Serratia ficaria and its application in wastewater treatment. Bioresource Technology, 2008, 99(11): 4668-4674. DOI:10.1016/j.biortech.2007.09.077 |
| [9] | Li Z, Zhong S, Lei HY, Chen RW, Yu Q, Li HL. Production of a novel bioflocculant by Bacillus licheniformis X14 and its application to low temperature drinking water treatment. Bioresource Technology, 2009, 100(14): 3650-3656. DOI:10.1016/j.biortech.2009.02.029 |
| [10] | Chang WN, Liu CW, Liu HS. Hydrophobic cell surface and bioflocculation behavior of Rhodococcus erythropolis. Process Biochemistry, 2009, 44(9): 955-962. DOI:10.1016/j.procbio.2009.04.014 |
| [11] | Liu WJ, Wang K, Li BZ, Yuan HL, Yang JS. Production and characterization of an intracellular bioflocculant by Chryseobacterium daeguense W6 cultured in low nutrition medium. Bioresource Technology, 2010, 101(3): 1044-1048. DOI:10.1016/j.biortech.2009.08.108 |
| [12] | Yokoi H, Arima T, Hirose J, Hayashi S, Takasaki Y. Flocculation properties of poly (γ-glutamic acid) produced by Bacillus subtilis. Journal of Fermentation and Bioengineering, 1996, 82(1): 84-87. DOI:10.1016/0922-338X(96)89461-X |
| [13] | Ching YC, Redzwan G. Biological treatment of fish processing saline wastewater for reuse as liquid fertilizer. Sustainability, 2017, 9(7): 1062. DOI:10.3390/su9071062 |
| [14] | Li J, Yu L, Yu DS, Wang D, Zhang PY, Ji ZG. Performance and granulation in an upflow anaerobic sludge blanket (UASB) reactor treating saline sulfate wastewater. Biodegradation, 2014, 25(1): 127-136. DOI:10.1007/s10532-013-9645-2 |
| [15] | Reid E, Liu XR, Judd SJ. Effect of high salinity on activated sludge characteristics and membrane permeability in an immersed membrane bioreactor. Journal of Membrane Science, 2006, 283(1−2): 164-171. |
| [16] | Maheshwari DK, Saraf M. Halophiles. Cham: Springer International Publishing, 2015. |
| [17] | Akapo CSO. Production and characterisation of bioflocculant produced by bacterial isolates from Richards Bay Harbour, Kwazulu Natal. University of Zululand Doctoral Dissertation, 2019. |
| [18] | Kumar CG, Joo HS, Kavali R, Choi JW, Chang CS. Characterization of an extracellular biopolymer flocculant from a haloalkalophilic Bacillus isolate. World Journal of Microbiology and Biotechnology, 2004, 20(8): 837-843. DOI:10.1007/s11274-004-9008-6 |
| [19] | He J, Zhen QW, Qiu N, Liu ZD, Wang BJ, Shao ZZ, Yu ZN. Medium optimization for the production of a novel bioflocculant from Halomonas sp. V3a' using response surface methodology. Bioresource Technology, 2009, 100(23): 5922-5927. DOI:10.1016/j.biortech.2009.06.087 |
| [20] | Li J, Gao YY, Dong HY, Sheng GP. Haloarchaea, excellent candidates for removing pollutants from hypersaline wastewater. Trends in Biotechnology, 2022, 40(2): 226-239. DOI:10.1016/j.tibtech.2021.06.006 |
| [21] | Wei LL, Li Y, Noguera DR, Zhao NB, Song Y, Ding J, Zhao QL, Cui FY. Adsorption of Cu2+ and Zn2+ by extracellular polymeric substances (EPS) in different sludges: effect of EPS fractional polarity on binding mechanism. Journal of Hazardous Materials, 2017, 321: 473-483. DOI:10.1016/j.jhazmat.2016.05.016 |
| [22] | Liu BB, Govindan R, Muthuchamy M, Cheng S, Li XB, Ye LJ, Wang LY, Guo SX, Li WJ, Alharbi NS, M Khaled J, Kadaikunnan S. Halophilic Archaea and their extracellular polymeric compounds in the treatment of high salt wastewater containing phenol. Chemosphere, 2022, 294: 133732. DOI:10.1016/j.chemosphere.2022.133732 |
| [23] | Shi YH, Huang JH, Zeng GM, Gu YL, Chen YN, Hu Y, Tang B, Zhou JX, Yang Y, Shi LX. Exploiting extracellular polymeric substances (EPS) controlling strategies for performance enhancement of biological wastewater treatments: an overview. Chemosphere, 2017, 180: 396-411. DOI:10.1016/j.chemosphere.2017.04.042 |
| [24] | Liu BB, Rao MPN, Yin XQ, Li X, Salam N, Zhang Y, Alkhalifah DHM, Hozzein WN, Li WJ. Description of Halegenticoccus soli gen. nov., sp. nov., a halophilic archaeon isolated from a soil sample of Ebi Lake. Extremophiles: Life Under Extreme Conditions, 2019, 23(5): 521-528. DOI:10.1007/s00792-019-01104-9 |
| [25] | Tang SK, Tian XP, Zhi XY, Cai M, Wu JY, Yang LL, Xu LH, Li WJ. Haloactinospora alba gen. nov., sp. nov., a halophilic filamentous actinomycete of the family Nocardiopsaceae. International Journal of Systematic and Evolutionary Microbiology, 2008, 58(9): 2075-2080. DOI:10.1099/ijs.0.65531-0 |
| [26] | Yang XY, Yin XM, Hou J, Zhu L, Cui HL. Halosimplex halophilum sp. nov. and Halosimplex salinum sp. nov., isolated from saline soil and a salt mine. International Journal of Systematic and Evolutionary Microbiology, 2021, 71(4): 004775. |
| [27] | Yoon SH, Ha SM, Kwon S, Lim J, Kim Y, Seo H, Chun J. Introducing EzBioCloud: a taxonomically united database of 16S rRNA gene sequences and whole-genome assemblies. International Journal of Systematic and Evolutionary Microbiology, 2017, 67(5): 1613-1617. DOI:10.1099/ijsem.0.001755 |
| [28] | Kim M, Oh HS, Park SC, Chun J. Towards a taxonomic coherence between average nucleotide identity and 16S rRNA gene sequence similarity for species demarcation of prokaryotes. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(Pt 2): 346-351. |
| [29] | Kumar S, Stecher G, Tamura K. MEGA7: molecular evolutionary genetics analysis version 7.0 for bigger datasets. Molecular Biology and Evolution, 2016, 33(7): 1870-1874. DOI:10.1093/molbev/msw054 |
| [30] | Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees. Molecular Biology and Evolution, 1987, 4(4): 406-425. |
| [31] | Fitch WM. Toward defining the course of evolution: minimum change for a specific tree topology. Systematic Biology, 1971, 20(4): 406-416. DOI:10.1093/sysbio/20.4.406 |
| [32] | Felsenstein J. Evolutionary trees from DNA sequences: a maximum likelihood approach. Journal of Molecular Evolution, 1981, 17(6): 368-376. DOI:10.1007/BF01734359 |
| [33] | Kurane R, Hatamochi K, Kakuno T, Kiyohara M, Hirano M, Taniguchi Y. Production of a bioflocculant by Rhodococcus erythropolis S-1 grown on alcohols. Bioscience, Biotechnology, and Biochemistry, 1994, 58(2): 428-429. DOI:10.1271/bbb.58.428 |
| [34] | 王坤. 微生物絮凝剂产生菌的筛选及其絮凝性的研究. 齐鲁工业大学硕士学位论文, 2015. |
| [35] | Chouchane H, Najjari A, Neifar M, Cherif H, Askri R, Naili F, Ouzari HI, Cherif A. Unravelling the characteristics of a heteropolysaccharide-protein from an Haloarchaeal strain with flocculation effectiveness in heavy metals and dyes removal. Environmental Technology, 2020, 41(17): 2180-2195. DOI:10.1080/09593330.2018.1556742 |
 2022, Vol. 62
2022, Vol. 62