中国科学院微生物研究所,中国微生物学会
文章信息
- 高如玥, 谭新, 马迎飞, 余加林. 2022
- GAO Ruyue, TAN Xin, MA Yingfei, YU Jialin.
- 噬菌体治疗小鼠肺部铜绿假单胞菌感染的研究
- Phage therapy for the mouse pulmonary infection caused by Pseudomonas aeruginosa
- 微生物学报, 62(10): 3971-3980
- Acta Microbiologica Sinica, 62(10): 3971-3980
-
文章历史
- 收稿日期:2022-02-24
- 修回日期:2022-03-28
- 网络出版日期:2022-05-12
2. 中国科学院深圳先进技术研究院, 深圳合成生物学创新研究院, 中国科学院定量工程生物学重点实验室, 广东 深圳 518055;
3. 中国科学院深圳理工大学(筹), 合成生物学院, 广东 深圳 518055
2. CAS Key Laboratory of Quantitative Engineering Biology, Shenzhen Institute of Synthetic Biology, Shenzhen Institute of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, Guangdong, China;
3. Institute of Synthetic Biology, Shenzhen Institute of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, Guangdong, China
铜绿假单胞菌(Pseudomonas aeruginosa,PA)是目前医院内获得性感染最常见的病原菌之一,易引起肺部感染,且其导致的肺部感染常具有持续时间长、治愈率低、致死率高的特点[1‒2]。临床上由于铜绿假单胞菌的耐药现象相当普遍,治疗效果通常并不理想,目前许多常用的抗生素已经无法抑制多重耐药铜绿假单胞菌的生长繁殖[3‒5]。根据中国细菌耐药监测网的数据统计,从中国三级医院临床分离的铜绿假单胞菌对美罗培南类抗生素产生抗性的菌株占23.5%,位居对该抗生素耐药细菌排名中第二;而对亚胺培南类抗生素产生抗性的比例为27.5%,位居第三[6‒7]。因此寻找新型抗菌药物及治疗方式格外重要,而近年来噬菌体疗法再次受到重视,有望成为临床防治耐药菌感染的有效手段之一[8]。
噬菌体是特异性感染细菌的病毒,也是地球上数量最多的微生物[9],能专一性地入侵并破坏宿主细菌,在宿主细菌内完成复制和自我增殖,进而达到抵抗细菌的目的,具有替代抗生素治疗感染的潜力。早在1917年加拿大微生物学家D’Herelle首次提出并使用噬菌体疗法,1936年Morrison和Gardner首次运用噬菌体治疗因芽胞杆菌引起的肺病[10]。然而由于过去人们对噬菌体微生物学特性认识不完整、实验设计不完善、抗生素问世等因素[11],噬菌体疗法并未得到认可。随着耐药菌越来越普遍、细菌耐药性产生速度远超抗生素研制的速度,噬菌体疗法再度进入了人们的视野。2009年,曾有研究使用噬菌体治疗铜绿假单胞菌引起的慢性中耳炎,并有效地降低了患者的细菌负荷。对比单一噬菌体治疗,有研究显示通过建立肺炎克雷伯菌感染小鼠模型,5种噬菌体联合使用较单一噬菌体更能有效对抗多重耐药菌感染[12]。同时近期一篇报道显示,一位15岁的囊性纤维化患者并发严重脓肿分枝杆菌感染,接受3种噬菌体鸡尾酒制剂治疗后,临床症状得到了极大的改善[13]。
因此,为解决铜绿假单胞菌耐药建立可行性依据,夯实未来噬菌体药物应用于临床治疗多重耐药菌的基础,探讨多种噬菌体联合应用的对抗作用,本研究选取了4株铜绿假单胞菌噬菌体制成鸡尾酒制剂,经气管灌注铜绿假单胞菌悬液的方式建立小鼠肺部感染模型,待感染后分别使用滴鼻与腹腔注射的给药方式给予小鼠噬菌体鸡尾酒制剂治疗并建立对照组。通过细菌学、病理学指标与炎症因子水平等检查,对噬菌体鸡尾酒制剂治疗小鼠肺部铜绿假单胞菌感染模型进行疗效的评价。
1 材料与方法 1.1 菌株铜绿假单胞菌标准菌株PAO1,由中国科学院深圳先进技术研究院合成所微生物组学研究中心马迎飞教授课题组提供。
1.2 实验动物40只无特定病原体(special pathogen free,SPF)级别BALB/c小鼠,雄性,6–8周龄,体重为18–22 g,由广东维通利华实验动物技术有限公司提供。动物实验通过香港理工大学实验动物伦理审查委员会审批(本单位无满足实验条件的ABSL-II级动物实验室,该实验在有资质的外单位开展),符合动物伦理和动物福利要求。
1.3 主要试剂耗材LB琼脂培养基(Sigma-Aldrich)、LB液体培养基(Sigma-Aldrich)、异氟烷(RWD)、4%多聚甲醛(Solarbio)、无菌磷酸缓冲盐溶液(Gibco)、SM缓冲液(Sangon Biotech)、氯化铯(Macklin)、内毒素检测鲎试剂盒(Bioendo)。
1.4 主要设备恒温摇晃培养箱(上海一恒)、生化培养箱(上海一恒)、超速离心机(HiMAC)、组织匀浆机(上海净信)、电子分析天平(岛津)、全自动高压灭菌锅(上海博迅)、动物呼吸麻醉机(RWD)。
1.5 实验分组将40只6–8周龄的SPF级别BALB/c小鼠,随机分为滴鼻治疗组、腹腔注射治疗组、滴鼻对照组和腹腔注射对照组,每组各10只;小鼠置于ABSL Ⅲ级动物房内,分笼饲养,自由取食。
1.6 菌株准备将PAO1接种至LB琼脂培养基中,于生化培养箱中37 ℃培养24 h可见菌落生长。挑取培养基上单菌落,置于4 mL LB液体培养基中,于恒温振荡培养箱中(220 r/min、37 ℃)振荡过夜,获得富集PA菌液。将富集的PA菌液取100 μL加入4 mL LB液体培养基中,待2–3 h生长至对数期后,用LB液体培养基将细菌浓度调整至所需的2×108 CFU/mL即为所需的铜绿假单胞菌悬液。
1.7 噬菌体分离采集污水,8 000 r/min离心10 min后取得污水上清液。取4 mL污水上清液,加入2 mL 3倍LB broth,以及200 μL过夜生长的宿主菌液。培养6–8 h后,将混合培养液12 000 r/min离心3 min。离心后取5 μL混合物上清液,滴于LB琼脂培养基上,置于恒温培养箱内,37 ℃培养4–6 h。若培养后可见明显噬菌斑,则使用0.22 μm过滤膜过滤菌液混合物,将该溶液再次接种于含有宿主菌的LB琼脂培养基上,放置于恒温培养箱内37 ℃培养4–6 h,挑选单个噬菌斑,并反复接种3次,最终4 ℃保存所得到的噬菌体。研究中选取了4株本实验室前期分离得到的具有较强抑菌能力且靶向不同宿主受体蛋白的铜绿假单胞菌噬菌体。
1.8 噬菌体制备挑取铜绿假单胞菌单菌落,过夜37 ℃培养宿主菌。按照1:20稀释隔夜培养菌液,恒温振荡培养箱37 ℃、220 r/min培养2 h后,按照噬菌体与铜绿假单胞菌的比值为1:100加入噬菌体,待细菌裂解完全后,12 000 r/min离心3 min,使用0.22 μm滤膜过滤。加入MgCl2,使用15 mL 100 kDa超滤管浓缩噬菌体,3 000 r/min离心3–5 min。加入10 mL SM缓冲液,3 000 r/min离心3–5 min。反复吹打浓缩液,然后吸出浓缩噬菌体,4 ℃保存。以此类推,扩增Pa3、39、47、55噬菌体。得到足量噬菌体浓缩液后,进一步通过氯化铯梯度离心进行噬菌体纯化。将20 mL噬菌体样品加入离心管,离心管内底部为1.7 g/L的CsCl,中部为1.5 g/L的CsCl,上部为1.3 g/L的CsCl;构建浓度梯度时,先加20 mL噬菌体浓缩液,随后在巴斯德吸管中吸入4 mL 1.3 g/L CsCl溶液,将其头部触碰到离心管底部,缓慢注入,可见明显的液面分层;随后在离心管底部注入4 mL 1.5 g/L CsCl溶液,最后离心管底部注入4 mL 1.7 g/L CsCl溶液。使用HiMAC超速离心机离心2 h (4 ℃、24 000 r/min)。离心完成后,在1.3 g/L与1.5 g/L之间可见一层白褐色分层,此为纯化后的噬菌体,用注射器针头在噬菌体平面以下2 mm左右的位置进针抽吸出所有白褐色液体,一个离心管可抽吸出约3 mL。使用噬菌体保存缓冲液(SM buffer)透析(采用20 kDa的透析膜),去除噬菌体样品中的氯化铯,每次使用5 L,每隔4 h更换1次透析液,至少透析3次,最终得到高纯度噬菌体。纯化噬菌体后使用内毒素检测鲎试剂盒检测噬菌体内毒素含量。
1.9 动物模型制备将小鼠固定在无菌手术台上,予以异氟烷呼吸麻醉后,于小鼠喉部正中处行气管切开,用微量注射针吸取2×108 CFU/mL的PAO1悬液50 μL,从气管注入肺内,以致小鼠肺部感染。注射完后,使用丝线缝合切口。
1.10 治疗肺部感染模型待完成小鼠肺部感染模型30 min后,予以模型滴鼻、腹腔注射噬菌体鸡尾酒制剂,对照组则滴鼻、腹腔注射磷酸缓冲盐(phosphate buffer solution,PBS)溶液。单次噬菌体鸡尾酒制剂的配比量如下,单次治疗肺部感染小鼠时,Pa3、39、47、55噬菌体各取5×107 PFU,共计2×108 PFU,铜绿假单胞菌与噬菌体的比值为1:20。予小鼠噬菌体治疗后监测体重、饮食活动、精神状态、毛色变化等。
1.11 肺组织匀浆菌落计数PA感染24 h后,用异氟烷呼吸麻醉后行颈椎脱臼法处死治疗组和对照组各10只小鼠,常规消毒小鼠整个胸腹部,从剑突下剪开皮肤,钝性分离肌肉层进入腹腔,然后倒三角沿肋骨剪开暴露胸腔,分离肺部,无菌收集右肺部标本,称重,将右肺标本放入匀浆研磨离心管中,加入1 mL预冷PBS溶液,于4 ℃冰浴下制备肺组织匀浆。用LB液体培养基8倍浓度梯度稀释组织匀浆至10–8。取各浓度的匀浆稀释液50 μL,用涂布棒均匀涂抹于LB琼脂固体培养基上,放入37 ℃生化培养箱中孵育24 h,进行菌落计数。
1.12 肺组织病理学检查用异氟烷呼吸麻醉后行颈椎脱臼法处死小鼠,收集左肺部标本并肉眼观察肺部大体病理观改变。用4%多聚甲醛固定液固定左肺组织,经脱水、石蜡包埋、切片进行苏木精-伊红(hematoxylin-eosin,HE)染色后再进行组织病理学检查,并通过光学显微镜分析炎症的范围及程度。
1.13 肺组织细胞因子检测处死小鼠后,于无菌操作下将小鼠的右肺标本放入匀浆研磨离心管中,加入1 mL预冷PBS溶液,于4 ℃冰浴下制备肺组织匀浆。得到肺组织匀浆液后,将匀浆液于低温下10 000 r/min离心5 min得到肺组织匀浆上清液。取上清液使用Luminex试剂盒检测肺组织内细胞因子的水平。
1.14 统计学分析采用统计学SPSS 17.0统计软件对实验数据进行了分析。两样本间均数比较均采用独立样本t检验,检验数据以均数±标准差(x±s)表示,检验标准α=0.05。
2 结果与分析 2.1 噬菌体分离、纯化本研究使用中国科学院深圳先进技术研究院合成所微生物中心马迎飞教授课题组前期分离的Pa3、39、47、55噬菌体。噬菌体来源、噬菌体滴度、内毒素含量如表 1所示,噬菌斑展示如图 1所示。
| Phages | Sources of isolation | Isolation P. aeruginosa host | The titers of phage | Toxin of phage |
| Pa3 | Zhuhai | PAO1 | 1.0×1011 PFU | 9×104 EU |
| Pa39 | Lanzhou | PAO1 | 1.0×1011 PFU | 1×105 EU |
| Pa47 | Guilin | PAO1 | 6.0×1010 PFU | 2×104 EU |
| Pa55 | Chongqing | PAO1 | 2.8×1011 PFU | 9×102 EU |
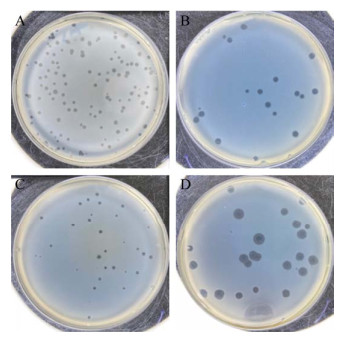
|
| 图 1 四株噬菌体噬菌斑展示 Figure 1 Plaque morphology of phage. A: Pa3; B: Pa39; C: Pa47; D: Pa55. |
2.2 动物一般状态
给予小鼠肺部灌注铜绿假单胞菌悬液术后1 d内,观察小鼠的日常活动状态、食欲、饮水、毛发等一般状态,同时检测小鼠的体重变化情况,结果如表 2所示。给予PBS滴鼻或腹腔注射的对照组小鼠,均出现了活动能力明显下降、进食与饮水减少、体重下降的情况,同时可以观察到小鼠毛发杂乱不顺滑、弓背,表现出明显的寒战状态。而给予噬菌体鸡尾酒制剂治疗后的治疗组小鼠,无论是滴鼻组或腹腔注射组,其小鼠的一般状态均显著优于PBS对照组的小鼠,虽小鼠体重有所下降(表 2),但均能表现出较好的活动状态、能正常进食饮水,小鼠毛发相对光滑柔顺。
| t/d | Vehicle i.p. | Phage i.p. | Vehicle i.n. | Phage i.n. |
| 0 | 22.55±1.06 | 21.67±1.50 | 22.72±1.48 | 21.93±1.23 |
| 1 | 20.52±0.97* | 20.07±1.57* | 20.81±1.43# | 20.37±1.12# |
| *: P=ns, the comparison between the treatment group (phage) and the vehicle group (PBS) by intraperitoneal delivery; #: P=ns, the comparison between the treatment group (phage) and the vehicle group (PBS) by intranasal delivery; ns=no significance. | ||||
2.3 肺组织匀浆细菌学结果
处死治疗组、对照组所有小鼠后,无菌收集右肺部标本。将肺组织匀浆进行细菌培养实验,对照组小鼠肺部组织匀浆均可以培养出铜绿假单胞菌,而滴鼻或腹腔注射治疗组小鼠肺匀浆均未见铜绿假单胞菌生长。计数对照组小鼠肺部组织匀浆的菌落,以每克肺组织所含的PA菌落数来表示肺部组织匀浆菌落数量(图 2)。菌落计数结果显示,对照组的小鼠肺匀浆菌落数均大于106 CFU/g,符合急性肺部感染的指征。从对照组小鼠肺部组织匀浆可培养出大小不等、边缘不整齐、边缘似毛玻璃样、形状扁平、表面光滑湿润的铜绿假单胞菌菌落。同时治疗组小鼠肺组织匀浆在同等条件及浓度下未见铜绿假单胞菌菌落生长。此结果说明通过噬菌体鸡尾酒制剂治疗小鼠肺部感染后,无论是使用滴鼻的方法或是通过腹腔注射的方法,均能够清除小鼠肺内感染的铜绿假单胞菌,减轻小鼠肺内感染情况。
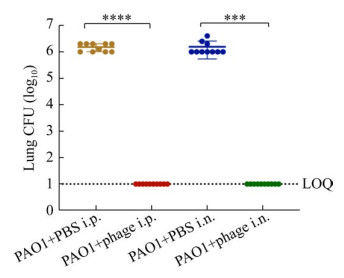
|
| 图 2 对照组与治疗组小鼠肺组织匀浆细菌计数结果(n=10) Figure 2 Bacterial loads (CFU) in infected mouse lungs between the treatment group and the vehicle group (n=10). ****: P < 0.001; ***: P < 0.005. The lower limit of quantification is 1 log10 units. Each group contained ten mice. |
2.4 肺组织病理学结果 2.4.1 肺组织大体观察
处死小鼠后,取左肺进行肺组织大体观察,可以观察到对照组的小鼠肺组织均显示有不同程度的充血、出血、水肿的情况。同时观察治疗组小鼠的肺部组织,其表现明显轻于对照组,只可见少许充血表现。
2.4.2 肺组织病理学观察对小鼠左肺组织取切片HE染色后观察肺组织病理表现,无论是滴鼻或腹腔注射对照组的小鼠肺组织病理表现均显示其肺泡间隔明显增宽、纤维化,并伴有大量炎症细胞浸润,其肺泡腔内可见出血与红细胞浸润。而治疗组中,使用噬菌体鸡尾酒制剂滴鼻治疗的小鼠肺组织病理切片显示肺组织结构大致正常,肺泡间隔厚薄大致正常,细支气管结构大致正常,无明显炎症细胞浸润。腹腔注射噬菌体的小鼠肺组织可见少许炎症细胞渗出的情况,但与对照组相比,其炎症程度较轻,细支气管结构总体较为完好。结果详见图 3。
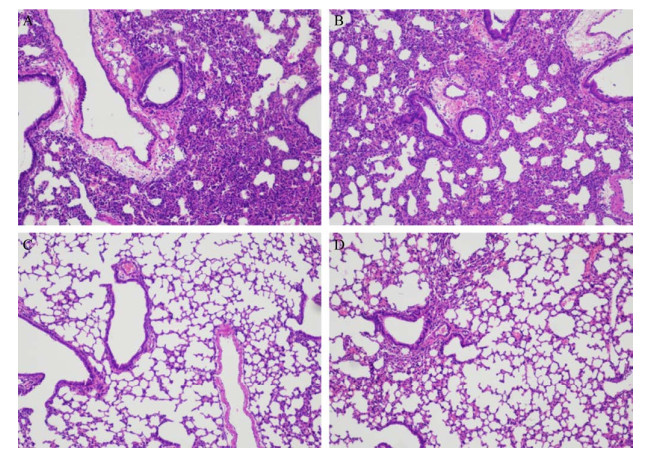
|
| 图 3 小鼠肺部组织HE染色观察(100×) Figure 3 Histopathological analyses of inflammatory responses and lung injury in infected mouse lungs (100×). A: the vehicle group (PBS) by intranasal delivery; B: the vehicle group (PBS) by intraperitoneal delivery; C: the treatment group (phage) by intranasal deliver; D: the treatment group (phage) by intraperitoneal deliver. |
2.5 肺组织匀浆细胞因子检测结果
处死所有小鼠后,研磨所得的肺组织经低温离心得到肺组织匀浆上清液,小心吸出肺组织匀浆上清液后行多因子检测。结果表明,通过滴鼻方式或经腹腔注射给予噬菌体治疗组的整体细胞因子水平相对于未治疗组无统计学差异(表 3)。
| Cytokines | Vehicle i.n. | Phage i.n. | Vehicle i.p. | Phage i.p. |
| TNF-α | 906.79±280.15 | 643.08±332.80 | 996.52±339.04 | 1 439.53±360.15 |
| MCP-1 | 8 422.04±2 723.85 | 5 333.65±3 753.33 | 6 322.22±2 301.06 | 14 380.38±6 419.04 |
| IL-1β | 10 035.42±3 105.82 | 7 780.82±1 404.07 | 4 812.60±1 696.24 | 8 210.14±2 054.66 |
| IL-6 | 9 044.94±2 600.04 | 6 341.56±3 596.72 | 5 808.55±2 662.20 | 134 022.27±6 351.49 |
| IL-10 | 14.33±5.75 | 14.40±8.67 | 16.49±5.61 | 22.92±8.15 |
| IFN-γ | 132.69±28.53 | 146.17±74.32 | 125.66±34.86 | 110.11±18.56 |
| G-CSF | 24 504.90±1 811.38 | 18 598.97±7 978.59 | 23 153.94±5 981.52 | 25 761.89±3 573.59 |
| MIP-1β | 8 932.15±3 422.09 | 7 707.60±4 815.92 | 8 640.19±3 266.66 | 19 964.12±10 461.15 |
| *: P=ns, compared between the vehicle i.n. group and the Phage i.n. group; #: P=ns, compared between the vehicle i.p. group and the phage i.p. group. Vehicle i.n.: the vehicle group (PBS) by intranasal delivery; Phage i.n.: the treatment group (phage) by intranasal deliver; Vehicle i.p.: the vehicle group (PBS) by intraperitoneal delivery; Phage i.p.: the treatment group (phage) by intraperitoneal deliver; TNF-α: recombinant human tumor necrosis factor-α; MCP-1: monocyte chemoattractant protein-1; IL: interleukin; IFN-γ: interferon-γ; G-CSF: granulocyte colony-stimulating factor; MIP-1β: macrophage inflammatory protein-1β. | ||||
3 讨论
铜绿假单胞菌作为一种常见条件致病菌,目前已成为全球公认的院内获得性感染常见的致病菌之一。研究表明[14],铜绿假单胞菌常常作为引起医院获得性肺炎和呼吸道相关肺炎的主要致病菌。然而随着抗生素愈加广泛地使用,近年来铜绿假单胞菌出现多重耐药的情况也愈发普遍,极大提高了临床治疗的困难度,同时给临床治疗带来了严峻的挑战。铜绿假单胞菌在2017年2月被世界卫生组织作为高危致病菌[15]列入了急需新型抗生素的超级细菌名单,寻找多重耐药菌的新型治疗方法也成为了当前研究的热点。因此,建立相关的噬菌体治疗铜绿假单胞菌肺部感染动物模型,在寻找新型治疗手段方面提供了一定指导意义。
在20世纪80年代晚期,Soothill[16‒17]开始使用铜绿假单胞菌噬菌体治疗小鼠皮肤感染模型。后续也有许多研究人员应用铜绿假单胞菌噬菌体治疗各类型的感染,如Mcvay等[18]通过注射噬菌体治疗烫伤后感染铜绿假单胞菌的小鼠;2013年Golkar[19]使用腹腔注射和口服的方式,治疗小鼠浅表皮肤划伤和深度刺伤的感染模型;Wang等[20]和Heo等[21]通过腹腔注射噬菌体治疗小鼠铜绿假单胞菌腹膜炎模型;Furusawa[22]使用噬菌体治疗小鼠铜绿假单胞菌角膜炎模型。以上大量的动物模型证实,噬菌体具有控制多重耐药铜绿假单胞菌感染、杀死动物模型内感染的铜绿假单胞菌的能力。在治疗肺部感染方面,Dufour等[23]曾使用噬菌体或抗生素治疗大肠杆菌引起的鼠急性肺部感染模型,结果显示不仅2种治疗方法有着相似的治疗效果,并且噬菌体治疗可使小鼠机体更快控制感染,并不会产生类似抗生素治疗后导致的炎症反应。另外,O’Flynn等发现使用多种混合噬菌体可以延缓大肠埃希菌噬菌体抗性菌株的产生,使菌株的抗性频率降至原来的1/100[24];Beeton等[25]也曾使用6种噬菌体鸡尾酒制剂治疗蜡螟虫铜绿假单胞菌感染模型,并获得了良好的疗效。因此,考虑到铜绿假单胞菌与肺部感染密切相关,多种噬菌体联合应用效果优于单一噬菌体治疗,本研究则更侧重于探索使用更能延缓噬菌体抗性菌株演变的鸡尾酒制剂,解决因铜绿假单胞菌多重耐药而引起的肺部感染问题。
有研究表明,经滴鼻给药的方式能够使达到肺内的噬菌体量较多,但在肺外组织脏器中噬菌体滴度较低[26]。同时也有研究发现,通过腹腔注射噬菌体1 h后,小鼠血液中的噬菌体滴度较低,但在6 h后将急速增加,并有效地抑制由耐药性金黄色葡萄球菌引起的小鼠败血症[27]。在短时间内给予小鼠大负荷量细菌感染后,通过腹腔注射的方式不仅能够降低肺内感染的程度,同时能够抵抗由于细菌入血所导致的全身性炎症情况,而获得更好的疗效。
在本研究中,选用了2种给药方式给予小鼠噬菌体。在研究过程中可以发现,无论是通过滴鼻或是腹腔注射的方式,噬菌体均能够清除小鼠肺内所有铜绿假单胞菌。小鼠肺部的病理切片也可以反映出使用噬菌体治疗后的小鼠,其肺部的炎症程度较轻,病理观察情况较好;而未使用噬菌体制剂治疗的对照组病理炎症水平较重,炎症渗出的情况明显。同时通过观察治疗组与对照组小鼠的一般状态,可以看出使用噬菌体治疗后的小鼠,其活动能力均比未治疗的对照组小鼠要好。而噬菌体不同给药方式比较后发现,使用滴鼻的方式给予小鼠噬菌体治疗后,肺组织匀浆内细胞因子降低的水平略优于腹腔注射治疗组的小鼠。
由于本研究选择气管切开的方式灌注铜绿假单胞菌悬浮液,手术损伤较大,对于小鼠恢复造成影响。同时感染后1 d作为治疗周期较短,因而导致治疗后的小鼠体重或是肺部炎症因子水平不能在1 d内恢复至完全正常。曾有研究表明,同样通过气管注射的方式建立铜绿假单胞菌肺部感染小鼠模型,使用妥布霉素治疗该模型1 d后,其治疗组与对照组小鼠肺部炎症因子的恢复水平相差较小,但肺内细菌负荷量仍有较大差异[28]。
因此,虽本研究存在局限性之处,但这不能成为否认噬菌体治疗有效的依据。未来将致力于使用损伤性较小的建模方式,在延长治疗时间后,探索噬菌体鸡尾酒制剂能否更快速地辅助降低体内炎症水平、加速体内炎症因子水平的恢复。
综上所述,本研究初步探索了应用铜绿假单胞菌噬菌体鸡尾酒制剂治疗小鼠肺部感染的有效性,为噬菌体治疗提供了有效、安全和至关重要的数据支持,为未来噬菌体疗法应用于多重耐药菌感染的临床应用打下了坚实的基础。
| [1] |
Chen ML, He XJ, Jian LY. Antimicrobial resistance and therapeutic progress of Pseudomonas aeruginosa. Chinese Journal of Antibiotics, 2022, 21(21): 4634-4637.
(in Chinese) 陈美玲, 何晓静, 菅凌燕. 铜绿假单胞菌的耐药趋势变化及治疗进展. 中国抗生素杂志, 2022, 21(21): 4634-4637. DOI:10.13461/j.cnki.cja.007196 |
| [2] |
Li JL, Li WR, Xie XB, Zhang JS. Research advance in drug resistance and heteroresistance of Pseudomonas aeruginosa. Industrial Microbiology, 2021, 51(5): 58-66.
(in Chinese) 李金玲, 李文茹, 谢小保, 张建设. 铜绿假单胞菌的耐药与异质性耐药研究进展. 工业微生物, 2021, 51(5): 58-66. DOI:10.3969/j.issn.1001-6678.2021.05.011 |
| [3] | Barrio Tofiño ED, Causapé CL, Cabot G, Rivera A, Benito N, Segura C, Montero MM, Sorlí L, Tubau F, Zorrilla SG, Tormo N, Navarro RD, Viedma E, Foz ER, Martínez MF, Rico CG, Cancho IA, Martínez JA, Echverria CL, Dueñas C, Ayestarán I, Zamorano L, Martinez LM, Horcajada JP, Oliver A. Genomics and susceptibility profiles of extensively drug-resistant Pseudomonas aeruginosa isolates from Spain. Antimicrobial Agents and Chemotherapy, 2017, 61(11): e02352-17. |
| [4] | Antonio O, Xavier M, Carla LC, Carlos J. The increasing threat of Pseudomonas aeruginosa high-risk clones. Drug Resistance Updates, 2015(21/22): 41-59. |
| [5] | Kalil AC, Metersky ML, Klompas M, Muscedere J, Sweeney DA, Palmer LB, Napolitano LM, O՚Grady NP, Bartlett JG, Carratalà J, El Solh AA, Ewig S, Fey PD, File TM, Restrepo MI, Roberts JA, Waterer GW, Cruse P, Knight SL, Brozek JL. Executive summary: management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the infectious diseases society of America and the American thoracic society. Clinical Infectious Diseases, 2016, 63(5): 575-582. DOI:10.1093/cid/ciw504 |
| [6] | Drulis-Kawa Z, Majkowska-Skrobek G, Maciejewska B, Delattre AS, Lavigne R. Learning from bacteriophages-advantages and limitations of phage and phage-encoded protein applications. Current Protein & Peptide Science, 2012, 13(8): 699-722. |
| [7] | Landsberger M, Gandon S, Meaden S, Rollie C, Chevallereau A, Chabas H, Buckling A, Westra ER, Van Houte S. Anti-CRISPR phages cooperate to overcome CRISPR-Cas immunity. Cell, 2018, 174(4): 908-916.e12. DOI:10.1016/j.cell.2018.05.058 |
| [8] |
Jin F, Gao YM, Huang YJ, Pu L, Xia L. Current therapies for Pseudomonas aeruginosa infection. Journal of Integration Technology, 2021, 10(4): 50-66.
(in Chinese) 金帆, 高艳梅, 黄亚佳, 蒲璐, 夏霖. 铜绿假单胞菌感染治疗现状. 集成技术, 2021, 10(4): 50-66. |
| [9] | Breitbart M, Rohwer F. Here a virus, there a virus, everywhere the same virus? Trends in Microbiology, 2005, 13(6): 278‒284. |
| [10] |
Bai CY, Bai YH, Xu Y. The effect of phage therapy on bacterial load and inflammation in mice with Pseudomonas aeruginosa-induced pneumonia. Genomics and Applied Biology, 2020, 39(3): 1369-1375.
(in Chinese) 白春艳, 白艳红, 徐英. 噬菌体治疗对铜绿假单胞菌诱导的肺炎小鼠细菌负荷和炎症水平的影响. 基因组学与应用生物学, 2020, 39(3): 1369-1375. DOI:10.13417/j.gab.039.001369 |
| [11] | Carlton RM. Phage therapy: past history and future prospects. Archivum Immunologiae et Therapiae Experimentalis, 1999, 47(5): 267-274. |
| [12] | Chadha P, Katare OP, Chhibber S. In vivo efficacy of single phage versus phage cocktail in resolving burn wound infection in BALB/c mice. Microbial Pathogenesis, 2016, 99: 68-77. DOI:10.1016/j.micpath.2016.08.001 |
| [13] | Łusiak-Szelachowska M, Weber-Dąbrowska B, Górski A. Bacteriophages and lysins in biofilm control. Virologica Sinica, 2020, 35(2): 125-133. DOI:10.1007/s12250-019-00192-3 |
| [14] |
Xing WL, Yang JW, Wang CZ. Drug resistance mechanism of Pseudomonas aeruginosa and new strategies for infection treatment. World Latest Medicine Information, 2019, 19(59): 38-39.
(in Chinese) 邢婉琳, 杨佳伟, 王重振. 铜绿假单胞菌的耐药机制和感染治疗新策略. 世界最新医学信息文摘, 2019, 19(59): 38-39. |
| [15] |
Yang YH, Le L. Progress on Pseudomonas aeruginosa bacteriophage therapy. Chinese Journal of Antibiotics, 2017, 42(10): 814-820.
(in Chinese) 杨雨卉, 乐率. 铜绿假单胞菌噬菌体治疗的研究进展. 中国抗生素杂志, 2017, 42(10): 814-820. DOI:10.3969/j.issn.1001-8689.2017.10.002 |
| [16] | Soothill JS. Treatment of experimental infections of mice with bacteriophages. Journal of Medical Microbiology, 1992, 37(4): 258-261. DOI:10.1099/00222615-37-4-258 |
| [17] | Soothill JS. Bacteriophage prevents destruction of skin grafts by Pseudomonas aeruginosa. Burns, 1994, 20(3): 209-211. DOI:10.1016/0305-4179(94)90184-8 |
| [18] | McVay CS, Velásquez M, Fralick JA. Phage therapy of Pseudomonas aeruginosa infection in a mouse burn wound model. Antimicrobial Agents and Chemotherapy, 2007, 51(6): 1934-1938. |
| [19] | Golkar Zhabiz. Experimental phage therapy on multiple drug resistant Pseudomonas aeruginosa infection in mice. Journal of Antivirals & Antiretrovirals, 2013, 5(6). DOI:10.4172/jaa.S10-005 |
| [20] | Wang J, Hu B, Xu MC, Yan Q, Liu SY, Zhu XH, Sun ZY, Reed E, Ding L, Gong JP, Li QQ, Hu JB. Use of bacteriophage in the treatment of experimental animal bacteremia from imipenem-resistant Pseudomonas aeruginosa. International Journal of Molecular Medicine, 2006, 17(2): 309-317. |
| [21] | Heo YJ, Lee YR, Jung HH, Lee J, Ko G, Cho YH. Antibacterial efficacy of phages against Pseudomonas aeruginosa infections in mice and Drosophila melanogaster. Antimicrobial Agents and Chemotherapy, 2009, 53(6): 2469-2474. |
| [22] | Furusawa T, Iwano H, Hiyashimizu Y, Matsubara K, Higuchi H, Nagahata H, Niwa H, Katayama Y, Kinoshita Y, Hagiwara K, Iwasaki T, Tanji Y, Yokota H, Tamura Y. Phage therapy is effective in a mouse model of bacterial equine keratitis. Applied and Environmental Microbiology, 2016, 82(17): 5332-5339. |
| [23] | Dufour N, Delattre R, Chevallereau A, Ricard JD, Debarbieux L. Phage therapy of pneumonia is not associated with an overstimulation of the inflammatory response compared to antibiotic treatment in mice. Antimicrobial Agents and Chemotherapy, 2019, 63(8): e00379-19. |
| [24] | O՚Flynn G, Ross RP, Fitzgerald GF, Coffey A. Evaluation of a cocktail of three bacteriophages for biocontrol of Escherichia coli O157: H7. Applied and Environmental Microbiology, 2004, 70(6): 3417-3424. |
| [25] | Beeton ML, Alves DR, Enright MC, Jenkins ATA. Assessing phage therapy against Pseudomonas aeruginosa using a Galleria mellonella infection model. International Journal of Antimicrobial Agents, 2015, 46(2): 196-200. |
| [26] |
Liang M, Guo SL, Zhang HM, Liu P, Wu TT. Metabolic distribution of mycobacteriophage D29 administered by different routes in mice. Chinese Journal of New Drugs and Clinical Remedies, 2012, 31(5): 272-276.
(in Chinese) 梁梅, 郭述良, 张红梅, 刘平, 邬亭亭. 噬菌体D29不同途径给入在小鼠体内的代谢分布. 中国新药与临床杂志, 2012, 31(5): 272-276. |
| [27] |
Yu HB, Zhang L, Feng C, Chi T, Qi YL, Jia KX, Zhang Y, Qian AD, Shan XF, Zhang L. Advances in phage pharmacokinetics. Chinese Journal of Veterinary Science, 2022, 42(2): 399-404.
(in Chinese) 于华波, 张亮, 冯超, 迟腾, 齐艳玲, 贾凯翔, 张洋, 钱爱东, 单晓枫, 张蕾. 噬菌体药代动力学研究进展. 中国兽医学报, 2022, 42(2): 399-404. |
| [28] | Cigana C, Ranucci S, Rossi A, De Fino I, Melessike M, Bragonzi A. Antibiotic efficacy varies based on the infection model and treatment regimen for Pseudomonas aeruginosa. The European Respiratory Journal, 2020, 55(3): 1802456. |
 2022, Vol. 62
2022, Vol. 62


 ,
, 