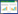中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 侯敏, 张晨曦, 詹发强, 杨蓉, 龙宣杞, 崔卫东. 2022
- Min HOU, Chenxi ZHANG, Faqiang ZHAN, Rong YANG, Xuanqi LONG, Weidong CUI. 2022
- 不同饲喂下棉铃虫肠道内生菌的分离鉴定及脱毒效果研究
- Isolation, identification and detoxification of intestinal endophytes of Helicoverpa armigera under different feeding
- 微生物学报, 62(1): 305-320
- Acta Microbiologica Sinica, 62(1): 305-320
-
文章历史
- 收稿日期:2021-04-13
- 修回日期:2021-06-20
- 网络出版日期:2021-09-15
2. 新疆农业大学动物科学学院, 新疆 乌鲁木齐 830052
2. College of Animal Science, Xinjiang Agricultural University, Urumqi 830052, Xinjiang Uygur Autonomous Region, China
棉酚是棉花体内重要的次生代谢物,一定程度上可以促进植物的生长发育[1],主要储存在根、茎、叶、花和种子等器官的色素腺体中,但是它的存在增加了综合开发利用棉花副产品饲料的难度和饲用价值。因为棉酚在植物体内有两种形式存在——结合棉酚(boundgossypol,BG)和游离棉酚(freegossypol,FG),其中游离棉酚是一种黄色结晶的有害物质,作为一种饲料抗营养因子具有肝毒性和生殖毒性[2];对动物消化系统造成影响,抑制消化道中蛋白水解酶活性[3];引起公畜尿结石、生育功能等[4],导致母畜早产、流产或产畸形胎[5];严重影响畜禽生产及生产产品的质量[6];棉源饲料饲喂过量时,可以导致动物死亡。
近年来,新疆养殖业发展迅速,由于饲料的匮乏,丰富的棉源性副产物广泛地成为当地替代反刍动物粗饲料的资源。利用有效技术手段抑制棉酚毒性,成为当前开发棉源性饲料急需解决的问题。鉴于无抗养殖新时代的来临,对棉酚降解功能微生物资源的挖掘是饲用微生物及相关微生物技术在棉酚脱毒利用中的最佳途径。
昆虫肠道是宿主与外部环境之间的重要交界面[7],昆虫肠道微生态系统栖息着大量的微生物[8],从昆虫体内分离、鉴定细菌,有可能挖掘到具有特殊功能的细菌资源[9],它们能够参与宿主代谢,提供营养物质[10],参与有害物质降解[11]。棉铃虫(Helicoverpa armigera)是棉花蕾铃期重要的钻蛀性害虫,主要蛀食蕾、花、铃和嫩叶。用含游离棉酚(FG)的饲料饲喂棉铃虫幼虫后,肠道会产生糖基化过程,可能是棉铃虫体内一种重要的FG脱毒机制[12]。有研究表明,棉铃虫肠道细菌或代谢产物[13]可以帮助宿主昆虫解除或抵御棉酚毒素的伤害[14]。鉴于棉铃虫对环境的强适应力和利用价值,以及微生物与昆虫存在的密切关系,研究棉铃虫肠道微生物及脱毒功能,对棉酚降解菌株资源开发意义重大。
本研究通过给棉铃虫饲喂一定量具有棉酚毒性的棉粕饲料,利用可培养方式分离、鉴定棉铃虫肠道中的内生细菌,对比饲喂正常饲料和棉粕饲料下棉铃虫肠道可培养细菌分布的不同,初步掌握棉酚对棉铃虫肠道微生物的影响,并对筛选菌株的棉酚耐受性和脱毒作用进行研究,为后续挖掘棉铃虫肠道微生物资源以及研究虫肠道内生菌在棉源饲料中的开发利用提供理论和实验支持。
1 材料与方法 1.1 供试昆虫从乌鲁木齐花卉市场科云生物购买室内饲养敏感品系棉铃虫1-2龄幼虫作为虫源,饲养条件为:温度27-28 ℃,相对湿度50%,光周期14L: 10D,根据实验需要饲喂正常饲料或棉粕等。
1.2 供试菌种粪肠球菌w13-7、J-4,枯草芽孢杆菌w7-1、ht4-2、J-1,植物乳杆菌J2-2,为新疆农业科学院微生物应用研究菌种保藏库所保存(保藏号分别为XJTR No.1004、XJTR No.1006、XJTR No.2011、XJTR No.1989、XJTR No.1981、XJTR No.1233)
1.3 培养基 1.3.1 分离(种子)培养基:MRS培养基、高氏1号培养基、LB培养基、NA培养基见《微生物学实验技术》[15]。
1.3.2 以醋酸棉酚为唯一碳源的固体培养基:0.2% (NH4)2SO4,0.02% MgSO4·7H2O,0.05% NaH2PO4·H2O,0.01% CaCl2·2H2O,0.05% K2HPO4,0.15%琼脂,去离子水定容至1 L。7×104 Pa (表压)(115 ℃) 20 min,待温度低于50 ℃,将醋酸棉酚溶解于少量的70%丙酮溶液中,加入培养基中,去离子水定容至1 L,分别配置成分棉酚浓度为100、200、300、400、500、600、700、800、900、1 000 mg/kg醋酸棉酚培养基。以上培养基在超净台里均匀倒入无菌9 cm培养皿内,厚度约4 mm,冷却凝固后,存放于4 ℃冰箱,备用。
1.3.3 以醋酸棉酚为唯一碳源的液体培养基:0.2% (NH4)2SO4,0.02% MgSO4·7H2O,0.05% NaH2PO4·H2O,0.01% CaCl2·2H2O,0.05% K2HPO4,去离子水定容至100 mL。7×104 Pa (表压)(115 ℃) 20 min,待温度低于50 ℃,将醋酸棉酚溶解于少量的70%丙酮溶液中,加入培养基中,去离子水定容至1 L,分别配置成分棉酚浓度为400 mg/kg醋酸棉酚培养基,备用。
1.4 饲喂材料棉铃虫专用饲料购于乌鲁木齐市花卉市场,棉粕购于昌吉米东区。
1.5 试验仪器培养箱、养虫盘(35 cm×20 cm×12 cm)、电子天平(0.000 1 g)、镊子、玻璃培养皿(90 mm、120 mm)、量筒(100 mL)、搅拌棒、三角瓶、摇床等。
1.6 饲喂试验供试棉铃虫,选取色泽鲜亮,个体健康,发育良好,活力强,龄期(1-2龄)和体型相近的个体,于试验前一天进行饥饿处理,24 h不予喂食饥饿处理,使用60目分离筛筛除虫粪。称取1 g粉碎棉籽粕,加30% H2O搅拌成粘稠状,置于养虫盘中,投入20头供试棉铃虫幼虫进行试验,对照组饲喂正常的棉铃虫饲料。将虫卵置于(28±1) ℃人工气候箱中饲养至5-6龄,相对湿度(60±10)%,光照14:10 (L: D),培养10-15 d。选大小一致的活虫1只作为1组,设3组重复,分别进行涂板,用于内生细菌的分离、培养。
1.7 棉铃虫肠道内生细菌的分离取1头6龄(老熟期)棉铃虫置于2 mL试管中,饥饿24 h后,移于无菌培养皿内,进行体表消毒,75%酒精浸泡30 s,无菌条件下取出虫体,至1%次氯酸钠浸泡5 min,无菌水漂洗10次。将表面消毒的虫体放在灭菌研钵中研磨,灭菌水稀释至10-1-10-4,取10-3和10-4浓度的稀释液,分别涂布在MRS培养基、高氏1号培养基、LB培养基、NA培养基上,重复3次。将最后一次清洗过的无菌水涂板后放在30 ℃培养2 d,检验表面消毒效果,检验该样品得到的可信度。涂布好的平板置于培养箱内,28 ℃下培养2-5 d。记录不同形态菌落的数量,将每种形态的菌落挑到相应的平板上划线、纯化、培养、标记菌株号。将纯化的菌落再移植到相应的斜面培养基上,编号保存,供16S rRNA基因序列分析。
1.8 棉铃虫肠道内生细菌16S rRNA基因序列分析从斜面培养基上,分别挑取纯化的内生菌株,采用TRIS饱和酚提取DNA模板。采用细菌16S rRNA基因序列通用引物27F (5′-CAGA GTTTGATCCTGGCT-3′)和1492R (5′-AGGAG GTGATCCAGCCGCA-3′)进行PCR扩增、测序。通用引物合成及PCR扩增产物测序均由上海生工完成。获得菌株16S rRNA基因序列后,通过NCBI BLAST (http://www.ncbi.nlm.nih.gov),将其与GenBank数据库中进行核苷酸同源性比对,获取相似度高的序列[16],确定各菌株的系统发育地位,根据16S rRNA基因序列相似度小于98.65%时,就可以认定为可能的新种或新属[17]。
1.9 降解棉酚菌株筛选 1.9.1 耐受菌株筛选:将单菌落在浓度为100 mg/kg醋酸棉酚培养基上划线培养,28 ℃恒温培养箱培养1-2 d,观察菌株生长状态。继续在100 mg/kg醋酸棉酚培养基上挑取单菌落,在200 mg/kg醋酸棉酚培养基上划线培养1-2 d。照此方法,依次在300、500、1 000 mg/kg醋酸棉酚培养基上,观察菌株的生长状态。
1.9.2 耐受菌株对醋酸棉酚的降解效果:挑选耐受菌株,取一环接100 mL种子液体培养基中,28 ℃,培养24 h,取1 mL接入以醋酸棉酚为唯一碳源的液体培养基中,醋酸棉酚浓度为400 mg/kg,28 ℃、120 r/min,发酵10 d,测定棉酚含量。
1.10 棉铃虫肠道棉酚降解菌组合降解效果将实验室前期对醋酸棉酚有耐受、降解效果的菌株,进行组合,与棉铃虫肠道棉酚降解菌组合进行对比。取混合菌液1 mL接入以醋酸棉酚为唯一碳源的液体培养基中,醋酸棉酚浓度400 mg/kg,28 ℃、120 r/min,发酵10 d,测定棉酚含量。对照组分组分为5组,分别为:对照组1:w13-7+w7-1,1:1;对照组2:w7-1+w13-7+ht4-2,1:1:1;对照组3:J-4+J2-2,1:1;对照组4:J-4+J2-2+J-1,1:1:1;对照5:J-4+J2-2+J-1+ht4-2,1:1:1:1。
1.11 棉酚含量的测定按国标GB13086-91《饲料中游离棉酚的测定方法》测定。
1.12 数据处理与统计分析数据分析使用SPSS 13.0统计软件,采用单因素方差分析(one-way ANOVA)程序,LSD法多重比较,不同处理对棉酚降解率结果以“平均值±标准差”表示,P < 0.05表示差异显著。
2 结果与分析 2.1 棉铃虫肠道可培养细菌的分离、纯化及形态鉴定将棉铃虫肠道样品进行处理,梯度稀释后涂布,培养2-5 d,根据菌落形态、湿润度、是否凸起,从饲喂正常饲料和棉粕饲料下棉铃虫肠道样品中共分离纯化细菌32株,其中正常饲喂虫肠道中分离出17株,饲喂棉粕的虫肠道中分离出15株。
从棉铃虫肠道中分离得到菌体和菌落的形态特征丰富多样的细菌(表 1),其中饲喂正常饲料棉铃虫肠道中分离的细菌(编号从1-1至1-17)菌落多较大;多呈白色,少数为黄色或红色,质地均匀,表面多光滑湿润,易挑起;菌体多为杆状和棒状,部分为球状和椭圆形;大部分为革兰氏阳性菌,少数为革兰氏阴性菌。饲喂棉粕虫肠道中分离的细菌(编号从2-1至2-15),菌落大的较多,菌落小的菌株较正常饲喂的菌株有所增加;多呈黄色或浅黄色或黄绿色,少数为白色或红色,质地均匀,表面多光滑湿润,易挑起;菌体大多为棒状,极少为球状和椭圆形;革兰氏阳性菌和革兰氏阴性菌各占约一半。
| Strains | Gram | Cell morphology | Colony characteristics |
| 1-1 | - | Rod | Moist, larger, raised, brick red, edge extended, opaque |
| 1-2 | + | Rod | Dry, larger, wrinkled, white, regular edges, opaque |
| 1-3 | + | Circular or elliptic | Moist, smaller, raised, milky white, regular edges, opaque |
| 1-4 | + | Circular or elliptic | Moist, smaller, raised, milky white, regular edges, opaque |
| 1-5 | + | Rod | Dry, larger, wrinkled, white, opaque |
| 1-6 | + | Short rod-like | Moist, cheesy, raised, red, regular edges, opaque |
| 1-7 | + | Rod | Wax drop like, raised, light yellow, irregular edges, opaque |
| 1-8 | + | Spherical or elliptic | Moist, smaller, raised, edge neat, white, smooth, opaque |
| 1-9 | + | Rod | Dry, larger, wrinkled, white, regular edges, opaque |
| 1-10 | + | Spherical or elliptic | Small, milky white, regular edge, opaque |
| 1-11 | + | Rod | Moist, raised, milky white, regular edges, opaque |
| 1-12 | - | Sphere | Raised, red, irregular edge, opaque |
| 1-13 | + | Rod | Dry, larger, wrinkled, white, regular edges, opaque |
| 1-14 | + | Rod | Dry, larger, wrinkled, white, regular edges, opaque |
| 1-15 | + | Rod | Dry, larger, wrinkled, white, irregular edges, opaque |
| 1-16 | + | Rod | Moist, larger, raised, milky white, regular edges, opaque |
| 1-17 | + | Rod | Moist, larger, milky white, regular edges, opaque |
| 2-1 | + | Short rod | Moist, smaller, raised, regular edges, transparent |
| 2-2 | - | Rod | Moist, larger, raised, brick red, opaque |
| 2-3 | - | Rod | Moist, larger, raised, red, extended edges, opaque |
| 2-4 | + | Spherical or elliptic | Moist, smaller, grayish white, smooth surface, regular edges, opaque |
| 2-5 | - | Rod | Moist, larger, yellowish green, regular edges, opaque |
| 2-6 | - | Rod | Moist, larger, yellowish green, regular edges, opaque |
| 2-7 | + | Circular or elliptic | Moist, smaller, raised, milky white, regular edges, opaque |
| 2-8 | - | Rod | Moist, yellow, regular edges, opaque |
| 2-9 | - | Rod | Moist, larger, raised, yellow, regular edges, opaque |
| 2-10 | + | Rod | Moist, smaller, raised, milky white, regular edges, opaque |
| 2-11 | - | Rod | Moist, larger, raised, yellow, regular edges, opaque |
| 2-12 | + | Rod | Wax drop like, raised, light yellow, irregular edges, opaque |
| 2-13 | + | Rod | Dry, larger, wrinkled, white, irregular edges, opaque |
| 2-14 | - | Rod | Moist, smaller, raised, light yellow, regular edges, translucent |
| 2-15 | + | Rod | Dry, larger, wrinkled, white, regular edges, opaque |
2.2 菌株16S rRNA序列和系统发育学分析
利用细菌16S rRNA通用引物进行PCR扩增,扩增产物长度为1 500 bp左右,对所分离的32株菌株进行16S rRNA基因PCR产物测序,将各序列提交至GenBank,并利用BLASTn软件搜索与之具有最高匹配率的模式标准菌株序列。统计结果表明,16S rRNA基因序列相似度小于98.65%的菌株有17株,其中饲喂正常饲料组有9株,饲喂棉粕饲料组有8株,这些菌可能是新种或新属,总新种属的比例高达53.1%。其中菌1-1、1-11、2-2最相似模式菌株的相似度均小于95%,可能代表潜在的新属[18],其他14株菌为潜在的新种(表 2)。
| Samples | The number of isolates | The number of isolates identified by 16S rRNA gene sequencing | The number of genera | The number of potential novel strains |
| Stress feeding | 15 | 17 | 8 | 8 |
| Normal feeding | 17 | 19 | 10 | 9 |
饲喂正常饲料组棉铃虫肠道17株细菌分属于10个属(表 3):假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、肠球菌属(Enterococcus)、红球菌属(Rhodococcus)、葡萄球菌属(Staphylococcus)、乳球菌属(Lactococcus)、棒杆菌属(Corynebacterium)、沙雷氏菌属(Serratia)、普罗威登斯菌属(Providencia)、乳杆菌属(Lactobacillus)。各属细菌所占比例(图 1),其中芽孢杆菌属为优势属,有7株,占分离细菌总数的41%;其次是肠球菌属,有2株,占分离细菌总数的12%;假单胞菌属、红球菌属、葡萄球菌属、乳球菌属、棒杆菌属、沙雷氏菌属、普罗威登斯菌属、乳杆菌属各有1株。所有细菌共分成3个分类单元:变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)。放线菌门有2个属;厚壁菌门有5个属;变形菌门共有3个属。
| Strains | Closest match | GenBank accession No. | Similarity/% |
| 1-1 | Pseudomonas fluorescens | MW555629 | 90.75 |
| 1-2 | Bacillus amyloliquefaciens | MW555630 | 99.79 |
| 1-3 | Enterococcus casseliflavus | MW555631 | 99.75 |
| 1-4 | Enterococcus faecium | MW555632 | 96.81 |
| 1-5 | Bacillus megaterium | MW555633 | 97.20 |
| 1-6 | Rhodococcus pyridinivorans | MW555634 | 95.69 |
| 1-7 | Bacillus thuringiensis | MW555635 | 97.34 |
| 1-8 | Staphylococcus epidermidis | MW555636 | 96.25 |
| 1-9 | Bacillus amyloliquefaciens | MW555637 | 99.53 |
| 1-10 | Lactococcus lactis | MW555638 | 99.50 |
| 1-11 | Corynebacterium nuruki | MW555639 | 90.65 |
| 1-12 | Serratia marcescens | MW555640 | 98.83 |
| 1-13 | Providencia alcalifaciens | MW555641 | 99.41 |
| 1-14 | Bacillus amyloliquefaciens | MW555642 | 96.37 |
| 1-15 | Bacillus cereus | MW555643 | 99.33 |
| 1-16 | Lactobacillus plantarum | MW555644 | 99.34 |
| 1-17 | Bacillus megaterium | MW555645 | 97.17 |
| 2-1 | Weissella paramesenteroides | MW555646 | 98.11 |
| 2-2 | Pseudomonas fluorescens | MW555647 | 87.99 |
| 2-3 | Pseudomonas fluorescens | MW555648 | 98.32 |
| 2-4 | Enterococcus casseliflavus | MW555649 | 99.06 |
| 2-5 | Pseudomonas aeruginosa | MW555650 | 99.72 |
| 2-6 | Pseudomonas aeruginosa | MW555651 | 99.07 |
| 2-7 | Enterococcus faecium | MW555652 | 99.90 |
| 2-8 | Microbacterium esteraromaticum | MW555653 | 99.11 |
| 2-9 | Sphingomonas paucimobilis | MW555654 | 95.66 |
| 2-10 | Lactobacillus plantarum | MW555655 | 96.31 |
| 2-11 | Sphingomonas paucimobilis | MW555656 | 99.62 |
| 2-12 | Bacillus thuringiensis | MW555657 | 96.17 |
| 2-13 | Bacillus cereus | MW555658 | 98.02 |
| 2-14 | Massilia timonae | MW555659 | 95.16 |
| 2-15 | Bacillus subtilis | MW555660 | 99.07 |
|
| 图 1 饲喂正常饲料组棉铃虫肠道内生细菌种类 Figure 1 The group of fed normal diet of species of intestinal endophytic bacteria of Helicoverpa armigera. |
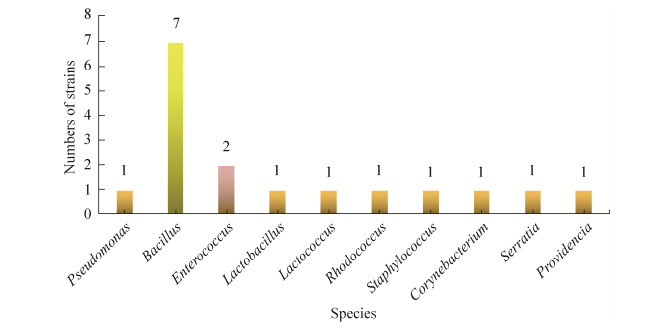
饲喂棉粕饲料组棉铃虫肠道15株细菌分属于8个属(表 3):魏斯氏属(Weissella)、假单胞菌属(Pseudomonas)、肠球菌属(Enterococcus)、微杆菌属(Microbacterium)、鞘氨醇单胞菌属(Sphingomonas)、乳杆菌属(Lactobacillus)、马赛菌属(Massilia)、芽孢杆菌属(Bacillus)。各属细菌所占比例(图 2),其中假单胞菌属为优势属,有4株,占分离细菌总数的26.7%、其次是芽孢杆菌属,有3株,占分离细菌总数的20%;肠球菌属和鞘氨醇单胞菌属各有2株,占分离细菌总数的13.3%,其余,魏斯氏属、微杆菌属、乳杆菌属、马赛菌属各有1株。所有细菌共分成2个分类单元:变形菌门(Proteobacteria)、厚壁菌门(Firmicutes),厚壁菌门有4个属;变形菌门有4个属。
|
| 图 2 饲喂棉粕饲料组棉铃虫肠道内生细菌种类 Figure 2 The group of fed cottonseed meal diet of species of intestinal endophytic bacteria of Helicoverpa armigera. |
2.3 不同饲喂条件下棉铃虫肠道内生细菌棉酚耐受性及棉酚降解率
将不同饲喂条件下的32株菌接种于醋酸棉酚为唯一碳源的无机盐培养基中,进行梯度醋酸棉酚耐受性生长实验,28 ℃条件下培养1-2 d,观察菌株的生长状态。饲喂正常饲料组17株菌中,12株对不同浓度醋酸棉酚具有耐受能力(表 4)。其中,1-1、1-2、1-3、1-8、1-16对醋酸棉酚没有耐受能力,在醋酸棉酚为碳源的平板上几乎不生长;1-10、1-12、1-13、1-14、1-15对醋酸棉酚的耐受能力较弱;1-4、1-5、1-6、1-7、1-9、1-11、1-17对醋酸棉酚的耐受能力相对较强,在不同浓度醋酸棉酚平板上生长良好。饲喂棉粕饲料组15株菌对不同浓度醋酸棉酚均具有耐受能力。2-7、2-8、2-11、2-13、2-14、2-15在不同梯度的醋酸棉酚平板上生长良好,说明它们对醋酸棉酚有很好的耐受性;2-6、2-10、2-12在醋酸棉酚平板上生长相对较弱。
| Strains | Gossypol acetate concentration/(mg/kg) | Strains | Gossypol acetate concentration/(mg/kg) | |||||||
| 100 | 300 | 500 | 1 000 | 100 | 300 | 500 | 1 000 | |||
| 1-1 | - | - | - | - | 2-1 | ++ | ++ | ++ | - | |
| 1-2 | - | - | - | - | 2-2 | +++ | +++ | ++ | - | |
| 1-3 | - | - | - | - | 2-3 | ++ | ++ | ++ | - | |
| 1-4 | +++ | ++ | ++ | - | 2-4 | +++ | ++ | ++ | - | |
| 1-5 | +++ | ++ | ++ | - | 2-5 | ++ | ++ | ++ | - | |
| 1-6 | +++ | +++ | +++ | +++ | 2-6 | ++ | ++ | - | - | |
| 1-7 | ++ | ++ | + | - | 2-7 | +++ | +++ | +++ | +++ | |
| 1-8 | - | - | - | - | 2-8 | +++ | +++ | +++ | +++ | |
| 1-9 | +++ | +++ | ++ | - | 2-9 | +++ | ++ | + | + | |
| 1-10 | ++ | + | - | - | 2-10 | ++ | + | - | - | |
| 1-11 | +++ | +++ | +++ | +++ | 2-11 | +++ | +++ | +++ | +++ | |
| 1-12 | ++ | ++ | - | - | 2-12 | ++ | + | + | - | |
| 1-13 | + | - | - | - | 2-13 | +++ | +++ | +++ | ++ | |
| 1-14 | ++ | + | - | - | 2-14 | +++ | +++ | +++ | +++ | |
| 1-15 | ++ | + | - | - | 2-15 | +++ | +++ | +++ | +++ | |
| 1-16 | - | - | - | - | ||||||
| 1-17 | +++ | +++ | +++ | +++ | ||||||
| +++: grow well; ++: normal growth; +: weak growth; -: unable to grow. | ||||||||||
随着醋酸棉酚浓度的升高,相对饲喂棉粕饲料组,饲喂正常饲料组耐受醋酸棉酚菌株数量下降(图 3)。醋酸棉酚浓度为100 mg/kg时,饲喂正常饲料组有12株菌株耐受棉酚,饲喂棉粕饲料组有15菌株耐受;醋酸棉酚浓度为300 mg/kg时,饲喂正常饲料组有11株耐受菌株,饲喂棉粕饲料组有15株;醋酸棉酚浓度为500 mg/kg时,耐受菌株下降到7株,饲喂棉粕饲料组有13株;醋酸棉酚浓度为1 000 mg/kg时,饲喂正常饲料组只有3株耐受菌,它们是菌株1-6、1-11、1-17;而饲喂棉粕饲料组有7株耐受菌,分别是2-7、2-8、2-9、2-11、2-13、2-14、2-15。

|
| 图 3 不同饲喂下棉铃虫肠道内生菌在不同浓度醋酸棉酚下生长菌株数对比图 Figure 3 Comparison of the number of strains growing in the intestinal endophytes of Helicoverpa armigera under different concentrations of gossypol acetate under different feeding conditions. |
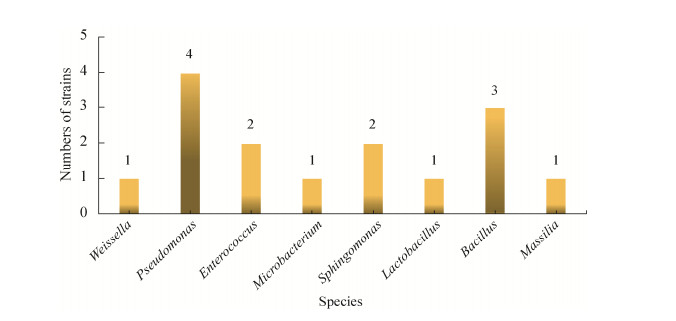
饲喂正常饲料组棉铃虫肠道中12株耐受棉酚菌株,其中对醋酸棉酚有降解效果的有10株,对棉酚的降解率在19.87%-88.68%之间,对棉酚降解率达到50%以上的菌株有5株(图 4)。其中,菌株1-6对棉酚的降解率最高,达到88.68%;1-17对棉酚的降解率为70.1%,1-5、1-11和1-9对棉酚降解率分别达到69.82%、67.85%和54.86%;1-14棉酚降解率最低,为19.87%。经鉴定,1-6为嗜吡啶红球菌(Rhodococcus pyridinivorans),1-17为巨大芽孢杆菌(Bacillus megaterium),16S rRNA基因序列相似度分别为95.69%和97.17%,可能是潜在新种。
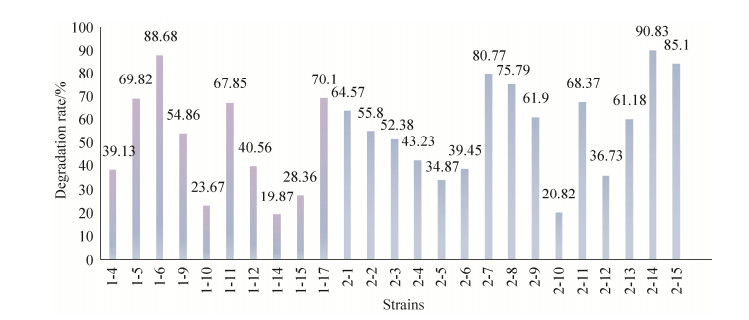
|
| 图 4 饲喂正常饲料组与饲喂棉粕饲料组棉铃虫肠道耐受棉酚内生菌的棉酚降解率 Figure 4 Gossypol degradation rate of gossypol endophytic bacteria in the group fed normal diet and cottonseed meal diet. |
饲喂棉粕饲料组棉铃虫肠道中15株耐受棉酚菌株,其中对醋酸棉酚有降解效果的有15株,对棉酚的降解率在20.82%-90.83%之间(图 4)。对棉酚降解率达到50%以上的菌株有10株,分别是2-14棉酚降解率90.83%、2-15为85.1%、2-7为80.77%、2-8为75.79%、2-11为68.37%、2-1为64.57%、2-9为61.9%、2-13为61.18%、2-2为55.8%、2-3为52.38%。经鉴定,它们分别为蒂莫内马赛菌(Massilia timonae)、枯草芽孢杆菌(Bacillus subtilis)、粪肠球菌(Enterococcus faecium)、酯芳香微菌(Microbacterium esteraromaticum)、少动鞘氨醇单胞菌(Sphingomonas paucimobilis)、蜡样芽胞杆菌(Bacillus cereus)、萤光假单胞菌(Pseudomonas fluorescens)。菌株2-14 16S rRNA基因序列相似度为95.16%,可能是潜在新种。根据菌株对棉酚的降解作用,挑选菌株进行下一步的实验。
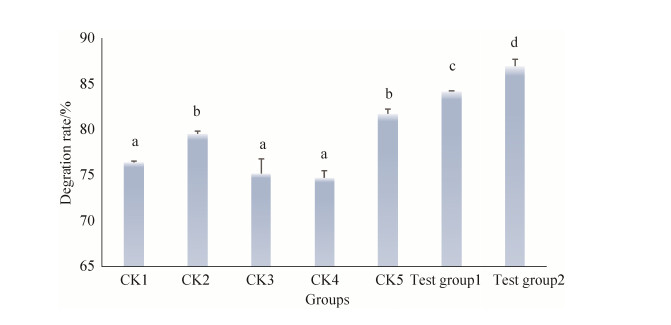
2.4 棉铃虫肠道棉酚降解菌组合对棉酚降解的效果将得到的对醋酸棉酚降解效果较好的棉铃虫肠道内生菌形成2种组合,如下:实验组1:2-15+2-7+2-10,1︰1︰1;实验组2:2-14+2-8+1-6,1︰1︰1。与实验室前期形成的棉酚降解菌组进行对比,2组棉铃虫肠道内生菌实验组对棉酚的降解率显著高于对照组(P < 0.05),实验组2棉酚降解率最高,为87.04%;实验组1棉酚降解率为84.33%。对照组对棉酚的降解率相对较低,但都到达70%以上,分别为76.6%、79.66%、75.22%、74.78%、81.79% (图 5)。实验组1菌剂组成为:枯草芽孢杆菌:粪肠球菌:植物乳杆菌=1︰1︰1;实验组2菌剂组成为:蒂莫内马赛菌:酯芳香微菌:嗜吡啶红球菌=1︰1︰1。
|
| 图 5 棉铃虫肠道棉酚降解菌组合降解效果 Figure 5 Degradation effect of combination of gossypol-degrading bacteria in the intestine of Helicoverpa armigera. |
3 讨论
昆虫肠道是宿主与外部环境之间的重要交界面,是一个庞大的微生物资源库[19],这些细菌参与昆虫肠道防御[20]及抑制有害物质[7],直接或间接地影响着宿主昆虫的生长发育[21]。有实验证明,棉铃虫在取食棉酚后会产生一系列的代谢酶来降解这些次生物质[22],推测这可能与肠道内生菌有关[23]。目前,对于棉铃虫肠道内生菌的资源挖掘还不够深入,其对棉酚的降解功能研究也鲜有报道。本文将棉铃虫经过空腹排泄24 h后,幼虫的存活率和生长力没有发生变化,饲喂非常规饲料棉粕和正常饲料,饲养至5-6龄,培养10-15 d,研究不同饲喂下肠道内生菌的变化,然后对肠道微生物进行一定的分离鉴定,这与骆伦伦[24]和胡亚楠等[16]给虫体饲喂非常规饲料后分离肠道内生菌的方法一致,通过空腹排泄后再饲喂,研究肠道微生物的变化,对肠道微生物进行一定的分离鉴定。本研究利用可培养方法[25]分离鉴定出的32株菌,16S rRNA基因序列相似度小于98.65%的菌种有17株,其中正常饲料喂组有9株,饲喂棉粕饲料组有8株。为今后采用高通量技术持续了解棉铃虫肠道内生细菌的种类、数量、分布,收集新种、新属打下良好的基础。
常见昆虫肠道内生细菌有变形菌(Proteobacteria)、拟杆菌(Bacteroidetes)、厚壁菌(Firmicutes)、放线菌(Actinomycetes)、螺旋体(Spirochetes)、和疣微菌(Verrucomicrobia) 等[26]。本研究以不同饲喂方式的棉铃虫为材料,通过饲喂棉粕驯化,采用富集培养、选择性培养等方法筛选可培养的肠道内生菌。饲喂正常饲料虫肠道中分离出17株,饲喂棉粕的虫肠道中分离出15株。16S rRNA测序结果表明,本研究饲喂正常饲料组的棉铃虫肠道分离出的细菌共分成3个分类单元:变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria),其中,放线菌门有2个属,厚壁菌门有5个属,变形菌门共有3个属;饲喂棉粕饲料组分成2个分类单元:变形菌门(Proteobacteria)、厚壁菌门(Firmicutes),其中,厚壁菌门有4个属,变形菌门有4个属。本研究饲喂正常饲料组和饲喂棉粕饲料组棉铃虫肠道内生可培养微生物结构呈现一定的不同,这跟外界的生存环境有一定的相关性[27],取食可能是造成肠道微生物组成结构存在差异的主要影响因素[28],饲喂正常饲料组棉铃虫肠道中芽孢杆菌属为优势属,占分离细菌总数的41%;其次是肠球菌属,占分离细菌总数的12%;其余各属各1株。另有研究表明,在特定条件的作用下分析棉铃虫肠道微生物有助于研究肠道菌群与棉铃虫抗性的联系[29],本研究饲喂棉粕后,棉铃虫肠道微生物结构发生了变化,假单胞菌属为优势属,占分离细菌总数的26.7%,芽孢杆菌属呈现了下降,占总菌数的20%;肠球菌属和鞘氨醇单胞菌属占13.3%。研究结果说明,假单胞菌、芽孢杆菌、肠球菌等在棉铃虫饲喂棉粕饲料后,对维持其生长和保护肠道起到一定作用[30]。
昆虫可以适应各种生境的重要原因之一是其肠道微生物在共同进化的过程中形成了复杂多样的种群结构和生物学功能[31],发掘和利用关键微生物特定的生物学功能,具有重要的实践价值。棉酚是锦葵科棉属植物分泌产生的一种多酚二萘结构衍生物[32],对动物机体健康产生各种危害[33-35],而且它也是制约棉源副产物成为优质反刍动物粗饲料的制约因素[36]。现今,动物饲料呈现绿色、安全、健康、无抗的发展趋势,发掘微生物资源寻求安全经济的生物发酵技术消除饲料中抗营养因子的毒害成为研究热点。利用微生物降解棉酚的研究始于20世纪80年代,但研究进展缓慢。国内所筛选的降解棉酚菌种主要集中在黑曲霉和产阮假丝酵母2类[37],地衣芽孢杆菌、植物乳杆菌、枯草芽孢杆菌等益生菌也具有一定的脱毒功能[36]。有研究表明,昆虫在一定代谢水平上可以对寄主植物次生物质产生防御机制[38],本研究通过可培养的方式分离培养棉铃虫肠道内生微生物,经过不同程度的胁迫适应性生长,分别在饲喂正常饲料组和饲喂棉粕饲料组得到对不同浓度醋酸棉酚具有耐受能力的菌株27株,饲喂棉粕饲料组虫肠道中分离出的15株菌株几乎对棉酚都有一定的耐受性,说明在饲喂棉粕饲料的过程中,虫肠道内生菌对棉酚产生了一定的耐受性,从而提高了棉铃虫对饲喂环境的适应性[20]。本研究通过棉酚降解实验得到对棉酚降解效率达50% 的菌株有15株,棉酚降解率最高达到90.83%,是1株来自饲喂棉粕饲料组分离的蒂莫内马赛菌(Massilia timonae),属于变形菌门(Proteobacteria)。杨恩东等[39]在对蒂莫内马赛菌的功能性研究上发现其对多环芳烃(polycyclic aromatic hydrocarbons,PAHs)具有降解作用,本研究中蒂莫内马赛菌对多酚二萘结构的棉酚毒性有抑制作用,但其降解机理还需进一步研究。目前,对多环芳烃毒性物有降解效果的大多为细菌,包括假单胞菌属(Pseudomonas)、红球菌属(Rhodococcus)、气单胞菌属(Aeromonas)、芽孢杆菌属(Bacillus)[40]等。在本研究中,筛选到的1株嗜吡啶红球菌(Rhodococcus pyridinivorans)对棉酚降解率达到88.68%,1株来自饲喂棉粕饲料组的枯草芽孢杆菌(Bacillus subtilis)对棉酚降解率达85.1%,说明在棉铃虫肠道中存在一定的多环芳烃毒性物抑制细菌,后期应通过高通量技术做更深入的挖掘。
目前,具有高效生物降解性能的复合制剂还很稀少。通过复配和组合,确实在一定程度上可以加强降解棉酚菌株的功能性[41-42]。本研究利用与多环芳烃毒性物有降解效果细菌进行混合配比,与实验室已有的相关棉酚降解菌剂对比,两组饲喂棉铃虫肠道内生菌实验组对棉酚的降解率显著高于对照组(P < 0.05)。这是首次报道棉铃虫肠道可培养内生混合菌对棉酚的降解效果,填补了昆虫肠道微生物在棉酚脱毒应用上的研究空白。本研究结果证实,棉铃虫肠道内存在棉酚降解细菌,为棉酚的生物降解菌的发掘提供了一条新途径。在本研究筛选出棉酚降解菌株的基础上,还要研究通过添加表面活性剂、调整碳氮源、优化培养条件等措施来提高降解效率,进一步研究降解的关键酶系,探究降解机制,以深入挖掘降解菌株的降解潜能,以期通过微生物及其发酵技术提高棉源副产物饲料的利用率,提高营养价值,解决新疆畜牧业饲料供应可持续发展的瓶颈问题。
| [1] |
Qian YY, Liu Y, Zhang HN, Cui SF, Jin WP, Wang GE, Li JL. Advances in genes related to gossypol biosynthesis and cotton gland formation. Cotton Science, 2017, 29(3): 301-306.
(in Chinese) 钱玉源, 刘祎, 张海娜, 崔淑芳, 金卫平, 王广恩, 李俊兰. 棉酚合成及棉花腺体形成相关基因的研究进展. 棉花学报, 2017, 29(3): 301-306. |
| [2] |
Hu B, Zheng WX, Gao WM, Yang HY. Research progress of toxicology and detoxification technology of free gossypol. Grass-Feeding Livestock, 2020(3): 1-7, 38.
(in Chinese) 胡波, 郑文新, 高维明, 杨海燕. 游离棉酚毒理学与脱毒技术的研究进展. 草食家畜, 2020(3): 1-7, 38. |
| [3] | 杨霞. 高效棉酚降解菌株的筛选鉴定及其差异蛋白质组学研究. 浙江大学学位论文, 2010. |
| [4] |
Zhou MY, Li HF, Wu Y, Yao J. Study on reproductive toxicity of free gossypol degradation products tetramethoxyl gossypol by mice sperm deformity effect. Journal of Xinjiang Medical University, 2018, 41(6): 744-746.
(in Chinese) 周梦宇, 李海芳, 武钰, 姚军. 游离棉酚降解产物四甲氧基棉酚致小鼠精子畸形效应的生殖毒性研究. 新疆医科大学学报, 2018, 41(6): 744-746. |
| [5] | Santana AT, Guelfi M, Medeiros HCD, Tavares MA, Bizerra PFV, Mingatto FE. Mechanisms involved in reproductive damage caused by gossypol in rats and protective effects of vitamin E. Biological Research, 2015, 48: 43. DOI:10.1186/s40659-015-0026-7 |
| [6] | 李建国. 游离棉酚对蛋鸡的毒性研究. 西北农林科技大学学位论文, 2005. |
| [7] | Stecher B, Hardt WD. Mechanisms controlling pathogen colonization of the gut. Current Opinion in Microbiology, 2011, 14(1): 82-91. DOI:10.1016/j.mib.2010.10.003 |
| [8] | Kaltenpoth M, Engl T. Defensive microbial symbionts in Hymenoptera. Functional Ecology, 2014, 28(2): 315-327. DOI:10.1111/1365-2435.12089 |
| [9] | Smith CC, Srygley RB, Healy F, Swaminath K, Mueller UG. Spatial structure of the Mormon cricket gut microbiome and its predicted contribution to nutrition and immune function. Frontiers in Microbiology, 2017, 8: 801. DOI:10.3389/fmicb.2017.00801 |
| [10] | Thong-On A, Suzuki K, Noda S, Inoue JI, Kajiwara S, Ohkuma M. Isolation and characterization of anaerobic bacteria for symbiotic recycling of uric acid nitrogen in the gut of various termites. Microbes and Environments, 2012, 27(2): 186-192. DOI:10.1264/jsme2.ME11325 |
| [11] | Ceja-Navarro JA, Vega FE, Karaoz U, Hao Z, Jenkins S, Lim HC, Kosina P, Infante F, Northen TR, Brodie EL. Gut microbiota mediate caffeine detoxification in the primary insect pest of coffee. Nature Communications, 2015, 6: 7618. DOI:10.1038/ncomms8618 |
| [12] | Radominska-Pandya A, Bratton SM, Redinbo MR, Miley MJ. The crystal structure of human UDP-glucuronosyltransferase 2B7 C-terminal end is the first mammalian UGT target to be revealed: the significance for human UGTs from both the 1A and 2B families. Drug Metabolism Reviews, 2010, 42(1): 133-144. DOI:10.3109/03602530903209049 |
| [13] | Howe GA, Jander G. Plant immunity to insect herbivores. Annual Review of Plant Biology, 2008, 59(1): 41-66. DOI:10.1146/annurev.arplant.59.032607.092825 |
| [14] | Frago E, Dicke M, Godfray HCJ. Insect symbionts as hidden players in insect-plant interactions. Trends in Ecology & Evolution, 2012, 27(12): 705-711. |
| [15] | 叶明. 微生物学实验技术. 合肥: 合肥工业大学出版社, 2009: 371-373. |
| [16] |
Hu YN, He X, YASENShali, Luo M, Zhang YH, Zhang S. Screening of polyethylene film-degrading bacteria from gut microbiota of Galleria mellonella and Tenebrio molitor. Microbiology China, 2020, 47(12): 4029-4041.
(in Chinese) 胡亚楠, 贺旭, 亚森·沙力, 罗明, 张宇宏, 张帅. 大蜡螟和黄粉虫肠道菌中聚乙烯地膜降解细菌的筛选及其降解性能. 微生物学通报, 2020, 47(12): 4029-4041. |
| [17] | Kim M, Oh HS, Park SC, Chun J. Towards a taxonomic coherence between average nucleotide identity and 16S rRNA gene sequence similarity for species demarcation of prokaryotes. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(Pt 2): 346-351. |
| [18] | Tindall BJ, Rosselló-Móra R, Busse HJ, Ludwig W, Kämpfer P. Notes on the characterization of prokaryote strains for taxonomic purposes. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(Pt 1): 249-266. |
| [19] | Byndloss MX, Bäumler AJ. The germ-organ theory of non-communicable diseases. Nature Reviews Microbiology, 2018, 16(2): 103-110. DOI:10.1038/nrmicro.2017.158 |
| [20] |
Yao ZC, Bai S, Zhang HY. Intestinal defense system and mechanism of maintenance of microbiota homeostasis in insects. Acta Microbiologica Sinica, 2018, 58(6): 1036-1048.
(in Chinese) 姚志超, 白帅, 张宏宇. 昆虫肠道防御及微生物稳态维持机制. 微生物学报, 2018, 58(6): 1036-1048. |
| [21] | Crotti E, Balloi A, Hamdi C, Sansonno L, Marzorati M, Gonella E, Favia G, Cherif A, Bandi C, Alma A, Daffonchio D. Microbial symbionts: a resource for the management of insect-related problems. Microbial Biotechnology, 2012, 5(3): 307-317. DOI:10.1111/j.1751-7915.2011.00312.x |
| [22] | Tao XY, Xue XY, Huang YP, Chen XY, Mao YB. Gossypol-enhanced P450 gene pool contributes to cotton bollworm tolerance to a pyrethroid insecticide. Molecular Ecology, 2012, 21(17): 4371-4385. DOI:10.1111/j.1365-294X.2012.05548.x |
| [23] | Frago E, Dicke M, Godfray HCJ. Insect symbionts as hidden players in insect-plant interactions. Trends in Ecology & Evolution, 2012, 27(12): 705-711. |
| [24] | 骆伦伦. 秸秆对黄粉虫生长发育、消化酶和肠道微生物的影响. 浙江农林大学学位论文, 2017. |
| [25] |
Mei C, Fan S, Yang H. The strategies of isolation of insect gut microorganisms. Acta Microbiologica Sinica, 2018, 58(6): 985-994.
(in Chinese) 梅承, 范硕, 杨红. 昆虫肠道微生物分离培养策略及研究进展. 微生物学报, 2018, 58(6): 985-994. |
| [26] | Colman DR, Toolson EC, Takacs-Vesbach CD. Do diet and taxonomy influence insect gut bacterial communities?. Molecular Ecology, 2012, 21(20): 5124-5137. DOI:10.1111/j.1365-294X.2012.05752.x |
| [27] | Engel P, Moran NA. The gut microbiota of insects - diversity in structure and function. FEMS Microbiology Reviews, 2013, 37(5): 699-735. DOI:10.1111/1574-6976.12025 |
| [28] | Rodríguez-Ruano SM, KochováV, Rego ROM, Schmidt JO, Roachell W, Hypša V, Nováková V. Microbiomes of North American Triatominae: the grounds for Chagas disease epidemiology. Frontiers in Microbiology, 2018, 9: 1167. DOI:10.3389/fmicb.2018.01167 |
| [29] | Xia XF, Sun BT, Gurr GM, Vasseur L, Xue MQ, You MS. Gut microbiota mediate insecticide resistance in the diamondback moth, Plutella xylostella (L.). Frontiers in Microbiology, 2018, 9: 25. DOI:10.3389/fmicb.2018.00025 |
| [30] |
Jiang XW, Guan DY, Li QY, Liu X, Libyarlay H, He BJ. Effects of tefluthrin and deltamethrin on gut microbiota in Helicoverpa armigera (Lepidoptera: noctuidae). Acta Entomologica Sinica, 2020, 63(10): 1183-1193.
(in Chinese) 姜笑维, 关丹阳, 李清亚, 刘晓, Hongmei LI-BYARLAY, 贺秉军. 七氟菊酯和溴氰菊酯对棉铃虫肠道菌群的影响. 昆虫学报, 2020, 63(10): 1183-1193. |
| [31] |
Wei FW. New angle to study the adaptive evolution: animal gut microbiome. Scientia Sinica: Vitae, 2016, 46(11): 1338-1340.
(in Chinese) 魏辅文. 动物适应性进化研究的新视角: 动物肠道微生物组. 中国科学: 生命科学, 2016, 46(11): 1338-1340. |
| [32] |
Hou M, Liu YN, Wang N, Bao HF, Zhan FQ, Hou XQ, Yang R, Cui WD. Advances in the application of microbial fermentation technology on cotton seed husk feed in Xinjiang. Heilongjiang Animal Science and Veterinary Medicine, 2020(21): 44-47, 56.
(in Chinese) 侯敏, 刘亚男, 王宁, 包慧芳, 詹发强, 侯新强, 杨蓉, 崔卫东. 微生物发酵技术在新疆棉籽壳饲料化的应用研究进展. 黑龙江畜牧兽医, 2020(21): 44-47, 56. |
| [33] | Panigrahi S, Hammonds TW. Egg discolouration effects of including screw-press cottonseed meal in laying hen diets and their prevention. British Poultry Science, 1990, 31(1): 107-120. DOI:10.1080/00071669008417236 |
| [34] | Santana AT, Guelfi M, Medeiros HCD, Tavares MA, Bizerra PFV, Mingatto FE. Mechanisms involved in reproductive damage caused by gossypol in rats and protective effects of vitamin E. Biological Research, 2015, 48: 43. DOI:10.1186/s40659-015-0026-7 |
| [35] | Ni ZH, Dai XF, Wang B, Ding W, Cheng PK, Xu L, Lian JQ, He FT. Natural Bcl-2 inhibitor (−)-gossypol induces protective autophagy via reactive oxygen species-high mobility group box 1 pathway in Burkitt lymphoma. Leukemia & Lymphoma, 2013, 54(10): 2263-2268. |
| [36] |
Hou M, Bao HF, Wang N, Zhan FQ, Yang R, Long XQ, Cui WD. Screening and breeding of highly-effected degrading gossypol strains and study on defoxication technology and conditions. Xinjiang Agricultural Sciences, 2016, 53(6): 1114-1121.
(in Chinese) 侯敏, 包慧芳, 王宁, 詹发强, 杨蓉, 龙宣杞, 崔卫东. 高效降解棉酚菌株的筛选及脱毒条件的研究. 新疆农业科学, 2016, 53(6): 1114-1121. |
| [37] |
Zhang WJ, Xu ZR, Sun JY, Yang X, Zhao SH. Effect of solid substrate fermentation with mixed cultured C. tropicalis ZD-3 and A. niger ZD-8 on nutritional value and detoxification of cottonseed meal. Journal of the Chinese Cereals and Oils Association, 2006, 21(6): 129-135.
(in Chinese) 张文举, 许梓荣, 孙建义, 杨霞, 赵顺红. 假丝酵母ZD-3与黑曲霉ZD-8复合固体发酵对棉籽饼脱毒及营养价值的影响研究. 中国粮油学报, 2006, 21(6): 129-135. DOI:10.3321/j.issn:1003-0174.2006.06.032 |
| [38] | Krempl C, Heidel-Fischer HM, Jiménez-Alemán GH, Reichelt M, Menezes RC, Boland W, Vogel H, Heckel DG, Joußen N. Gossypol toxicity and detoxification in Helicoverpa armigera and Heliothis virescens. Insect Biochemistry and Molecular Biology, 2016, 78: 69-77. DOI:10.1016/j.ibmb.2016.09.003 |
| [39] |
Yang ED, Cui DX, Wang WY. Research progress on the genus Massilia. Microbiology China, 2019, 46(6): 1537-1548.
(in Chinese) 杨恩东, 崔丹曦, 汪维云. 马赛菌属细菌研究进展. 微生物学通报, 2019, 46(6): 1537-1548. |
| [40] |
Wang T, Lan H, Tian Y, Lu XY. Research progress on microbial degradation mechanisms for polycyclic aromatic hydrocarbons. Chemistry & Bioengineering, 2016, 33(2): 8-14.
(in Chinese) 王涛, 蓝慧, 田云, 卢向阳. 多环芳烃的微生物降解机制研究进展. 化学与生物工程, 2016, 33(2): 8-14. DOI:10.3969/j.issn.1672-5425.2016.02.002 |
| [41] |
Guo K, Cui WD, Wang N, Hou M, Bao HF, Fang SJ. Optimization of cellulase production by Aspergillus niger ZD using solid fermentation of cotton straw. Xinjiang Agricultural Sciences, 2018, 55(9): 1717-1727.
(in Chinese) 郭凯, 崔卫东, 王宁, 侯敏, 包慧芳, 房世杰. 黑曲霉ZD利用棉花秸秆固体发酵产纤维素酶条件优化. 新疆农业科学, 2018, 55(9): 1717-1727. |
| [42] | Oboh G. Nutrient enrichment of cassava peels using a mixed culture of Saccharomyces cerevisae and Lactobacillus spp. solid media fermentation techniques. Electronic Journal of Biotechnology, 2006, 9(1): 46-49. DOI:10.2225/vol9-issue1-fulltext-1 |
 2022, Vol. 62
2022, Vol. 62