中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 李威杰, 刘明刚, 李建臻, 潘康成. 2022
- Weijie LI, Minggang LIU, Jianzhen LI, Kangcheng PAN. 2022
- 枯草芽孢杆菌表面展示技术用于黏膜疫苗的研究进展
- Research progress on Bacillus subtilis surface display technology for mucosal vaccine
- 微生物学报, 62(1): 65-76
- Acta Microbiologica Sinica, 62(1): 65-76
-
文章历史
- 收稿日期:2021-04-29
- 修回日期:2021-07-21
- 网络出版日期:2021-11-05
2. 福建洛东生物技术有限公司, 福建 莆田 351162;
3. 成都农业科技职业学院, 四川 成都 611130
2. Fujian Luodong Bio-Technology Limited Compamy, Putian 351162, Fujian, China;
3. Chengdu Agricultural College, Chengdu 611130, Sichuan, China
枯草杆菌是一种好氧、形成芽孢的革兰氏阳性菌,其分泌能力强,细胞壁结构简单,不含毒素,是非致病性和非侵入性的细菌,被公认为安全的可直接食用的微生物(GRAS)[1],目前已广泛地用作人类和其他动物的益生菌和食品添加剂[2]。枯草杆菌的芽孢可耐受高温、干燥、裂解酶、有毒化学物质、紫外线辐射和极端pH值等,因此,可利用芽孢的外壳蛋白(如CotB,CotC和CotG)作为载体,可在芽孢表面稳定展示异源抗原,是口服疫苗抗原递送的理想平台[3]。1985年Smith[4]发表利用丝状融合噬菌体作为表达载体进行表面展示抗原技术以来,许多真核、原核生物的表面展示技术被陆续报道[5-6]。尽管微生物的表面展示技术具有操作简单、表达的外源蛋白稳定等优势,但非芽孢杆菌类微生物的表面展示系统不耐热、不耐酸碱和不耐贮存等问题,于2001年Isticato等首次成功在枯草杆菌的芽孢表面展示了破伤风毒素蛋白C端的459个氨基酸残基[7]。目前,枯草杆菌的芽孢表面展示系统已经被成功地用于药物或抗原的递送、生物催化、污染物的监测以及生物修复等领域[8-10]。枯草杆菌芽孢表面展示技术(Bacillus subtilis spore surface display,BSSD)的基本原理是通过使用各种技术将外源蛋白锚定在芽孢上来增强靶蛋白的功能与稳定性。本文旨在讨论BSSD技术用于生产口服黏膜疫苗的策略、应用的最新进展以及未来前景。
1 芽孢的形成与结构 1.1 芽孢的形成不利的环境条件将刺激营养细胞内部的级联化磷酸反应,改变转录蛋白Spo0A的磷酸化水平来控制营养性细胞向芽孢化转变。低水平的Spo0A磷酸化促进生物膜的形成,高水平的Spo0A磷酸化就会启动芽孢化的过程[11]。在初始阶段,营养细胞的复制染色质借助RecA蛋白定位到细胞两极,然后细胞膜激活σF和σE因子将细胞不对称地分隔成前芽孢与母细胞。随后前芽孢在σF和σE因子的介导下被母细胞吞噬。此外σF和σE因子在细胞中调控相关基因的表达,从而激活σG和σK 2种细胞因子,促进细菌细胞壁周围形成一层肽聚糖薄层。最后在活化的芽孢自溶酶的作用下,母细胞裂解释放出成熟的芽孢[12]。如果有足够的营养,芽孢又可以恢复营养生长,重新发育为营养细胞。
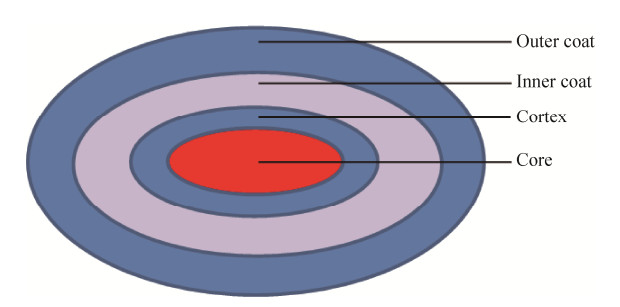
1.2 芽孢的结构成熟的芽孢结构由内而外包括核心、皮层、芽孢衣与外芽孢(图 1)。核心中包含细菌基因组DNA及2, 6-吡啶二羧酸(pyridine-2, 6-dicarboxylic acid,DPA)与α/β型的小型的酸溶性芽孢蛋白(small acid soluble spore proteins,SASP),其中DPA取代核心的水分,而SASP与基因组中DNA结合。DPA可以大大增强芽孢的耐热性和抵抗紫外线能力,具有维持脱水、芽孢休眠和复苏的作用,而SASP与DPA协同作用保护细菌基因组抵抗外界的湿热、干燥、强氧化性等[13]。芽孢的皮层主要由肽聚糖(PG)组成,其结构与营养细胞细胞壁中的肽聚糖结构类似但是具有特殊的修饰过程。芽孢衣由约70种蛋白质组成,其复杂结构使得芽孢具有抵抗化学试剂的能力[14]。
|
| 图 1 芽孢结构模式图 Figure 1 Schematic diagram of spore structure. |
2 芽孢杆菌表面展示的策略 2.1 基因重组方法
基因重组方法是BSSD技术中最常用的方法,原理是将编码芽孢表面的锚定蛋白与外源蛋白的基因融合并与质粒连接为重组质粒。重组菌在形成芽孢时,外源蛋白与芽孢衣壳蛋白一同表达在芽孢表面[15]。根据基因重组所用到的质粒种类,可分为游离型与整合型质粒。其中整合型质粒是在质粒的融合基因两端加上枯草杆菌基因组的同源臂与抗生素的抗性标记基因,质粒进入枯草杆菌感受态细胞后发生同源交叉重组事件。
同源重组的片段多为不影响枯草杆菌生长的基因片段如thrC、amyE、pyrD、lacA、scaA和gltA[16]。整合型质粒没有枯草杆菌的复制起始位点,只有通过同源重组将插入的目的基因片段整合到细菌基因组中才能发挥作用。同源重组之后的重组菌,拥有了相应的抗生素抗性可以进行筛选。Iwanicki等[17]报道了16种可用于染色体整合的载体质粒,这类质粒中没有插入抗生素的抗性基因,但是在构建载体时需插入营养缺陷型的相关营养基因,才能成功从缺乏某种营养成分的培养基筛选得到重组菌,这种无抗生素筛选方式使得这类重组芽孢杆菌不会向外界环境扩散抗性基因。以amyE为同源臂构建的整合型质粒是目前使用最多的,因为当外源基因被插入时会破坏amyE基因使得宿主菌表达淀粉酶的能力丧失,可以快速筛选阳性重组子。此外还有一类整合型载体只含有一段同源臂,重组载体转入枯草杆菌后发生单交叉互换。这类载体发生同源重组所需的同源臂更短,整合率高并且能稳定地存在于染色体上,不易发生逆转。Feucht等[18]利用PSG1151构建的重组整合质粒,在枯草杆菌中发生单交叉重组,从而获得表达融合荧光蛋白以标记活细胞中的蛋白定位。一些整合型质粒见表 1。
| Vector plasmids | Homologous fragments | References |
| pDG364 | aymE | Dai X et al., 2018[8] |
| pDG1663 | trpC | A M Guérout-Fleury et al., 1996[19] |
| pDG1661 | amyE | A M Guérout-Fleury et al., 1996[19] |
| pDL | amyE | Yuan G et al., 1995[20] |
| pJOE8999 | aymE | Antonio García-Moyano et al., 2020[21] |
| pA-spac | lacA | B Härtl et al., 2001[22] |
| pNW33N | aymE | Bin Ye et al., 2020[23] |
| pGlt-Cm | gltA | Rebecca Middleton et al., 2004[24] |
| pSac-Kan | sacA | Rebecca Middleton et al., 2004[24] |
游离型质粒又称为自主复制型载体,融合基因连接在这类载体上转入芽孢杆菌后可以自我复制与表达。这类载体在大肠杆菌与枯草杆菌中都具有相应的启动子,在枯草杆菌中以衣壳蛋白启动子作为其穿梭至芽孢杆菌后的启动位点。这样在芽孢化时穿梭质粒就被激活,融合蛋白开始表达,外源蛋白随着衣壳蛋白锚定在芽孢表面。但是这类穿梭质粒并不像整合型质粒那样具有很好的遗传稳定性,容易随着细菌的分裂增殖时发生质粒丢失[25]。由于这类质粒的不稳定性使得外源蛋白在枯草杆菌中的表达水平受到了限制,因此,研究出稳定遗传不易丢失的游离型穿梭质粒是未来的研究方向之一。Zhao等[26]报道了一种具有高拷贝数,高遗传稳定型的游离型穿梭质粒—pWB980,该质粒来源于pUB110质粒。他们研究了多种质粒上启动子的插入位点,发现在BA3-1上游插入启动子可以使得质粒具有更高的拷贝数与更好的遗传稳定性,并且利用pWB980构建的重组穿梭质粒表达外源的碱性蛋白酶Spro1和碱性果胶酸裂合酶PelN的产量明显高于pUB110重组质粒。
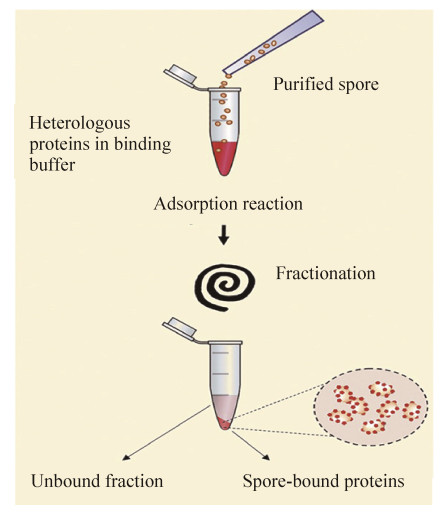
2.2 非基因重组非基因重组方法是将已经纯化的外源蛋白吸附于芽孢表面(图 2)。Huang等[27]首次使用非重组方式在枯草杆菌芽孢表面吸附了各种蛋白,如破伤风杆菌TTFC蛋白、炭疽芽孢杆菌PA蛋白、产气荚膜梭菌Cpa蛋白以及日本血吸虫谷胱甘肽S转移酶。在这项研究中发现,芽孢带负电荷和疏水性的表面为吸附异源蛋白提供了合适的平台,并且在低pH环境会加强芽孢与蛋白之间的静电与疏水作用,促进它们之间的非共价结合。他们的研究证明,非重组吸附的抗原可有效发挥黏膜免疫的作用。有趣的是即使结合了异源蛋白的芽孢被灭活,但发挥的免疫保护效果仍与活芽孢相当。因此,有理由相信芽孢在呈递所结合的抗原时,其天然构象起到了免疫佐剂的作用。这种吸附后的抗原蛋白或者酶蛋白在高温(75 ℃)和低pH值(pH 4.0)下比未结合的游离蛋白更稳定[28-29]。
在最近的一些研究中更多的抗原被成功地吸附到了芽孢表面上,并且均被证实可以诱导特异性的免疫反应。如大肠杆菌不耐热性肠毒素B亚基(LTB)[30]以及艰难梭菌毒素蛋白BclA2[31]均被成功地吸附于芽孢表面。有趣的是在对吸附的LTB蛋白空间结构进行分析时发现,该抗原以五聚体的形式存在于芽孢表面,表明芽孢表面吸附更适合于抗原以其天然构象进行展示。在基于Isticato等提出的标准吸附方法(图 2)的基础上,有许多人对吸附方法进行了改良。Song等将芽孢灭活后再用于吸附抗原,已经成功地吸附了H5N1流感病毒粒子[32]和结核分枝杆菌Acr-Ag85B抗原[33]。此外,Gashtasbi等与Ghaedmohammadi等[34-35]分别用戊二醛等作为交联剂,将α-淀粉酶和金黄色葡萄球菌SpA蛋白吸附在枯草杆菌的芽孢表面上,获得更稳定的非重组表面展示蛋白。
3 芽孢表面展示系统的组成 3.1 衣壳蛋白衣壳蛋白对于在芽孢表面成功表达外源蛋白至关重要。有效的外壳蛋白需要满足以下要求[37]:(1) 拥有可以确保外源蛋白成功展示在芽孢表面的结构域;(2) 拥有可与外源蛋白融合的锚定结构域,以将外源蛋白牢固地展示在芽孢表面;(3) 融合蛋白不影响它们各自结构与功能的外壳蛋白与外源蛋白组成;(4) 拥有在胞外周质抵抗蛋白酶水解的能力。
近年来,报道了许多衣壳蛋白可以在BSSD技术中使用,包括CotB、CotC、CotG、CotZ、CotX、CotY、CotA、OxdD、CotE、CotZ、CgeA等,其中对CotB、CotC和CotG研究较为广泛、深入。CotB与CotC主要用于展示抗原,而CotG主要用于展示有活性的酶蛋白等。这3种衣壳蛋白的位置与丰度可以确保BSSD的外源蛋白与外部环境的接触最大。CotZ可用于表达相对分子质量较大的蛋白,如FliD(艰难梭菌的鞭毛蛋白)。Negri等[38]使用CotB、CotC、CotG和CotZ作为BSSD的锚定蛋白,成功展示了FliD蛋白片段,并诱导了特异性的免疫应答。目前为止,除了内衣壳蛋白OxdD外,用到的锚蛋白都属于外衣壳蛋白。Potot等[39]利用OxdD成功展示了具有活性的植酸酶。内衣壳蛋白目前的应用仍然很少,但由于其在衣壳蛋白中的特殊定位,可以最大程度地减少芽孢外壳蛋白组装过程对外源蛋白的影响,从而更大程度地保护外源蛋白,因此在表面展示高分子量的寡聚酶上有很广阔的研究前景。
3.2 连接肽在早期表面展示系统的融合蛋白的设计中并没有用到连接肽,而是直接将衣壳蛋白与外源蛋白进行简单融合,这种方法时常会使得融合的2种蛋白之间形成空间位阻,无法形成正确的空间折叠,从而影响表面展示蛋白的活性[40]。因此,人们逐渐开始使用连接肽。
1988年Huston等[41]最先应用甘氨酸Gly于连接肽的设计中,提出的(GGGGS)n(n≤6)循环序列已经被广泛应用。这种连接肽由于富含甘氨酸而使得整体柔软易弯折,因此被称为柔性连接肽。但由于柔性连接肽柔软的结构使得融合蛋白可能形成“肩并肩”的结构导致它们之间
靠拢挤压,使得活性位点被掩埋导致活性下降。因此,2001年Arai等[42]报道了一种(EAAAK)n (n=2–5)构成的刚性连接肽。该连接肽可以形成稳定的α-螺旋结构,可有效地将融合蛋白之间的功能域分隔开。Hinc等[43]首先将一种新型的稳定连接肽(GGGEAAAKGGG)应用于脲酶ureA亚单位基因与cotB基因融合构成的融合基序,并成功构建了(CotB-GGGEAAAKGGG- UreA)和(CotB-GGGGS-UreA),新型连接肽(CotB-GGGEAAAKGGG-UreA)融合基序在枯草杆菌芽孢上展示约1.0×104个重组分子,而(CotB-GGGGS-UreA)融合基序则仅展示2.5×102个重组分子。Ullah等[44]以CotB为融合基序在芽孢表面展示海栖热袍菌脂肪酶Tm1350时发现,使用了连接肽(GGGGS)4与(GGGGS- GGGGS-EAAAK-EAAAK-GGGGS-GGGGS)时酶活性分别比未使用连接肽时高了1.29倍与1.16倍,在80 ℃孵育5 h后表现出了较高的热稳定性,而酶活性提高了1.4倍与1.35倍。Negri等[38]对比研究CotB-FliD与CotB-linker-FliD 2种展示FliD抗原的方式发现,前者在每个芽孢表面展示6.9×102个抗原蛋白,后者在芽孢表面上则展示1.1×103个抗原蛋白。由此可见,设计适当的连接肽在提高BSSD效率的应用上至关重要。
4 芽孢表面展示在制备口服黏膜疫苗中的应用黏膜免疫疫苗具有免疫程序的简化、免疫接种快速、安全性高、降低疫苗生产的成本和注射带来的痛苦等优点。当通过点眼、滴鼻方式等接种疫苗时在黏膜和全身水平都可以观察到有效的免疫反应,但其缺点是抗原可能迁移到中枢神经系统,从而增加了不良风险。就免疫程序的简便以及预防肠道病原感染而言,口服黏膜疫苗可能是最有吸引力的方法。然而,胃肠道理化环境常导致抗原蛋白降解并且会阻碍抗原呈递,这是阻碍口服疫苗发展的主要原因之一。由于枯草杆菌的芽孢特殊结构,展示在芽孢表面的异源抗原对恶劣的外界环境具有独特的抵抗能力,而且已经证实枯草杆菌芽孢具有免疫佐剂的作用[45],因而芽孢作为口服黏膜疫苗递送载体可克服其缺点。
4.1 口服黏膜疫苗介导的免疫应答有效的黏膜疫苗不仅应在黏膜递送部位提供相应的黏膜免疫,还应该在全身都可以诱导产生相应的免疫保护作用。特异性上皮细胞微褶细胞(M细胞)主要存在于肠道中的派尔集合淋巴结[46]。这种细胞负责摄取抗原并将其呈递给黏膜淋巴组织中的树突状细胞(DC)。DC将表面展示异源抗原的芽孢加工后呈递给T细胞与B细胞,产生特异性B淋巴母细胞后分化为浆细胞分泌IgA与IgG。IgA通过分泌片的介导进入黏膜表面中和抗原物质,而IgG进入外周血液与组织液中发挥全局免疫作用。此外DC提呈的抗原在MHC II分子介导下激活CD4+ T细胞,其中CD4+ Th2细胞可以分泌TGF-β、IL-4、IL-5、IL-6及IL-10等细胞因子。这些细胞因子又可以协同促进sIgA+ B细胞分化为IgA+浆细胞[47]。
Huang等[48]研究发现重组枯草杆菌可以诱导细胞毒性T淋巴细胞(CTL)反应,这在对抗细胞内病原体及癌症中十分重要。目前为止,基于可溶性抗原的亚单位疫苗难以诱导CTL反应,因为异源抗原的呈递偏向于MHC II类,从而导致CD4+ T发挥作用而非CD8+ T细胞诱导的细胞毒作用。Duc等[49]发现重组芽孢杆菌被M细胞摄取后会被递送至派尔集合淋巴结与肠系膜淋巴结,在淋巴结中被巨噬细胞吞噬的芽孢有部分已经萌发;在免疫的早期阶段,血清中IgG2a亚类比IgG1、IgG2b更多,这一结果表明发生了由TH1细胞介导的CTL反应与相应的IgG合成;对细胞免疫早期主要效应物IFN-γ的mRNA进行荧光定量分析也证明发生了细胞免疫。这些证据都表明,摄入重组枯草杆菌有利于抗原呈递向MHC I类分子发展,从而诱导TH1型细胞介导的CTL反应。这一发现为益生菌的免疫佐剂作用提供了一定的理论支持。但是到目前为止,其分子机制仍不清楚,有待进一步研究。此外,枯草杆菌还可以刺激TLR2与TLR4受体相关基因的表达,激活机体的天然免疫。
重组枯草杆菌由于其自身的免疫佐剂作用具有更为优秀的免疫原性。Lee等[45]用灭活H9N2病毒免疫鸡并设置了添加枯草杆菌芽孢组(Spore+灭活H9N2)与未添加枯草杆菌芽孢组(仅灭活H9N2)。结果,与仅灭活H9N2组相比,Spore+灭活H9N2组可以显著增加鸡脾脏中B细胞的比例,体内H9N2特异性IgG升高,IL-1β和IL-6的表达显著增加,特异性CD4+和CD8+ T细胞增殖程度更高并增加了促炎性细胞因子的产生。Song等[32]研究表明,灭活的芽孢同样具有类似的免疫佐剂功能。Santos等[50]通过吸附法在芽孢表面展示TTFC蛋白给予小鼠滴鼻免疫,与纯化的TTFC蛋白组比,可增加肠道中TTFC特异性的sIgA分泌量,且血清中特异性IgG产生的速度更快。
4.2 芽孢表面展示生产口服黏膜疫苗的应用芽孢表面展示的异源抗原经大量研究已经证实可以在肠黏膜以及外周血液、组织器官中显著地增加sIgA以及特异性IgG的含量,可以起到免疫保护作用。白斑综合征是一种由白斑综合征病毒感染虾类造成的严重疫病,具有发病急、死亡率高的特点,每年对虾类的生产造成极大的经济损失。由于虾类特殊的养殖环境,寻常的免疫手段难以对虾类进行免疫接种。这种情况下,重组枯草杆菌有其优秀的环境抵抗力、拌料口服接种的简便,以及优秀的免疫原性引起了人们的注意。Nguyen等[51]将白斑综合征病毒包膜蛋白VP28与cotB基因构成融合基因并展示于芽孢表面,对凡纳滨对虾进行攻毒保护试验,饲喂重组枯草杆菌的试验组死亡率显著下降,SOD酶活性、酚酶活性等较空白对照组分别增加了15%和33%,表明表面展示VP28的枯草杆菌具有预防性治疗白斑综合征的巨大潜力。
艰难梭菌(Clostridium difficile)是一种革兰氏阳性菌,专性厌氧并可以产生芽孢,是通过口-粪传播的腹泻常见病原菌。在肠道中,艰难梭菌营养细胞产生毒性因子如Toxin A、Toxin B,加剧腹泻和伪膜性结肠炎。该细菌病根治困难,目前较好的治疗方法主要是粪便菌群移植(FMT),但是该方法价格昂贵、操作繁琐、耗时较长,并且针对不同的个体所使用的产品都不一样[52]。目前已有学者采用BSSD技术将艰难梭菌的不同抗原蛋白展示于枯草杆菌芽孢表面,用于防治该病。Negri等[38]将FliD成功展示于枯草杆菌的芽孢表面,并通过WB试验证明了展示的异源抗原蛋白具有反应原性,但他们没有进行相关的免疫原性试验;近年来,他们将IL-1蛋白与FliD融合并共同展示于芽孢表面,证明了该表面展示的IL-1-FliD融合蛋白比单纯展示的FliD蛋白具有更为优秀的免疫原性,产生效价更高的特异性IgA与IgG;与野生型168菌株相比,TNF-α,IFN-γ,IL-17A,IL-6,IL-4,IL-2等多种细胞因子浓度都显著增加,这表明通过CotG表面展示的IL-1-FliD蛋白可以诱导强大的免疫应答,显示其具有潜在的疫苗应用价值[53]。Permpoonpattana等[54]利用CotB、CotC将艰难梭菌毒素蛋白Toxin A和Toxin B成功展示在枯草杆菌表面,在对小鼠进行攻毒保护试验后发现,只要小鼠体内产生了Toxin A的中和抗体就可以产生对艰难梭菌的免疫保护作用;在对艰难梭菌的中和中,sIgA发挥的作用优于IgG和非分泌型的IgA;同时,在给予小鼠展示Toxin A的重组枯草杆菌进行免疫后,对产生的特异性IgG进行分型后发现IgG1与IgG2a型都出现了显著上升,随着免疫次数增加(3次后),IgG1/IgG2a明显增加,这说明在免疫后期更倾向于Th2型细胞介导的免疫应答。Maia等[31]利用非重组吸附方法将艰难梭菌芽孢表面蛋白BclA2成功吸附在枯草杆菌芽孢表面,并诱导小鼠产生了特异性IgG,表明这种非重组的表面展示方式同样能够诱导产生较好的免疫保护。
幽门螺杆菌是革兰氏阴性菌,是导致胃溃疡、胃炎,甚至胃癌等疾病的主要致病因素,在我国居民中平均感染率达59%。由于三联疗法(克拉霉素和阿莫西林或甲硝唑)或含铋的四联疗法的盛行,幽门螺杆菌的耐药性逐渐增强[55],人们迫切需要减少抗生素使用的治疗手段。Hinc等[56]构建了2株重组枯草杆菌,一株(BKH108)展示幽门螺杆菌的脲酶B亚基(UreB),另一株(BKH121)展示IL-2作为免疫佐剂,将2种重组芽孢拌料给予小鼠后对其脾脏细胞进行的IFN-γ ELISpot试验表明,小鼠体内产生了强大的细胞免疫,并且随着免疫次数增加,免疫反应不断增强;然而他们的试验并没有诱导产生特异性抗体,作者推测可能是BKH121株展示的IL-2强烈地促进了体内的免疫应答向TH1型转变。随后Stasiłojć等[57]更深入地研究了重组芽孢杆菌BKH108与BKH121在体内的免疫特性,通过流式细胞术证明,同时饲喂这两种重组菌可以在体内促进免疫反应强烈地向TH1/TH17介导的细胞免疫趋化,并且抑制了向TH2趋化;在试验小鼠的脾细胞发现IL-2、IFN-γ、TNF-α、IL-6、IL-17等细胞因子显著增加,而IL-4、IL-10等与体液免疫相关的细胞因子有所下降;但是他们发现在饲喂重组BKH108与免疫佐剂Al(OH)3可以促进体液免疫应答水平的上升,认为这种在体内同时诱导产生体液与细胞免疫的方式可以对幽门螺杆菌的治疗与预防提供一定的参考价值。Iwanicki等[17]成功利用CgeA成功展示了幽门螺杆菌的细胞毒性蛋白A (CagA),该抗原后续的免疫特性还有待进一步的研究探索。
近年来枯草杆菌的BSSD技术在防治渔业寄生虫病上也发展迅速。由于鱼类的特殊生理构造与特殊的养殖环境,重组枯草杆菌可以比传统疫苗发挥更为优秀的免疫性能。Tang等[58]将华支睾吸虫的半胱氨酸蛋白酶(CsCP)成功与CotC融合展示于芽孢表面并拌料给予草鱼,结果在试验组的肠道与皮肤分泌物中都检测到了特异性免疫球蛋白如IgD、IgM与IgZ/T,其中特异性IgM是硬骨鱼类血清与黏膜相关淋巴组织中最重要的抗体,它在试验组中的含量显著高于对照组;华支睾吸虫接种后发现试验组血清中GPT/ALT与GOT/AST都显著下降,证明在试验组中肝脏的损伤水平显著低于对照组,产生了对华支睾吸虫的保护力;在对试验组肠绒毛进行切片后观察发现肠绒毛发育更好,且小肠上皮内淋巴细胞数目显著增多。Sun等[59]将副肌球蛋白(CsPmy)成功与CotC融合展示在芽孢表面,然后对小鼠进行拌料饲喂,结果试验组小鼠体内的sIgA与特异性IgG都显著高于PBS对照组和野生型对照组;华支睾吸虫接种后对试验组肝脏组织进行病理学切片与酶活性测定发现,饲喂重组芽孢组可以显著降低肝脏组织的病理性变化与GPT/ALT与GOT/AST水平,这与Tang等的结果类似;此外他们以口服与腹腔注射两种不同的方式给予重组芽孢后发现,两种给药方式产生的免疫保护作用并无太大差距,小鼠粪便中的华支睾吸虫减卵率分别为48.3%与51.2%。
本实验室已经成功将猪轮状病毒的VP8蛋白[60]、鸡白痢沙门氏菌的OmpC蛋白[8]、猪流行性腹泻病毒的COE1蛋白成功展示在枯草杆菌表面,并且都成功诱导了特异性的免疫应答,表现出优异的免疫性能与益生功能。
5 前景展望基于重组枯草杆菌的诸多口服黏膜疫苗在临床前疫苗接种充分证明能诱导强烈的免疫保护反应,这些疫苗制作方法可以避免复杂的纯化步骤、简化用于运输分配的冷链、减少运输过程中失效造成的损失,以及降低对于佐剂需求,应用成本低。但是目前该类疫苗仍然没有大规模地进行商业化的应用,未来的一个主要目标就是该类疫苗的安全性评估以及制作过程的标准化。目前我国非洲猪瘟、高致病性蓝耳病、猪圆环病毒病等大肆流行,对我国食品安全造成巨大威胁,迫切需要有效的疫苗来对抗这些病原,也许枯草杆菌BSSD技术是一个强有力的武器。目前为止,大多数芽孢表面展示异源抗原还是使用的基因重组的方法进行构建,主要是因为该方法较之于非重组的方法更为成熟与稳定。但近年来,有人研究将两种方法结合起来成功构建了重组的枯草杆菌,Potocki等[61]先利用基因重组方法构建了表面展示IL-2的重组枯草杆菌,随后将纯化的FliD蛋白吸附在重组芽孢表面,并且证明了两种方法结合的重组芽孢具有优秀的免疫原性与稳定性,未来这种结合方法一定会是研究的热点之一。随着分子生物学的快速发展,有人利用人工合成的类芽孢颗粒展示抗原[62],表现出了优秀的免疫原性。另外,也有人研究在培养芽孢形成过程时,利用母细胞过表达异源抗原,使一部分的异源抗原自发地吸附于芽孢表面,目前该手段已经成功地展示了炭疽芽孢杆菌的抗原蛋白[63]。相信随着对枯草杆菌表面展示系统不断深入研究,利用该技术生产的疫苗一定能够日渐成熟并且大规模商业化使用。
| [1] | 张晓舟. 枯草杆菌新型表达系统和遗传操作体系的建立及应用. 南京农业大学学位论文, 2006. |
| [2] | Di J, Chu ZP, Zhang SH, Huang J, Du H, Wei QW. Evaluation of the potential probiotic Bacillus subtilis isolated from two ancient sturgeons on growth performance, serum immunity and disease resistance of Acipenser dabryanus. Fish & Shellfish Immunology, 2019, 93: 711-719. |
| [3] | Rosales-Mendoza S, Angulo C. Bacillus subtilis comes of age as a vaccine production host and delivery vehicle. Expert Review of Vaccines, 2015, 14(8): 1135-1148. |
| [4] | Smith GP. Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface. Science, 1985, 228(4705): 1315-1317. DOI:10.1126/science.4001944 |
| [5] | Boder ET, Wittrup KD. Yeast surface display for screening combinatorial polypeptide libraries. Nature Biotechnology, 1997, 15(6): 553-557. DOI:10.1038/nbt0697-553 |
| [6] | Hu SM, Kong J, Sun ZL, Han LL, Kong WT, Yang P. Heterologous protein display on the cell surface of lactic acid bacteria mediated by the s-layer protein. Microbial Cell Factories, 2011, 10: 86. DOI:10.1186/1475-2859-10-86 |
| [7] | Isticato R, Cangiano G, Tran HT, Ciabattini A, Medaglini D, Oggioni MR, de Felice M, Pozzi G, Ricca E. Surface display of recombinant proteins on Bacillus subtilis spores. Journal of Bacteriology, 2001, 183(21): 6294-6301. DOI:10.1128/JB.183.21.6294-6301.2001 |
| [8] | Dai XX, Liu MG, Pan KC, Yang JL. Surface display of OmpC of Salmonella serovar Pullorum on Bacillus subtilis spores. PLoS ONE, 2018, 13(1): e0191627. DOI:10.1371/journal.pone.0191627 |
| [9] |
Lin P, Song LX, Chang DJ, Ma YH, Wang TF. Display of glucose oxidase on Bacillus subtilis spore surface and preparation for enzyme electrode. Chinese Journal of Biotechnology, 2020, 36(9): 1908-1917.
(in Chinese) 林平, 宋龙祥, 常德军, 马耀宏, 王腾飞. 葡萄糖氧化酶在枯草芽孢杆菌芽孢表面的展示及其酶电极制备. 生物工程学报, 2020, 36(9): 1908-1917. |
| [10] | 丁尊丹. 芽孢杆菌表面展示系统的构建及其在环境污染生物修复中的应用. 中国农业科学院学位论文, 2019. |
| [11] | Beskrovnaya P, Sexton DL, Golmohammadzadeh M, Hashimi A, Tocheva EI. Structural, metabolic and evolutionary comparison of bacterial endospore and exospore formation. Frontiers in Microbiology, 2021, 12: 630573. DOI:10.3389/fmicb.2021.630573 |
| [12] | Riley EP, Schwarz C, Derman AI, Lopez-Garrido J. Milestones in Bacillus subtilis sporulation research. Microbial Cell: Graz, Austria, 2020, 8(1): 1-16. |
| [13] | Zammuto V, Rizzo MG, De Plano LM, Franco D, Guglielmino S, Caccamo MT, Magazù S, Fujimori A, Giudice AL, Guglielmin M, McAlpin KR, Moeller R, Gugliandolo C. Effects of heavy ion particle irradiation on spore germination of Bacillus spp. from extremely hot and cold environments. Life, 2020, 10(11): 264. DOI:10.3390/life10110264 |
| [14] | Zhang GY, An YF, Zabed H, Guo Q, Yang MM, Yuan J, Wen L, Sun WJ, Qi XH. Bacillus subtilis spore surface display technology: a review of its development and applications. Journal of Microbiology and Biotechnology, 2019, 29(2): 179-190. DOI:10.4014/jmb.1807.06066 |
| [15] | Chen HY, Chen Z, Wu BG, Ullah J, Zhang TX, Jia JR, Wang HC, Tan TW. Influences of various peptide linkers on the Thermotoga maritima MSB8 nitrilase displayed on the spore surface of Bacillus subtilis. Journal of Molecular Microbiology and Biotechnology, 2017, 27(1): 64-71. DOI:10.1159/000454813 |
| [16] | Yang MM, Zhang WW, Zhang XF, Cen PL. Construction and characterization of a novel maltose inducible expression vector in Bacillus subtilis. Biotechnology Letters, 2006, 28(21): 1713-1718. DOI:10.1007/s10529-006-9146-z |
| [17] | Iwanicki A, Piątek I, Stasiłojć M, Grela A, Lęga T, Obuchowski M, Hinc K. A system of vectors for Bacillus subtilis spore surface display. Microbial Cell Factories, 2014, 13(1): 30. DOI:10.1186/1475-2859-13-30 |
| [18] | Feucht A, Lewis PJ. Improved plasmid vectors for the production of multiple fluorescent protein fusions in Bacillus subtilis. Gene, 2001, 264(2): 289-297. DOI:10.1016/S0378-1119(01)00338-9 |
| [19] | Guérout-Fleury AM, Frandsen N, Stragier P. Plasmids for ectopic integration in Bacillus subtilis. Gene, 1996, 180(1/2): 57-61. |
| [20] | Yuan G, Wong SL. Regulation of groE expression in Bacillus subtilis: the involvement of the Sigma A-like promoter and the roles of the inverted repeat sequence (CIRCE). Journal of Bacteriology, 1995, 177(19): 5427-5433. DOI:10.1128/jb.177.19.5427-5433.1995 |
| [21] | García-Moyano A, Larsen Ø, Gaykawad S, Christakou E, Boccadoro C, Puntervoll P, Bjerga GEK. Fragment exchange plasmid tools for CRISPR/Cas9-mediated gene integration and protease production in Bacillus subtilis. Applied and Environmental Microbiology, 2020, 87(1): e02090-20. |
| [22] | Härtl B, Wehrl W, Wiegert T, Homuth G, Schumann W. Development of a new integration site within the Bacillus subtilis chromosome and construction of compatible expression cassettes. Journal of Bacteriology, 2001, 183(8): 2696-2699. DOI:10.1128/JB.183.8.2696-2699.2001 |
| [23] | Ye B, Li Y, Tao Q, Yao XL, Cheng MG, Yan X. Random mutagenesis by insertion of error-prone PCR products to the chromosome of Bacillus subtilis. Frontiers in Microbiology, 2020, 11: 570280. DOI:10.3389/fmicb.2020.570280 |
| [24] | Middleton R, Hofmeister A. New shuttle vectors for ectopic insertion of genes into Bacillus subtilis. Plasmid, 2004, 51(3): 238-245. DOI:10.1016/j.plasmid.2004.01.006 |
| [25] | Bron S, Luxen E, Swart P. Instability of recombinant pUB110 plasmids in Bacillus subtilis: plasmid-encoded stability function and effects of DNA inserts. Plasmid, 1988, 19(3): 231-241. DOI:10.1016/0147-619X(88)90041-8 |
| [26] | Zhao XY, Xu JY, Tan M, Zhen J, Shu WJ, Yang SB, Ma YH, Zheng HC, Song H. High copy number and highly stable Escherichia coli-Bacillus subtilis shuttle plasmids based on pWB980. Microbial Cell Factories, 2020, 19(1): 1-12. DOI:10.1186/s12934-019-1269-8 |
| [27] | Huang JM, Hong HA, van Tong H, Hoang TH, Brisson A, Cutting SM. Mucosal delivery of antigens using adsorption to bacterial spores. Vaccine, 2010, 28(4): 1021-1030. DOI:10.1016/j.vaccine.2009.10.127 |
| [28] | Sirec T, Strazzulli A, Isticato R, De Felice M, Moracci M, Ricca E. Adsorption of β-galactosidase of Alicyclobacillus acidocaldarius on wild type and mutants spores of Bacillus subtilis. Microbial Cell Factories, 2012, 11(1): 1-11. DOI:10.1186/1475-2859-11-1 |
| [29] | Cho EA, Kim EJ, Pan JG. Adsorption immobilization of Escherichia coli phytase on probiotic Bacillus polyfermenticus spores. Enzyme and Microbial Technology, 2011, 49(1): 66-71. DOI:10.1016/j.enzmictec.2011.03.006 |
| [30] | Isticato R, Sirec T, Treppiccione L, Maurano F, De Felice M, Rossi M, Ricca E. Non-recombinant display of the B subunit of the heat labile toxin of Escherichia coli on wild type and mutant spores of Bacillus subtilis. Microbial Cell Factories, 2013, 12: 98. DOI:10.1186/1475-2859-12-98 |
| [31] | Maia AR, Reyes-Ramírez R, Pizarro-Guajardo M, Saggese A, Castro-Córdova P, Isticato R, Ricca E, Paredes-Sabja D, Baccigalupi L. Induction of a specific humoral immune response by nasal delivery of Bcla2ctd of Clostridioides difficile. International Journal of Molecular Sciences, 2020, 21(4): 1277. DOI:10.3390/ijms21041277 |
| [32] | Song M, Hong HA, Huang JM, Colenutt C, Khang DD, Nguyen TVA, Park SM, Shim BS, Song HH, Cheon IS, Jang JE, Choi JA, Choi YK, Stadler K, Cutting SM. Killed Bacillus subtilis spores as a mucosal adjuvant for an H5N1 vaccine. Vaccine, 2012, 30(22): 3266-3277. DOI:10.1016/j.vaccine.2012.03.016 |
| [33] | Reljic R, Sibley L, Huang JM, Pepponi I, Hoppe A, Hong HA, Cutting SM. Mucosal vaccination against tuberculosis using inert bioparticles. Infection and Immunity, 2013, 81(11): 4071-4080. DOI:10.1128/IAI.00786-13 |
| [34] | Gashtasbi F, Ahmadian G, Noghabi KA. New insights into the effectiveness of alpha-amylase enzyme presentation on the Bacillus subtilis spore surface by adsorption and covalent immobilization. Enzyme and Microbial Technology, 2014, 64/65: 17-23. DOI:10.1016/j.enzmictec.2014.05.006 |
| [35] | Ghaedmohammadi S, Rigi G, Zadmard R, Ricca E, Ahmadian G. Immobilization of bioactive protein A from Staphylococcus aureus (SpA) on the surface of Bacillus subtilis spores. Molecular Biotechnology, 2015, 57(8): 756-766. DOI:10.1007/s12033-015-9868-z |
| [36] | Ricca E, Baccigalupi L, Isticato R. Spore-adsorption: mechanism and applications of a non-recombinant display system. Biotechnology Advances, 2021, 47: 107693. DOI:10.1016/j.biotechadv.2020.107693 |
| [37] | Isticato R, Ricca E. Spore surface display. Microbiology Spectrum, 2014, 2(5): TBS-0011-2012. |
| [38] | Negri A, Potocki W, Iwanicki A, Obuchowski M, Hinc K. Expression and display of Clostridium difficile protein FliD on the surface of Bacillus subtilis spores. Journal of Medical Microbiology, 2013, 62(Pt 9): 1379-1385. |
| [39] | Potot S, Serra CR, Henriques AO, Schyns G. Display of recombinant proteins on Bacillus subtilis spores, using a coat-associated enzyme as the carrier. Applied and Environmental Microbiology, 2010, 76(17): 5926-5933. DOI:10.1128/AEM.01103-10 |
| [40] |
Yu J, Setrerrahmane S, Xu HM. Selection and application of linker peptide in the design of fusion protein. Pharmaceutical Biotechnology, 2016, 23(3): 260-263.
(in Chinese) 于健, Sarra Setrerrahmane, 徐寒梅. 连接肽在融合蛋白设计中的选择及应用. 药物生物技术, 2016, 23(3): 260-263. |
| [41] | Huston JS, Levinson D, Mudgett-Hunter M, Tai MS, Novotny J, Margolies MN, Ridge RJ, Bruccoleri RE, Haber E, Crea R. Protein engineering of antibody binding sites: recovery of specific activity in an anti-digoxin single-chain Fv analogue produced in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of Amercia, 1988, 85(16): 5879-5883. DOI:10.1073/pnas.85.16.5879 |
| [42] | Arai R, Ueda H, Kitayama A, Kamiya N, Nagamune T. Design of the linkers which effectively separate domains of a bifunctional fusion protein. Protein Engineering, Design and Selection, 2001, 14(8): 529-532. DOI:10.1093/protein/14.8.529 |
| [43] | Hinc K, Iwanicki A, Obuchowski M. New stable anchor protein and peptide linker suitable for successful spore surface display in B. subtilis. Microbial Cell Factories, 2013, 12: 22. DOI:10.1186/1475-2859-12-22 |
| [44] | Ullah J, Chen HY, Vastermark A, Jia JR, Wu BG, Ni Z, Le YL, Wang HC. Impact of orientation and flexibility of peptide linkers on T. maritima lipase Tm1350 displayed on Bacillus subtilis spores surface using CotB as fusion partner. World Journal of Microbiology and Biotechnology, 2017, 33(9): 1-9. DOI:10.1007/s11274-017-2327-1 |
| [45] | Lee JE, Kye YC, Park SM, Shim BS, Yoo S, Hwang E, Kim H, Kim SJ, Han SH, Park TS, Park BC, Yun CH. Bacillus subtilis spores as adjuvants against avian influenza H9N2 induce antigen-specific antibody and T cell responses in White Leghorn chickens. Veterinary Research, 2020, 51(1): 68. DOI:10.1186/s13567-020-00788-8 |
| [46] |
Cheng Y, Zhang L, Yin YW, Dai J, Shang XC, Lu YT, Li YH. Advances in research on Bacillus subtilis spores as delivery vehicles for mucosal vaccines. Animal Husbandry & Veterinary Medicine, 2020, 52(1): 134-140.
(in Chinese) 程义, 张蕾, 尹玉伟, 代静, 尚信池, 卢玉婷, 李月红. 枯草芽孢杆菌芽孢作为黏膜疫苗载体研究进展. 畜牧与兽医, 2020, 52(1): 134-140. |
| [47] | Perez-Lopez A, Behnsen J, Nuccio SP, Raffatellu M. Mucosal immunity to pathogenic intestinal bacteria. Nature Reviews Immunology, 2016, 16(3): 135-148. DOI:10.1038/nri.2015.17 |
| [48] | Huang JM, la Ragione RM, Nunez A, Cutting SM. Immunostimulatory activity of Bacillus spores. FEMS Immunology & Medical Microbiology, 2008, 53(2): 195-203. |
| [49] | Duc LH, Hong HA, Uyen NQ, Cutting SM. Intracellular fate and immunogenicity of B. subtilis spores. Vaccine, 2004, 22(15/16): 1873-1885. |
| [50] | Santos FDS, Mazzoli A, Maia AR, Saggese A, Isticato R, Leite F, Iossa S, Ricca E, Baccigalupi L. A probiotic treatment increases the immune response induced by the nasal delivery of spore-adsorbed TTFC. Microbial Cell Factories, 2020, 19(1): 1-13. DOI:10.1186/s12934-019-1269-8 |
| [51] | Nguyen ATV, Pham CK, Pham HTT, Pham HL, Nguyen AH, Dang LT, Huynh HA, Cutting SM, Phan TN. Bacillus subtilis spores expressing the VP28 antigen: a potential oral treatment to protect Litopenaeus vannamei against white spot syndrome. FEMS Microbiology Letters, 2014, 358(2): 202-208. DOI:10.1111/1574-6968.12546 |
| [52] | Khoruts A, Staley C, Sadowsky MJ. Faecal microbiota transplantation for Clostridioides difficile: mechanisms and pharmacology. Nature Reviews Gastroenterology & Hepatology, 2021, 18(1): 67-80. |
| [53] | Potocki W, Negri A, Peszyńska-Sularz G, Hinc K, Obuchowski M, Iwanicki A. IL-1 fragment modulates immune response elicited by recombinant Bacillus subtilis spores presenting an antigen/adjuvant chimeric protein. Molecular Biotechnology, 2018, 60(11): 810-819. DOI:10.1007/s12033-018-0117-0 |
| [54] | Permpoonpattana P, Hong HA, Phetcharaburanin J, Huang JM, Cook J, Fairweather NF, Cutting SM. Immunization with Bacillus spores expressing toxin A peptide repeats protects against infection with Clostridium difficile strains producing toxins A and B. Infection and Immunity, 2011, 79(6): 2295-2302. DOI:10.1128/IAI.00130-11 |
| [55] | Fischbach W, Malfertheiner P. Helicobacter pylori infection. Deutsches Aerzteblatt Online, 2018, 115(25): 429-436. |
| [56] | Hinc K, Stasiłojć M, Piątek I, Peszyńska-Sularz G, Isticato R, Ricca E, Obuchowski M, Iwanicki A. Mucosal adjuvant activity of IL-2 presenting spores of Bacillus subtilis in a murine model of Helicobacter pylori vaccination. PLoS ONE, 2014, 9(4): e95187. DOI:10.1371/journal.pone.0095187 |
| [57] | Stasiłojć M, Hinc K, Peszyńska-Sularz G, Obuchowski M, Iwanicki A. Recombinant Bacillus subtilis spores elicit Th1/Th17-polarized immune response in a murine model of Helicobacter pylori vaccination. Molecular Biotechnology, 2015, 57(8): 685-691. DOI:10.1007/s12033-015-9859-0 |
| [58] | Tang ZL, Sun HC, Chen TJ, Lin ZP, Jiang HY, Zhou XY, Shi CB, Pan HJ, Chang OQ, Ren PL, Yu JY, Li XR, Xu J, Huang Y, Yu XB. Oral delivery of Bacillus subtilis spores expressing cysteine protease of Clonorchis sinensis to grass carp (Ctenopharyngodon idellus): induces immune responses and has no damage on liver and intestine function. Fish & Shellfish Immunology, 2017, 64: 287-296. |
| [59] | Sun HC, Lin ZP, Zhao L, Chen TJ, Shang M, Jiang HY, Tang ZL, Zhou XY, Shi MC, Zhou LN, Ren PL, Qu HL, Lin JS, Li XR, Xu J, Huang Y, Yu XB. Bacillus subtilis spore with surface display of paramyosin from Clonorchis sinensis potentializes a promising oral vaccine candidate. Parasites & Vectors, 2018, 11(1): 1-15. |
| [60] | Li WQ, Feng J, Li JJ, Li JZ, Wang ZH, Khalique A, Yang M, Ni XQ, Zeng D, Zhang DM, Jing B, Luo QH, Pan KC. Surface display of antigen protein VP8* of porcine Rotavirus on Bacillus subtilis spores using CotB as a fusion partner. Molecules, 2019, 24(20): 3793. DOI:10.3390/molecules24203793 |
| [61] | Potocki W, Negri A, Peszyńska-Sularz G, Hinc K, Obuchowski M, Iwanicki A. The combination of recombinant and non-recombinant Bacillus subtilis spore display technology for presentation of antigen and adjuvant on single spore. Microbial Cell Factories, 2017, 16(1): 1-11. DOI:10.1186/s12934-016-0616-2 |
| [62] | Wu IL, Narayan K, Castaing JP, Tian F, Subramaniam S, Ramamurthi KS. A versatile nano display platform from bacterial spore coat proteins. Nature Communications, 2015, 6: 6777. DOI:10.1038/ncomms7777 |
| [63] | Oh Y, Kim JA, Kim CH, Choi SK, Pan JG. Bacillus subtilis spore vaccines displaying protective antigen induce functional antibodies and protective potency. BMC Veterinary Research, 2020, 16(1): 259. DOI:10.1186/s12917-020-02468-3 |
 2022, Vol. 62
2022, Vol. 62