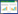中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 刘莹璐, 陈从立, 付亮, 周丹丹. 2022
- Yinglu LIU, Congli CHEN, Liang FU, Dandan ZHOU. 2022
- 藻际环境中微生物胞间通讯行为及作用
- The roles of 'cell-to-cell communication' in phycosphere
- 微生物学报, 62(1): 33-46
- Acta Microbiologica Sinica, 62(1): 33-46
-
文章历史
- 收稿日期:2021-03-09
- 修回日期:2021-04-20
- 网络出版日期:2021-07-07
微生物产生并向环境中释放信号分子,通过胞内的相应受体识别环境中信号分子浓度,来监测周围环境中自身或其他微生物的变化。当信号分子达到一定的浓度阈值时,微生物启动或抑制特定基因的表达,进而产生单一微生物个体无法完成的生理功能或行为叫作群体感应(quorum sensing,QS)或胞间通讯(cell-to-cell communication)[1]。胞间通讯既是微生物建立微生态联络的通用方式,也是微生物进化和自然选择的关键环节。在胞间通讯这一微生物社会行为的研究过程中,信号分子作为微生物间沟通的“语言”,其甄别一直是研究的重点。在早期,细胞信号物质的种类大多是通过粗提微生物产物再重新回填这一方式来探究其作用机制。随着现代分离与分析技术的发展,操纵微生物胞间通讯行为的信号分子精密结构被逐渐解析。不同微生物种内或种间的信号分子不尽相同,其介导的胞间通讯作用也大相径庭。目前已有大量研究表明,细菌、真菌在生长繁殖的过程中会感知外界环境变化,持续地释放信号分子。当信号分子积累达到一定阈值后,微生物便会表达特定的功能基因进而表现出特殊的生理生化行为[2],包括生物发光[3-4]、生物膜形成[5-7]、色素的产生[8-9]以及抗生素合成等[10],从而与其他微生物构成生物网络关联。
类似于陆地生态系统中的“根际环境”,藻细胞分泌胞外产物对周围的生物进行选择,形成藻际环境。在水生生态系统中,藻际环境的稳定对维持生态系统平衡起着至关重要的作用,与此同时,合理收集利用微藻产生的油脂、类胡萝卜素等生物质能源,也有助于节约资源。在藻际环境中,微生物具有分解者与制造者的双重身份。此外,物种间还存在着竞争、协同、合作等复杂的作用关系,这些关系的本质是胞间通讯。藻际环境下的共生模式需考虑多种组合,包括细菌-微藻、真菌-微藻及多菌-多藻等,其作用模式主要为营养交换[11]、信号传递[12]和基因转移[13-14]这3类。基于藻际环境中种类多样复杂的这一特性,策略性利用微藻与其他微生物的胞间通讯信号传导作用,发挥信号分子的痕量优势,既可以避免单一物种过度繁殖引发的生态环境污染,又可以经济合理收集利用微藻生物质能源。然而现阶段,微藻与藻际环境中微生物的胞间通讯机制,特别是信号分子传递路径、信号接收途径和代谢功能调节机制等方面尚存在较大研究空白。
1 藻际环境概述 1.1 藻际环境微藻是自然中最重要的初级生产者,它向周围环境分泌多种代谢产物,与一定距离范围内的微生物具有紧密的关联并形成了独特的微生态环境,即藻际环境[15]。基于这些代谢产物的作用,结合环境选择、物种竞争等因素的影响所形成的微生物种群,被称为“藻际微生物”[16]。水环境条件变化会显著影响微藻及其藻际微生物群落结构演替,因此藻际环境具有特异性、多样性和复杂性。例如,微藻分泌的胞外产物、甚至是死亡藻体,可以为细菌提供营养源[17]。细菌也可能产生藻类生长所必需的营养盐和生长素[18],直接或间接地影响藻类的生长,甚至裂解藻细胞[19-20]。
1.2 藻际微生物间的作用 1.2.1 营养物质交换与作用:营养物质互补是藻际微生物微生态行为发生的关键基础,是提高藻际环境生物群落稳定性的重要前提。最为经典的模式是,藻类通过光合作用释放大量的O2作为异养细菌呼吸的电子受体,同时细菌呼吸产生的CO2被微藻所摄取并合成细胞质。在这一物质循环过程中,细菌分解环境中的有机物,微藻固定无机碳,细菌和微藻共生互利,提高了生态环境微生态结构的稳定性[21-22]。营养物质的交换还存在其他模式:固氮蓝细菌UCYN-A可为定鞭藻类(Prymnesium parvum)提供生长所需的氮源[23];根瘤菌(Rhizobium sp.)能够分解有机物并提供碳源供小球藻(Chlorella vulgaris)呼吸代谢[24]。在水环境中营养物质匮乏的情况下,藻类释放更多的小分子物质,促进异养细菌生长[25]。
但是,也有一些种间争夺营养物现象发生。枯草芽孢杆菌的大量繁殖会与铜绿微囊藻竞争环境中的营养源,间接抑制后者生长。枯草芽孢杆菌的滤液对铜绿微囊藻的光合作用、细胞组织合成都有明显的抑制作用,这表明其分泌物对微藻生长产生了负面影响[26]。夜光藻(Noctiluca scintillans)摄食链状硅藻,这一行为会改变藻际环境的群落结构,进而影响物质传递[27]。
1.2.2 活性物质的产生与作用:藻际微生物会分泌种类丰富的活性物质,一般为碳水化合物、蛋白、腐殖酸及多种生长因子等,具有提高藻际环境多样性的作用[28]。有研究表明,共生菌产生的维生素B12是藻类生长所需的痕量物质,具有提高藻细胞的光合作用活性的作用[29]。藻类促生菌代谢产生活性物质,可改善藻体对于环境胁迫的耐受程度[30]。藻细胞溶解会释放胞内脂质及颗粒物等大分子物质,能够维系微藻与细菌群落的共生关系[31]。
活性物质也可能产生拮抗作用。细菌分泌活性物质导致的溶藻行为是藻-菌拮抗的典型例子。从太湖中分离得到的溶藻细菌,其分泌到胞外的活性物质可明显抑制小球藻的生长,降低了铜绿微囊藻的光合效率,对中肋骨条藻有明显的溶解作用[32]。溶藻细菌L7的胞内外代谢物对水华鱼腥藻和铜绿微囊藻都具有溶藻效应,不同程度地降低了藻细胞密度,促进了异形胞分化[33]。相似地,有些藻类产生的活性物质可抑制细菌的生长繁殖[34]。不同的微藻抗菌活性不同,尤其是球等鞭金藻H29对革兰氏阴性菌和革兰氏阳性菌的生长均有抑制作用[35]。策略性提高微藻的抗菌活性,筛选目标藻种,可以提高微藻规模化培养系统的稳定性。
近年来,研究者们提出藻际间微生物的胞间通讯作用是藻际微生态行为发生的基础。微藻与藻际微生物之间的“交流”,是以信号分子为媒介而诱发细胞生长、代谢功能调控,并发生共生、竞争或拮抗等作用行为。细胞发生聚集并释放信号分子,在信号分子达到一定浓度激发胞间通讯反应。束毛藻(Trichodesmium)的培养液已发现信号分子N-酰化高丝氨酸内酯的存在,细菌接收该信号后能够调节磷酸盐获取能力,进行物质交流,促进藻际环境生态稳定[36]。
2 藻际胞间通讯行为 2.1 藻-菌共生体系中的胞间通讯 2.1.1 微藻-细菌胞间通讯行为:自1976年首次发现海洋费氏弧菌(Vibrio fiscberi)的自发荧光特性具有细胞密度依赖性后[1],微生物之间复杂而精细的“语言”的广谱性得到逐渐公认。在不同环境胁迫下,不同种属微生物会分泌不同种类的信号分子,组成其语言体系的“语种”,通过这些胞外信号分子的转导和传递,调控胞内特异性基因的表达,从而协调菌群体之间的生理行为。
实质上,微藻-细菌稳定共生体系主要依赖于微藻与细菌微生物之间的相互作用。目前,关于介导革兰氏阴性菌群体感应系统的N-酰化高丝氨酸内酯(N-3-acyl-homoserine lactones,AHLs)是藻-菌胞间通讯行为的研究焦点。低浓度C6-HSL (≤200 nmol/L)能够激活藻细胞的防御性反应,对小球藻(Chlorella vulgaris)的生长速率具有显著的促进作用。然而,在C6-HSL浓度大于400 nmol/L时,小球藻生长速率受到抑制,同时其抗氧化系统发生一定程度的损伤。这一现象表明,微藻对革兰氏阴性菌分泌的信号分子响应具有浓度依赖性[37]。有研究人员发现,外源添加400 nmol/L的C6-HSL,使得小球藻光合作用系统中D1蛋白表达量显著下调,但烯醇酶的表达量呈上调趋势,这一结果说明信号分子抑制了藻细胞的光合作用,但同时促进了细胞的厌氧呼吸作用[38]。对于多藻共培养体系,在400 nmol/L C6-HSL刺激下,小球藻和栅藻的生长和线粒体活性几乎不受C6-HSL的影响,油脂产量和油脂产率提高209%。而小球藻和栅藻纯培养体系的生物量比对照组分别降低50%和35%[39]。与之相似,东海原甲藻、赤潮异弯藻的生长明显受到海洋细菌产生的C6-HSL和C8-HSL的抑制作用[40]。窦勇等研究发现,小球藻在C10-HSL胁迫下PSII光化学活性变化表现不同剂量-效应关系,例如Fv/Fm总体呈下降趋势,实验结束时不同浓度处理组较初始状态降低21%–36%不等,C10-HSL对微藻细胞施加了一定程度的抗氧化胁迫,同时干扰了微藻细胞固有的ATP合成和离子运输过程[41]。本课题组前期研究发现,小球藻能够感知氮饥饿胁迫下菌胶团释放的信号分子,促进酪氨酸蛋白形成并产生聚集响应的特性[42]。细菌与微藻的胞间通讯行为是相互作用的,细菌能够感应小球藻的细胞密度,并在藻细胞密度比较高时启动固氮基因的表达[43]。
微藻与细菌之间还可能表现出拮抗作用。细菌Z-QS01会分泌特殊化学物质抑制小球藻的生长[44],粘细菌甚至在群体感应的调控下分泌大量的纤维素溶解酶直接破坏藻细胞壁[45]。微藻也有自己的生存之道,它们能够降解细菌信号分子或合成类似物发生淬灭效应,以对抗细菌菌群产生的负面作用[46]。莱茵衣藻(Chlamydomonas reinhardtii)能够分泌AHLs类似物干扰细菌的生理活动[47];澳大利亚红藻(Delisea pulchra)能产生与AHLs结构相似的呋喃酮,在细菌表面与受体蛋白竞争性结合,导致受体分子降解、抑制细菌的生长和生物膜的形成[48]。藻-菌之间的作用是相互的、复杂的,调控藻-菌胞间通讯行为是维系藻-菌体系平衡的重要手段。
2.1.2 微藻-真菌胞间通讯行为:丝状真菌近年来被广泛用于提高微藻收获效率。新型丝状真菌孢子和小球藻藻液共培养时,能够形成直径为3–5 mm真菌-微藻小球,藻收获率可高达98%[49]。真菌-微藻小球的形成主要受外界环境胁迫条件的影响[50],它们之间的作用机制仍不清楚。丝状真菌菌丝球形成的前提是菌丝形成及其延展缠绕,这与真菌的胞间通讯行为密切相关。
与细菌类似,真菌菌群也存在群体感应现象,其中法尼醇(farnesol)是最具代表性的真菌信号分子。烟曲霉菌(Aspergilus fumigatus)能够响应法尼醇,导致细胞壁和细胞骨架的完整性受到干扰而使菌丝的延伸被抑制[51]。白色念珠菌(Candida albicans)细胞膜表面的G蛋白偶联受体GPCRs与法尼醇结合,使Ras1-Cyr1p- PKA-Efg1路径的相关基因下调,从而显著抑制菌丝的形成[52]。随着检测技术的发展和完善,越来越多的真菌信号分子被甄别和发现,主要归属于4大类别:(1) 内酯类化合物(如羟基羧酸与丁内酯);(2) 萜类化合物(如法尼醇或环倍半萜);(3) 醇类化合物(如色氨酸和苯乙醇,酪醇和2-甲基-1-丁醇等);(4) 多肽类化合物。
有研究表明,真菌不仅自身具有群体感应特性,也能广泛响应细菌分泌的AHLs,进而参与跨界胞间通讯。4 μmol/L的C4-HSL、C6-HSL和C10-HSL可以使Galactomyce的生长速率提升43%–180%,孢子萌发率提高8%–33%[53]。然而,区别于短链信号分子的促进作用,外源添加C12-HSL导致Galactomyce菌丝生长速率抑制21%,孢子萌发率降低28%[53]。铜绿假单胞菌产生的C4-HSL和3-oxo-C12-HSL能够抑制烟曲霉菌丝的形成,并因此抑制了生物膜的形成。这是因为3-oxo-C12-HSL “伪装”成法尼醇,并与Cyr1p中的法尼醇抑制位点相结合,使下游菌丝形成相关基因的表达下调[54]。尽管目前仅有极少量报道,但是仍可证实真菌与微藻之间存在胞间通讯作用。真菌次级代谢产物如蒽醌类、联苯醚类和倍半萜类等,对微藻的活性都具有一定的抑制性。可见,真菌和微藻能够基于信号分子调节促进微生态平衡[55]。
2.2 藻间胞间通讯行为微藻的细胞特征受营养盐、光强、温度、盐度和重金属等环境因子的影响。这不仅仅是营养和能量供给的作用,外界环境变化还刺激了微藻产生小分子化学信号类物质,介导微藻的生长及胞内物的合成。在水生生态系统中,藻间胞间通讯作用因藻种和培养条件不同而存在显著差异。链状亚历山大藻(Alexandrium catenella)和锥状施氏藻(Scrippsiella trochoidea)混合培养,其滤液会抑制拟菱形藻的生长[56]。类似地,小球藻与雨生血球藻(Haematococcus pluvialis)也通过代谢产物影响彼此的生长[57]。在球等鞭金藻的胞外滤液浓度大于40%的情况下,可促进纤细角毛藻生长,而纤细角毛藻的乙酸乙酯萃取物会抑制球等金鞭藻的生长[58]。墨西哥湾裸甲藻(Karenia brevis)赤潮爆发时,普通小球藻能够释放脂肪酸、碳氢化合物和绿藻素到环境中,抑制藻际环境中其他藻类的生长[59-62]。此外,微藻Scenedesmus obliquus AS-6-1产生的大量胞外聚合物会促进小球藻絮凝[63]。
环境胁迫对微藻产生植物激素的种类和水平具有一定影响。外源添加植物激素能够有效缓解环境胁迫条件对藻细胞的伤害作用。在氮限制条件下,外源添加植物激素萘乙酸和吲哚丁酸的组合能够促进栅藻(Scendesmus sp.)的生长和脂质累积,减轻小球藻SDEC-8因氮缺乏引起的氧化损伤[64]。另外,玉米素,生长素和赤霉素组合使斜切线虫在氮限制下的生物量和脂质产量提高了44%–79%,Fv/Fm和相对电子传输速率也得到提升[65]。综上所述,微藻之间的植物激素在不同藻种之间相互关系的调控起到了主要作用,可以看作是微藻之间胞间通讯的“语种”。
3 藻际胞间通讯信号分子及作用机制 3.1 藻际胞间通讯信号分子甄别早期对胞间通讯信号分子作用的认知,是通过从滤液中粗提、浓缩信号物质,再回填至新的培养液中而获得的。但是,滤液成分十分复杂,导致研究人员对于信号分子的化学结构和浓度水平知之甚少。随着提纯及检测技术的发展,滤液提纯方法经历了粗放式提取到定性提取的发展,分析方法也由化学半定性法过渡到色谱及多级质谱联用等仪器的分析手段。表 1列举了本文中提到的几种藻际胞间通讯典型的信号分子及其作用。
| Cell-to-cell communication in phycosphere | Signal molecules name | Composition | Function | References |
| Microalgae-bacterial | C6-HSL | 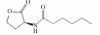
|
Promote/inhibit the growth of algae cells | [38] |
| C8-HSL | 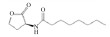
|
[40] | ||
| C10-HSL | 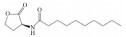
|
[41] | ||
| Microalgae-fungus | 3-oxo-C12-HSL | 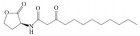
|
Inhibit the formation of fungal hyphae | [54] |
| Farnesol | 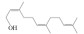
|
[51] | ||
| Microalgae-microalgae | 1-naphthylacetic acid | 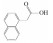
|
Promote the growth of algae cells, accumulate lipid, improve photosynthetic efficiency, etc. | [64] |
| 3-indolebutyric acid | 
|
[64] | ||
| Zeatin | 
|
[65] | ||
| Auxin | 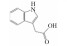
|
[65] | ||
| GA | 
|
[65] |
目前对于信号分子的提取主要采取固相萃取技术(SPE),在萃取过程中,根据萃取柱的性质不同,可以对不同目标物进行有效富集,降低了滤液中杂质对检测结果造成的影响。近年来固相微萃取技术(SPME)也逐步应用到研究中,仅用一个装置即可完成萃取、浓缩等全部前处理和进样工作。在减少了工作量的同时,也提高了萃取效率。研究人员为了获得更完整的信号分子信息,可根据目标信号分子的物理化学性质和固相萃取柱的特点,耦联使用两种或者两种以上固相萃取柱进行处理,富集纯化目标信号分子。较为常用的固相萃取小柱包括离子交换柱[66]、反相色谱柱(C18柱、Oasis HLB柱)[67]、混合模式色谱柱(Oasis MAX柱、Oasis MCX柱)等[68-69]。
在信号分子检测方面,提高微量信号分子检测的精准度,分析生物群落结构演替与时空分布特征的关联,是阐明藻际胞间化学信号在生态环境中功能作用的重要途径。目前广泛采用多级反应监控模式(multiple reaction monitor,MRM),其在信号分子定量分析时具有显著优势。MRM具有较高的选择性和特异性, 可以快速灵敏地从少量粗提物中直接检测出相关信号分子[70],并结合保留时间和母离子/子离子对样品中的信号分子进行准确定性与定量[71]。
研究者们采用改进的固相萃取-液质联用技术,从小球藻滤液中甄别了5种介导微藻胞间通讯的植物激素,主要包括:生长素(Auxins)[72]、脱落酸(abscisic acid,ABA)[73]、细胞分裂素(cytokinins)[69]、赤霉素(gibberellin,GA)[68]和乙烯(ethylene)等[74]。
3.2 藻际胞间通讯信号分子的作用机制 3.2.1 AHLs对微藻基因表达路径的调控:随着测序技术的发展与成熟,转录组和蛋白组学分析技术可在基因、转录水平深入揭示藻-菌共生体系中藻菌微生物之间的胞间通讯路径调控机制。真核藻类感知原核细菌分泌的AHLs并做出生理响应这一系列的胞间通讯行为主要涉及3个关键环节:藻类接受AHLs信号分子的方式、AHLs信号分子在藻胞内进行转导的方式以及AHLs信号分子介导微藻细胞特异性基因表达的相关路径。
在微藻的感知系统中,细胞表面的受体蛋白对胞外不同结构的AHLs具有不同的识别能力,这主要是由于微藻细胞对不同酰基链长度和取代基结构的AHLs的感知和响应具有差异性。通过比对AHLs处理前后小球藻蛋白质表达的变化,发现仅仅C4-HSL和C6-HSL可以促进绿藻(Ulva)和红藻(Gracilaria)果孢子的形成和释放[75]。向小球藻培养液中外源添加AHLs,可以类似于细菌受体(DNA结合转录因子称为R蛋白)的方式与同源受体结合,并且会导致受体蛋白活化或抑制多个靶基因转录表达[38]。Zhang等研究表明,在C6-HSL的刺激下,小球藻的生物量降低77%,但油脂含量提高60%[76]。信号分子对小球藻的作用主要体现在油脂合成和DNA复制两方面,具体表现为:在油脂合成路径上的关键酶,例如乙酰辅酶A羧化酶以及脂肪酸合成酶等,共有14个酶的表达量上调;在DNA复制路径上的关键酶,例如DNA聚合酶、DNA连接酶等,共有41个酶的表达量呈显著下调趋势[76]。AHLs对微藻细胞影响模式如图 1所示。
AHLs主要通过3种潜在机制调控微藻细胞的生理活动:(1) 同细菌感知AHLs方式类似,AHLs通过自由扩散和转运机制进入微藻细胞内部,结合胞内特异性受体,启动特异性功能基因的表达[57, 77];(2) AHLs作为胞外信号分子,与微藻细胞膜表面偶联的受体蛋白结合,信号转导为胞内第二信使分子(cAMP或Ca2+等),调控下游级联反应[54, 78];(3) 胞内AHLs及转导后的第二信使分子通过调控胞内酶活性、三羧酸循环、氨基酸合成或糖酵解等代谢路径,从而促使藻菌形成聚集体,或介导油脂生物合成路径,提高油脂产量[79]。
3.2.2 植物激素的调节作用:目前,植物激素是最为广泛研究微藻胞间的信号物质,其对微藻基因表达的调控影响了藻细胞的代谢功能与其他生理生态特征。与原核微生物产生信号物质类似,微藻细胞也可以合成植物激素,如在小球藻NC64A基因组中检测到5种ABA相关基因的同源序列[78]。基于现有的研究手段,对藻细胞内植物激素检测方法十分有限,所以微藻内源植物激素的研究大都是基于对高等植物激素的认知,采用添加至微藻培养液中的方式而开展的。植物激素介导的藻细胞的胞间通讯行为与机制尚存在相当的研究空白。
植物激素对微藻生长、胞内生物质合成和抗氧化机制等都具有显著的影响。在磷营养盐调节作用下,小球藻之间可以通过内源性信号分子苯甲酸和水杨酸进行胞间通讯作用。苯甲酸和水杨酸的生物合成是通过来自反式肉桂酸(t-CA)的CoA依赖的非氧化途径实现。在磷酸盐胁迫下,水合作用明显加强,BA生物合成所需关键酶苯甲酸合成酶(NAD)的转录量明显增加。两种信号分子(苯甲酸BA和水杨酸SA)的浓度与细胞生长呈良好的线性关系。这是因为BA相关的下游产物乙酰辅酶A改善了TCA的碳同化循环,同时DNA复制的相关基因表达也普遍得到了促进[80-81]。这一发现,支持了磷补给在氮饥饿胁迫条件下促进藻细胞生长的生物信息机制,也为微藻生物质能源的高效合成提供了新思路。图 2基于转录组数据分析,揭示了藻细胞产生的植物激素类信号分子BA和SA的合成路径及作用机制。多个研究表明,SA可促进细胞中油脂的积累。具体作用方式为:在细胞中通过调控氨基酸代谢、糖酵解以及戊糖磷酸化等途径,使得脂肪酸代谢路径上关键酶表达量上调;同时,促进胞内碳水化合物及蛋白质的降解,促进碳源流向脂肪酸合成路径,提高细胞内油脂含量[82-83]。
生长素也是一种微藻胞内合成的、调节微藻生长代谢的一种信号类物质。IAA作为一种典型的生长素,在适宜浓度下对大多数微藻的生长均有促进作用。它通过控制小球藻固碳关键酶核酮糖-1, 5-二磷酸羧化酶/加氧酶(Rubisco)、抗氧化酶(POD、SOD及CAT等)、油脂合成关键酶乙酰辅酶A羧化酶(ACCase)的活性[84]。在金藻(Nannochloropsis oceanica)培养过程中,生长素和赤霉素介导了金藻胞间通讯,对其生物量、脂质和DHA产量起到了积极的调节作用。生长素和赤霉素能够促进葡萄糖摄取、脂肪酸生物合成和甲羟戊酸途径的上调表达,同时抑制糖酵解和TCA循环路径的转录表达[85-86]。
综上所述,植物激素通过基因表达能够调节微藻脂肪酸合成、TCA循环、戊糖磷酸途径以及DNA复制等,由此对微藻生物质资源/能源生产具有重要影响。不同于微藻对AHLs信号分子的感知和响应机制,植物激素对微藻的调控作用通过膜蛋白或膜内蛋白组成的信号受体完成,主要包括离子通道激动剂类受体[82]、G蛋白偶联受体[85]、蛋白质超家族类胞内受体[87]。
4 展望胞间通讯作为重要的信息交流手段,对藻际微生物之间的相互作用具有重要影响。藻际胞间通讯影响了藻际微生物多样性、微生物群落组成,并在藻际环境的影响下而发生变化与调节。在菌-藻或藻-藻共存状态下,胞间通讯是藻际微生物之间相互作用的主要驱动力。多种藻际信号分子及其性质已逐渐被辨明和解析。在不同环境胁迫下分离出的信号分子,其介导的微藻胞间通讯作用也不尽相同,主要包括对微藻生长、光合效率、胞内生物质组分和抗氧化性等特征指标的影响。基因组学、代谢组学和转录组学及其联用技术为深入解析藻际信号分子作用机制提供了有力支持。植物激素具有痕量的特性,且多数易合成,廉价高产。相比于其他调节机制(营养胁迫、温度、光强改变等),植物激素在较低成本投入时,就可以达到显著提高生物质能源产率、提高生态环境稳定性的效果。
但是,藻际胞间通讯的研究尚处于起步阶段,藻际信号分子的产生路径及作用机制尚存在相当的研究空白。借鉴胞间通讯在其他微生物种群中的研究历程,结合微藻生物质资源/能源领域的需求,藻际胞间通讯领域在以下几方面的研究工作需引起关注:(1) 优化藻间信号分子的提取方法,使用核磁共振氢谱仪深入解析特征官能团,利用超高效液相色谱/高分辨率LTQ轨道质谱方法检测信号分子,精准识别未知信号分子;(2) 随着系统生物学的不断发展,联合使用转录组、蛋白组等多组学分析,解析藻际微生物之间功能性信号分子对微藻的响应和调控机制。以此为理论依据,可以采用基因工程手段,建立提高微藻的生物质资源/能源生产效率的策略;(3) 采用多种信号分子联合投加策略,结合不同地区的生态环境特性,有效经济地发挥信号分子调控微生物种间交流提高生态系统稳定性,提高微藻生产生物质能源工业化进程;(4) 目前藻际胞间通讯的研究主要是基于微观层面,但其具有的巨大应用潜力,值得研究人员从宏观调控生态系统上进一步深入研究。
| [1] | Nealson KH, Platt T, Hastings JW. Cellular control of the synthesis and activity of the bacterial luminescent system. Journal of Bacteriology, 1970, 104(1): 313-322. DOI:10.1128/jb.104.1.313-322.1970 |
| [2] | De Kievit TR, Iglewski BH. Bacterial quorum sensing in pathogenic relationships. Infection and Immunity, 2000, 68(9): 4839-4849. DOI:10.1128/IAI.68.9.4839-4849.2000 |
| [3] | Bulman, Za ck, Hudson, Andre, Savka, Michel A. Propolis, a product of the bee hive, has an antagonistic affect on quorum-sensing regulated bioluminescence, gene transcription and motility. The FASEB Journal, 1994, 25(51): 9581-9584. |
| [4] | Chong G, Kimyon O, Manefield M. Quorum sensing signal synthesis may represent a selective advantage independent of its role in regulation of bioluminescence in Vibrio fischeri. PLoS ONE, 2013, 8(6): e67443. DOI:10.1371/journal.pone.0067443 |
| [5] | Willenbacher J, Mohr T, Henkel M, Gebhard S, Mascher T, Syldatk C, Hausmann R. Substitution of the native srfA promoter by constitutive Pveg in two B. subtilis strains and evaluation of the effect on surfactin production. Journal of Biotechnology, 2016, 224: 14-17. DOI:10.1016/j.jbiotec.2016.03.002 |
| [6] | Chen X, Schauder S, Potier N, van Dorsselaer A, Pelczer I, Bassler BL, Hughson FM. Structural identification of a bacterial quorum-sensing signal containing boron. Nature, 2002, 415(6871): 545-549. DOI:10.1038/415545a |
| [7] | Ren TT, Yu HQ, Li XY. The quorum-sensing effect of aerobic granules on bacterial adhesion, biofilm formation, and sludge granulation. Applied Microbiology and Biotechnology, 2010, 88(3): 789-797. DOI:10.1007/s00253-010-2796-8 |
| [8] | Withers H, Swift S, Williams P. Quorum sensing as an integral component of gene regulatory networks in gram-negative bacteria. Current Opinion in Microbiology, 2001, 4(2): 186-193. DOI:10.1016/S1369-5274(00)00187-9 |
| [9] | Adonizio A, Kong KF, Mathee K. Inhibition of quorum sensing-controlled virulence factor production in Pseudomonas aeruginosa by South Florida plant extracts. Antimicrobial Agents and Chemotherapy, 2008, 52(1): 198-203. DOI:10.1128/AAC.00612-07 |
| [10] | Takayama Y, Kato N. In vitro analysis of essential binding sites on the promoter of the Serratia marcescens spn operon with the quorum-sensing receptor SpnR. Biotechnology and Bioengineering, 2016, 113(11): 2513-2517. DOI:10.1002/bit.26013 |
| [11] | Moran MA. The global ocean microbiome. Science, 2015, 350(6266): aac8455. DOI:10.1126/science.aac8455 |
| [12] | Vanelslander B, Paul C, Grueneberg J, Prince EK, Gillard J, Sabbe K, Pohnert G, Vyverman W. Daily bursts of biogenic cyanogen bromide (BrCN) control biofilm formation around a marine benthic diatom. PNAS, 2012, 109(7): 2412-2417. DOI:10.1073/pnas.1108062109 |
| [13] | Krediet CJ, Ritchie KB, Paul VJ, Teplitski M. Coral-associated micro-organisms and their roles in promoting coral health and thwarting diseases. Proceedings of the Royal Society B: Biological Sciences, 2013, 280(1755): 20122328. DOI:10.1098/rspb.2012.2328 |
| [14] | Amin SA, Hmelo LR, van Tol HM, Durham BP, Carlson LT, Heal KR, Morales RL, Berthiaume CT, Parker MS, Djunaedi B, Ingalls AE, Parsek MR, Moran MA, Armbrust EV. Interaction and signalling between a cosmopolitan phytoplankton and associated bacteria. Nature, 2015, 522(7554): 98-101. DOI:10.1038/nature14488 |
| [15] |
Shen ML, Yang R, Luo QJ, Wang SG, Ren JR. Microbial diversity of Pyropia haitanensis phycosphere during cultivation. Acta Microbiologica Sinica, 2013, 53(10): 1087-1102.
(in Chinese) 沈梅丽, 杨锐, 骆其君, 王淑刚, 任继锐. 坛紫菜养殖周期中的藻际微生物多样性. 微生物学报, 2013, 53(10): 1087-1102. |
| [16] | 方文雅. 紫菜与藻际微生物互作研究平台的初步研究. 宁波大学学位论文, 2010. |
| [17] | Williams TJ, Wilkins D, Long E, Evans F, DeMaere MZ, Raftery MJ, Cavicchioli R. The role of planktonic Flavobacteria in processing algal organic matter in coastal East Antarctica revealed using metagenomics and metaproteomics. Environmental Microbiology, 2013, 15(5): 1302-1317. DOI:10.1111/1462-2920.12017 |
| [18] | Carrillo P, Villar-Argaiz M, Medina-Sánchez JM. Does microorganism stoichiometry predict microbial food web interactions after a phosphorus pulse?. Microbial Ecology, 2008, 56(2): 350-363. DOI:10.1007/s00248-007-9353-8 |
| [19] | Dimitrieva GY, Crawford RL, Yüksel GÜ. The nature of plant growth-promoting effects of a pseudoalteromonad associated with the marine algae Laminaria japonica and linked to catalase excretion. Journal of Applied Microbiology, 2006, 100(5): 1159-1169. DOI:10.1111/j.1365-2672.2006.02831.x |
| [20] | Georges AA, El-Swais H, Craig SE, Li WK, Walsh DA. Metaproteomic analysis of a winter to spring succession in coastal northwest Atlantic Ocean microbial plankton. The ISME Journal, 2014, 8(6): 1301-1313. DOI:10.1038/ismej.2013.234 |
| [21] | 易齐涛. 海洋菌-藻关系及对营养盐吸收作用的研究. 中国海洋大学学位论文, 2006. |
| [22] |
Xu LL, Wang QX, Wu SX, Li DZ. Optimization of co-cultivation conditions of transgenic alga hemHc-lbac and Bradyrhizobium japonicum for hydrogen production. Ecological Science, 2014, 33(1): 106-112.
(in Chinese) 许丽丽, 王全喜, 吴双秀, 李德志. 转基因莱茵衣藻hemHc-lbac和根瘤菌共培养提高产氢培养条件的优化. 生态科学, 2014, 33(1): 106-112. |
| [23] | Foster RA, Kuypers MMM, Vagner T, Paerl RW, Musat N, Zehr JP. Nitrogen fixation and transfer in open ocean diatom-cyanobacterial symbioses. The ISME Journal, 2011, 5(9): 1484-1493. DOI:10.1038/ismej.2011.26 |
| [24] | Kim BH, Ramanan R, Cho DH, Oh HM, Kim HS. Role of Rhizobium, a plant growth promoting bacterium, in enhancing algal biomass through mutualistic interaction. Biomass and Bioenergy, 2014, 69(3): 95-105. |
| [25] | Danger M, Leflaive J, Oumarou C, Ten-Hage L, Lacroix G. Control of phytoplankton-bacteria interactions by stoichiometric constraints. Oikos, 2007, 116(7): 1079-1086. |
| [26] |
Zhang R, Wang GJ, Li ZF, Yu EM, Xia Y. Inhibition of Microcystis aeruginosa by Bacillus subtilis. China Environmental Science, 2015, 35(6): 1814-1821.
(in Chinese) 张睿, 王广军, 李志斐, 郁二蒙, 夏耘. 枯草芽孢杆菌对铜绿微囊藻抑制效果的研究. 中国环境科学, 2015, 35(6): 1814-1821. DOI:10.3969/j.issn.1000-6923.2015.06.026 |
| [27] | 田达玮. 胶州湾夜光藻种群动态及其摄食特征研究. 中国科学院大学学位论文, 2017. |
| [28] | 林伟. 海洋微藻与细菌相互关系的研究-正负相互作用的几个例证. 中国科学院研究生院学位论文, 2005. |
| [29] | Ridley CJA, Day JG, Smith AG. Cryopreservation studies of an artificial co-culture between the cobalamin-requiring green alga Lobomonas rostrata and the bacterium Mesorhizobium loti. Journal of Applied Phycology, 2018, 30(2): 995-1003. DOI:10.1007/s10811-017-1270-8 |
| [30] |
Zheng TL, Tian Y, Su JQ, Wang YL, Lian YW, Hong HS. Study on the ecological relationship between a red-tide causative alga and three strains of bacteria isolated from Xiamen harbor. Acta Ecologica Sinica, 2002, 22(12): 2063-2070.
(in Chinese) 郑天凌, 田蕴, 苏建强, 王艳丽, 连玉武, 洪华生. 海洋赤潮生物与厦门海域几种细菌的生态关系研究. 生态学报, 2002, 22(12): 2063-2070. DOI:10.3321/j.issn:1000-0933.2002.12.007 |
| [31] | Bar-Zeev E, Rahav E. Microbial metabolism of transparent exopolymer particles during the summer months along a eutrophic estuary system. Frontiers in Microbiology, 2015, 6: 403. |
| [32] | 汪辉. 溶藻细菌对水华与赤潮微藻的抑制效应研究. 南京农业大学学位论文, 2011. |
| [33] | 谢静. 溶藻细菌L7对两种水华藻类的溶藻机制研究. 华南理工大学学位论文, 2013. |
| [34] | Sun Z, Liu J, Zeng XH, Huangfu JQ, Jiang Y, Wang MF, Chen F. Protective actions of microalgae against endogenous and exogenous advanced glycation endproducts (AGEs) in human retinal pigment epithelial cells. Food & Function, 2011, 2(5): 251-258. |
| [35] | 姚领. 海洋微藻抗菌活性藻株筛选及其活性物质分离纯化研究. 天津商业大学学位论文, 2007. |
| [36] | Van Mooy BAS, Hmelo LR, Sofen LE, Campagna SR, May AL, Dyhrman ST, Heithoff A, Webb EA, Momper L, Mincer TJ. Quorum sensing control of phosphorus acquisition in Trichodesmium consortia. The ISME Journal, 2012, 6(2): 422-429. DOI:10.1038/ismej.2011.115 |
| [37] | 毕相东. 小球藻与优势共栖异养细菌间的相互作用及其对细菌群体感应信号分子的响应. 中国海洋大学学位论文, 2013. |
| [38] |
Bi XD, Zhou WL, Xing KZ, Tang XX. Effects of AHLs (N-hexanoyl-DL-homoserine lactone, C6-HSL) on growth and antioxidant defense system of Chlorella vulgaris. Marine Environmental Science, 2012, 31(6): 897-900.
(in Chinese) 毕相东, 周文礼, 邢克智, 唐学玺. AHLs信号分子对小球藻生长及抗氧化酶系统的影响. 海洋环境科学, 2012, 31(6): 897-900. |
| [39] | Zhang CF, Ho SH, Li AR, Fu L, Zhou DD. Co-culture of Chlorella and Scenedesmus could enhance total lipid production under bacteria quorum sensing molecule stress. Journal of Water Process Engineering, 2021, 39: 101739. DOI:10.1016/j.jwpe.2020.101739 |
| [40] |
Xu LY, Zheng L, Han XT, Cui ZS, Guo XC, Li XZ. Screening of microalgae associated bacteria with quorum sensing system and their algicidal activity. Oceanologia et Limnologia Sinica, 2012, 43(6): 1149-1155.
(in Chinese) 徐鲁燕, 郑立, 韩笑天, 崔志松, 郭秀春, 李馨子. 具有群体感应系统微藻共栖细菌的筛选及抑藻活性的研究. 海洋与湖沼, 2012, 43(6): 1149-1155. |
| [41] |
Dou Y, Gan Y, Tang XX, Zhang WH, Jiang ZF, Gao JW, Zhou WL. Effects of AHLs on PSⅡ photochemistry activity and biochemical indexes of Chlorella vulgaris. Periodical of Ocean University of China, 2017, 47(11): 40-46.
(in Chinese) 窦勇, 甘雨, 唐学玺, 张文慧, 姜智飞, 高金伟, 周文礼. AHLs对小球藻PSⅡ光化学活性与生化指标的影响研究. 中国海洋大学学报: 自然科学版, 2017, 47(11): 40-46. |
| [42] | Zhou DD, Zhang CF, Fu L, Xu L, Cui XC, Li QC, Crittenden JC. Responses of the microalga Chlorophyta sp. bacterial quorum sensing molecules (N-acylhomoserine lactones): aromatic protein-induced self-aggregation.. Environmental Science & Technology, 2017, 51(6): 3490-3498. |
| [43] | Wyss SC. Design of a cross-domain quorum sensing pathway for algae biofuel applications. 2013. |
| [44] | Zhou WL, Xiao H, Qiao XT, Sun JF, Xing KZ, Tang XX. Quorum sensing of an associated heterotrophic bacteria-Z-QS01 with Chlorella vulgaris and response to enhanced UV-B radiation. Transactions of Beijing Institute of Technology, 2011, 31(1): 109-112. |
| [45] | Daft MJ, McCord SB, Stewart WDP. Ecological studies on algal-lysing bacteria in fresh waters. Freshwater Biology, 1975, 5(6): 577-596. DOI:10.1111/j.1365-2427.1975.tb00157.x |
| [46] | Miller MB, Bassler BL. Quorum sensing in bacteria. Annual Review of Microbiology, 2001, 55: 165-199. DOI:10.1146/annurev.micro.55.1.165 |
| [47] | Teplitski M, Chen HC, Rajamani S, Gao MS, Merighi M, Sayre RT, Robinson JB, Rolfe BG, Bauer WD. Chlamydomonas reinhardtii secretes compounds that mimic bacterial signals and interfere with quorum sensing regulation in bacteria. Plant Physiology, 2004, 134(1): 137-146. DOI:10.1104/pp.103.029918 |
| [48] | Manefield M, Rasmussen TB, Henzter M, Andersen JB, Steinberg P, Kjelleberg S, Givskov M. Halogenated furanones inhibit quorum sensing through accelerated LuxR turnover. Microbiology: Reading, England, 2002, 148(Pt 4): 1119-1127. |
| [49] | Zhou WG, Cheng YL, Li Y, Wan YQ, Liu YH, Lin XY, Ruan R. Novel fungal pelletization-assisted technology for algae harvesting and wastewater treatment. Applied Biochemistry and Biotechnology, 2012, 167(2): 214-228. DOI:10.1007/s12010-012-9667-y |
| [50] | 叶晨松. 基于丝状真菌的微藻收获技术研究及废水处理初探. 南昌大学学位论文, 2018. |
| [51] | Dinamarco TM, Goldman MHS, Goldman GH. Farnesol-induced cell death in the filamentous fungus Aspergillus nidulans. Biochemical Society Transactions, 2011, 39(5): 1544-1548. DOI:10.1042/BST0391544 |
| [52] | Deveau A, Piispanen AE, Jackson AA, Hogan DA. Farnesol induces hydrogen peroxide resistance in Candida albicans yeast by inhibiting the Ras-cyclic AMP signaling pathway. Eukaryotic Cell, 2010, 9(4): 569-577. DOI:10.1128/EC.00321-09 |
| [53] | 王越. 丝状真菌(Galactomyces)对N-酰基高丝氨酸内酯的响应机制. 东北师范大学学位论文, 2020. |
| [54] | Barriuso J, Hogan DA, Keshavarz T, Martínez MJ. Role of quorum sensing and chemical communication in fungal biotechnology and pathogenesis. FEMS Microbiology Reviews, 2018, 42(5): 627-638. DOI:10.1093/femsre/fuy022 |
| [55] | 钟荣. 一种南海海绵与一株海绵来源真菌次级代谢产物及微藻生长抑制活性研究. 中国海洋大学学位论文, 2013. |
| [56] |
Zhang DP, Wu BG. Studies on respones of red tide algae on temperature, nitrogen, phosphorus and the algal interactions. Journal of Jinan University: Natural Science & Medicine Edition, 2000, 21(5): 82-87.
(in Chinese) 张冬鹏, 武宝玕. 几种赤潮藻对温度、氮、磷的响应及藻间相互作用的研究. 暨南大学学报: 自然科学与医学版, 2000, 21(5): 82-87. DOI:10.3969/j.issn.1000-9965.2000.05.016 |
| [57] |
Zheng D, Duan SS. Allelopathic effects on Chlorella vulgaris and Haematococcus pluvialis. Journal of Anhui Agricultural Sciences, 2009, 37(6): 2380-2383.
(in Chinese) 郑迪, 段舜山. 普通小球藻和雨生血球藻之间的化感效应. 安徽农业科学, 2009, 37(6): 2380-2383. DOI:10.3969/j.issn.0517-6611.2009.06.020 |
| [58] |
Sun YY, Yan BL, Wang CH. Allelophathy between the four species of marine microalgae and Isochrysis galbana. Marine Science Bulletin, 2009, 28(5): 79-84.
(in Chinese) 孙颖颖, 阎斌伦, 王长海. 球等鞭金藻与4种海洋微藻间的化感作用. 海洋通报, 2009, 28(5): 79-84. DOI:10.3969/j.issn.1001-6392.2009.05.012 |
| [59] | Spoehr HA, Smith JHC, Strain HH, Milner HW, Hardin GJ. Fatty acids antibacterials from plants. Quarterly Review of Biology, 1950. |
| [60] | McCracken MD, Middaugh RE, Middaugh RS. A chemical characterization of an algal inhibitor obtained from Chlamydomonas. Hydrobiologia, 1980, 70(3): 271-276. DOI:10.1007/BF00016771 |
| [61] | Fergola P, Cerasuolo M. An algal Allelopathic competition with internal and external toxic compounds. Math Everywhere, 2007. DOI:10.1007/978-3-540-44446-6_21 |
| [62] | Guo SL, Zhao XQ, Wan C, Huang ZY, Yang YL, Asraful Alam M, Ho SH, Bai FW, Chang JS. Characterization of flocculating agent from the self-flocculating microalga Scenedesmus obliquus AS-6-1 for efficient biomass harvest. Bioresource Technology, 2013, 145: 285-289. DOI:10.1016/j.biortech.2013.01.120 |
| [63] | Kanagasabhapathy M, Yamazaki G, Ishida A, Sasaki H, Nagata S. Presence of quorum-sensing inhibitor-like compounds from bacteria isolated from the brown alga Colpomenia sinuosa. Letters in Applied Microbiology, 2009, 49(5): 573-579. DOI:10.1111/j.1472-765X.2009.02712.x |
| [64] | Yu Z, Pei HY, Jiang LQ, Hou QJ, Nie CL, Zhang LJ. Phytohormone addition coupled with nitrogen depletion almost tripled the lipid productivities in two algae. Bioresource Technology, 2018, 247: 904-914. DOI:10.1016/j.biortech.2017.09.192 |
| [65] | Renuka N, Guldhe A, Singh P, Bux F. Combined effect of exogenous phytohormones on biomass and lipid production in Acutodesmus obliquus under nitrogen limitation. Energy Conversion and Management, 2018, 168: 522-528. DOI:10.1016/j.enconman.2018.05.029 |
| [66] | Izumi Y, Okazawa A, Bamba T, Kobayashi A, Fukusaki E. Development of a method for comprehensive and quantitative analysis of plant hormones by highly sensitive nanoflow liquid chromatography-electrospray ionization-ion trap mass spectrometry. Analytica Chimica Acta, 2009, 648(2): 215-225. DOI:10.1016/j.aca.2009.07.001 |
| [67] | Astot C, Dolezal K, Moritz T, Sandberg G. Deuteriumin vivo labelling of cytokinins in Arabidopsis thaliana analysed by capillary liquid chromatography/frit-fast atom bombardment mass spectrometry. Journal of Mass Spectrometry, 2000, 35(1): 13-22. DOI:10.1002/(SICI)1096-9888(200001)35:1<13::AID-JMS901>3.0.CO;2-I |
| [68] | Ma Z, Ge LY, Lee ASY, Yong JWH, Tan SN, Ong ES. Simultaneous analysis of different classes of phytohormones in coconut (Cocos nucifera L.) water using high-performance liquid chromatography and liquid chromatography-tandem mass spectrometry after solid-phase extraction. Analytica Chimica Acta, 2008, 610(2): 274-281. DOI:10.1016/j.aca.2008.01.045 |
| [69] | Ge LY, Yong JWH, Tan SN, Yang XH, Ong ES. Analysis of cytokinin nucleotides in coconut (Cocos nucifera L.) water using capillary zone electrophoresis-tandem mass spectrometry after solid-phase extraction. Journal of Chromatography A, 2006, 1133(1/2): 322-331. |
| [70] | Pan XQ, Welti R, Wang XM. Simultaneous quantification of major phytohormones and related compounds in crude plant extracts by liquid chromatography-electrospray tandem mass spectrometry. Phytochemistry, 2008, 69(8): 1773-1781. DOI:10.1016/j.phytochem.2008.02.008 |
| [71] | Segarra G, Jáuregui O, Casanova E, Trillas I. Simultaneous quantitative LC-ESI-MS/MS analyses of salicylic acid and jasmonic acid in crude extracts of Cucumis sativus under biotic stress. Phytochemistry, 2006, 67(4): 395-401. DOI:10.1016/j.phytochem.2005.11.017 |
| [72] | Zhang FJ, Jin YJ, Xu XY, Lu RC, Chen HJ. Study on the extraction, purification and quantification of jasmonic acid, abscisic acid and indole-3-acetic acid in plants. Phytochemical Analysis, 2008, 19(6): 560-567. DOI:10.1002/pca.1085 |
| [73] | Ross ARS, Ambrose SJ, Cutler AJ, Allan Feurtado J, Kermode AR, Nelson K, Zhou R, Abrams SR. Determination of endogenous and supplied deuterated abscisic acid in plant tissues by high-performance liquid chromatography-electrospray ionization tandem mass spectrometry with multiple reaction monitoring. Analytical Biochemistry, 2004, 329(2): 324-333. DOI:10.1016/j.ab.2004.02.026 |
| [74] | Ge LY, Yong JWH, Goh NK, Chia LS, Tan SN, Ong ES. Identification of kinetin and kinetin riboside in coconut (Cocos nucifera L.) water using a combined approach of liquid chromatography-tandem mass spectrometry, high performance liquid chromatography and capillary electrophoresis. Journal of Chromatography B, 2005, 829(1/2): 26-34. |
| [75] | Singh RP, Baghel RS, Reddy CRK, Jha B. Effect of quorum sensing signals produced by seaweed-associated bacteria on carpospore liberation from Gracilaria Dura. Frontiers in Plant Science, 2015, 6: 117. |
| [76] | Zhang CF, Li QC, Fu L, Zhou DD, Crittenden JC. Quorum sensing molecules in activated sludge could trigger microalgae lipid synthesis. Bioresource Technology, 2018, 263: 576-582. DOI:10.1016/j.biortech.2018.05.045 |
| [77] | Shiner EK, Reddy S, Timmons C, Li GG, Williams SC, Rumbaugh KP. Construction of a bacterial autoinducer detection system in mammalian cells. Biological Procedures Online, 2004, 6(1): 268-276. DOI:10.1251/bpo98 |
| [78] | Lu YD, Xu J. Phytohormones in microalgae: a new opportunity for microalgal biotechnology?. Trends in Plant Science, 2015, 20(5): 273-282. DOI:10.1016/j.tplants.2015.01.006 |
| [79] | Chhabra SR, Harty C, Hooi DSW, Daykin M, Williams P, Telford G, Pritchard DI, Bycroft BW. Synthetic analogues of the bacterial signal (quorum sensing) molecule N-(3-oxododecanoyl)-L-homoserine lactone as immune modulators. Journal of Medicinal Chemistry, 2003, 46(1): 97-104. DOI:10.1021/jm020909n |
| [80] | Li QC, Fu L, Wang Y, Zhou DD, Rittmann BE. Excessive phosphorus caused inhibition and cell damage during heterotrophic growth of Chlorella regularis. Bioresource Technology, 2018, 268: 266-270. DOI:10.1016/j.biortech.2018.07.148 |
| [81] | Fu L, Li QC, Chen CL, Zhang YJ, Liu YL, Xu L, Zhou YH, Li CB, Zhou DD, Rittmann BE. Benzoic and salicylic acid are the signaling molecules of Chlorella cells for improving cell growth. Chemosphere, 2021, 265: 129084. DOI:10.1016/j.chemosphere.2020.129084 |
| [82] | Xu JH, Fan XJ, Li XX, Liu GF, Zhang ZY, Zhu YC, Fu ZW, Qian HF. Effect of salicylic acid on fatty acid accumulation in Phaeodactylum tricornutum during stationary growth phase. Journal of Applied Phycology, 2017, 29(6): 2801-2810. DOI:10.1007/s10811-017-1191-6 |
| [83] | Zhao PC, Lin ZY, Wang YM, Chai HX, Li YC, He L, Zhou J. Facilitating effects of plant hormones on biomass production and nutrients removal by Tetraselmis cordiformis for advanced sewage treatment and its mechanism. Science of the Total Environment, 2019, 693: 133650. DOI:10.1016/j.scitotenv.2019.133650 |
| [84] | Piotrowska-Niczyporuk A, Bajguz A, Zambrzycka E, Godlewska-Żyłkiewicz B. Phytohormones as regulators of heavy metal biosorption and toxicity in green alga Chlorella vulgaris (Chlorophyceae). Plant Physiology and Biochemistry, 2012, 52: 52-65. DOI:10.1016/j.plaphy.2011.11.009 |
| [85] | Park WK, Yoo G, Moon M, Kim CW, Choi YE, Yang JW. Phytohormone supplementation significantly increases growth of Chlamydomonas reinhardtii cultivated for biodiesel production. Applied Biochemistry and Biotechnology, 2013, 171(5): 1128-1142. DOI:10.1007/s12010-013-0386-9 |
| [86] | Giridhar Babu A, Wu XG, Kabra AN, Kim DP. Cultivation of an indigenous Chlorella sorokiniana with phytohormones for biomass and lipid production under N-limitation. Algal Research, 2017, 23: 178-185. DOI:10.1016/j.algal.2017.02.004 |
| [87] | 王联结. 生物化学与分子生物学原理. 北京: 科学出版社, 1999. |
 2022, Vol. 62
2022, Vol. 62