中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 李晋, 杨晓晓, 杨文平, 李文广, 景豆豆, 杨珍平, 高志强. 2021
- Jin Li, Xiaoxiao Yang, Wenping Yang, Wenguang Li, Doudou Jing, Zhenping Yang, Zhiqiang Gao. 2021
- 饲料油菜压青还田对后作小麦土壤真菌群落的影响
- Effect of forage rape green manure returning to field on soil fungal community in winter wheat field
- 微生物学报, 61(9): 2869-2882
- Acta Microbiologica Sinica, 61(9): 2869-2882
-
文章历史
- 收稿日期:2020-11-18
- 修回日期:2021-03-24
- 网络出版日期:2021-06-11
2. 华北理工大学生命科学学院, 河北 唐山 063210
2. College of Life Sciences, North China University of Science and Technology, Tangshan 063210, Hebei Province, China
我国城乡居民三大主粮中的小麦和玉米在国家粮食安全和农业发展大局中占有重要的战略地位。山西位于黄土高原东缘,年降水量370–600 mm,属典型的旱作农业区;是我国北方小麦、玉米等粮食作物的重要产区。据2015–2018年山西省统计年鉴报告,全省粮食作物播种面积平均3196700 hm2,其中小麦玉米播种面积约占全省粮食作物总播种面积的74.7%,而产量约占全省粮食作物总产量的89.8%。运城位于山西省境内南部,光热资源充足,在长期的农业生产中,形成了以小麦-玉米一年两作为主的种植制度,成为山西省小麦玉米主要产区,就小麦生产及品质而言,位居全国十大主产麦区之一,隶属全国强中筋优质麦区。其中小麦播种面积约占全省的50%左右,而产量几乎占全省小麦总产量的70%[1-2]。玉米需肥量大,生产中采用的一次性施肥法易导致前期养分供应过剩,挥发淋溶等损失,后期出现脱氮现象[3]。长期冬小麦-夏玉米一年两熟制度一定程度上实现了对光热和耕地资源的高效利用,但集约化种植、过量施肥,使得耕层浅薄、土壤紧实化、养分利用率低等一系列土壤健康问题尤为突出[4]。
油菜作绿肥的优势体现在能够活化土壤难溶性磷、还田后营养物质均衡、改善土壤物理性状等方面[5]。土壤真菌参与复杂化合物的降解、腐殖质的形成、营养元素的循环,在促进植物生长、维持土壤健康方面起到了重要作用[6-8]。因而在传统种植模式中引入绿肥作物,以冬小麦-油菜替代冬小麦-夏玉米,探究绿肥还田模式下土壤真菌组成,尽最大可能实现资源高效与环境友好的目标。
前人研究已明确,绿肥还田有利于提高冬小麦播前土壤水分,改善土壤物理结构,增加土壤有机质、速效磷、速效钾含量[9-11];同时可以刺激土壤微生物活性,增加耕层土壤微生物数量[12-16]。在生物防治方面,绿肥油菜可以抑制小麦根系丝核菌的数量,有效抑制小麦根腐病的发生,抑制马铃薯枯丝核菌和腐霉菌的生长[17-18]。但迄今对真菌群落组成及真菌功能未有详细报道。因此,本试验采用高通量测序技术,对麦田土壤真菌进行检测,并结合FUNGuild数据库进行真菌功能预测[19],进一步明确饲料油菜作绿肥的优势,为绿肥油菜在晋南麦区的推广提供理论依据。
1 材料和方法 1.1 试验地概况试验于2016年6月–2017年6月在山西省运城市垣曲县长直乡鲁家坡村十倾园(111°43.3′E,35°14.4′N)冬小麦-夏玉米一年两熟试验田进行。以麦后复种夏玉米为对照,小麦收获后复种饲料油菜,试验地为典型旱作雨养农业区。试验田为山顶梯田,土壤类型为褐土性红立黄土,土质为中壤土。0–20 cm耕层土壤基本理化性质为:土壤全氮含量0.87 g/kg,碱解氮含量41.13 mg/kg,速效磷含量14.58 mg/kg,有机质含量11.51 g/kg,土壤pH 8.0。试验期间当地气温及降水变化如图 1所示。

|
| 图 1 试验区气温和降水分布 Figure 1 Temperature and precipitation in Yuanqu county for June 2016–June 2017. |
1.2 试验材料
供试油菜品种为“华油杂62号”,由华中农业大学油菜实验室提供。供试冬小麦品种为“烟农21号”,该品种具有较强的抗寒、抗旱和抗倒伏能力;夏玉米品种为“联创808”;由山西省侯马市金色农田有限公司提供。
1.3 试验设计于前茬小麦收获当天(2016年6月10日)复种饲料油菜,条播,行距20 cm。试验采用二因素裂区试验设计,以油菜播量为主区,设置小播量(S),7.5 kg/hm2;中播量(M),15 kg/hm2;大播量(L),22.5 kg/hm2 3个播量梯度;以还田时间为副区,设置早期还田(D1),9月10日;中期还田(D2),9月20日;晚期还田(D3),9月30日3个还田时期。还田时油菜全量还田。以常规农户麦后复种夏玉米为对照(CK)。共计10个处理,各处理3个小区重复,共30个小区,小区面积15 m×44 m。复种玉米采用机械化种肥同播技术,75000株/hm2,复合肥750 kg/hm2,复种玉米收获后秸秆粉碎还田。
于2016年10月9日使用施肥播种一体机统一种植冬小麦,条播,行距为20 cm,播量112.5 kg/hm2,所用肥料为氮磷钾复合肥(肥料用量合纯N 135 kg/hm2、P2O5 165 kg/hm2、K2O 37.5 kg/hm2),小麦播种后田间管理同常规大田生产。
1.4 土壤样品采集于2017年6月1日小麦收获前采集土壤样品,各小区随机选取5个样方(1 m×1 m),每个样方随机选取3个点,以小麦根为中心,使用无菌土钻采集0–20 cm根区土样,将各小区内15个点的土样去除动植物残体、石块等杂物后混合均匀装入无菌自封袋,作为1个重复样,放于4 ℃冰盒中带回实验室,于–80 ℃的冰箱中保存,备用。田间布局及取样方法如图 2所示。

|
| 图 2 田间设计及取样方式 Figure 2 Field design and sampling method. |
1.4.1 真菌DNA的提取和测序:
将采集的土壤样品用土壤DNA提取试剂盒(MP Biomedicals,Satan Ana,CA,USA)提取土壤微生物总DNA,并采用NanoDrop ND-1000分光光度计(Thermo Fisher Scientific,Waltham,MA,USA)以及琼脂糖凝胶电泳进行DNA质量检测。利用ITS5F (GGAAGTAAAAGTCGTAACAAGG)和ITS1R (GCTGCGTTCTTCATCGATGC) 对18S rRNA的ITS区进行PCR扩增。PCR扩增体系为:5 μL Q5反应缓冲液(5×),5 μL Q5高保真气相色谱缓冲液(5×),0.25 μL Q5高保真DNA聚合酶(5 U/μL),2 μL (2.5 mmol/L)的dNTPs,上游引物与下游引物各1 μL (10 μmol/L),2 μL DNA模板,8.75 μL灭菌ddH2O。扩增过程:98 ℃ 2 min;98 ℃ 15 s,55 ℃ 30 s,72 ℃ 30 s,25个循环;72 ℃ 5 min。PCR扩增子使用Agencourt AMPure Beads (Beckman Coulter,Indianapolis,IN)纯化,使用PicoGreen dsDNA Assay Kit (Invitrogen, Carlsbad,CA,USA)量化。个体定量步骤结束后,取等量扩增子,使用上海派森诺生物技术有限公司的Illlumina MiSeq平台,MiSeq试剂盒对末端2×300 bp进行高通量测序。
1.4.2 OTU划分和分类地位确定:使用QIIME软件,调用UCLUST序列比对工具,对获得的序列按97%的相似度进行归并和OTU (可操作分类单元)划分,去除丰度值低于总测序量的十万分之一的OTU,根据每个OTU在每个样本中包含的序列数,构建OTU表。通过将OTU代表序列与对应数据库模板序列进行比对,得到每个OTU所对应的分类学信息。真菌注释所用的数据库为Silva数据库(Release115,http://www.arb-silva.de)和UNITE数据库(Release 5.0,https://unite.ut.ee/)。
1.5 数据分析高通量测序结果采用QIIME和R package (v 3.8.3)进行分析。采用Excel 2010进行基本计算和部分图表绘制;使用R软件进行可视化分析,根据OTU表格使用QIIME软件计算α多样性指数,使用SPSS 26进行方差分析、多重比较(P < 0.05)及Spearman相关分析(P值);真菌功能预测采用FUNGuild在线数据库(http://www.stbates.org/guilds/app.php)进行分析。
2 结果和分析 2.1 饲料油菜还田对土壤真菌群落OTU及α多样性的影响Alpha多样性指数包括反映物种丰富度的ACE和Chao1指数和反映物种多样性的Simpson和Shannon指数,ACE和Chao1数值越大,说明物种数量越多;Shannon指数越大,Simpson指数越小,则表明样品中物种多样性越丰富。复种玉米后土壤OTU总数为678,显著高于复种油菜各处理(P < 0.05);复种油菜处理中土壤真菌丰富度指数与复种玉米的对照相比显著降低;播量增大,真菌丰富度先减后增,以中播量早还田(MD1)处理效果最显著。随播量增加,还田量显著增加,小麦产量表现为先增后减的变化趋势;相比于CK,中播量中期还田(MD2)显著提高小麦产量,小播量晚还田(SD3)处理产量降幅最小;随还田期的推迟,大播量处理下小麦产量逐渐降低,可见还田量低的情况下应适当晚还田,随还田生物量的增加,还田时间应提前(表 1)。
| Treatment | Feed rape biomass/(kg/hm2) | OTU | Chao 1 | ACE | Simpson | Shannon | Grain yield/(kg/hm2) |
| CK | – | 678a | 726.4a | 748.2a | 0.93a | 5.81a | 5137.7de |
| SD1 | 793.7c | 478 b | 518.5bc | 521.9bc | 0.96a | 6.10a | 4830.5f |
| SD2 | 794.5c | 435b | 448.5bc | 444.9bc | 0.94a | 5.80a | 4576.5g |
| SD3 | 815.2c | 477b | 485.1bc | 486.2bc | 0.94a | 5.87a | 4928.7ef |
| MD1 | 1367.4b | 423b | 430.4c | 428.9c | 0.92a | 5.30a | 5503.6b |
| MD2 | 1379.0b | 506b | 506.0bc | 507.1bc | 0.96a | 6.07a | 5706.4a |
| MD3 | 1388.8b | 418b | 434.1c | 442.7c | 0.90a | 5.11a | 5337.3c |
| LD1 | 1866.47a | 506b | 506.3bc | 509.0bc | 0.96a | 6.00a | 5213.6d |
| LD2 | 1854.3a | 547b | 581.1b | 583.3b | 0.96a | 6.18a | 5211.7d |
| LD3 | 1938.7a | 528b | 528.4bc | 532.1bc | 0.94a | 5.80a | 5107.8e |
| Lowercase letters in the same column indicate significant differences among treatments, P < 0.05. | |||||||
2.2 不同分类水平下微生物类群统计 2.2.1 不同处理门水平、纲水平下优势菌群物种组成及相关分析:
在门水平上,共鉴定出8个真菌门。其中,相对丰度大于1%的有子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)和壶菌门(Chytridiomycota),相对丰度分别为66.85%–87.77%、4.17%–19.63%、1.14%–10.25%和0.19%–7.52%。子囊菌门在播量为15 kg/hm2和22.5 kg/hm2情况下,随还田期推迟,丰度显著提高。与复种玉米对照相比,中播量和大播量晚还田(MD3、LD3)处理使土壤中子囊菌门相对丰度分别提高了7.1%和1.7%。小播量显著提高了担子菌门相对丰度;其中,晚还田(SD3)处理下担子菌门相对丰度较对照增加了3.7倍。结合菌门与壶菌门则对油菜中播量早还田(MD1)处理更为敏感(图 3-A)。
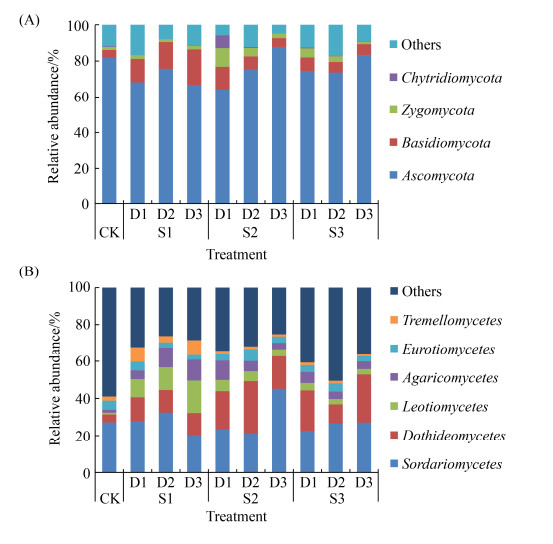
|
| 图 3 不同处理下土壤真菌门水平(A) 和纲水平(B) 相对丰度 Figure 3 Relative abundance of soil fungi community at phylum (A) and class (B) levels under different treatments. |
在纲水平对真菌进行物种注释分析,已鉴别真菌中相对丰度大于1%的有6个优势纲,分别为子囊菌门中的粪壳菌纲(Sordariomycetes)、座囊菌纲(Dothideomycets)、锤舌菌纲(Leotiomcets)、散囊菌纲(Eurotiomcetes)及担子菌门中的伞菌纲(Agaricomycets)和银耳纲(Tremellomycets)。上述6个优势纲在对照(CK)中相对丰度占41.05%,油菜还田后提高至49.49%–74.73%。增大油菜播量,座囊菌纲丰度相对增加,锤舌菌纲、伞菌纲、银耳纲的相对丰度逐渐降低。其中,中播量中期还田(MD2)和大播量晚期还田(LD3)分别使座囊菌纲丰度提高了23.69%和24.45%;小播量中期及晚期还田(SD2、SD3)使锤舌菌纲和伞菌纲相对丰度提高了9.33%–16.38%;早期和晚期还田(SD1、SD3)处理使银耳纲丰度提高了5.73%和5.94%。以上数据处理间差异均达到显著水平(P < 0.05) (图 3-B)。
对门水平真菌的相对丰度进行相关分析发现,子囊菌门(Ascomycota)与担子菌门(Basidiomycota),Cercozoa与Cilliophora均呈显著负相关,R2分别为0.64和0.69 (P < 0.05);接合菌门(Zygomycota)与壶菌门(Chytridiomycota)极显著正相关(R2=0.71,P < 0.01) (图 4-A)。在纲水平,粪壳菌纲与其他真菌纲均呈负相关关系,锤舌菌纲与伞菌纲和银耳纲显著正相关(R2=0.88,R2=0.7) (图 4-B)。
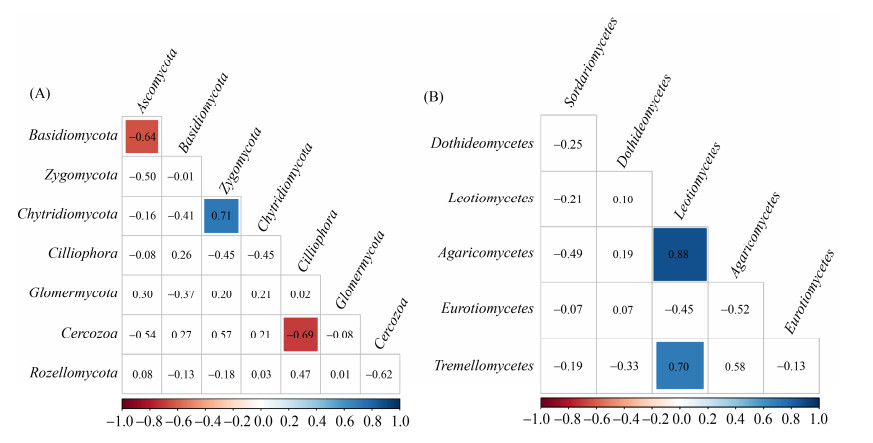
|
| 图 4 土壤真菌门水平(A)、纲水平(B) 相关性分析 Figure 4 Correlation analysis of soil fungi on phyla (A) and class (B) level. |
2.2.2 不同处理属水平聚类热图及相关性分析:
已鉴定的相对丰度前20的真菌属中,有16个属于子囊菌门,3个属于担子菌门,1个属于接合菌门。将上述真菌属的OTU丰度数据进行聚类分析(图 5-A),发现可将包含对照(CK)在内的10个处理分为两大类:其中CK与小播量下(S) 3个还田期处理聚为一类,中播量和大播量处理聚为一类。从各处理下优势菌属来看,麦后复种夏玉米(CK)土壤中,圆孢霉属(Staphylotrichum)、腐质霉属(Humicola)和曲霉属(Aspergillus)处于优势地位,显著高于油菜还田的各个处理,同时赤霉属(Gibbeella)、Heteroplacidium处于较高水平。

|
| 图 5 属水平相对丰度前20已鉴定真菌丰度热图(A) 及相关性分析(B) Figure 5 The heatmap (A) and correlation analysis (B) of relative abundance of top 20 soil fungi communities at genus-level in differernt treatments. |
小播量各还田时期处理中,以毛壳菌属(Chaetomium)、青霉菌属(Penicillium)、枝顶孢属(Acremonium)、角担菌属(Ceratobasidium)和酵母属(Bullera)的相对丰度较高;LD1和LD2处理下赤霉菌属(Gibbeella)、Heteroplacidium、Pyrenochaetopsis和短梗霉属(Aureobasidium)等相对丰度较高;MD3处理中Podospra丰度高于其他处理;MD1区别于中播量和大播量的其他处理,其中被孢霉属(Mortierella)、粉褶菌属(Entoloma)和Cladorrhinum的相对丰度显著高于其他处理。Magnaporthiopsis在小播量早还田(SD1)、中播量晚还田(MD3)、大播量中期还田(LD2)处理下相对丰度较大;平脐蠕孢属(Biploaris)和球囊菌属(Mycosphaerella)在中播量各处理及大播量晚还田中相对较高。
对已鉴别丰度前20的真菌属和小麦产量进行相关性分析,结果如图 5-B所示。平脐蠕孢属(Bipolaris)与枝顶孢属(Acremonium)、毛壳菌属(Chaetomium)、腐质霉属(Humicola)等生防菌显著负相关;被孢霉属(Mortierella)与角担菌属(Ceratobasidium)呈负相关,与粉褶菌属(Entoloma)呈正相关;枝顶孢属与Pyrenochaetopsis、Microdochium显著负相关,与Chaetomium显著正相关;赤霉属(Gibberella)与圆孢霉属(Staphylotrichum)、Heteroplacidium显著正相关;毛壳菌属与腐质霉属、曲霉属(Aspergillus)显著正相关。平脐蠕孢属、被孢霉属与小麦产量极显著正相关(R2=0.78,R2=0.88),角担菌属与产量显著负相关。
2.3 基于FUNGuild数据库的真菌营养型及功能类群分类对不同处理下属水平真菌群落的营养型(trophic mode)进行分组,除病理营养型(pathotroph)、共生营养型(symbiotroph)、腐生营养型(saprotroph)之外,还可将其划分为腐生-共生菌群(saprotroph-symbiotroph)、病理-共生菌群(pathotroph-symbiotroph)、病理-腐生菌群(pathotroph-saprotroph)、病理-腐生-共生菌群(pathotroph-saprotroph-symbiotroph)等具兼性功能的过渡型真菌类群(图 6)。腐生营养型类群的真菌在各处理中占比最大,为41.32%–50.72%;病理营养型真菌在CK中占14.75%,在复种油菜小播量处理中降低至12.26%,增大播量,该类真菌含量先增加后减少,在大播量早还田(LD1)处理下所占比例最大,为18.98%。复种油菜还田后,土壤兼性功能类群真菌含量相比复种夏玉米的对照(28.95%)增加,增至30.05%–40.10%。

|
| 图 6 基于OTU水平注释表的属水平真菌营养类型相对丰度 Figure 6 Relative abundance of fungal trophic mode based on OTU annotation table with distribution frequency level. |
相对丰度前20的真菌中,平脐蠕孢属(Biploaris)、赤霉属(Gibberella)、Magnaporthiopsis、球囊菌属(Mycosphaerella)、青霉属中Penicillium oxalicum和Penicillium citrinum等有较大可能性属于植物病原菌,以上真菌在中播量及大播量的中早期还田处理中丰度较高。Chaetomium、Humicola、Podaspora和Staphylotrichum为腐生营养型真菌,其可分为木腐真菌(Wood Saprotroph)、不明确腐菌(Undifined Saprotroph)、粪腐菌(Dung Saprotroph)及不明确腐菌-木腐菌兼性(Undefined Saprotroph-Wood Saprotroph)等,该类营养型真菌在CK与小播量早、中期还田处理中占比较大。Heteroplacidium的功能分组为苔藓化真菌(Lichenized)。相对丰度前20的真菌属中,角担菌属(Ceratobasidium)和粉褶菌属(Entoloma)按功能划分为菌根真菌。
3 讨论 3.1 麦后复种饲料油菜对土壤真菌群落结构组成的影响生物多样性指数作为评价土壤微生物群落丰富度和多样性的重要指标,表示微生物物种的多寡。本研究发现,饲料油菜还田降低了土壤真菌的丰富度指数,减轻了土壤真菌化程度[19]。从群落组成来看,土壤真菌通过对植物残体的分解,推动土壤中碳、氮循环过程[20],本试验通过对真菌各分类水平物种的注释分析,发现在各处理中,虽然土壤真菌在门、纲、属水平上相对丰度存在差异,但子囊菌门、担子菌门、粪壳菌纲等仍为土壤中的优势菌群,与前人研究结果相似[21-22]。小麦产量并未与油菜还田量呈现同步增长的变化趋势;小播量虽然造成产量降低,但随着还田期的推迟,产量并未与CK产生显著差异,大播量表现则相反。原因可能与油菜植株在土壤中残留状态有关。油菜还田,提供了真菌生长的营养来源,减轻对土壤有机质的消耗[23-24],但还田量过低,可能弥补程度较低;还田量过高且还田期推迟,使得腐解缓慢,引起油菜自身病害传播、腐解时与小麦争肥等问题,最终影响到小麦产量[25];因此应随着还田生物量的增加适当提前还田时间。
3.2 麦后复种饲料油菜对土壤真菌功能的影响从真菌在土壤中承担的功能来看,子囊菌门和担子菌门主要分解土壤有机质和纤维素[26-27];粪壳菌纲参与土壤中含钾有机物质的矿化过程[28];被孢霉属[29-30]通过分泌草酸刺激土壤中难溶性磷的溶解,促进根系对矿质元素的吸收,并且具有较强的分解纤维素的能力;同时还具有潜在分泌抗菌素、抑制部分病原菌如镰刀菌属(Fusarium)生长的能力[31-32]。枝顶孢属通过分泌某些酶来抑制病原细菌和真菌[33-34],该类真菌可在玉米根系内定植,且其合成的抗生素能有效抑制黄曲霉(Aspergillus flavus)、立枯丝核菌(Rhizoctonia solani)和褐腐镰刀菌(Fusarium verticillioides)等病原菌的生长[35-36]。毛壳菌属和青霉菌属能够降解纤维素,同时也是土壤中重要的生防菌[37-39]。在油菜还田后,以上菌属丰度增加,表明麦后种油菜有利于土壤微生物环境健康。
FUNGuild数据库功能比对结果表明,除病理营养型、共生营养型、腐生营养型三大类外,油菜还田后具有兼性功能真菌所占比例增加,原因可能是还田后的饲料油菜在降解过程中,利于病原菌和具有降解植株残体功能的真菌生长,使得具有多种兼性功能的真菌更占优势,从而影响真菌功能多样化。但在中播量和大播量早期、中期还田处理中,通过损害寄主细胞来获取营养的病理营养型真菌如平脐蠕孢属(Biploaris)、赤霉属(Gibberella)、球囊菌属(Mycosphaerella)[40]、Magnaporthiopsis[41]、青霉属中的Penicillium oxalicum和Penicillium citrinum等[42-43]有较高的丰度,原因可能是油菜还田后,在促进土壤有益菌生长的同时,也为病原真菌的生长提供了营养物质及适宜的环境。产量与病理型平脐蠕孢属表现正相关可能是基于此,小麦产量未降低可能是角担菌属与平脐蠕孢属相互平衡所致,后续应对此作进一步验证。
本研究在一定程度上阐述了麦田休闲期复种饲料油菜作绿肥对土壤真菌群落结构的影响,在增加有益菌的同时使得病原真菌比例也有所提高,对于不同营养型真菌对小麦产量的影响,仍需要从作物自身分泌物及菌属之间相互作用的角度进一步分析。
4 结论相比常规的麦后复种夏玉米模式,饲料油菜作绿肥还田降低了真菌丰富度指数,提高了子囊菌门、担子菌门相对丰度;使纲水平优势真菌比例增加;增加土壤被孢霉属、枝顶孢属等有益菌的相对丰度;使土壤中兼性营养型真菌含量增加,功能类群趋向于过渡类型。油菜采取15 kg/hm2的播量于9月20日还田增产效果最为显著。
| [1] | 山西省统计局. 2014山西统计年鉴. 北京: 中国统计出版社, 2014. |
| [2] |
Luan Q, Guo JP, Ma YL, Mi XN, Zhang LM, Li MW. Evaluation of climate resource utilization rate of main grain crops in Shanxi Province. Chinese Journal of Ecology, 2021, 40(5): 1386-1396.
(in Chinese) 栾青, 郭建平, 马雅丽, 米晓楠, 张丽敏, 李孟蔚. 山西省主要粮食作物气候资源利用率评估. 生态学杂志, 2021, 40(5): 1386-1396. |
| [3] |
Wu WM, Chen HJ, Wang SJ, Wei FZ, Li JC. Effects of nitrogen fertilization application regime on dry matter, nitrogen accumulation and transportation in summer maize under waterlogging at the seedling stage. Acta Agronomica Sinica, 2015, 41(8): 1246-1256.
(in Chinese) 武文明, 陈洪俭, 王世济, 魏凤珍, 李金才. 氮肥运筹对苗期受渍夏玉米干物质和氮素积累与转运的影响. 作物学报, 2015, 41(8): 1246-1256. |
| [4] |
Tian SZ, Wang Y, Zhang YF, Bian WF, Dong L, Luo JF, Guo HH. Residue returning with subsoiling replacing rotary tillage improving aggregate and associated carbon. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(24): 133-140.
(in Chinese) 田慎重, 王瑜, 张玉凤, 边文范, 董亮, 罗加法, 郭洪海. 旋耕转深松和秸秆还田增加农田土壤团聚体碳库. 农业工程学报, 2017, 33(24): 133-140. DOI:10.11975/j.issn.1002-6819.2017.24.018 |
| [5] |
Gu CM, Li YS, Xie LH, Hu XJ, Liao X, Qin L. Analysis on application advantages of rapeseed as green manure. Soil and Fertilizer Sciences in China, 2019(1): 180-183.
(in Chinese) 顾炽明, 李银水, 谢立华, 胡小加, 廖星, 秦璐. 浅析油菜作为绿肥的应用优势. 中国土壤与肥料, 2019(1): 180-183. |
| [6] |
Wang F, Bau Tolgor. Research advances in the diversity of soil fungi. Journal of Fungal Research, 2014, 12(3): 178-186.
(in Chinese) 王芳, 图力古尔. 土壤真菌多样性研究进展. 菌物研究, 2014, 12(3): 178-186. |
| [7] | Barbi F, Prudent E, Vallon L, Buée M, Dubost A, Legout A, Marmeisse R, Fraissinet-Tachet L, Luis P. Tree species select diverse soil fungal communities expressing different sets of lignocellulolytic enzyme-encoding genes. Soil Biology and Biochemistry, 2016(100): 149-159. |
| [8] | Brito I, Goss MJ, de Carvalho M, Chatagnier O, van Tuinen D. Impact of tillage system on arbuscular mycorrhiza fungal communities in the soil under Mediterranean conditions. Soil and Tillage Research, 2012(121): 63-67. |
| [9] |
Li HY, Hu TC, Cao QH, Yu CW, Cao WD, Huang DL, Zhai BN, Gao YJ. Effect of improving soil fertility by planting different green manures in different patterns in dryland. Journal of Plant Nutrition and Fertilizer, 2016, 22(5): 1310-1318.
(in Chinese) 李红燕, 胡铁成, 曹群虎, 鱼昌为, 曹卫东, 黄冬琳, 翟丙年, 高亚军. 旱地不同绿肥品种和种植方式提高土壤肥力的效果. 植物营养与肥料学报, 2016, 22(5): 1310-1318. |
| [10] |
Wang L, Fan TL, Wang Y, Li SZ, Zhao G, Zhang JJ, Dang Y. Effects of cultivation modes in summer fallow period on soil moisture and water use efficiency of winter wheat. Journal of Irrigation and Drainage, 2015, 34(5): 55-58.
(in Chinese) 王磊, 樊廷录, 王勇, 李尚中, 赵刚, 张建军, 党翼. 夏闲期栽培模式对土壤水分及冬小麦水分利用效率的影响. 灌溉排水学报, 2015, 34(5): 55-58. |
| [11] |
Wang Z, Liang Y, Yao PW, Lu JJ, Li J, Li ZB, Yu CW, Cao QH, Cao WD, Gao YJ. Effects of fertilization before sowing of leguminous green manure and its incorporation methods on soil moisture and nutrient regime of wheat field in Weibei Dryland. Agricultural Research in the Arid Areas, 2014, 32(3): 119-126.
(in Chinese) 王峥, 梁颖, 姚鹏伟, 芦俊俊, 李婧, 黎志波, 鱼昌为, 曹群虎, 曹卫东, 高亚军. 绿肥播前施肥和翻压方式对旱地麦田土壤水肥性状的影响. 干旱地区农业研究, 2014, 32(3): 119-126. |
| [12] |
Wan SX, Tang S, Wang YQ, Zhu HB, Guo XS. Effect of returning quantity of Astragalus sinicus to soil on quantity and activity of microbial in paddy soil. Soil and Fertilizer Sciences in China, 2013(4): 39-42.
(in Chinese) 万水霞, 唐杉, 王允青, 朱宏斌, 郭熙盛. 紫云英还田量对稻田土壤微生物数量及活度的影响. 中国土壤与肥料, 2013(4): 39-42. |
| [13] |
Liu GS, Luo ZB, Wang Y, Li HL, Wang GF, Ma JM. Effect of green manure application on soil properties and soil microbial biomass in tobacco field. Journal of Soil and Water Conservation, 2006, 20(1): 95-98.
(in Chinese) 刘国顺, 罗贞宝, 王岩, 李洪亮, 王国锋, 马京民. 绿肥翻压对烟田土壤理化性状及土壤微生物量的影响. 水土保持学报, 2006, 20(1): 95-98. DOI:10.3321/j.issn:1009-2242.2006.01.023 |
| [14] |
Yang RJ, Ma HL, Yang QF, Niu JY. Effects of planting density and nitrogen application rate on soil microbial activity under wheat/forage rape multiple cropping. Chinese Journal of Applied Ecology, 2007, 18(1): 113-117.
(in Chinese) 杨瑞吉, 马海灵, 杨祁峰, 牛俊义. 种植密度与施氮量对麦茬复种饲料油菜土壤微生物活性的影响. 应用生态学报, 2007, 18(1): 113-117. DOI:10.3321/j.issn:1001-9332.2007.01.019 |
| [15] |
Chen XB, Guan HL, Guo YZ, Hong LF, Ren SS, Cao WD. The effect of plowing under green manure on the soil microorganism and fertility in tobacco cultivation red soil. Soil and Fertilizer Sciences in China, 2011(4): 74-78.
(in Chinese) 陈晓波, 官会林, 郭云周, 洪丽芳, 任石所, 曹卫东. 绿肥翻压对烟地红壤微生物及土壤养分的影响. 中国土壤与肥料, 2011(4): 74-78. DOI:10.3969/j.issn.1673-6257.2011.04.017 |
| [16] |
Li P, Li YC, Shi JL, Zheng XQ, Wu GG, Jiang W, Zhao K, Ming F, Pan AH, Lv WG, Tang XM. Rice straw return of different decomposition days altered soil fungal community structure. Acta Ecologica Sinica, 2017, 37(13): 4309-4317.
(in Chinese) 李鹏, 李永春, 史加亮, 郑宪清, 武国干, 蒋玮, 赵凯, 明凤, 潘爱虎, 吕卫光, 唐雪明. 水稻秸秆还田时间对土壤真菌群落结构的影响. 生态学报, 2017, 37(13): 4309-4317. |
| [17] | Handiseni M, Brown J, Zemetra R, Mazzola M. Effect of Brassicaceae seed meals with different glucosinolate profiles on Rhizoctonia root rot in wheat. Crop Protection, 2013(48): 1-5. |
| [18] | Snapp SS, Date KU, Kirk W, O'Neil K, Kremen A, Bird G. Root, shoot tissues of Brassica juncea and Cereal Secale promote potato health. Plant and Soil, 2007, 294(1/2): 55-72. |
| [19] |
Chen DM, Duan YQ, Yang YH, Jin Y, Huang JG, Yuan L. Effects of long-term fertilization on flue-cured tobacco soil nutrients and microorganisms community structure. Scientia Agricultura Sinica, 2014, 47(17): 3424-3433.
(in Chinese) 陈丹梅, 段玉琪, 杨宇虹, 晋艳, 黄建国, 袁玲. 长期施肥对植烟土壤养分及微生物群落结构的影响. 中国农业科学, 2014, 47(17): 3424-3433. DOI:10.3864/j.issn.0578-1752.2014.17.010 |
| [20] |
Wang QT, Gao MY, Liu ML, Wang HT, Dong YF, Wang YP. Illumina Miseq sequencing-based fungal community of rhizosphere soils along root orders of poplar plantation. Chinese Journal of Applied Ecology, 2017, 28(4): 1177-1183.
(in Chinese) 汪其同, 高明宇, 刘梦玲, 王华田, 董玉峰, 王延平. 基于高通量测序的杨树人工林根际土壤真菌群落结构. 应用生态学报, 2017, 28(4): 1177-1183. |
| [21] | Degrune F, Dufrêne M, Colinet G, Massart S, Taminiau B, Bodson B, Hiel MP, Daube G, Nezer C, Vandenbol M. A novel sub-Phylum method discriminates better the impact of crop management on soil microbial community. Agronomy for Sustainable Development, 2015, 35(3): 1157-1166. DOI:10.1007/s13593-015-0291-4 |
| [22] |
Lou JX, Liu H, Shen SJ, Feng ZH, He DD, Wu SS, Chen W, Jiang GH, Chang PF, Peng GH. Effects of different agronomic measures on the structure and function of soil fungi community in tobacco fields. Chinese Tobacco Science, 2020, 41(1): 38-43, 55.
(in Chinese) 娄俊鑫, 刘泓, 沈少君, 冯芷菡, 何冬冬, 吴树松, 陈炜, 江桂花, 常鹏飞, 彭国华. 不同农艺措施对烟田土壤真菌群落结构和功能的影响. 中国烟草科学, 2020, 41(1): 38-43, 55. |
| [23] | Clocchiatti A, Hannula SE, van den Berg M, Korthals G, de Boer W. The hidden potential of saprotrophic fungi in arable soil: Patterns of short-term stimulation by organic amendments. Applied Soil Ecology, 2020(147): 103434. |
| [24] | 王帅. 真菌利用纤维素和木质素形成腐殖物质及其结构特征研究. 吉林农业大学博士学位论文, 2013. |
| [25] |
Pan FX, Lu JW, Liu W, Geng MJ, Li XK, Cao WD. Study on characteristics of decomposing and nutrients releasing of three kinds of green manure crops. Plant Nutrition and Fertilizer Science, 2011, 17(1): 216-223.
(in Chinese) 潘福霞, 鲁剑巍, 刘威, 耿明建, 李小坤, 曹卫东. 三种不同绿肥的腐解和养分释放特征研究. 植物营养与肥料学报, 2011, 17(1): 216-223. |
| [26] |
He YH, Zhou GY, Wang SJ, Li H. Fungal diversity in Cunninghamia lanceolata plantation soil. Acta Ecologica Sinica, 2014, 34(10): 2725-2736.
(in Chinese) 何苑皞, 周国英, 王圣洁, 李河. 杉木人工林土壤真菌遗传多样性. 生态学报, 2014, 34(10): 2725-2736. |
| [27] | Frey SD, Knorr M, Parrent JL, Simpson RT. Chronic nitrogen enrichment affects the structure and function of the soil microbial community in temperate hardwood and pine forests. Forest Ecology and Management, 2004, 196(1): 159-171. DOI:10.1016/j.foreco.2004.03.018 |
| [28] |
Lu J, Wu LH, Zheng H, Zhang X, Fei YC, Cao SJ, Ji CS, Cao GQ. Effects of different undergrowth vegetation management measures on the soil fungi community structure of large diameter timber plantation of Cunninghamia lanceolata. Chinese Journal of Applied and Environmental Biology, 2020(3): 626-634.
(in Chinese) 路锦, 伍丽华, 郑宏, 张筱, 费裕翀, 曹世江, 季春杉, 曹光球. 不同林下植被管理措施对杉木大径材林分土壤真菌群落结构的影响. 应用与环境生物学报, 2020(3): 626-634. |
| [29] |
Qiao ZW. Screening of phosphorus solubilizing fungi and the effects of combined application of insoluble phosphorus on soil phosphorus availability. Journal of Soil and Water Conservation, 2019, 33(5): 329-333.
(in Chinese) 乔志伟. 溶磷真菌的筛选及配施难溶态磷对土壤磷素有效性的影响. 水土保持学报, 2019, 33(5): 329-333. |
| [30] |
Lu GX, Li ZR, Li XL, Wang JB, Wu C, Li X, Zhang GX, Sun Q, Li FK, Zheng HM. Community structure characteristics of culturable cellulose-decomposing fungi in soils from different ecosystems in the Sanjiangyuan Regions. Acta Prataculturae Sinica, 2016, 25(1): 76-87.
(in Chinese) 芦光新, 李宗仁, 李希来, 王军邦, 吴楚, 李欣, 张更兄, 孙乾, 李峰科, 郑慧美. 三江源区高寒草地不同生境土壤可培养纤维素分解真菌群落结构特征研究. 草业学报, 2016, 25(1): 76-87. |
| [31] | Miao CP, Mi QL, Qiao XG, Zheng YK, Chen YW, Xu LH, Guan HL, Zhao LX. Rhizospheric fungi of Panax notoginseng: diversity and antagonism to host phytopathogens. Journal of Ginseng Research, 2016, 40(2): 127-134. DOI:10.1016/j.jgr.2015.06.004 |
| [32] | Li R, Shen ZZ, Sun L, Zhang RF, Fu L, Deng XH, Shen QR. Novel soil fumigation method for suppressing cucumber Fusarium wilt disease associated with soil microflora alterations. Applied Soil Ecology, 2016(101): 28-36. |
| [33] | Izumikawa M, Khan ST, Komaki H, Nagai A, Inaba S, Takagi M, Shin-Ya K. JBIR-37 and-38, novel glycosyl benzenediols, isolated from the sponge-derived fungus, Acremonium sp. SpF080624G1f01. Bioscience, Biotechnology, and Biochemistry, 2009, 73(9): 2138-2140. DOI:10.1271/bbb.90346 |
| [34] | Zhang P, Bao BQ, Dang HT, Hong J, Lee HJ, Yoo ES, Bae KS, Jung JH. Anti-inflammatory sesquiterpenoids from a sponge-derived fungus Acremonium sp.. Journal of Natural Products, 2009, 72(2): 270-275. DOI:10.1021/np8006793 |
| [35] | Wicklow DT, Poling SM. Antimicrobial activity of pyrrocidines from Acremonium Zeae against endophytes and pathogens of maize. Phytopathology, 2009, 99(1): 109-115. DOI:10.1094/PHYTO-99-1-0109 |
| [36] | Wicklow DT, Roth S, Deyrup ST, Gloer JB. A protective endophyte of maize: Acremonium zeae antibiotics inhibitory to Aspergillus flavus and Fusarium verticillioides. Mycological Research, 2005, 109(5): 610-618. DOI:10.1017/S0953756205002820 |
| [37] | Hodge A, Robinson D, Fitter A. Are microorganisms more effective than plants at competing for nitrogen?. Trends in Plant Science, 2000, 5(7): 304-308. DOI:10.1016/S1360-1385(00)01656-3 |
| [38] | 郭云忠. 毛壳科Chaetomiaceae真菌多基因系统演化及分类鉴定研究. 西北农林科技大学博士学位论文, 2012. |
| [39] |
Luo Q, Peng C, Ye BP. New advances in research of the genus Penicillium. Pharmaceutical Biotechnology, 2016, 23(5): 452-456.
(in Chinese) 罗清, 彭程, 叶波平. 青霉属真菌研究新进展. 药物生物技术, 2016, 23(5): 452-456. |
| [40] | Tedersoo L, Bahram M, Põlme S, Kõljalg U, Yorou NS, Wijesundera R, Villarreal RL, VascoPalacios AM, Thu PQ, Suija A, Smith ME, Sharp C, Saluveer E, Saitta A, Rosas M, Riit T, Ratkowsky D, Pritsch K, Põldmaa K, Piepenbring M, Phosri C, Peterson M, Parts K, Pärtel K, Otsing E, Nouhra E, Njouonkou A L, Nilsson RH, Morgado LN, Mayor J, May TW, Majuakim L, Lodge DJ, Lee SS, Larsson KH, Kohout P, Hosaka K, Hiiesalu I, Henkel TW, Harend H, Guo LD, Greslebin A, Grelet G, Geml J, Gates G, Dunstan W, Dunk C, Drenkhan R, Dearnaley J, De KA, Dang T, Chen X, Buegger F, Brearley FQ, Bonito G, Anslan S, Abell S, Abarenkov K. Fungal biogeography global diversity and geography of soil fungi. Science, 2014, 346(6213): 1256688. DOI:10.1126/science.1256688 |
| [41] | Cannon PF, Kirk PF. Fungal families of the world. Wallingford: CABI, 2007. |
| [42] | Windels CE. Growth of Penicillium oxalicum as a biological seed treatment on pea seed in soil. Phytopathology, 1981, 71(9): 929. DOI:10.1094/Phyto-71-929 |
| [43] | Caldwell RW. Pathogenicity of Penicilliato corn ears. Phytopathology, 1981, 71(2): 175. DOI:10.1094/Phyto-71-175 |
 2021, Vol. 61
2021, Vol. 61




